北京市第五十五中学2023-2024学年高二下学期(等级考)3月调研化学试卷(PDF版含答案)
文档属性
| 名称 | 北京市第五十五中学2023-2024学年高二下学期(等级考)3月调研化学试卷(PDF版含答案) |

|
|
| 格式 | |||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-31 10:13:23 | ||
图片预览

文档简介
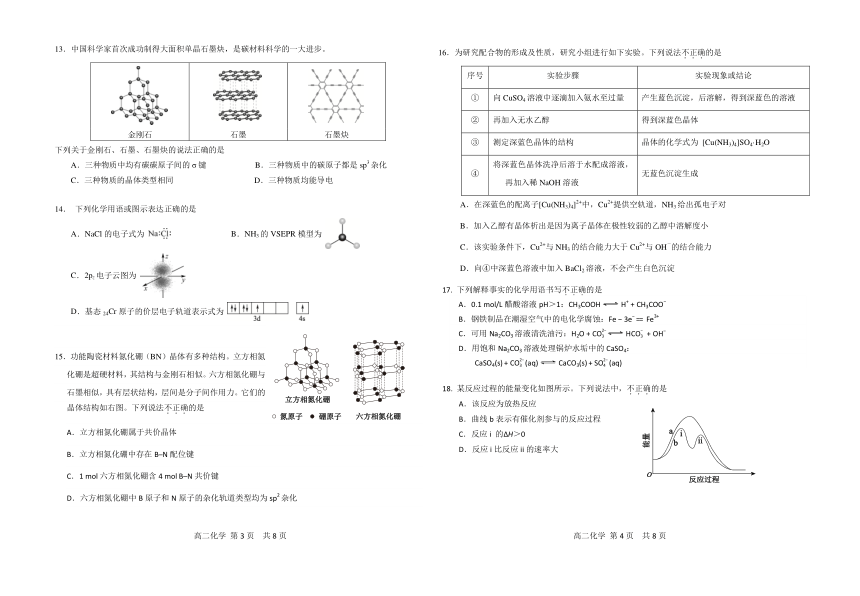
-
7.氰离子(CN )和氰[(CN)2]的结构如下图。下列说法不正确的是
北京市第五十五中学 2023-2024 学年度第二学期 ...
氰离子: 氰:
3 月调研试卷
- -
A.CN 中的 N 原子和 C 原子上各有 1 个孤电子对 B.CN 可以作配合物中的配体
高二化学(等级考)
-
C.CN 中 N 原子和 C 原子之间形成 2 个 σ 键和 1 个 π 键 D.(CN)2 分子中的 4 个原子在一条直线上
本试卷共 8 页,共 100 分,调研时长 80 分钟
8.下列物质的类别与所含官能团都正确的是
可能用到的相对原子质量:H 1 C 12 N 14 O 16
第一部分 A. 酚 羟基 B.CH3COCH3 醚 醚键
本部分共 20题,共 50分。每小题只.有.一.个.选.项.符合题意(1~10 题,每题 3 分;11~20 题,每题 2 分)
C. 醛 醛基 D. 酮 酮羰基
1.下列物质中,属于强电解质的是
A.NaCl B.H2O C.CH3COOH D.NH3·H2O 9.下列有机物分子中的碳原子既有 3 2sp 杂化又有 sp 杂化的是
2.下列关于 σ 键和 π 键的说法中,不.正.确.的是
A.CH CH CH B.CH C CH3 2 3
A.σ 键由原子轨道“头碰头”重叠形成 B.N2 分子中的 π 键为 p-p π 键,π 键不能绕键轴旋转
C.CH CH OH D.CH CH
C.HCl 分子中的 σ 键为 s-s σ 键 D.p 轨道和 p 轨道之间既能形成 π 键,又能形成 σ 键 3 2 2 2
3.下列事实不能 10.理清概念是化学学习的基础。下列说法错误的是 ..通过比较氟元素和氯元素的电负性进行解释的是
129 131
A.F-F 键的键能小于 Cl-Cl 键的键能 B.三氟乙酸的 Ka大于三氯乙酸的 Ka A. X e 与 X e54 互为同位素 B.金刚石与石墨互为同素异形体 54
C.氟化氢分子的极性强于氯化氢分子的极性 D.气态氟化氢中存在(HF)2 而气态氯化氢中是 HCl 分子
4.下列分子或离子中,VSEPR 模型和空间结构不.一.致.的是 C. 与 是同种物质 D. 与 互为同分异构体
-
A. 2CO2 B.SO4 C.BeCl2 D.NH3
5.下列各物质的晶体中,晶体类型相同的是
11.下列叙述不.正.确.的是
A.SO2 和 H2O B.HCl 和 NaCl C.CO2 和 SiO2 D.Cu 和 Ne A.CO2 是直线形分子 B.NaCl 晶体溶于水时,破坏了离子键
6. 下列说法不.正.确.的是
C.CH4 的空间结构呈三角锥形,存在手性异构体 D.金刚石是典型的共价晶体,熔点高,硬度大
+ +
A.PCl3是极性键构成的极性分子 B.H 能与 H2O 以配位键形成 H3O
12.下列性质比较中,正确的是
C.分子晶体中,分子间作用力越大,分子越稳定 A.沸点:H2O<H2S B.热稳定性:HCl<HI
D.对固体进行 X 射线衍射测定是区分晶体和非晶体最可靠的科学方法 C.酸性:CH3COOH>CH2ClCOOH D.在水中的溶解度:CH3CH2OH>CH3CH2CH2CH2CH2OH
高二化学 第 1 页 共 8 页 高二化学 第 2 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
13.中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。 16.为研究配合物的形成及性质,研究小组进行如下实验。下列说法不.正.确.的是
序号 实验步骤 实验现象或结论
① 向 CuSO4 溶液中逐滴加入氨水至过量 产生蓝色沉淀,后溶解,得到深蓝色的溶液
② 再加入无水乙醇 得到深蓝色晶体
金刚石 石墨 石墨炔
③ 测定深蓝色晶体的结构 晶体的化学式为 [Cu(NH3)4]SO4·H2O
下列关于金刚石、石墨、石墨炔的说法正确的是
A.三种物质中均有碳碳原子间的 σ 键 3 B.三种物质中的碳原子都是 sp 杂化 将深蓝色晶体洗净后溶于水配成溶液,
④ 无蓝色沉淀生成
C.三种物质的晶体类型相同 D.三种物质均能导电 再加入稀 NaOH 溶液
2+ 2+
A.在深蓝色的配离子[Cu(NH ) ] 中,Cu 提供空轨道,NH 给出孤电子对
14. 下列化学用语或图示表达正确的是 3 4 3
B.加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
A.NaCl 的电子式为 B.NH3 的 VSEPR 模型为
-
C.该实验条件下, 2+Cu 与 NH3的结合能力大于
2+
Cu 与 OH 的结合能力
D.向④中深蓝色溶液中加入 BaCl2 溶液,不会产生白色沉淀
C.2pz电子云图为
17. 下列解释事实的化学用语书写不.正.确.的是
A.0.1 mol/L 醋酸溶液 pH>1:CH3COOH H
+
+ CH3COO
D.基态 24Cr 原子的价层电子轨道表示式为
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe 3e == Fe3+
2
C.可用 Na2CO3 溶液清洗油污:H
2O + CO3 HCO3 + OH
D.用饱和 Na2CO3 溶液处理锅炉水垢中的 CaSO4:
15.功能陶瓷材料氮化硼(BN)晶体有多种结构。立方相氮 2 2
CaSO4(s)
+ CO3 (aq) CaCO3(s)
+ SO4 (aq)
化硼是超硬材料,其结构与金刚石相似。六方相氮化硼与
石墨相似,具有层状结构,层间是分子间作用力。它们的 18. 某反应过程的能量变化如图所示。下列说法中,不.正.确.的是
A.该反应为放热反应
晶体结构如右图。下列说法不.正.确.的是
B.曲线 b 表示有催化剂参与的反应过程
A.立方相氮化硼属于共价晶体 C.反应 i 的 H>0
D.反应 i 比反应 ii 的速率大
B.立方相氮化硼中存在 B─N 配位键
C.1 mol 六方相氮化硼含 4 mol B─N 共价键
D.六方相氮化硼中 B 原子和 N 原子的杂化轨道类型均为 sp2 杂化
高二化学 第 3 页 共 8 页 高二化学 第 4 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
19.一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入 A 和 B,发生反应: 第二部分
3A(g) + B(g) 2C(g) H<0,200 ℃时该反应的化学平衡常数 K=1,反应体系
本部分共 4题,共 50分。
中各物质的物质的量浓度的相关数据如下:
容器 温度 起始时物质的浓度 10 分钟时物质的浓度 21.(10 分)甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为
℃ (mol/L) (mol/L)
c(A) c(B) c(C)
甲 200 6 2 1
乙 300 6 2 0.8
丙 200 6 3 a (1)C、H、O 三种元素的电负性由大到小的顺序为________。
下列说法中,不.正.确.的是 (2)H2O 的中心原子上的孤电子对数为________。
A.K 甲>K 乙
B.甲中,10 分钟内 A 的化学反应速率υ(A)= 0.15 mol/(L·min) (3)HCHO 分子内 σ 键与 π 键个数之比为________,HCHO 的空间结构为________。
C.乙中,10 分钟时υ正 =υ逆 (4)CH3OH 和 HCHO 分子中碳原子的杂化轨道类型分别为________和________。
D.丙中,达到化学平衡状态时 A 的转化率是 25%
(5)甲醇氧化生成 HCHO 时,会产生 CO、CO2、CH3OCH3 等副产物。相同条件下,CO2 的沸点比
20.常温下完成下列实验。其中实验 I 中浑浊不消失,实验Ⅱ和Ⅲ中浊液变澄清。 O2的高,主要原因为________。
下列说法中,不.正.确.的是
(6)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:________。
22.( 3-14 分)[FeF6] 与许多金属离子或
+
NH4 形成的化合物有广泛的用途。
(1)基态 Fe 原子的价层电子轨道表示式为_______。
A.实验 I 中加入 8 滴水后溶液的 pH 不变 (2)钢铁表面成膜技术是钢铁防腐的重要方法。工业上利用某种转化液使钢铁表面形成致密的 K3[FeF6]
+ 2
B.实验Ⅱ中加入浓氨水后,c(Na+) + c(H+) + c(NH4 ) = 2c(CO3 ) + c(HCO3 ) + c(OH
)
膜以进行防腐,该转化液是含 KF、HNO
2 3
、(NH4)2S2O8(或 H2O2)等物质的溶液(pH ≈ 2)。
C.实验Ⅲ中加入 NH4Cl 溶液后,c(CO3 )/c(HCO3 )比值增大
2-
D.实验Ⅱ和实验Ⅲ中浊液变澄清可能与 HCO3的电离平衡、水解平衡有关 S2O8 的结构如下:
①比较 O 原子和 S 原子的第一电离能大小,从原子结构的角度说明理由:
_______。
高二化学 第 5 页 共 8 页 高二化学 第 6 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
②下列说法正确的是_______(填字母)。
a.(NH4)2S2O8能将
2+
Fe 氧化为 3+Fe 的可能原因是含有“-O-O-”结构
b.依据结构分析,(NH4)2S2O8中硫元素的化合价为+7 价
2-
c.S2O8 中“S-O-O”在一条直线上
③ 转化液 pH 过小时,不易得到 K3[FeF6],原因是_______。
-1
( ) 3-
①ΔH3= kJ·mol 。
与 +3 [FeF6] NH4 形成的化合物可以作为锂离子电池的电极材料。
②为维持炉内温度基本不变,FeSO4所带结晶水越多,掺烧比[n(FeS2) : n(FeSO4)]应
①化合物(NH4)3[FeF6]中的化学键类型有_______(填字母)。
______。(填“增大”“减小”或“不变”)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
Ⅱ.浸出法处理ZnS
② (NH4)3[FeF6]的晶胞形状为立方体,边长为 a nm,结构如下图所示:
(3)ZnS难溶于水,处理ZnS常使用酸浸法,两步反应依次为:
ⅰ + 2+ -3 . ZnS(s) + 2H (aq) Zn (aq) + H2S(aq) K1 = 2.2×10
ⅱ.2H2S + O2 ===
71
2H2O + 2S K2 = 2×10
①平衡常数 K1的表达式为______。
图中 + 3-“ ”代表的是_______(填“NH ”或“[FeF6] ”)。 ②仅发生反应ⅰ时,ZnS 酸浸效果不好,结合平衡常数说明原因:______。 4
已知 的摩尔质量是 · -1(NH4)3[FeF6] M g mol ,阿伏加德罗常数为 NA,该晶体的密度 (4)从平衡移动角度解释通入 O2在 ZnS 酸浸过程中的作用:______。
为 · -3 -7_______ g cm 。(1nm =10 cm)
24.(12 分)某同学利用如图所示装置制作简单的燃料电池。
(1)闭合 K1,断开 K2。
23.(14 分)金属矿物常以硫化物形式存在,如 FeS2、ZnS 等。 ①电极 a 的电极反应式是_____。
2
Ⅰ.掺烧FeS 和FeSO ,用于制铁精粉和硫酸 ②SO4 的迁移方向为_____ (填“a→b”或“b→a”)。 2 4
=== ③一段时间后,电极 b 附近的现象是_____。 (1)已知:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)为吸热反应。25℃、101 kPa时,1 mol
(2)一段时间后断开 K1,闭合 K2,电流表的指针偏转。
FeS2固体在2.75 mol氧气中完全燃烧生成气态SO2和Fe2O3固体,放出826 kJ热量。
①电极 b 的电极反应式是_____。
①FeS2与O2反应的热化学方程式为______。
②总反应的化学方程式是_____。
②将FeS2与FeSO4掺烧(混合燃烧),其目的包括______(填字母)。 (3)下列说法中,不.正.确.的是_____(填字母)。
a. 节约燃料和能量 b. 为制备硫酸提供原料 c. 减少空气污染 a.通过调节 K1、K2 可以实现化学能和电能的相互转化
(2)FeSO4常带一定量的结晶水。FeSO4·7H2O(s)分解脱水反应的能量变化如下图所示。 b.若将 Na2SO4 溶液替换为稀硫酸,闭合 K2 后,电极反应不变
c.闭合 K1,电路中每转移 4 mol 电子,电极 a 理论上产生的气体在标准状况下
的体积为 44.8 L
高二化学 第 7 页 共 8 页 高二化学 第 8 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
2023—2024 学年度第二学期 3 月调研 高二化学参考答案
选择题 ( 1-10 题每题 3 分,11-20 题每题 2 分,共 50 分。)
1-5 ACADA 6-10 CCCAD 11-15 CDACC 16-20 DBDDC
非选择(共 50 分,除标记的空,每空 2 分。)
21.(10 分,(5)(6)每空 2 分,其余每空 1 分)
(1)O>C>H (2)2 (3)3︰1 平面三角形
( ) 3 2 4 sp sp
(5)CO2和 O2 都属于分子晶体,CO2 相对分子质量大,范德华力强
(6)甲醛分子与水分子能形成分子间氢键
22.(14 分)
(1) 3d 4s
(2)① 第一电离能 O>S。O 和 S 为同主族元素,电子层数 S>O,原子半径 S>O,原子
核对最外层电子的吸引作用 O>S。
② a
③ + c(H )较大, -与 + -F H 结合形成 HF,c(F )降低,不易与 3+Fe 形成 3-[FeF6]
(3)① abe
3- ② [FeF6]
23.(14 分)
(1)① -14FeS2(s) + 11O2(g) === 2Fe2O3(s) + 8SO2(g) ΔH= -3304kJ·mol ②ab
(2)①+31.4 ②增大
( +) ( )(3)①K1= + ②K1较小,说明 ZnS 酸浸反应ⅰ进行得不充分(合理即可) ( )
(4)O2与 H2S 充分反应,使平衡ⅰ正向移动,促进 ZnS 的溶解(合理即可)
24. (12 分)
-
(1)①2H2O - 4e == O
+
2 + 4H ②b→a ③产生无色气泡,溶液变为红色
- -
(2)①H2 - 2e
+ 2OH == 2H2O
-
②2H + + 2 O2 == 2H2O 或 2H2 + 4OH + O2 + 4H == 6H2O
(3)bc
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
7.氰离子(CN )和氰[(CN)2]的结构如下图。下列说法不正确的是
北京市第五十五中学 2023-2024 学年度第二学期 ...
氰离子: 氰:
3 月调研试卷
- -
A.CN 中的 N 原子和 C 原子上各有 1 个孤电子对 B.CN 可以作配合物中的配体
高二化学(等级考)
-
C.CN 中 N 原子和 C 原子之间形成 2 个 σ 键和 1 个 π 键 D.(CN)2 分子中的 4 个原子在一条直线上
本试卷共 8 页,共 100 分,调研时长 80 分钟
8.下列物质的类别与所含官能团都正确的是
可能用到的相对原子质量:H 1 C 12 N 14 O 16
第一部分 A. 酚 羟基 B.CH3COCH3 醚 醚键
本部分共 20题,共 50分。每小题只.有.一.个.选.项.符合题意(1~10 题,每题 3 分;11~20 题,每题 2 分)
C. 醛 醛基 D. 酮 酮羰基
1.下列物质中,属于强电解质的是
A.NaCl B.H2O C.CH3COOH D.NH3·H2O 9.下列有机物分子中的碳原子既有 3 2sp 杂化又有 sp 杂化的是
2.下列关于 σ 键和 π 键的说法中,不.正.确.的是
A.CH CH CH B.CH C CH3 2 3
A.σ 键由原子轨道“头碰头”重叠形成 B.N2 分子中的 π 键为 p-p π 键,π 键不能绕键轴旋转
C.CH CH OH D.CH CH
C.HCl 分子中的 σ 键为 s-s σ 键 D.p 轨道和 p 轨道之间既能形成 π 键,又能形成 σ 键 3 2 2 2
3.下列事实不能 10.理清概念是化学学习的基础。下列说法错误的是 ..通过比较氟元素和氯元素的电负性进行解释的是
129 131
A.F-F 键的键能小于 Cl-Cl 键的键能 B.三氟乙酸的 Ka大于三氯乙酸的 Ka A. X e 与 X e54 互为同位素 B.金刚石与石墨互为同素异形体 54
C.氟化氢分子的极性强于氯化氢分子的极性 D.气态氟化氢中存在(HF)2 而气态氯化氢中是 HCl 分子
4.下列分子或离子中,VSEPR 模型和空间结构不.一.致.的是 C. 与 是同种物质 D. 与 互为同分异构体
-
A. 2CO2 B.SO4 C.BeCl2 D.NH3
5.下列各物质的晶体中,晶体类型相同的是
11.下列叙述不.正.确.的是
A.SO2 和 H2O B.HCl 和 NaCl C.CO2 和 SiO2 D.Cu 和 Ne A.CO2 是直线形分子 B.NaCl 晶体溶于水时,破坏了离子键
6. 下列说法不.正.确.的是
C.CH4 的空间结构呈三角锥形,存在手性异构体 D.金刚石是典型的共价晶体,熔点高,硬度大
+ +
A.PCl3是极性键构成的极性分子 B.H 能与 H2O 以配位键形成 H3O
12.下列性质比较中,正确的是
C.分子晶体中,分子间作用力越大,分子越稳定 A.沸点:H2O<H2S B.热稳定性:HCl<HI
D.对固体进行 X 射线衍射测定是区分晶体和非晶体最可靠的科学方法 C.酸性:CH3COOH>CH2ClCOOH D.在水中的溶解度:CH3CH2OH>CH3CH2CH2CH2CH2OH
高二化学 第 1 页 共 8 页 高二化学 第 2 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
13.中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。 16.为研究配合物的形成及性质,研究小组进行如下实验。下列说法不.正.确.的是
序号 实验步骤 实验现象或结论
① 向 CuSO4 溶液中逐滴加入氨水至过量 产生蓝色沉淀,后溶解,得到深蓝色的溶液
② 再加入无水乙醇 得到深蓝色晶体
金刚石 石墨 石墨炔
③ 测定深蓝色晶体的结构 晶体的化学式为 [Cu(NH3)4]SO4·H2O
下列关于金刚石、石墨、石墨炔的说法正确的是
A.三种物质中均有碳碳原子间的 σ 键 3 B.三种物质中的碳原子都是 sp 杂化 将深蓝色晶体洗净后溶于水配成溶液,
④ 无蓝色沉淀生成
C.三种物质的晶体类型相同 D.三种物质均能导电 再加入稀 NaOH 溶液
2+ 2+
A.在深蓝色的配离子[Cu(NH ) ] 中,Cu 提供空轨道,NH 给出孤电子对
14. 下列化学用语或图示表达正确的是 3 4 3
B.加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
A.NaCl 的电子式为 B.NH3 的 VSEPR 模型为
-
C.该实验条件下, 2+Cu 与 NH3的结合能力大于
2+
Cu 与 OH 的结合能力
D.向④中深蓝色溶液中加入 BaCl2 溶液,不会产生白色沉淀
C.2pz电子云图为
17. 下列解释事实的化学用语书写不.正.确.的是
A.0.1 mol/L 醋酸溶液 pH>1:CH3COOH H
+
+ CH3COO
D.基态 24Cr 原子的价层电子轨道表示式为
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe 3e == Fe3+
2
C.可用 Na2CO3 溶液清洗油污:H
2O + CO3 HCO3 + OH
D.用饱和 Na2CO3 溶液处理锅炉水垢中的 CaSO4:
15.功能陶瓷材料氮化硼(BN)晶体有多种结构。立方相氮 2 2
CaSO4(s)
+ CO3 (aq) CaCO3(s)
+ SO4 (aq)
化硼是超硬材料,其结构与金刚石相似。六方相氮化硼与
石墨相似,具有层状结构,层间是分子间作用力。它们的 18. 某反应过程的能量变化如图所示。下列说法中,不.正.确.的是
A.该反应为放热反应
晶体结构如右图。下列说法不.正.确.的是
B.曲线 b 表示有催化剂参与的反应过程
A.立方相氮化硼属于共价晶体 C.反应 i 的 H>0
D.反应 i 比反应 ii 的速率大
B.立方相氮化硼中存在 B─N 配位键
C.1 mol 六方相氮化硼含 4 mol B─N 共价键
D.六方相氮化硼中 B 原子和 N 原子的杂化轨道类型均为 sp2 杂化
高二化学 第 3 页 共 8 页 高二化学 第 4 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
19.一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入 A 和 B,发生反应: 第二部分
3A(g) + B(g) 2C(g) H<0,200 ℃时该反应的化学平衡常数 K=1,反应体系
本部分共 4题,共 50分。
中各物质的物质的量浓度的相关数据如下:
容器 温度 起始时物质的浓度 10 分钟时物质的浓度 21.(10 分)甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为
℃ (mol/L) (mol/L)
c(A) c(B) c(C)
甲 200 6 2 1
乙 300 6 2 0.8
丙 200 6 3 a (1)C、H、O 三种元素的电负性由大到小的顺序为________。
下列说法中,不.正.确.的是 (2)H2O 的中心原子上的孤电子对数为________。
A.K 甲>K 乙
B.甲中,10 分钟内 A 的化学反应速率υ(A)= 0.15 mol/(L·min) (3)HCHO 分子内 σ 键与 π 键个数之比为________,HCHO 的空间结构为________。
C.乙中,10 分钟时υ正 =υ逆 (4)CH3OH 和 HCHO 分子中碳原子的杂化轨道类型分别为________和________。
D.丙中,达到化学平衡状态时 A 的转化率是 25%
(5)甲醇氧化生成 HCHO 时,会产生 CO、CO2、CH3OCH3 等副产物。相同条件下,CO2 的沸点比
20.常温下完成下列实验。其中实验 I 中浑浊不消失,实验Ⅱ和Ⅲ中浊液变澄清。 O2的高,主要原因为________。
下列说法中,不.正.确.的是
(6)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:________。
22.( 3-14 分)[FeF6] 与许多金属离子或
+
NH4 形成的化合物有广泛的用途。
(1)基态 Fe 原子的价层电子轨道表示式为_______。
A.实验 I 中加入 8 滴水后溶液的 pH 不变 (2)钢铁表面成膜技术是钢铁防腐的重要方法。工业上利用某种转化液使钢铁表面形成致密的 K3[FeF6]
+ 2
B.实验Ⅱ中加入浓氨水后,c(Na+) + c(H+) + c(NH4 ) = 2c(CO3 ) + c(HCO3 ) + c(OH
)
膜以进行防腐,该转化液是含 KF、HNO
2 3
、(NH4)2S2O8(或 H2O2)等物质的溶液(pH ≈ 2)。
C.实验Ⅲ中加入 NH4Cl 溶液后,c(CO3 )/c(HCO3 )比值增大
2-
D.实验Ⅱ和实验Ⅲ中浊液变澄清可能与 HCO3的电离平衡、水解平衡有关 S2O8 的结构如下:
①比较 O 原子和 S 原子的第一电离能大小,从原子结构的角度说明理由:
_______。
高二化学 第 5 页 共 8 页 高二化学 第 6 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
②下列说法正确的是_______(填字母)。
a.(NH4)2S2O8能将
2+
Fe 氧化为 3+Fe 的可能原因是含有“-O-O-”结构
b.依据结构分析,(NH4)2S2O8中硫元素的化合价为+7 价
2-
c.S2O8 中“S-O-O”在一条直线上
③ 转化液 pH 过小时,不易得到 K3[FeF6],原因是_______。
-1
( ) 3-
①ΔH3= kJ·mol 。
与 +3 [FeF6] NH4 形成的化合物可以作为锂离子电池的电极材料。
②为维持炉内温度基本不变,FeSO4所带结晶水越多,掺烧比[n(FeS2) : n(FeSO4)]应
①化合物(NH4)3[FeF6]中的化学键类型有_______(填字母)。
______。(填“增大”“减小”或“不变”)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
Ⅱ.浸出法处理ZnS
② (NH4)3[FeF6]的晶胞形状为立方体,边长为 a nm,结构如下图所示:
(3)ZnS难溶于水,处理ZnS常使用酸浸法,两步反应依次为:
ⅰ + 2+ -3 . ZnS(s) + 2H (aq) Zn (aq) + H2S(aq) K1 = 2.2×10
ⅱ.2H2S + O2 ===
71
2H2O + 2S K2 = 2×10
①平衡常数 K1的表达式为______。
图中 + 3-“ ”代表的是_______(填“NH ”或“[FeF6] ”)。 ②仅发生反应ⅰ时,ZnS 酸浸效果不好,结合平衡常数说明原因:______。 4
已知 的摩尔质量是 · -1(NH4)3[FeF6] M g mol ,阿伏加德罗常数为 NA,该晶体的密度 (4)从平衡移动角度解释通入 O2在 ZnS 酸浸过程中的作用:______。
为 · -3 -7_______ g cm 。(1nm =10 cm)
24.(12 分)某同学利用如图所示装置制作简单的燃料电池。
(1)闭合 K1,断开 K2。
23.(14 分)金属矿物常以硫化物形式存在,如 FeS2、ZnS 等。 ①电极 a 的电极反应式是_____。
2
Ⅰ.掺烧FeS 和FeSO ,用于制铁精粉和硫酸 ②SO4 的迁移方向为_____ (填“a→b”或“b→a”)。 2 4
=== ③一段时间后,电极 b 附近的现象是_____。 (1)已知:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)为吸热反应。25℃、101 kPa时,1 mol
(2)一段时间后断开 K1,闭合 K2,电流表的指针偏转。
FeS2固体在2.75 mol氧气中完全燃烧生成气态SO2和Fe2O3固体,放出826 kJ热量。
①电极 b 的电极反应式是_____。
①FeS2与O2反应的热化学方程式为______。
②总反应的化学方程式是_____。
②将FeS2与FeSO4掺烧(混合燃烧),其目的包括______(填字母)。 (3)下列说法中,不.正.确.的是_____(填字母)。
a. 节约燃料和能量 b. 为制备硫酸提供原料 c. 减少空气污染 a.通过调节 K1、K2 可以实现化学能和电能的相互转化
(2)FeSO4常带一定量的结晶水。FeSO4·7H2O(s)分解脱水反应的能量变化如下图所示。 b.若将 Na2SO4 溶液替换为稀硫酸,闭合 K2 后,电极反应不变
c.闭合 K1,电路中每转移 4 mol 电子,电极 a 理论上产生的气体在标准状况下
的体积为 44.8 L
高二化学 第 7 页 共 8 页 高二化学 第 8 页 共 8 页
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
2023—2024 学年度第二学期 3 月调研 高二化学参考答案
选择题 ( 1-10 题每题 3 分,11-20 题每题 2 分,共 50 分。)
1-5 ACADA 6-10 CCCAD 11-15 CDACC 16-20 DBDDC
非选择(共 50 分,除标记的空,每空 2 分。)
21.(10 分,(5)(6)每空 2 分,其余每空 1 分)
(1)O>C>H (2)2 (3)3︰1 平面三角形
( ) 3 2 4 sp sp
(5)CO2和 O2 都属于分子晶体,CO2 相对分子质量大,范德华力强
(6)甲醛分子与水分子能形成分子间氢键
22.(14 分)
(1) 3d 4s
(2)① 第一电离能 O>S。O 和 S 为同主族元素,电子层数 S>O,原子半径 S>O,原子
核对最外层电子的吸引作用 O>S。
② a
③ + c(H )较大, -与 + -F H 结合形成 HF,c(F )降低,不易与 3+Fe 形成 3-[FeF6]
(3)① abe
3- ② [FeF6]
23.(14 分)
(1)① -14FeS2(s) + 11O2(g) === 2Fe2O3(s) + 8SO2(g) ΔH= -3304kJ·mol ②ab
(2)①+31.4 ②增大
( +) ( )(3)①K1= + ②K1较小,说明 ZnS 酸浸反应ⅰ进行得不充分(合理即可) ( )
(4)O2与 H2S 充分反应,使平衡ⅰ正向移动,促进 ZnS 的溶解(合理即可)
24. (12 分)
-
(1)①2H2O - 4e == O
+
2 + 4H ②b→a ③产生无色气泡,溶液变为红色
- -
(2)①H2 - 2e
+ 2OH == 2H2O
-
②2H + + 2 O2 == 2H2O 或 2H2 + 4OH + O2 + 4H == 6H2O
(3)bc
{#{QQABJQIQogigApBAABgCEQWCCAMQkBEACIoOAAAAIAAAiAFABAA=}#}
同课章节目录
