2.3.2 分子间的作用力(课件)(共21张PPT)高二化学(人教版2019选择性必修2)
文档属性
| 名称 | 2.3.2 分子间的作用力(课件)(共21张PPT)高二化学(人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-30 14:49:21 | ||
图片预览





文档简介
(共21张PPT)
年 级:高二 学 科:化学(人教版)
课时2.3.2 分子间的作用力
第三节 分子的结构与物质的性质
第二章 分子结构与性质
1.熟悉两种常见的分子间作用力:范德华力和氢键;了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用,培养宏观辨识与微观探析的核心素养。
2.结合实例初步认识分子的手性以及手性分子在生命科学和药物合成中的应用,培养科学态度与社会责任的核心素养。
1.了解范德华力的实质及对物质性质的影响。
2.知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
学习目标
下雪不冷,化雪冷
【思考与讨论】
冰山融化现象是物理变化还是化学变化?
冰山融化过程中有没有破坏其中的化学键?
冰雪融化成水,需要吸热;
把水变成水蒸气仍然需要吸热。
这说明水分子之间存在着相互作用力。
下面我们学习:分子间的作用力
二、分子间的作用力——范德华力1、概念:物质的分子之间存在着相互作用力,把这类分子间作用力称为范德华力,常见的分子间作用力有范德华力和氢键两类。
本质:属于分子间作用力的一种,是一种分子之间的静电作用。广泛存在于各种相邻的分子之间。
2、证明分子间作用力的存在:降低气体的温度时,气体分子的平均动能逐渐减小。随着温度降低,分子间的距离逐渐减小,最后凝聚在一起,形成液态或固体。在这个过程中,分子由不规则运动的混乱状态转变为有规则排列,这个事实证明分子间存在着相互作用。
范德华力与共价键的区别
(1)范德华力很弱,比化学键的键能小1∽2个数量级。
(2)范德华力一般没有方向性和饱和性
(3)主要影响物理性质--熔沸点
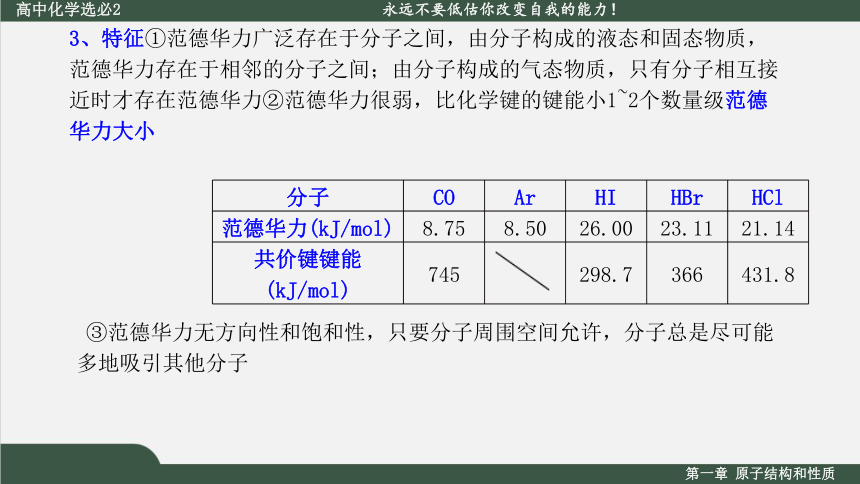
3、特征①范德华力广泛存在于分子之间,由分子构成的液态和固态物质,范德华力存在于相邻的分子之间;由分子构成的气态物质,只有分子相互接近时才存在范德华力②范德华力很弱,比化学键的键能小1~2个数量级范德华力大小
分子 CO Ar HI HBr HCl
范德华力(kJ/mol) 8.75 8.50 26.00 23.11 21.14
共价键键能(kJ/mol) 745 298.7 366 431.8
③范德华力无方向性和饱和性,只要分子周围空间允许,分子总是尽可能多地吸引其他分子
哪些物质的微粒存在分子间作用力呢?
大多数共价化合物分子间,例如:
CO2、H2SO4、HF, H2O, AlCl3、各种有机化合物等等;
2.大多数非金属单质分子间;石墨片层之间,例如:H2、P4、S8、C60、
3.各种稀有气体分子间(例如Ar、Kr),等等
离子化合物,例如:
NH4Cl、Al2O3、KF,等等;
金属单质,例如:
Cu、Fe、Na,等等;
某些共价化合物,如石英SiO2,金刚砂 SiC;某些非金属单质,如金刚石C、晶体硅Si,等等
1.
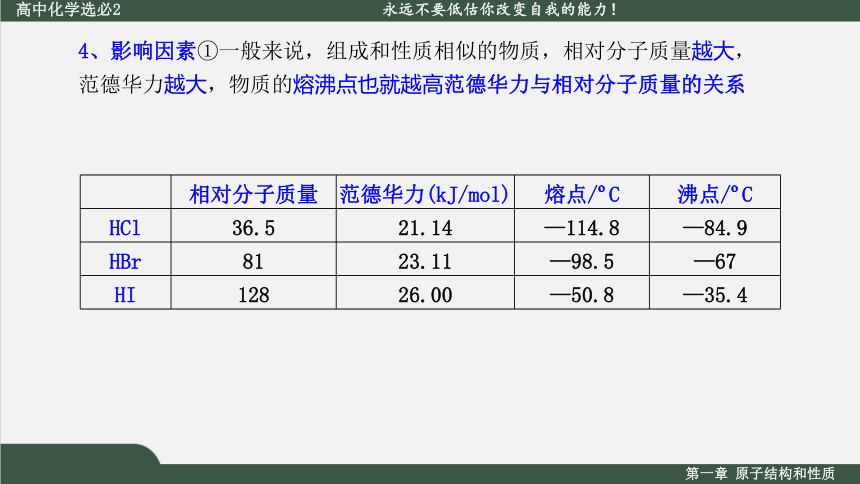
4、影响因素①一般来说,组成和性质相似的物质,相对分子质量越大,范德华力越大,物质的熔沸点也就越高范德华力与相对分子质量的关系
相对分子质量 范德华力(kJ/mol) 熔点/ C 沸点/ C
HCl 36.5 21.14 —114.8 —84.9
HBr 81 23.11 —98.5 —67
HI 128 26.00 —50.8 —35.4
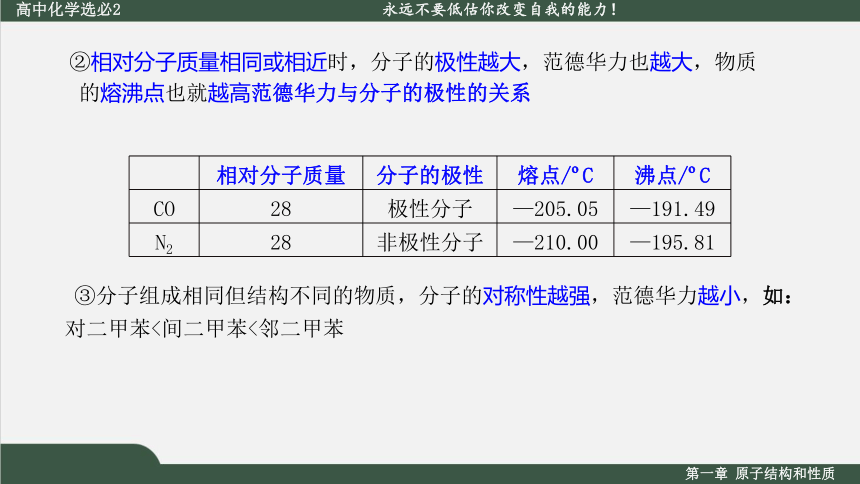
②相对分子质量相同或相近时,分子的极性越大,范德华力也越大,物质的熔沸点也就越高范德华力与分子的极性的关系
相对分子质量 分子的极性 熔点/ C 沸点/ C
CO 28 极性分子 —205.05 —191.49
N2 28 非极性分子 —210.00 —195.81
③分子组成相同但结构不同的物质,分子的对称性越强,范德华力越小,如:对二甲苯<间二甲苯<邻二甲苯
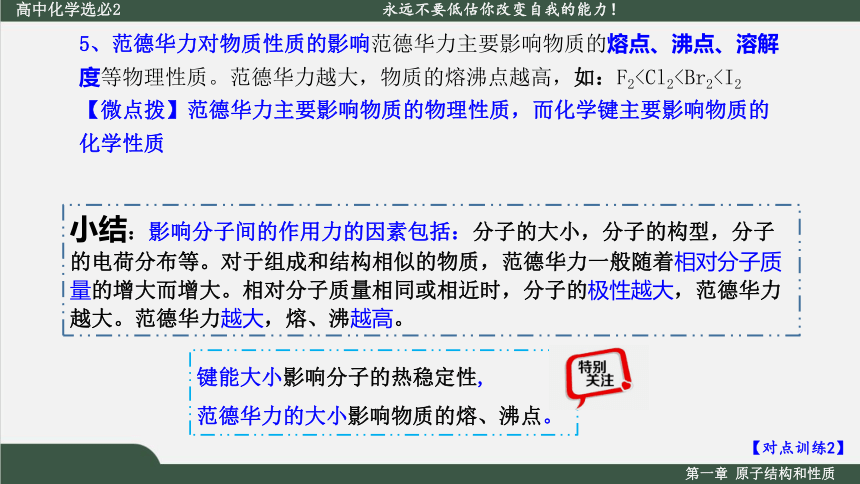
5、范德华力对物质性质的影响范德华力主要影响物质的熔点、沸点、溶解度等物理性质。范德华力越大,物质的熔沸点越高,如:F2【对点训练2】
小结:影响分子间的作用力的因素包括:分子的大小,分子的构型,分子的电荷分布等。对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增大。相对分子质量相同或相近时,分子的极性越大,范德华力越大。范德华力越大,熔、沸越高。
键能大小影响分子的热稳定性,
范德华力的大小影响物质的熔、沸点。
小结:
判断分子的熔沸点高低的方法
相对分子质量(越大)→范德华力(越大)→熔沸点(越高)
如果两物质的相对分子质量相近,则看分子的极性。
分子的极性(越大)→范德华力(越大)→熔沸点(越高)
例:将下列物质按熔沸点由高到低的顺序排列:
D2O_____H2O I2_____Br2
CO_____N2 CH4_____SiH4
>
>
>
<
101.4℃
100℃
184.35℃
58.76℃
-190℃
-195.8℃
-161.5℃
-111.9℃
1.组成和结构相似的分子,相对分子质量越大,范德华力越大,物质的熔、沸点就越高,如熔、沸点:CF42.组成相似且相对分子质量相近的物质,分子极性越大(电荷分布越不均匀),其熔、沸点就越高,如熔、沸点:CO>N2。
3.在同分异构体中,一般来说,支链数越多,熔、沸点就越低,如沸点:正戊烷>异戊烷>新戊烷。
归纳总结
化学键 范德华力
概念
存在范围
作用力强弱
影响的性质
使原子(离子)结合的强烈的相互作用
把分子聚集在一起的较弱的作用力
分子内、原子间
分子间
较 强
很 弱
化学性质
物理性质(如熔沸点)
化学键与范德华力的比较
知识拓展:构成物质的微粒之间的作用力
1. 非金属单质:有的非金属单质,内部只有共价键,不存在分子,例如金刚石(C);Si
有的非金属单质,原子之间靠共价键连接,并形成分子,分子之间有分子间作用力,如C60。P4,H2 , O2
2. 共价化合物:由两个或两个以上的不同元素的原子构成,原子之间有共价键相互连接;如果原子按一定的结合方式形成分子,则分子之间有分子间作用力;例如CO2,NO,NO2 N2O3,SO2;
而有些共价化合物不形成分子,例如SiO2,只有Si—O键,没有分子间作用力,再如SiC,只有Si—C键,没有分子间作用力。
3. 离子化合物:
由阳离子与阴离子构成,离子之间有离子键,没有分子这一概念,因此不存在分子间作用力。
NaCl
CaF2
4. 金属单质:
由金属阳离子与自由电子构成,有金属键进行联系,无分子的概念,因此也不存在分子间作用力.
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)极性分子中不可能含有非极性键( )
(2)一般极性分子中含有极性键 ( )
(3)H2O、CO2、CH4都是非极性分子 ( )
(4)HF的沸点较高,是因为H—F的键能很大( )
×
×
×
√
2.下列各组物质中,都是由极性键形成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl
解析:CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S都是由极性键形成的极性分子,Br2是由非极性键形成的非极性分子。
B
3.下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的区别是作用力的强弱问题
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏分子间的范德华力不需要消耗能量
解析:范德华力的实质也是一种电性作用,但范德华力是分子间较弱的作用力,不是化学键,A错误;化学键是粒子间的强烈的相互作用,范德华力是分子间较弱的作用力,B正确;若分子间的距离足够远,则分子间没有范德华力,C错误;虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。
B
4.下列物质的变化中,破坏的主要是范德华力的是( )
A.碘单质的升华 B.NaCl溶于水
C.将冰加热变为液态 D.NH4Cl受热分解
解析:碘升华只是状态发生了变化,破坏的是范德华力,没有破坏化学键;NaCl溶于水,会破坏离子键;冰由固态变为液态,破坏的主要是氢键;NH4Cl受热分解,破坏的是化学键(包括共价键和离子键)。
A
5.(1)BCl3分子的空间结构为平面三角形,则BCl3分子为________(填“极性”或“非极性”,下同)分子,其分子中的共价键类型为________键。
(2)BF3的熔点比BCl3 _____ (填“高”“低”或“无法确定”)。
解析: (1)BCl3分子的空间结构为平面三角形,故BCl3为含有极性键的非极性分子。(2)BF3与BCl3的组成和结构相似,但BF3的相对分子质量较小,范德华力较弱,熔点较低。
非极性
极性
低
年 级:高二 学 科:化学(人教版)
课时2.3.2 分子间的作用力
第三节 分子的结构与物质的性质
第二章 分子结构与性质
1.熟悉两种常见的分子间作用力:范德华力和氢键;了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用,培养宏观辨识与微观探析的核心素养。
2.结合实例初步认识分子的手性以及手性分子在生命科学和药物合成中的应用,培养科学态度与社会责任的核心素养。
1.了解范德华力的实质及对物质性质的影响。
2.知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
学习目标
下雪不冷,化雪冷
【思考与讨论】
冰山融化现象是物理变化还是化学变化?
冰山融化过程中有没有破坏其中的化学键?
冰雪融化成水,需要吸热;
把水变成水蒸气仍然需要吸热。
这说明水分子之间存在着相互作用力。
下面我们学习:分子间的作用力
二、分子间的作用力——范德华力1、概念:物质的分子之间存在着相互作用力,把这类分子间作用力称为范德华力,常见的分子间作用力有范德华力和氢键两类。
本质:属于分子间作用力的一种,是一种分子之间的静电作用。广泛存在于各种相邻的分子之间。
2、证明分子间作用力的存在:降低气体的温度时,气体分子的平均动能逐渐减小。随着温度降低,分子间的距离逐渐减小,最后凝聚在一起,形成液态或固体。在这个过程中,分子由不规则运动的混乱状态转变为有规则排列,这个事实证明分子间存在着相互作用。
范德华力与共价键的区别
(1)范德华力很弱,比化学键的键能小1∽2个数量级。
(2)范德华力一般没有方向性和饱和性
(3)主要影响物理性质--熔沸点
3、特征①范德华力广泛存在于分子之间,由分子构成的液态和固态物质,范德华力存在于相邻的分子之间;由分子构成的气态物质,只有分子相互接近时才存在范德华力②范德华力很弱,比化学键的键能小1~2个数量级范德华力大小
分子 CO Ar HI HBr HCl
范德华力(kJ/mol) 8.75 8.50 26.00 23.11 21.14
共价键键能(kJ/mol) 745 298.7 366 431.8
③范德华力无方向性和饱和性,只要分子周围空间允许,分子总是尽可能多地吸引其他分子
哪些物质的微粒存在分子间作用力呢?
大多数共价化合物分子间,例如:
CO2、H2SO4、HF, H2O, AlCl3、各种有机化合物等等;
2.大多数非金属单质分子间;石墨片层之间,例如:H2、P4、S8、C60、
3.各种稀有气体分子间(例如Ar、Kr),等等
离子化合物,例如:
NH4Cl、Al2O3、KF,等等;
金属单质,例如:
Cu、Fe、Na,等等;
某些共价化合物,如石英SiO2,金刚砂 SiC;某些非金属单质,如金刚石C、晶体硅Si,等等
1.
4、影响因素①一般来说,组成和性质相似的物质,相对分子质量越大,范德华力越大,物质的熔沸点也就越高范德华力与相对分子质量的关系
相对分子质量 范德华力(kJ/mol) 熔点/ C 沸点/ C
HCl 36.5 21.14 —114.8 —84.9
HBr 81 23.11 —98.5 —67
HI 128 26.00 —50.8 —35.4
②相对分子质量相同或相近时,分子的极性越大,范德华力也越大,物质的熔沸点也就越高范德华力与分子的极性的关系
相对分子质量 分子的极性 熔点/ C 沸点/ C
CO 28 极性分子 —205.05 —191.49
N2 28 非极性分子 —210.00 —195.81
③分子组成相同但结构不同的物质,分子的对称性越强,范德华力越小,如:对二甲苯<间二甲苯<邻二甲苯
5、范德华力对物质性质的影响范德华力主要影响物质的熔点、沸点、溶解度等物理性质。范德华力越大,物质的熔沸点越高,如:F2
小结:影响分子间的作用力的因素包括:分子的大小,分子的构型,分子的电荷分布等。对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增大。相对分子质量相同或相近时,分子的极性越大,范德华力越大。范德华力越大,熔、沸越高。
键能大小影响分子的热稳定性,
范德华力的大小影响物质的熔、沸点。
小结:
判断分子的熔沸点高低的方法
相对分子质量(越大)→范德华力(越大)→熔沸点(越高)
如果两物质的相对分子质量相近,则看分子的极性。
分子的极性(越大)→范德华力(越大)→熔沸点(越高)
例:将下列物质按熔沸点由高到低的顺序排列:
D2O_____H2O I2_____Br2
CO_____N2 CH4_____SiH4
>
>
>
<
101.4℃
100℃
184.35℃
58.76℃
-190℃
-195.8℃
-161.5℃
-111.9℃
1.组成和结构相似的分子,相对分子质量越大,范德华力越大,物质的熔、沸点就越高,如熔、沸点:CF4
3.在同分异构体中,一般来说,支链数越多,熔、沸点就越低,如沸点:正戊烷>异戊烷>新戊烷。
归纳总结
化学键 范德华力
概念
存在范围
作用力强弱
影响的性质
使原子(离子)结合的强烈的相互作用
把分子聚集在一起的较弱的作用力
分子内、原子间
分子间
较 强
很 弱
化学性质
物理性质(如熔沸点)
化学键与范德华力的比较
知识拓展:构成物质的微粒之间的作用力
1. 非金属单质:有的非金属单质,内部只有共价键,不存在分子,例如金刚石(C);Si
有的非金属单质,原子之间靠共价键连接,并形成分子,分子之间有分子间作用力,如C60。P4,H2 , O2
2. 共价化合物:由两个或两个以上的不同元素的原子构成,原子之间有共价键相互连接;如果原子按一定的结合方式形成分子,则分子之间有分子间作用力;例如CO2,NO,NO2 N2O3,SO2;
而有些共价化合物不形成分子,例如SiO2,只有Si—O键,没有分子间作用力,再如SiC,只有Si—C键,没有分子间作用力。
3. 离子化合物:
由阳离子与阴离子构成,离子之间有离子键,没有分子这一概念,因此不存在分子间作用力。
NaCl
CaF2
4. 金属单质:
由金属阳离子与自由电子构成,有金属键进行联系,无分子的概念,因此也不存在分子间作用力.
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)极性分子中不可能含有非极性键( )
(2)一般极性分子中含有极性键 ( )
(3)H2O、CO2、CH4都是非极性分子 ( )
(4)HF的沸点较高,是因为H—F的键能很大( )
×
×
×
√
2.下列各组物质中,都是由极性键形成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl
解析:CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S都是由极性键形成的极性分子,Br2是由非极性键形成的非极性分子。
B
3.下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的区别是作用力的强弱问题
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏分子间的范德华力不需要消耗能量
解析:范德华力的实质也是一种电性作用,但范德华力是分子间较弱的作用力,不是化学键,A错误;化学键是粒子间的强烈的相互作用,范德华力是分子间较弱的作用力,B正确;若分子间的距离足够远,则分子间没有范德华力,C错误;虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。
B
4.下列物质的变化中,破坏的主要是范德华力的是( )
A.碘单质的升华 B.NaCl溶于水
C.将冰加热变为液态 D.NH4Cl受热分解
解析:碘升华只是状态发生了变化,破坏的是范德华力,没有破坏化学键;NaCl溶于水,会破坏离子键;冰由固态变为液态,破坏的主要是氢键;NH4Cl受热分解,破坏的是化学键(包括共价键和离子键)。
A
5.(1)BCl3分子的空间结构为平面三角形,则BCl3分子为________(填“极性”或“非极性”,下同)分子,其分子中的共价键类型为________键。
(2)BF3的熔点比BCl3 _____ (填“高”“低”或“无法确定”)。
解析: (1)BCl3分子的空间结构为平面三角形,故BCl3为含有极性键的非极性分子。(2)BF3与BCl3的组成和结构相似,但BF3的相对分子质量较小,范德华力较弱,熔点较低。
非极性
极性
低
