7.1.2烷烃的性质(共29张PPT)-2023-2024学年高一下学期人教版(2019)高中化学必修2
文档属性
| 名称 | 7.1.2烷烃的性质(共29张PPT)-2023-2024学年高一下学期人教版(2019)高中化学必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 47.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-30 17:07:42 | ||
图片预览






文档简介
(共29张PPT)
第一节 认识有机化合物
课时2 烷烃的性质
第七章 有机化合物
新人教版 化学 必修第二册
分析并掌握烷烃的物理性质
PART
01
PART
02
PART
03
通过甲烷化学性质的学习,掌握烷烃的化学性质
学习目标
通过甲烷与氯气反应,认识取代反应的原理
1.掌握烷烃的物理性质
2.掌握烷烃的化学性质
甲烷与氯气发生取代反应的实验探究和反应原理的微观探析
难点:
重点和难点
重点:
目录
01
烷烃的物理性质
02
烷烃的化学性质
情景导入
天然气
沼气
蜡烛
凡士林
以下这些物质大家并不陌生,你们知道它们的主要成分吗?
生活中使用的天然气,沼气,以及煤矿坑道气(煤层气)、油田气、瓦斯等主要成分都是甲烷(CH4)。蜡烛中的石蜡和护肤品、医用软膏中的“凡士林”,其主要成分是含碳原子数较多的烷烃。
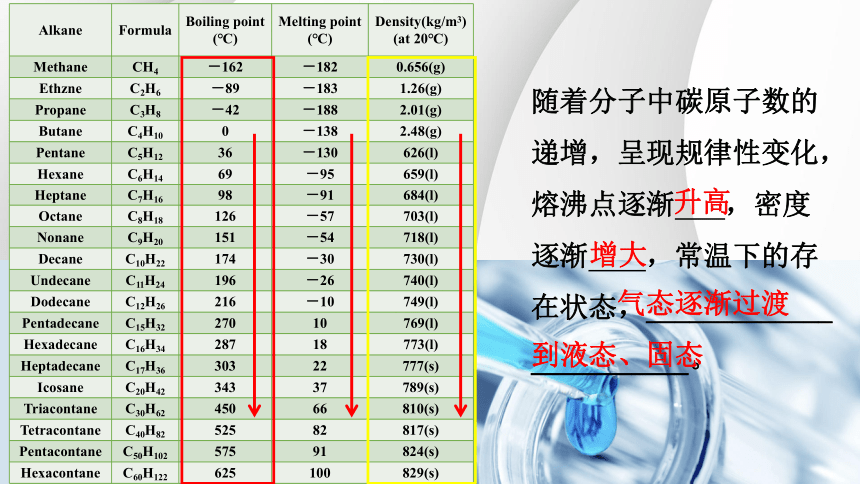
一、烷烃的物理性质
Alkane Formula Boiling point (℃) Melting point (℃) Density(kg/m3)
(at 20℃)
Methane CH4 -162 -182 0.656(g)
Ethzne C2H6 -89 -183 1.26(g)
Propane C3H8 -42 -188 2.01(g)
Butane C4H10 0 -138 2.48(g)
Pentane C5H12 36 -130 626(l)
Hexane C6H14 69 -95 659(l)
Heptane C7H16 98 -91 684(l)
Octane C8H18 126 -57 703(l)
Nonane C9H20 151 -54 718(l)
Decane C10H22 174 -30 730(l)
Undecane C11H24 196 -26 740(l)
Dodecane C12H26 216 -10 749(l)
Pentadecane C15H32 270 10 769(l)
Hexadecane C16H34 287 18 773(l)
Heptadecane C17H36 303 22 777(s)
Icosane C20H42 343 37 789(s)
Triacontane C30H62 450 66 810(s)
Tetracontane C40H82 525 82 817(s)
Pentacontane C50H102 575 91 824(s)
Hexacontane C60H122 625 100 829(s)
随着分子中碳原子数的递增,呈现规律性变化,
熔沸点逐渐 ,密度逐渐 ,常温下的存在状态,_____________
___________。
升高
增大
气态逐渐过渡
到液态、固态
一、烷烃的物理性质
Alkane Formula Boiling point (℃) Melting point (℃) Density(kg/m3)
(at 20℃)
Methane CH4 -162 -182 0.656(g)
Ethzne C2H6 -89 -183 1.26(g)
Propane C3H8 -42 -188 2.01(g)
Butane C4H10 0 -138 2.48(g)
Pentane C5H12 36 -130 626(l)
Hexane C6H14 69 -95 659(l)
Heptane C7H16 98 -91 684(l)
Octane C8H18 126 -57 703(l)
Nonane C9H20 151 -54 718(l)
Decane C10H22 174 -30 730(l)
Undecane C11H24 196 -26 740(l)
Dodecane C12H26 216 -10 749(l)
Pentadecane C15H32 270 10 769(l)
Hexadecane C16H34 287 18 773(l)
Heptadecane C17H36 303 22 777(s)
Icosane C20H42 343 37 789(s)
Triacontane C30H62 450 66 810(s)
Tetracontane C40H82 525 82 817(s)
Pentacontane C50H102 575 91 824(s)
Hexacontane C60H122 625 100 829(s)
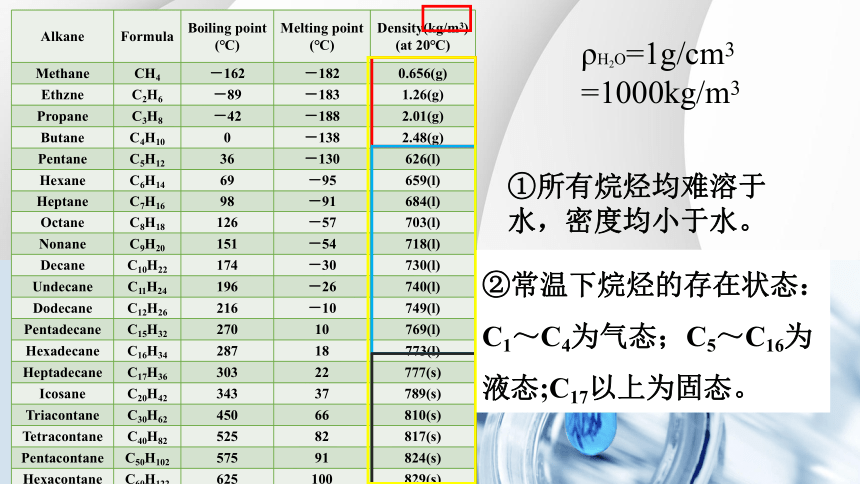
②常温下烷烃的存在状态:C1~C4为气态;C5~C16为液态;C17以上为固态。
ρH2O=1g/cm3 =1000kg/m3
①所有烷烃均难溶于水,密度均小于水。
一、烷烃的物理性质
烷烃物理性质递变规律
烷烃,随着碳原子数的递增,熔点、沸点逐渐升高、密度逐渐增大,且小于水。均难溶于水。
常温下烷烃的存在状态:C1~C4为气态;C5~C16为液态;C17以上为固态。
同分异构体的熔点沸点规律:支链越多,熔点沸点越低。
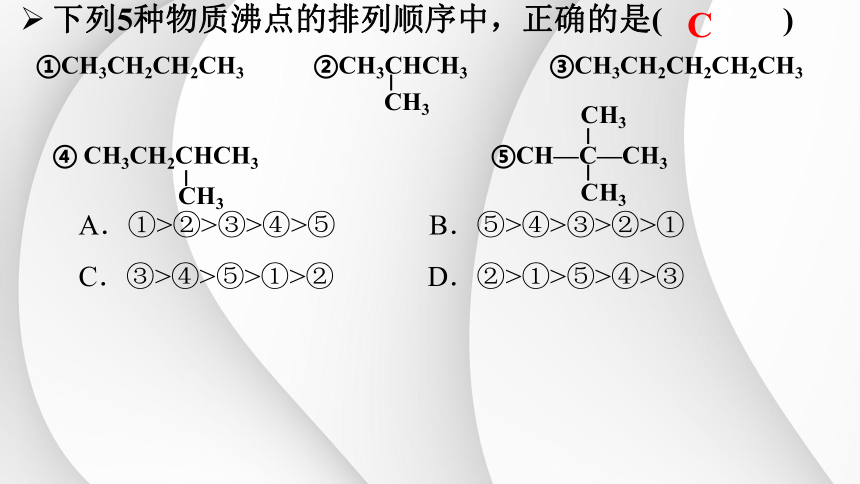
C
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
①CH3CH2CH2CH3 ②CH3CHCH3 ③CH3CH2CH2CH2CH3
④ CH3CH2CHCH3 ⑤CH—C—CH3
CH3
I
CH3
I
下列5种物质沸点的排列顺序中,正确的是( )
CH3
I
I
CH3
二、烷烃的化学性质
1.稳定性
通常情况下,烷烃比较稳定,与强酸、强碱或酸性高锰酸钾等强氧化剂都不发生反应。
二、烷烃的化学性质
以甲烷为例
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。
2.氧化反应
CH4爆炸极限:5%~15.4%
1.点燃甲烷前必须验纯,否则会爆炸。
2.有机反应方程式中用“ → ”不用“=”
燃烧
二、烷烃的化学性质
烷烃都能燃烧。
烷烃燃烧通式:_____________________________________
2.氧化反应
燃料
甲烷
丙烷
石蜡
煤油
丁烷
燃烧
3.高温分解
烷烃在较高温度下会发生分解。这个性质常被应用于石油化工和天然气化工生产中,从烷烃可得到一系列重要的化工基本原料和燃料。
C4H10 C2H4+C2H6
△
C16H34 C8H16+C8H18
二、烷烃的化学性质
实验探究 —— 甲烷与氯气反应
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4,和半试管Cl2,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
注意:暗处不反应 强光会爆炸
二、烷烃的化学性质
实验现象 原因分析
无光照
光照
无明显变化
无光照该反应不能发生
试管内气体颜色变浅
氯气逐渐消耗
试管壁上有油状液滴
生成不溶于水的液体
试管中液面上升
生成的气体溶于水中使试管内压强减小
水槽中有固体析出
Cl-饱和
可能观察到白雾
生成了易溶于水的HCl气体
二、烷烃的化学性质
如:一氯甲烷的形成
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
CH4 + Cl2 CH3Cl + HCl
光
常温下是无色气体,沸点:-24.2 ℃,难溶于水,主要用作有机硅的原料,也用作溶剂、冷冻剂、香料等。
(一氯甲烷)
二、烷烃的化学性质
如:二氯甲烷的形成
常温下是油状液体,沸点:39.8 ℃,难溶于水,用作牙科局部麻醉剂、冷冻剂、灭火剂、金属表面漆层清洗脱脂及脱膜剂。
CH3Cl + Cl2 CH2Cl2 + HCl
光
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
C
Cl
H
H
Cl
二氯甲烷只有一种结构,说明甲烷分子是正四面体形
(二氯甲烷)
二、烷烃的化学性质
如:三氯甲烷的形成
三氯甲烷(又称“氯仿”):常温下是油状液体,沸点:61.7 ℃,难溶于水,密度比水大的液体,常用作有机溶剂,主要用来生产氟利昂、染料和药物,在医学上,常用作麻醉剂
CH2Cl2 + Cl2 CHCl3 + HCl
光
(三氯甲烷)
Cl—Cl
+
光
Cl
H
+
C
Cl
H
H
Cl
C
H
Cl
Cl
Cl
二、烷烃的化学性质
如:四氯甲烷的形成
四氯甲烷(又称“四氯化碳”):常温下是油状液体,沸点:76.5 ℃,难溶于水,主要用作优良的溶剂、干洗剂、灭火剂、制冷剂及农药等
CHCl3 + Cl2 CCl4 + HCl
光
Cl—Cl
+
光
Cl
H
+
C
H
Cl
Cl
Cl
C
Cl
Cl
Cl
Cl
(四氯甲烷)
二、烷烃的化学性质
CH4 + Cl2 CH3Cl + HCl
光
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应
CH3Cl + Cl2 CH2Cl2+ HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4+ HCl
光
特点:是“上一下一,取而代之”,类似无机反应中的复分解反应,注意在书写化学方程式时,防止漏写产物中的小分子。
每取代n mol H原子需要n mol Cl2
4.取代反应
二、烷烃的化学性质
烷烃(以甲烷为例)发生取代反应的一般规律
反应物 反应条件 生成物 反应特点 连锁反应
数量关系
甲烷与氯气(不能用氯水,需气态纯卤素单质)
漫散光照射(不用太阳光直射,以防爆炸)
甲烷与氯气反应生成四种有机产物:CH3Cl、CH2Cl2、CHCl3、CCl4和无机物HCl,其中HCl的产量最多(产物复杂)
甲烷中的氢原子被氯原子逐步取代,各步反应同时进行,即第一步反应一旦开始,后续反应立即进行(举例乙烷)
每取代1 mol氢原子,消耗1 mol Cl2,生成1 mol HCl
课堂小结
二、烷烃的化学性质(以甲烷为例进行分析)
三、用途
一、烷烃的物理性质
1、稳定性:
2、氧化反应—
3、取代反应(特征反应)
不与强酸、强碱、酸性KMnO4溶液反应
燃烧
现象:
反应条件:
特点:
光照,与气态纯卤素反应 (与氯水、溴水不反应)
逐步取代(随机并行),产物为混合物
除作燃料外,大量用于合成氨、尿素和炭黑,还可用于生产甲醇、氢气、乙炔、乙烯、甲醛、氢氰酸等。
4、高温分解:应用于石油化工和天然气化工生产中
碳原子数越多,熔沸点越高。当碳原子数相同时,支链越多,熔沸点越低。
课堂检测
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
D
1.下列关于烷烃性质的叙述正确的是( )
A.烷烃的沸点随碳原子数增加而逐渐降低
B.烷烃易被酸性高锰酸钾溶液氧化
C.在光照条件下,烷烃会发生分解
D.烷烃的取代反应很难得到纯净的产物
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
2.下列化学反应中不属于取代反应的是 (C )
A.CH2Cl2+Br2 CHBrCl2+HBr
B.CH3OH+HCl CH3Cl+H2O
C.2Na+2H2O==2NaOH+H2↑
D.CH3—CH2—Br+H2O CH3—CH2—OH+HBr
光照
光照
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
D
3.将体积比为1∶4的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )
A.产物中只有四氯化碳分子是正四面体结构
B.瓶中气体的黄绿色逐渐变浅,瓶内壁有油状液滴形成
C.若日光直射,可能发生爆炸
D.生成物只有CCl4、HCl
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
C
4.在标准状况下,22.4 L CH4与氯气在光照下发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的氯气为( )
A.1.25 mol B.2 mol
C.2.5 mol D.4 mol
THANKS
感谢观看
第一节 认识有机化合物
课时2 烷烃的性质
第七章 有机化合物
新人教版 化学 必修第二册
分析并掌握烷烃的物理性质
PART
01
PART
02
PART
03
通过甲烷化学性质的学习,掌握烷烃的化学性质
学习目标
通过甲烷与氯气反应,认识取代反应的原理
1.掌握烷烃的物理性质
2.掌握烷烃的化学性质
甲烷与氯气发生取代反应的实验探究和反应原理的微观探析
难点:
重点和难点
重点:
目录
01
烷烃的物理性质
02
烷烃的化学性质
情景导入
天然气
沼气
蜡烛
凡士林
以下这些物质大家并不陌生,你们知道它们的主要成分吗?
生活中使用的天然气,沼气,以及煤矿坑道气(煤层气)、油田气、瓦斯等主要成分都是甲烷(CH4)。蜡烛中的石蜡和护肤品、医用软膏中的“凡士林”,其主要成分是含碳原子数较多的烷烃。
一、烷烃的物理性质
Alkane Formula Boiling point (℃) Melting point (℃) Density(kg/m3)
(at 20℃)
Methane CH4 -162 -182 0.656(g)
Ethzne C2H6 -89 -183 1.26(g)
Propane C3H8 -42 -188 2.01(g)
Butane C4H10 0 -138 2.48(g)
Pentane C5H12 36 -130 626(l)
Hexane C6H14 69 -95 659(l)
Heptane C7H16 98 -91 684(l)
Octane C8H18 126 -57 703(l)
Nonane C9H20 151 -54 718(l)
Decane C10H22 174 -30 730(l)
Undecane C11H24 196 -26 740(l)
Dodecane C12H26 216 -10 749(l)
Pentadecane C15H32 270 10 769(l)
Hexadecane C16H34 287 18 773(l)
Heptadecane C17H36 303 22 777(s)
Icosane C20H42 343 37 789(s)
Triacontane C30H62 450 66 810(s)
Tetracontane C40H82 525 82 817(s)
Pentacontane C50H102 575 91 824(s)
Hexacontane C60H122 625 100 829(s)
随着分子中碳原子数的递增,呈现规律性变化,
熔沸点逐渐 ,密度逐渐 ,常温下的存在状态,_____________
___________。
升高
增大
气态逐渐过渡
到液态、固态
一、烷烃的物理性质
Alkane Formula Boiling point (℃) Melting point (℃) Density(kg/m3)
(at 20℃)
Methane CH4 -162 -182 0.656(g)
Ethzne C2H6 -89 -183 1.26(g)
Propane C3H8 -42 -188 2.01(g)
Butane C4H10 0 -138 2.48(g)
Pentane C5H12 36 -130 626(l)
Hexane C6H14 69 -95 659(l)
Heptane C7H16 98 -91 684(l)
Octane C8H18 126 -57 703(l)
Nonane C9H20 151 -54 718(l)
Decane C10H22 174 -30 730(l)
Undecane C11H24 196 -26 740(l)
Dodecane C12H26 216 -10 749(l)
Pentadecane C15H32 270 10 769(l)
Hexadecane C16H34 287 18 773(l)
Heptadecane C17H36 303 22 777(s)
Icosane C20H42 343 37 789(s)
Triacontane C30H62 450 66 810(s)
Tetracontane C40H82 525 82 817(s)
Pentacontane C50H102 575 91 824(s)
Hexacontane C60H122 625 100 829(s)
②常温下烷烃的存在状态:C1~C4为气态;C5~C16为液态;C17以上为固态。
ρH2O=1g/cm3 =1000kg/m3
①所有烷烃均难溶于水,密度均小于水。
一、烷烃的物理性质
烷烃物理性质递变规律
烷烃,随着碳原子数的递增,熔点、沸点逐渐升高、密度逐渐增大,且小于水。均难溶于水。
常温下烷烃的存在状态:C1~C4为气态;C5~C16为液态;C17以上为固态。
同分异构体的熔点沸点规律:支链越多,熔点沸点越低。
C
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
①CH3CH2CH2CH3 ②CH3CHCH3 ③CH3CH2CH2CH2CH3
④ CH3CH2CHCH3 ⑤CH—C—CH3
CH3
I
CH3
I
下列5种物质沸点的排列顺序中,正确的是( )
CH3
I
I
CH3
二、烷烃的化学性质
1.稳定性
通常情况下,烷烃比较稳定,与强酸、强碱或酸性高锰酸钾等强氧化剂都不发生反应。
二、烷烃的化学性质
以甲烷为例
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。
2.氧化反应
CH4爆炸极限:5%~15.4%
1.点燃甲烷前必须验纯,否则会爆炸。
2.有机反应方程式中用“ → ”不用“=”
燃烧
二、烷烃的化学性质
烷烃都能燃烧。
烷烃燃烧通式:_____________________________________
2.氧化反应
燃料
甲烷
丙烷
石蜡
煤油
丁烷
燃烧
3.高温分解
烷烃在较高温度下会发生分解。这个性质常被应用于石油化工和天然气化工生产中,从烷烃可得到一系列重要的化工基本原料和燃料。
C4H10 C2H4+C2H6
△
C16H34 C8H16+C8H18
二、烷烃的化学性质
实验探究 —— 甲烷与氯气反应
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4,和半试管Cl2,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
注意:暗处不反应 强光会爆炸
二、烷烃的化学性质
实验现象 原因分析
无光照
光照
无明显变化
无光照该反应不能发生
试管内气体颜色变浅
氯气逐渐消耗
试管壁上有油状液滴
生成不溶于水的液体
试管中液面上升
生成的气体溶于水中使试管内压强减小
水槽中有固体析出
Cl-饱和
可能观察到白雾
生成了易溶于水的HCl气体
二、烷烃的化学性质
如:一氯甲烷的形成
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
CH4 + Cl2 CH3Cl + HCl
光
常温下是无色气体,沸点:-24.2 ℃,难溶于水,主要用作有机硅的原料,也用作溶剂、冷冻剂、香料等。
(一氯甲烷)
二、烷烃的化学性质
如:二氯甲烷的形成
常温下是油状液体,沸点:39.8 ℃,难溶于水,用作牙科局部麻醉剂、冷冻剂、灭火剂、金属表面漆层清洗脱脂及脱膜剂。
CH3Cl + Cl2 CH2Cl2 + HCl
光
Cl—Cl
+
光
C
H
H
H
Cl
Cl
H
+
C
Cl
H
H
Cl
二氯甲烷只有一种结构,说明甲烷分子是正四面体形
(二氯甲烷)
二、烷烃的化学性质
如:三氯甲烷的形成
三氯甲烷(又称“氯仿”):常温下是油状液体,沸点:61.7 ℃,难溶于水,密度比水大的液体,常用作有机溶剂,主要用来生产氟利昂、染料和药物,在医学上,常用作麻醉剂
CH2Cl2 + Cl2 CHCl3 + HCl
光
(三氯甲烷)
Cl—Cl
+
光
Cl
H
+
C
Cl
H
H
Cl
C
H
Cl
Cl
Cl
二、烷烃的化学性质
如:四氯甲烷的形成
四氯甲烷(又称“四氯化碳”):常温下是油状液体,沸点:76.5 ℃,难溶于水,主要用作优良的溶剂、干洗剂、灭火剂、制冷剂及农药等
CHCl3 + Cl2 CCl4 + HCl
光
Cl—Cl
+
光
Cl
H
+
C
H
Cl
Cl
Cl
C
Cl
Cl
Cl
Cl
(四氯甲烷)
二、烷烃的化学性质
CH4 + Cl2 CH3Cl + HCl
光
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫做取代反应
CH3Cl + Cl2 CH2Cl2+ HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4+ HCl
光
特点:是“上一下一,取而代之”,类似无机反应中的复分解反应,注意在书写化学方程式时,防止漏写产物中的小分子。
每取代n mol H原子需要n mol Cl2
4.取代反应
二、烷烃的化学性质
烷烃(以甲烷为例)发生取代反应的一般规律
反应物 反应条件 生成物 反应特点 连锁反应
数量关系
甲烷与氯气(不能用氯水,需气态纯卤素单质)
漫散光照射(不用太阳光直射,以防爆炸)
甲烷与氯气反应生成四种有机产物:CH3Cl、CH2Cl2、CHCl3、CCl4和无机物HCl,其中HCl的产量最多(产物复杂)
甲烷中的氢原子被氯原子逐步取代,各步反应同时进行,即第一步反应一旦开始,后续反应立即进行(举例乙烷)
每取代1 mol氢原子,消耗1 mol Cl2,生成1 mol HCl
课堂小结
二、烷烃的化学性质(以甲烷为例进行分析)
三、用途
一、烷烃的物理性质
1、稳定性:
2、氧化反应—
3、取代反应(特征反应)
不与强酸、强碱、酸性KMnO4溶液反应
燃烧
现象:
反应条件:
特点:
光照,与气态纯卤素反应 (与氯水、溴水不反应)
逐步取代(随机并行),产物为混合物
除作燃料外,大量用于合成氨、尿素和炭黑,还可用于生产甲醇、氢气、乙炔、乙烯、甲醛、氢氰酸等。
4、高温分解:应用于石油化工和天然气化工生产中
碳原子数越多,熔沸点越高。当碳原子数相同时,支链越多,熔沸点越低。
课堂检测
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
D
1.下列关于烷烃性质的叙述正确的是( )
A.烷烃的沸点随碳原子数增加而逐渐降低
B.烷烃易被酸性高锰酸钾溶液氧化
C.在光照条件下,烷烃会发生分解
D.烷烃的取代反应很难得到纯净的产物
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
2.下列化学反应中不属于取代反应的是 (C )
A.CH2Cl2+Br2 CHBrCl2+HBr
B.CH3OH+HCl CH3Cl+H2O
C.2Na+2H2O==2NaOH+H2↑
D.CH3—CH2—Br+H2O CH3—CH2—OH+HBr
光照
光照
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
D
3.将体积比为1∶4的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )
A.产物中只有四氯化碳分子是正四面体结构
B.瓶中气体的黄绿色逐渐变浅,瓶内壁有油状液滴形成
C.若日光直射,可能发生爆炸
D.生成物只有CCl4、HCl
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
C
4.在标准状况下,22.4 L CH4与氯气在光照下发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的氯气为( )
A.1.25 mol B.2 mol
C.2.5 mol D.4 mol
THANKS
感谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
