化学人教版(2019)选择性必修3 3.2.1醇(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.2.1醇(共39张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 26.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-31 00:16:08 | ||
图片预览






文档简介
(共39张PPT)
醇
第二节 醇 酚
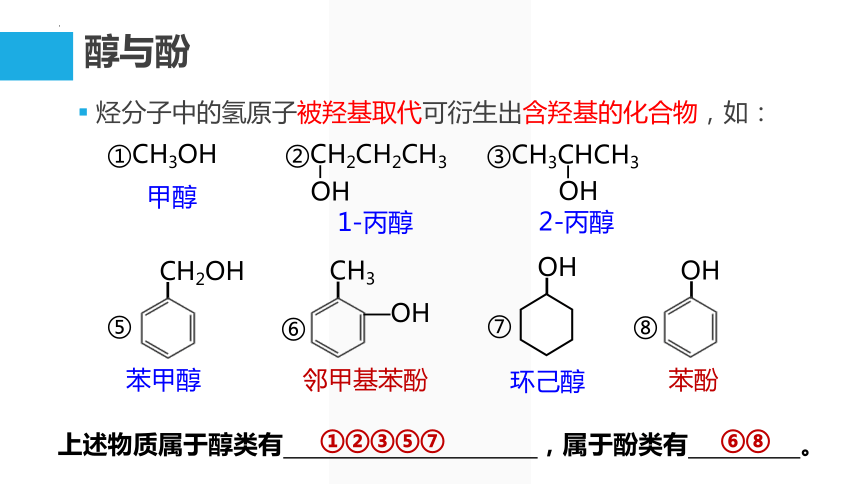
醇与酚
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
①CH3OH
③CH3CHCH3
OH
②CH2CH2CH3
OH
OH
⑦
甲醇
1-丙醇
2-丙醇
苯酚
苯甲醇
邻甲基苯酚
环己醇
CH2OH
⑤
⑥
CH3
—OH
OH
⑧
上述物质属于醇类有 ,属于酚类有 。
①②③⑤⑦
⑥⑧
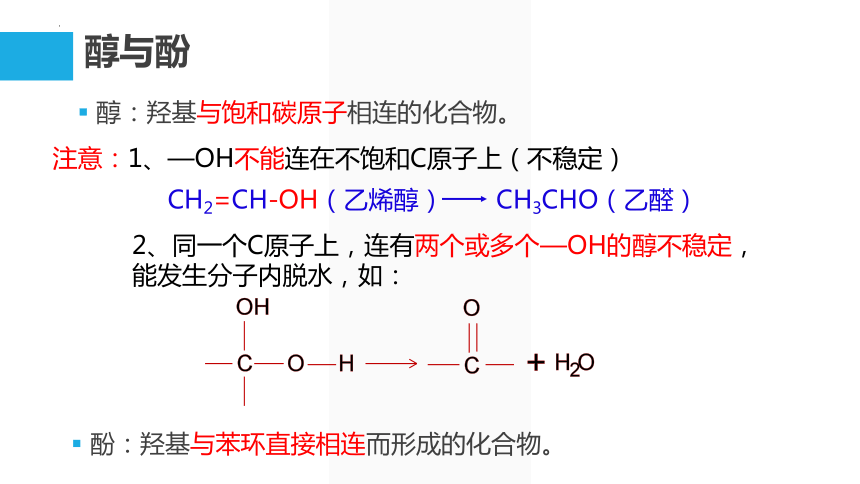
醇与酚
醇:羟基与饱和碳原子相连的化合物。
注意:1、—OH不能连在不饱和C原子上(不稳定)
CH2=CH-OH(乙烯醇) CH3CHO(乙醛)
2、同一个C原子上,连有两个或多个—OH的醇不稳定,能发生分子内脱水,如:
酚:羟基与苯环直接相连而形成的化合物。
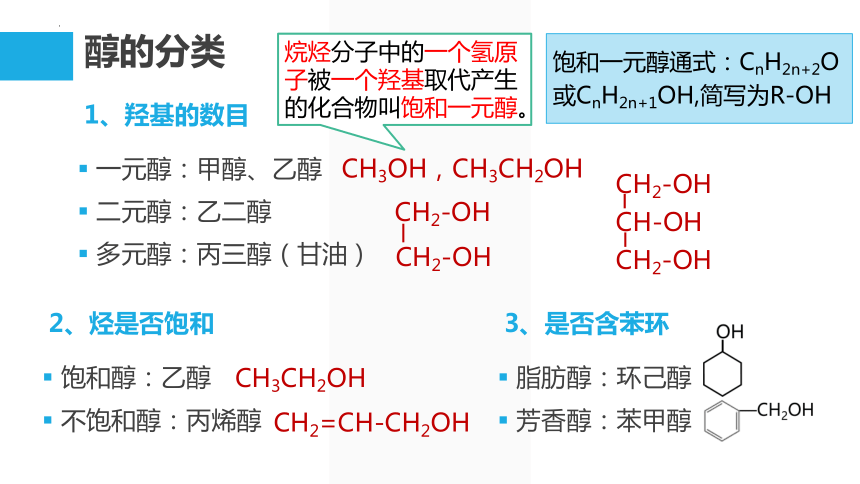
醇的分类
1、羟基的数目
一元醇:甲醇、乙醇
二元醇:乙二醇
多元醇:丙三醇(甘油)
2、烃是否饱和
饱和醇:乙醇
不饱和醇:丙烯醇
3、是否含苯环
脂肪醇:环己醇
芳香醇:苯甲醇
CH3OH,CH3CH2OH
CH2=CH-CH2OH
CH3CH2OH
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式:CnH2n+2O
或CnH2n+1OH,简写为R-OH
醇的命名
选主链。选择含有与羟基相连的碳原子的最长碳链为主链,根据碳原子数目称为某醇;
编序号。从距离羟基最近的一端给主链碳原子依次编号;
写名称。用阿拉伯数字标出羟基位置,羟基的个数用“二”“三”等表示。
OH
CH3—CH2 —CH —CH3
2-丁醇
CH3 CH C CH3
OH
OH
CH3
2-甲基-2,3-丁二醇
1
2
3
4
注意:羟基不是取代基
2一羟基丁烷
(×)
(√)
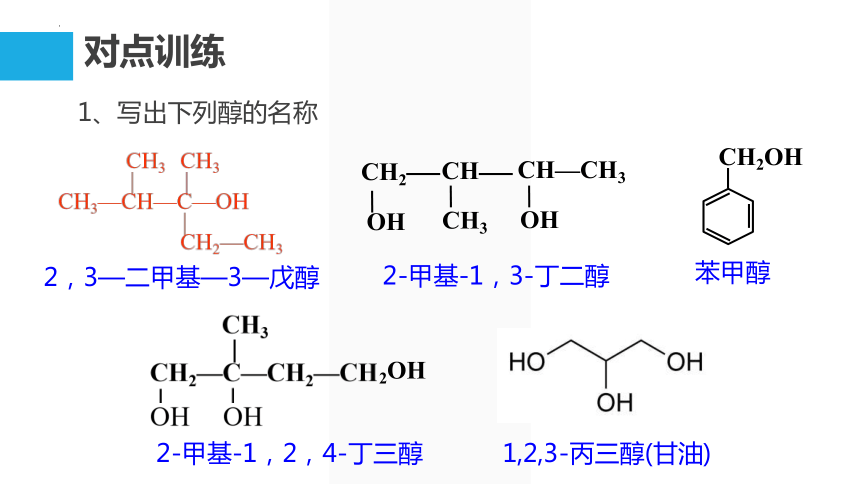
对点训练
1、写出下列醇的名称
2-甲基-1,3-丁二醇
2,3—二甲基—3—戊醇
CH2
CH
CH—CH3
OH
OH
CH3
2-甲基-1,2,4-丁三醇
2OH
苯甲醇
CH2OH
1,2,3-丙三醇(甘油)
几种常见的醇
1、甲醇 ch3oh
饱和一元醇
无色、具有挥发性的液体,沸点65℃
剧毒,误服会损伤视神经,甚至导致死亡
工业酒精中因含有少量甲醇而不能食用。
工业原料、燃料
几种常见的醇
2、乙二醇 ch2ohch2oh
二元醇
无色、粘稠、有甜味的液体,易溶于水和乙醇
化工原料、汽车用抗冻剂
3、丙三醇 ch2ohchohch2oh
多元醇,俗称甘油
无色、粘稠、有甜味的液体,易溶于水和乙醇
化工原料、添加在护肤品中保湿
醇的物理性质
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
【发现】
2、在水中的溶解度随碳原子数的增加而降低。
1、饱和一元醇的熔、沸点随碳原子数的增加而升高。
烃基越大,憎水基占比例大,削弱了-OH的亲水作用,因而水溶性降低
醇的物理性质
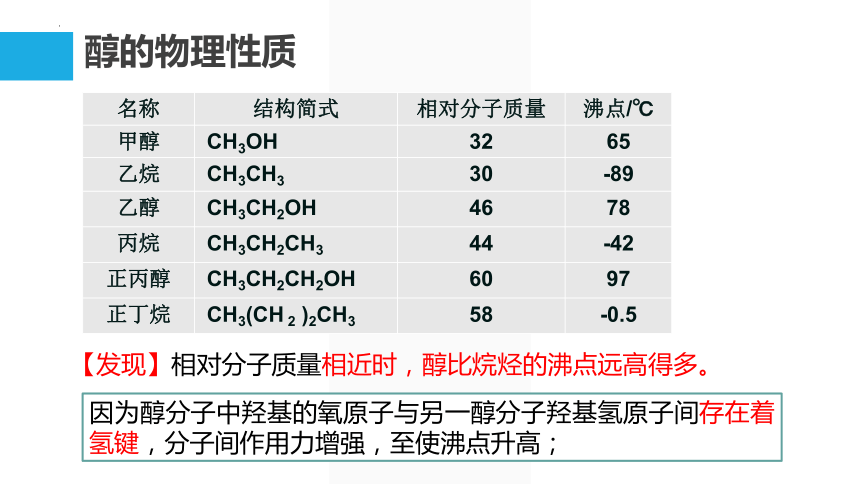
【发现】相对分子质量相近时,醇比烷烃的沸点远高得多。
因为醇分子中羟基的氧原子与另一醇分子羟基氢原子间存在着氢键,分子间作用力增强,至使沸点升高;
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3(CH 2 )2CH3 58 -0.5
醇的物理性质
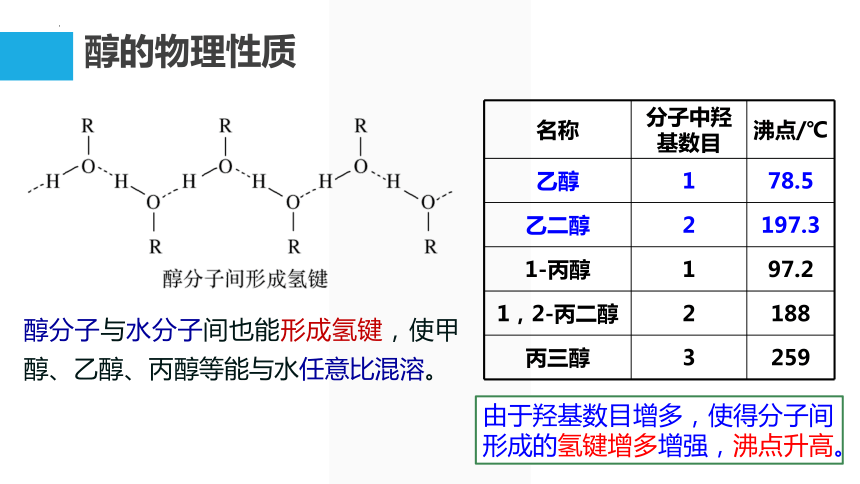
醇分子与水分子间也能形成氢键,使甲醇、乙醇、丙醇等能与水任意比混溶。
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
丙三醇 3 259
由于羟基数目增多,使得分子间形成的氢键增多增强,沸点升高。
醇的物理性质
1) 沸点:
2) 水溶性:
①甲醇、乙醇、丙醇、乙二醇、丙三醇等与水可以任意比例混溶
②相对分子质量相近时,醇比烷烃的沸点远高得多
①饱和一元醇,随碳原子数增加,熔、沸点升高
③碳原子数相同时,羟基越多,醇的沸点越高
氢键
② 4-11个碳的醇为油状液体,部分溶于水
烃基: 憎水基
—OH: 亲水基
烃基碳数越多,越难溶于水;羟基越多,越易溶于水
③ C12以上的醇为无色固体,不溶于水
3) 醇的密度均小于水
对点训练
2、下列物质的沸点按由高到低的顺序排列正确的是( )
①丙三醇 ②丙烷 ③乙二醇 ④乙醇
A.①②③④ B. ④③②①
C. ①③④② D. ①③②④
3、只用水就能鉴别的一组物质是( )
A.苯 乙醇 四氯化碳 B.乙醇 乙酸 戊烷
C.乙二醇 甘油 溴乙烷 D.苯 己烷 甲苯
C
A
醇的化学性质
回顾乙醇的化学性质,书写相应的化学方程式,并分析反应过程中的断键位置。
1.与活泼金属的置换反应
2CH3CH2—O—H+2Na→2CH3CH2ONa+H2↑
CH3CO-OH + H-O-C2H5 CH3COOC2H5+H2O
浓硫酸
(1)燃烧反应(完全燃烧)
2CO2 + 3H2O
C2H5OH + 3O2
点燃
(2)催化氧化
2CH3CH-O-H + O2
Cu
2CH3CHO + 2 H2O
△
H
3、酯化反应(取代反应)
2.氧化反应
醇的化学性质
醇的化学性质主要由官能团羟基决定,羟基氧原子吸引电子能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。
H—C—C—O—H
H
H
H
H
①O—H键容易断裂,使羟基氢原子被取代;
②C—O键也易断裂,脱去羟基,发生取代反应或消去反应;
醇的化学性质
取代反应
(1)乙醇和浓氢溴酸在加热的条件下反应生成溴乙烷
CH3CH2—OH+H—Br CH3CH2Br+H2O
△
反应机理:
-Br取代了-OH,-OH和-H结合生成H2O
此类反应通式:
R-OH +H-X→ R-X +H2O
溴乙烷 乙醇:
对比:
(碱性条件)
CH3CH2-Br + H-OH
CH3CH2-OH + H-Br
NaOH
△
说明:反应条件不同,反应方向不同。但上述反应不是可逆反应!
醇的化学性质
取代反应
(2)乙醇在浓硫酸作用下加热至140 ℃时,两个乙醇分子间会脱去一个水分子而生成乙醚:
C2H5—OH + H—OC2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
乙醚:无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用 ;乙醚微溶于水,易溶于有机溶剂 乙醚本身是一种优良溶剂,能溶解多种有机物。
醇的化学性质
取代反应
(2)乙醇在浓硫酸作用下加热至140 ℃时,两个乙醇分子间会脱去一个水分子而生成乙醚:
C2H5—OH + H—OC2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
醚:由两个烃基通过一个氧原子连接起来的化合物叫做醚。醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O(n≥2)。醚类物质在化工生产中被广泛用作溶剂,有的醚可被用作麻醉剂。
醇的化学性质
实验3-2
为何使液体温度迅速升到170℃?
放入碎瓷片作用是什么?
浓硫酸的作用是什么?
混合液颜色如何变化?为什么?
氢氧化钠溶液的作用?
醇的化学性质
醇的化学性质
实验现象:有无色气体生成,液体变黑,溴的四氯化碳溶液、酸性高锰钾溶液褪色。
实验结论:乙醇在浓硫酸催化作用下,加热生成乙烯。
反应原理:
CH2-CH2 CH2=CH2↑+H2O
浓H2SO4
H OH
170℃
消去反应
OH和 OH相连碳相邻碳上的C H
断键位置:
应用:实验室制取乙烯
醇的化学性质
实验思考与讨论
1、放入几片碎瓷片作用是什么?
防止液体暴沸
2、浓硫酸的作用是什么?
催化剂和脱水剂
3、乙醇与浓硫酸体积比为何要为1∶3?
浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,乙醇为无水乙醇,乙醇与浓硫酸体积比以1∶3为宜。
4、温度计的位置?
温度计要置于反应物的中央位置因为需要测量的是反应物的温度。
醇的化学性质
实验思考与讨论
5、为何使液体温度迅速升到170℃?
乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
可能的副反应:
CH3CH2-OH + H-OCH2CH3 CH3CH2-O-CH2CH3 + H2O
浓H2SO4
140℃
醇的化学性质
实验思考与讨论
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,乙醇和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将乙醇氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
醇的化学性质
实验思考与讨论
7、装置中氢氧化钠溶液有什么作用?
由于乙醇和浓硫酸发生的氧化还原反应,还可能生成碳等物质,所以反应制得的乙烯中往往混有H2O、CO2、SO2等气体。
可能的副反应:
C+ 2H2SO4(浓) CO2↑+2SO2↑+2H2O
Δ
氢氧化钠溶液可除去酸性杂质,防止其后续干扰乙烯气体的检验。
对点训练
4、下列醇能否发生消去反应?若能,请写出有机产物的结构简式。
A、CH3OH
B、CH3-CH-CH3
OH
C、CH3-C-CH2-OH
CH3
CH3
E、CH3-CH2-CH-CH3
OH
F 、
OH
√
√
√
D 、
×
×
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
CH2=CH-CH3
(主产物)
CH2OH
= CH2
无H
无相邻C
苯环上为独特的碳碳键
×
–OH
醇的化学性质
醇发生消去反应的规律
2.若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为:
CH3CH=CHCH3 或 CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
—C—C—
H OH
浓H2SO4
+ H2O
—C=C—
α
β
要求与羟基相连碳的邻位碳原子上有氢原子。
1.醇发生消去反应(分子内脱水)的断键位置:
醇的化学性质
氧化反应
1、燃烧反应(完全氧化)
2CO2 + 3H2O
C2H5OH + 3O2
点燃
2、催化氧化
2CH3CH—O—H + O2
Cu
2CH3CHO + 2H2O
△
H
例:下列各醇,能发生催化氧化生成醛的是( )
A
+ O2
Cu
△
R—C—R’
O
反应机理:
R—C—O—H
H
R’
+ H2O
醇的化学性质
氧化反应
+ O2
Cu
△
R—C—R’
O
醇的催化氧化反应机理:
R—C—O—H
H
R’
+ H2O
醇的催化氧化反应规律:
①若R,R’中一个为H,则该醇一定条件下被氧化生成醛。
②若R,R’均不为H,则该醇一定条件下被氧化生成酮。
③若是结构为 的醇,通常不能被氧化。
醇的化学性质
氧化反应——实验3-3
醇的化学性质
氧化反应——实验3-3
K2Cr2O7(H+)
C2H5OH
还原
橙色
Cr2O72-
Cr3+
灰绿色
+6
+3
可用重铬酸钾的颜色变化来检验酒驾
CH3COOH
继续氧化
CH3CHO
醇的化学性质
氧化反应
1、燃烧反应(完全氧化)
2CO2 + 3H2O
C2H5OH + 3O2
点燃
2、催化氧化
2CH3CH—O—H + O2
Cu
2CH3CHO + 2H2O
△
H
3、被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化
氧化
C2H5OH
CH3COOH
继续氧化
CH3CHO
在有机化学反应中,通常把有机化合物分子中失去氢原子或加入氧原子的反应叫做氧化反应;把有机化合物分子中加入氢原子或失去氧原子的反应叫做还原反应。
反应 断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃
浓硫酸加热到140℃
浓硫酸条件下与乙酸加热
与HX加热反应
醇的化学性质
H―C―C―O―H
H
H
H
H
②
①
⑤
③
④
②④
②
①③
①②
①
①
课堂练习
1、下列关于醇类的说法错误的是( )
A.羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇
B.醇的同分异构体中一定有酚类物质
C.乙二醇和丙三醇都是无色液体,易溶于水和乙醇,其中丙三醇可用于配制化妆品
D.甲醇是一种无色、易挥发、易溶于水的液体,常用作车用燃料
B
课堂练习
2、下列有关乙醇的实验操作或实验现象正确的是( )
A.①中酸性KMnO4溶液会褪色,乙醇转化为乙醛
B.②中有气泡产生,上方的火焰为淡蓝色
C.③中灼热的铜丝插入乙醇中,铜丝由红色变为黑色
D.④中X是饱和的NaOH溶液,X液面上有油状液体生成
B
课堂练习
3、对于 ,若断裂C—O键,则可能发生的反应有( )
①与钠反应 ②卤代反应 ③消去反应 ④催化氧化反应
A.①② B.②③ C.③④ D.①④
B
4、下列有机反应属于取代反应的是( )
A.CH3CH2OH以铜作催化剂在空气中加热
B.乙烯与水在一定条件下反应生成乙醇
C.乙醇与浓硫酸加热至170℃制取乙烯
D.乙醇与浓硫酸加热至140℃制取乙醚
D
课堂练习
5、1,4-二氧六环乙醚是一种常见的溶剂,它可以通过下列方法合成:
Br2
NaOH溶液
浓H2SO4
—H2O
CH2
CH2
CH2
CH2
O
O
写出各步的化学方程式:
1,4-二氧六环乙醚
A(烃)
B
C
CH2=CH2+Br2→CH2BrCH2Br
CH2BrCH2Br + 2NaOH
CH2OHCH2OH +2NaBr
H2O
△
2CH2OHCH2OH
+ 2H2O
浓H2SO4
140℃
CH2
CH2
CH2
CH2
O
O
谢谢
醇
第二节 醇 酚
醇与酚
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
①CH3OH
③CH3CHCH3
OH
②CH2CH2CH3
OH
OH
⑦
甲醇
1-丙醇
2-丙醇
苯酚
苯甲醇
邻甲基苯酚
环己醇
CH2OH
⑤
⑥
CH3
—OH
OH
⑧
上述物质属于醇类有 ,属于酚类有 。
①②③⑤⑦
⑥⑧
醇与酚
醇:羟基与饱和碳原子相连的化合物。
注意:1、—OH不能连在不饱和C原子上(不稳定)
CH2=CH-OH(乙烯醇) CH3CHO(乙醛)
2、同一个C原子上,连有两个或多个—OH的醇不稳定,能发生分子内脱水,如:
酚:羟基与苯环直接相连而形成的化合物。
醇的分类
1、羟基的数目
一元醇:甲醇、乙醇
二元醇:乙二醇
多元醇:丙三醇(甘油)
2、烃是否饱和
饱和醇:乙醇
不饱和醇:丙烯醇
3、是否含苯环
脂肪醇:环己醇
芳香醇:苯甲醇
CH3OH,CH3CH2OH
CH2=CH-CH2OH
CH3CH2OH
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式:CnH2n+2O
或CnH2n+1OH,简写为R-OH
醇的命名
选主链。选择含有与羟基相连的碳原子的最长碳链为主链,根据碳原子数目称为某醇;
编序号。从距离羟基最近的一端给主链碳原子依次编号;
写名称。用阿拉伯数字标出羟基位置,羟基的个数用“二”“三”等表示。
OH
CH3—CH2 —CH —CH3
2-丁醇
CH3 CH C CH3
OH
OH
CH3
2-甲基-2,3-丁二醇
1
2
3
4
注意:羟基不是取代基
2一羟基丁烷
(×)
(√)
对点训练
1、写出下列醇的名称
2-甲基-1,3-丁二醇
2,3—二甲基—3—戊醇
CH2
CH
CH—CH3
OH
OH
CH3
2-甲基-1,2,4-丁三醇
2OH
苯甲醇
CH2OH
1,2,3-丙三醇(甘油)
几种常见的醇
1、甲醇 ch3oh
饱和一元醇
无色、具有挥发性的液体,沸点65℃
剧毒,误服会损伤视神经,甚至导致死亡
工业酒精中因含有少量甲醇而不能食用。
工业原料、燃料
几种常见的醇
2、乙二醇 ch2ohch2oh
二元醇
无色、粘稠、有甜味的液体,易溶于水和乙醇
化工原料、汽车用抗冻剂
3、丙三醇 ch2ohchohch2oh
多元醇,俗称甘油
无色、粘稠、有甜味的液体,易溶于水和乙醇
化工原料、添加在护肤品中保湿
醇的物理性质
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
【发现】
2、在水中的溶解度随碳原子数的增加而降低。
1、饱和一元醇的熔、沸点随碳原子数的增加而升高。
烃基越大,憎水基占比例大,削弱了-OH的亲水作用,因而水溶性降低
醇的物理性质
【发现】相对分子质量相近时,醇比烷烃的沸点远高得多。
因为醇分子中羟基的氧原子与另一醇分子羟基氢原子间存在着氢键,分子间作用力增强,至使沸点升高;
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3(CH 2 )2CH3 58 -0.5
醇的物理性质
醇分子与水分子间也能形成氢键,使甲醇、乙醇、丙醇等能与水任意比混溶。
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
丙三醇 3 259
由于羟基数目增多,使得分子间形成的氢键增多增强,沸点升高。
醇的物理性质
1) 沸点:
2) 水溶性:
①甲醇、乙醇、丙醇、乙二醇、丙三醇等与水可以任意比例混溶
②相对分子质量相近时,醇比烷烃的沸点远高得多
①饱和一元醇,随碳原子数增加,熔、沸点升高
③碳原子数相同时,羟基越多,醇的沸点越高
氢键
② 4-11个碳的醇为油状液体,部分溶于水
烃基: 憎水基
—OH: 亲水基
烃基碳数越多,越难溶于水;羟基越多,越易溶于水
③ C12以上的醇为无色固体,不溶于水
3) 醇的密度均小于水
对点训练
2、下列物质的沸点按由高到低的顺序排列正确的是( )
①丙三醇 ②丙烷 ③乙二醇 ④乙醇
A.①②③④ B. ④③②①
C. ①③④② D. ①③②④
3、只用水就能鉴别的一组物质是( )
A.苯 乙醇 四氯化碳 B.乙醇 乙酸 戊烷
C.乙二醇 甘油 溴乙烷 D.苯 己烷 甲苯
C
A
醇的化学性质
回顾乙醇的化学性质,书写相应的化学方程式,并分析反应过程中的断键位置。
1.与活泼金属的置换反应
2CH3CH2—O—H+2Na→2CH3CH2ONa+H2↑
CH3CO-OH + H-O-C2H5 CH3COOC2H5+H2O
浓硫酸
(1)燃烧反应(完全燃烧)
2CO2 + 3H2O
C2H5OH + 3O2
点燃
(2)催化氧化
2CH3CH-O-H + O2
Cu
2CH3CHO + 2 H2O
△
H
3、酯化反应(取代反应)
2.氧化反应
醇的化学性质
醇的化学性质主要由官能团羟基决定,羟基氧原子吸引电子能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。
H—C—C—O—H
H
H
H
H
①O—H键容易断裂,使羟基氢原子被取代;
②C—O键也易断裂,脱去羟基,发生取代反应或消去反应;
醇的化学性质
取代反应
(1)乙醇和浓氢溴酸在加热的条件下反应生成溴乙烷
CH3CH2—OH+H—Br CH3CH2Br+H2O
△
反应机理:
-Br取代了-OH,-OH和-H结合生成H2O
此类反应通式:
R-OH +H-X→ R-X +H2O
溴乙烷 乙醇:
对比:
(碱性条件)
CH3CH2-Br + H-OH
CH3CH2-OH + H-Br
NaOH
△
说明:反应条件不同,反应方向不同。但上述反应不是可逆反应!
醇的化学性质
取代反应
(2)乙醇在浓硫酸作用下加热至140 ℃时,两个乙醇分子间会脱去一个水分子而生成乙醚:
C2H5—OH + H—OC2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
乙醚:无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用 ;乙醚微溶于水,易溶于有机溶剂 乙醚本身是一种优良溶剂,能溶解多种有机物。
醇的化学性质
取代反应
(2)乙醇在浓硫酸作用下加热至140 ℃时,两个乙醇分子间会脱去一个水分子而生成乙醚:
C2H5—OH + H—OC2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
醚:由两个烃基通过一个氧原子连接起来的化合物叫做醚。醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O(n≥2)。醚类物质在化工生产中被广泛用作溶剂,有的醚可被用作麻醉剂。
醇的化学性质
实验3-2
为何使液体温度迅速升到170℃?
放入碎瓷片作用是什么?
浓硫酸的作用是什么?
混合液颜色如何变化?为什么?
氢氧化钠溶液的作用?
醇的化学性质
醇的化学性质
实验现象:有无色气体生成,液体变黑,溴的四氯化碳溶液、酸性高锰钾溶液褪色。
实验结论:乙醇在浓硫酸催化作用下,加热生成乙烯。
反应原理:
CH2-CH2 CH2=CH2↑+H2O
浓H2SO4
H OH
170℃
消去反应
OH和 OH相连碳相邻碳上的C H
断键位置:
应用:实验室制取乙烯
醇的化学性质
实验思考与讨论
1、放入几片碎瓷片作用是什么?
防止液体暴沸
2、浓硫酸的作用是什么?
催化剂和脱水剂
3、乙醇与浓硫酸体积比为何要为1∶3?
浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,乙醇为无水乙醇,乙醇与浓硫酸体积比以1∶3为宜。
4、温度计的位置?
温度计要置于反应物的中央位置因为需要测量的是反应物的温度。
醇的化学性质
实验思考与讨论
5、为何使液体温度迅速升到170℃?
乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
可能的副反应:
CH3CH2-OH + H-OCH2CH3 CH3CH2-O-CH2CH3 + H2O
浓H2SO4
140℃
醇的化学性质
实验思考与讨论
6、混合液颜色如何变化?为什么?
烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,乙醇和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将乙醇氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。
醇的化学性质
实验思考与讨论
7、装置中氢氧化钠溶液有什么作用?
由于乙醇和浓硫酸发生的氧化还原反应,还可能生成碳等物质,所以反应制得的乙烯中往往混有H2O、CO2、SO2等气体。
可能的副反应:
C+ 2H2SO4(浓) CO2↑+2SO2↑+2H2O
Δ
氢氧化钠溶液可除去酸性杂质,防止其后续干扰乙烯气体的检验。
对点训练
4、下列醇能否发生消去反应?若能,请写出有机产物的结构简式。
A、CH3OH
B、CH3-CH-CH3
OH
C、CH3-C-CH2-OH
CH3
CH3
E、CH3-CH2-CH-CH3
OH
F 、
OH
√
√
√
D 、
×
×
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
CH2=CH-CH3
(主产物)
CH2OH
= CH2
无H
无相邻C
苯环上为独特的碳碳键
×
–OH
醇的化学性质
醇发生消去反应的规律
2.若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为:
CH3CH=CHCH3 或 CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
—C—C—
H OH
浓H2SO4
+ H2O
—C=C—
α
β
要求与羟基相连碳的邻位碳原子上有氢原子。
1.醇发生消去反应(分子内脱水)的断键位置:
醇的化学性质
氧化反应
1、燃烧反应(完全氧化)
2CO2 + 3H2O
C2H5OH + 3O2
点燃
2、催化氧化
2CH3CH—O—H + O2
Cu
2CH3CHO + 2H2O
△
H
例:下列各醇,能发生催化氧化生成醛的是( )
A
+ O2
Cu
△
R—C—R’
O
反应机理:
R—C—O—H
H
R’
+ H2O
醇的化学性质
氧化反应
+ O2
Cu
△
R—C—R’
O
醇的催化氧化反应机理:
R—C—O—H
H
R’
+ H2O
醇的催化氧化反应规律:
①若R,R’中一个为H,则该醇一定条件下被氧化生成醛。
②若R,R’均不为H,则该醇一定条件下被氧化生成酮。
③若是结构为 的醇,通常不能被氧化。
醇的化学性质
氧化反应——实验3-3
醇的化学性质
氧化反应——实验3-3
K2Cr2O7(H+)
C2H5OH
还原
橙色
Cr2O72-
Cr3+
灰绿色
+6
+3
可用重铬酸钾的颜色变化来检验酒驾
CH3COOH
继续氧化
CH3CHO
醇的化学性质
氧化反应
1、燃烧反应(完全氧化)
2CO2 + 3H2O
C2H5OH + 3O2
点燃
2、催化氧化
2CH3CH—O—H + O2
Cu
2CH3CHO + 2H2O
△
H
3、被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化
氧化
C2H5OH
CH3COOH
继续氧化
CH3CHO
在有机化学反应中,通常把有机化合物分子中失去氢原子或加入氧原子的反应叫做氧化反应;把有机化合物分子中加入氢原子或失去氧原子的反应叫做还原反应。
反应 断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃
浓硫酸加热到140℃
浓硫酸条件下与乙酸加热
与HX加热反应
醇的化学性质
H―C―C―O―H
H
H
H
H
②
①
⑤
③
④
②④
②
①③
①②
①
①
课堂练习
1、下列关于醇类的说法错误的是( )
A.羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇
B.醇的同分异构体中一定有酚类物质
C.乙二醇和丙三醇都是无色液体,易溶于水和乙醇,其中丙三醇可用于配制化妆品
D.甲醇是一种无色、易挥发、易溶于水的液体,常用作车用燃料
B
课堂练习
2、下列有关乙醇的实验操作或实验现象正确的是( )
A.①中酸性KMnO4溶液会褪色,乙醇转化为乙醛
B.②中有气泡产生,上方的火焰为淡蓝色
C.③中灼热的铜丝插入乙醇中,铜丝由红色变为黑色
D.④中X是饱和的NaOH溶液,X液面上有油状液体生成
B
课堂练习
3、对于 ,若断裂C—O键,则可能发生的反应有( )
①与钠反应 ②卤代反应 ③消去反应 ④催化氧化反应
A.①② B.②③ C.③④ D.①④
B
4、下列有机反应属于取代反应的是( )
A.CH3CH2OH以铜作催化剂在空气中加热
B.乙烯与水在一定条件下反应生成乙醇
C.乙醇与浓硫酸加热至170℃制取乙烯
D.乙醇与浓硫酸加热至140℃制取乙醚
D
课堂练习
5、1,4-二氧六环乙醚是一种常见的溶剂,它可以通过下列方法合成:
Br2
NaOH溶液
浓H2SO4
—H2O
CH2
CH2
CH2
CH2
O
O
写出各步的化学方程式:
1,4-二氧六环乙醚
A(烃)
B
C
CH2=CH2+Br2→CH2BrCH2Br
CH2BrCH2Br + 2NaOH
CH2OHCH2OH +2NaBr
H2O
△
2CH2OHCH2OH
+ 2H2O
浓H2SO4
140℃
CH2
CH2
CH2
CH2
O
O
谢谢
