化学人教版(2019)选择性必修2 2.2分子的空间结构 共3课时(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.2分子的空间结构 共3课时(共35张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-31 10:48:21 | ||
图片预览


文档简介
(共35张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第 1-3 课时
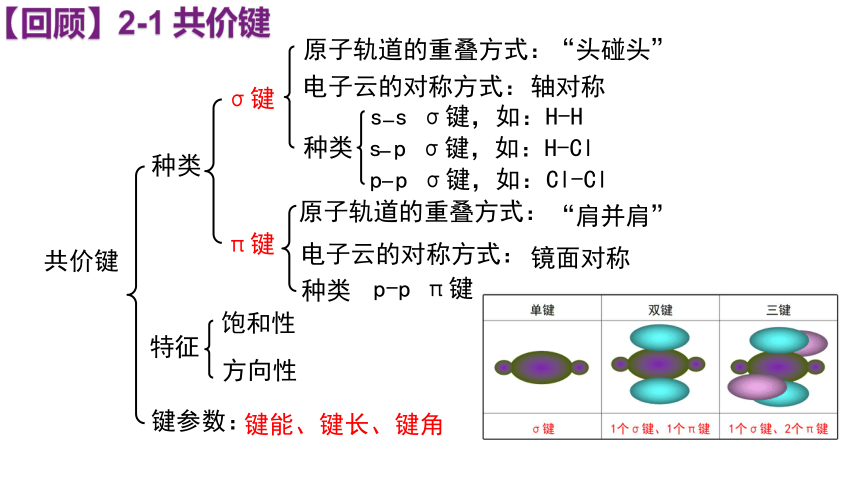
种类
σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
“头碰头”
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
π键
p-p π键
“肩并肩”
原子轨道的重叠方式:
镜面对称
电子云的对称方式:
种类
特征
饱和性
方向性
共价键
-
键能、键长、键角
键参数:
【回顾】2-1 共价键
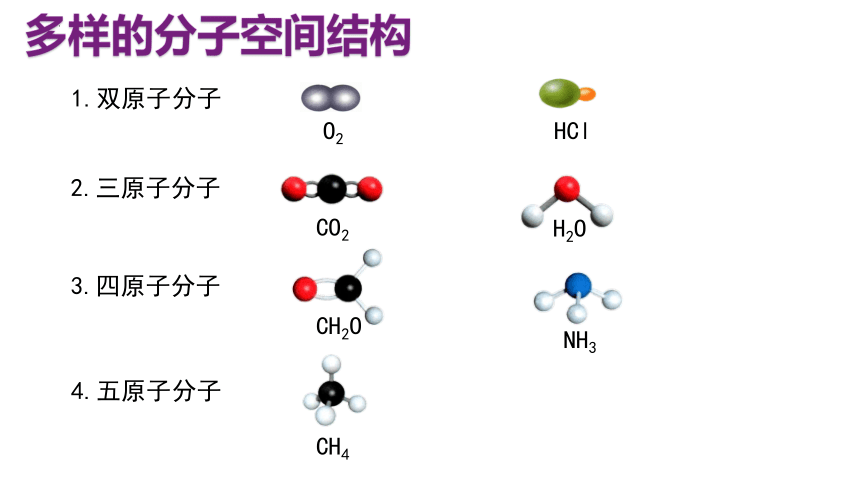
多样的分子空间结构
1.双原子分子
O2
HCl
2.三原子分子
3.四原子分子
4.五原子分子
CO2
H2O
CH2O
NH3
CH4
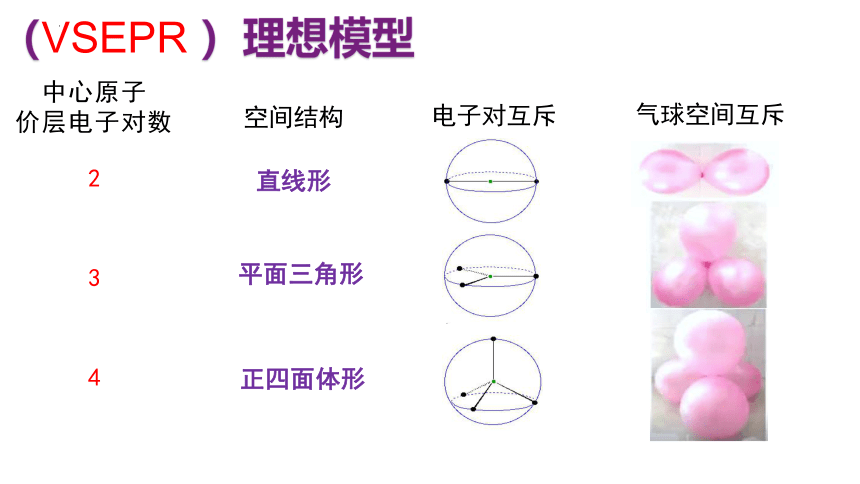
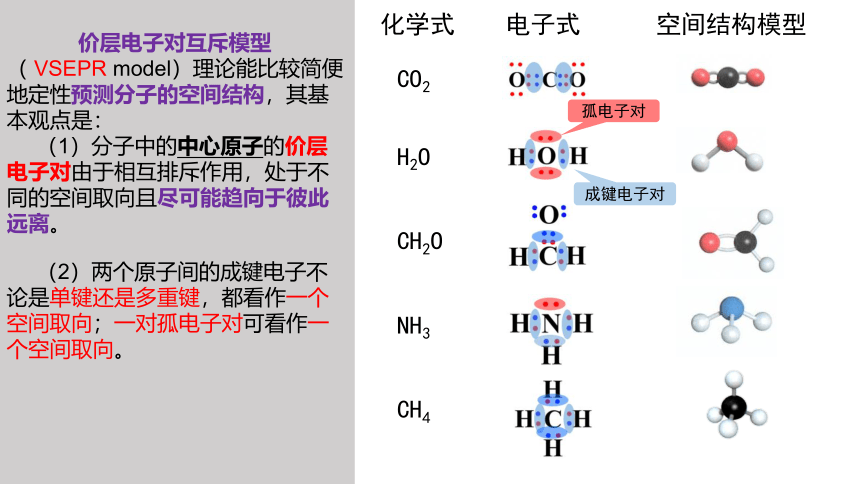
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
【思考】为什么甲烷分子的空间结构是正四面体形而不是正方形?
C
H
H
H
H
··
··
··
··
空间结构:正四面体形 键角:109°28′
中心原子
价层电子对数
电子对互斥
气球空间互斥
空间结构
2
3
4
平面三角形
(VSEPR )理想模型
直线形
正四面体形
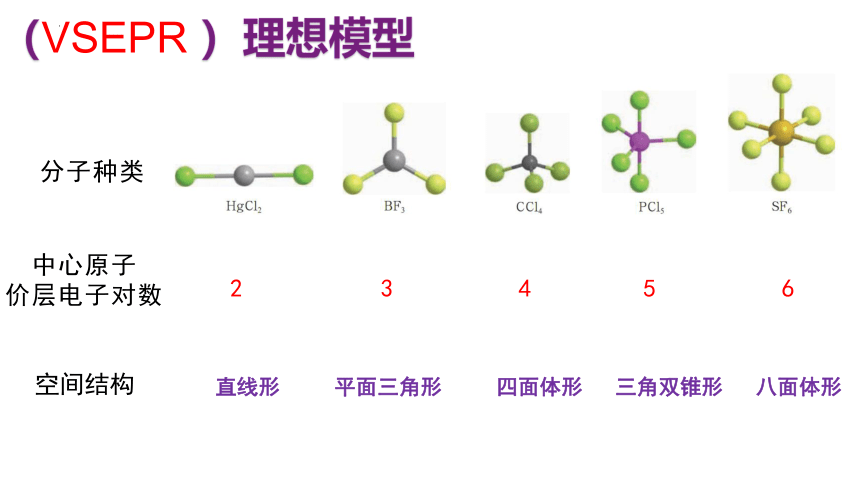
(VSEPR )理想模型
中心原子
价层电子对数
空间结构
分子种类
2 3 4 5 6
直线形 平面三角形 四面体形 三角双锥形 八面体形
化学式 电子式 空间结构模型
CO2
H2O
CH2O
NH3
CH4
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
(2)两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。
成键电子对
孤电子对
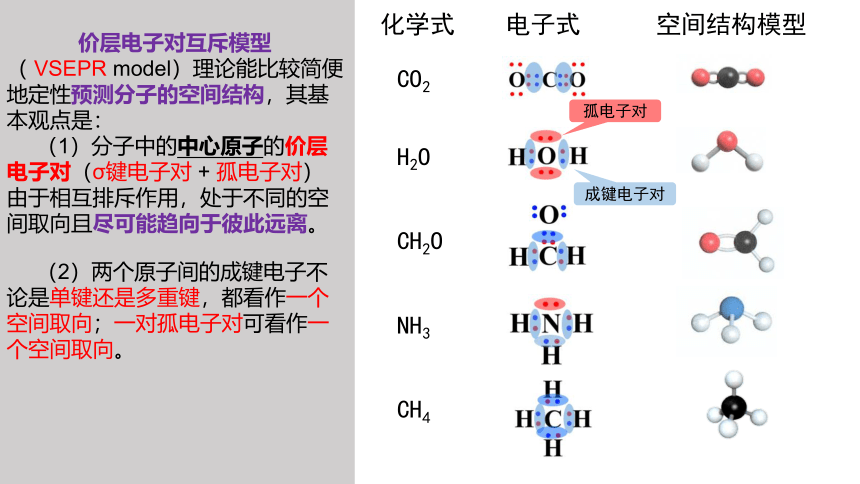
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对(σ键电子对 + 孤电子对)
由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
化学式 电子式 空间结构模型
CO2
H2O
CH2O
NH3
CH4
(2)两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。
成键电子对
孤电子对
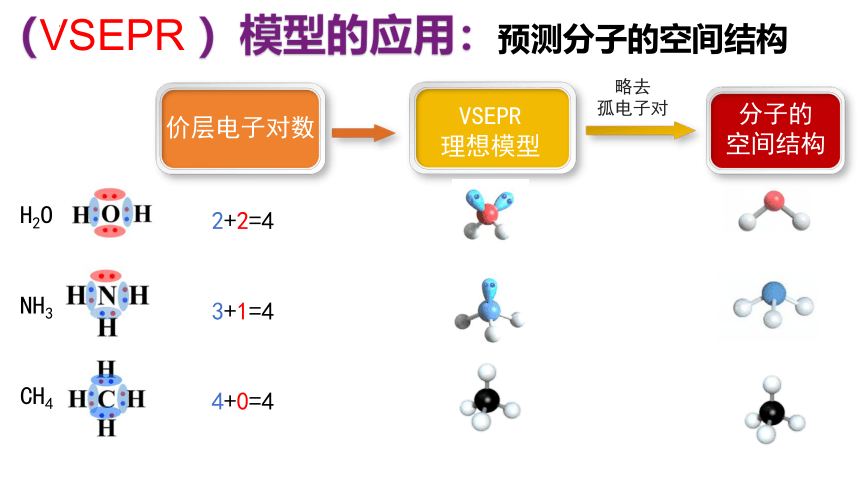
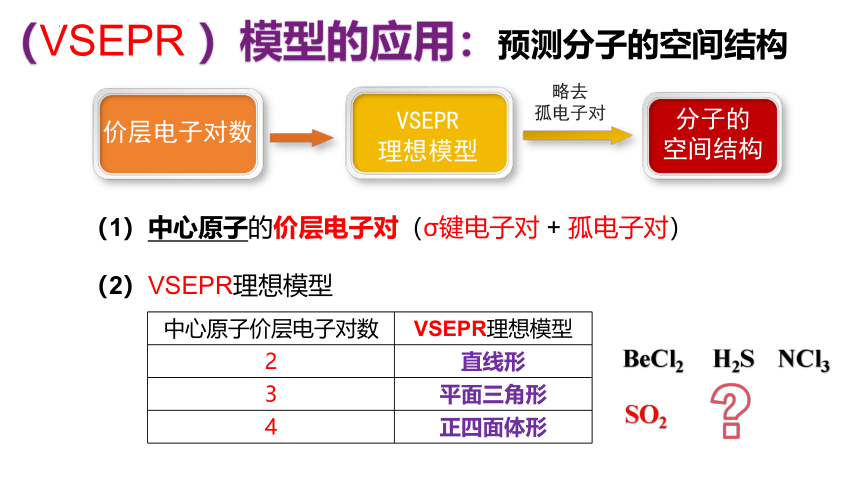
(VSEPR )模型的应用:预测分子的空间结构
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
H2O
NH3
CH4
2+2=4
3+1=4
4+0=4
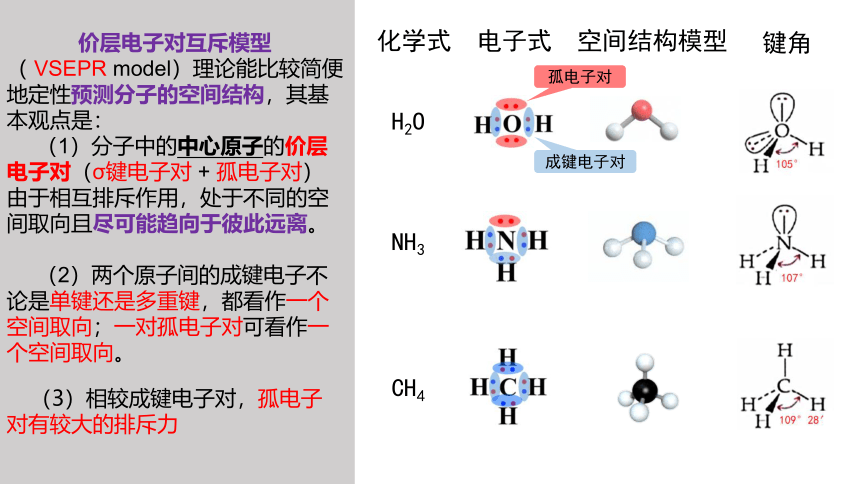
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对(σ键电子对 + 孤电子对)
由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
(2)两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。
化学式 电子式 空间结构模型
H2O
NH3
CH4
(3)相较成键电子对,孤电子对有较大的排斥力
成键电子对
孤电子对
键角
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
(VSEPR )模型的应用:预测分子的空间结构
SO2
(2)VSEPR理想模型
中心原子价层电子对数 VSEPR理想模型
2 直线形
3 平面三角形
4 正四面体形
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
BeCl2 H2S NCl3
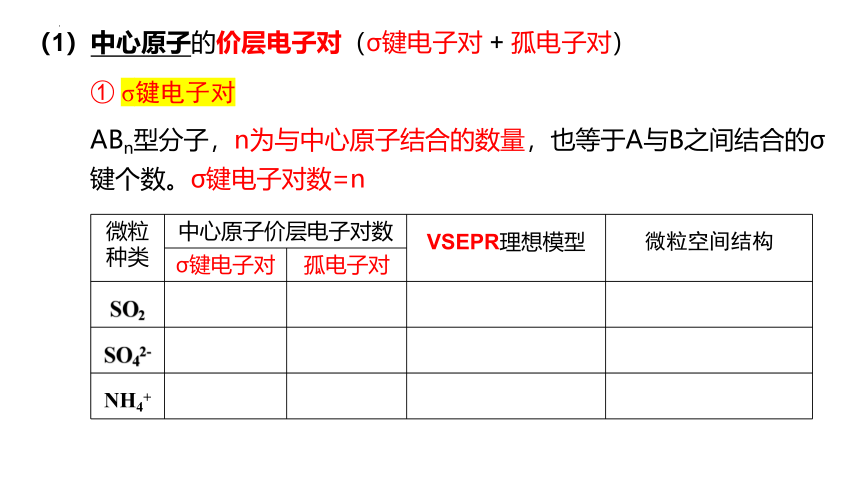
① σ键电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
ABn型分子,n为与中心原子结合的数量,也等于A与B之间结合的σ键个数。σ键电子对数=n
微粒种类 中心原子价层电子对数 VSEPR理想模型 微粒空间结构
σ键电子对 孤电子对 SO2
SO42-
NH4+
② 孤电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
方法一:根据电子式直接确定
方法二:公式计算中心原子上的孤电子对数
CH4
×(4-4×1)=0
NH3
×(5-3×1)=1
H2O
×(6-2×1)=2
2
1
2
1
2
1
=
—
2
1
(a – xb)
中心原子的价电子数
中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
② 孤电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
微粒种类 中心原子价层电子对数 VSEPR理想模型 微粒空间结构
σ键电子对 孤电子对 SO2 2
SO42- 4
NH4+ 4
方法一:根据电子式直接确定
方法二:公式计算中心原子上的孤电子对数
=
—
2
1
(a – xb)
中心原子的价电子数
中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
注意:
①价层电子对互斥模型对分子空间结构的预测少有失误,但它不能用于预测以过渡金属为中心原子的分子或离子【如Ni(CO)4等】。
②一般适用于ABn型分子,对于复杂结构【如P4O10等】无法判断。
(VSEPR )模型的应用:预测分子的空间结构
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
(VSEPR )模型的应用:预测分子的空间结构
(2)VSEPR理想模型
中心原子价层电子对数 VSEPR
理想模型名称
2 直线形
3 平面三角形
4 正四面体形
5 三角双锥形
6 正八面体形
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
三角双锥形
正八面体形
【巩固练习】
微粒 中心原子价层电子对数 VSEPR 理想模型名称 微粒
空间结构名称
σ键电子对 孤电子对 BeCl2
BF3
CH4
NH3
H2O
【思考】如何解释CH4的空间结构是正四面体形?
碳原子的价层电子排布:2s22p2
2s
2p
2s
2p
x
y
z
杂化轨道理论
鲍林
在形成分子时:
中心原子中能量相近的轨道发生混杂,混杂时保持轨道总数不变
重新分配能量和调整空间伸展方向,组成能量相等、方向不同的新原子轨道
杂化轨道理论
2p
2s
2s
2p
sp3
4个 sp3 杂化轨道
跃迁
sp3杂化
基态
激发态
甲烷分子中C原子的1个2s轨道与3个2p轨道形成4个相同的sp3杂化轨道,夹角109°28′。
甲烷分子中碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-Hσ键,呈正四面体形。
CH4
2s2p轨道
2s
2p
2s
2p
sp2
3个sp2杂化轨道
跃迁
sp2杂化
BF3
2s2p轨道
2s
2p
2s
2p
sp
2个sp杂化轨道
跃迁
sp杂化
BeCl2
杂化轨道理论
微粒 中心原子价层电子对数 VSEPR 理想模型名称 微粒 空间结构名称 中心原子杂化类型
σ键电子对 孤电子对 BeCl2 2 0 直线形 直线形 sp
BF3 3 0 平面三角形 平面三角形 sp2
CH4 4 0 正四面体形 正四面体形 sp3
【思考】中心原子杂化轨道数、类型与中心原子价层电子对数、VSEPR模型的关系?
在学习价层电子对互斥模型时,知道NH3和H2O的VSEPR模型跟CH4一样也是四面体形。尝试用杂化轨道理论来解释NH3、H2O的空间结构。
sp3杂化
2s
2p
NH3
氮原子的3个sp3杂化轨道与3个氢原子的1s原子轨道重叠形成3个N-Hσ键,其中1个sp3杂化轨道中占有孤电子对。
2s
2p
H2O
sp3杂化
氧原子的2个sp3杂化轨道与2个氢原子的1s原子轨道重叠形成2个N-Hσ键,其中2个sp3杂化轨道中占有孤电子对。
微粒 中心原子价层电子对数 VSEPR 理想模型名称 微粒 空间结构名称 中心原子杂化类型
σ键电子对 孤电子对 BeCl2 2 0 直线形 直线形 sp
BF3 3 0 平面三角形 平面三角形 sp2
CH4 4 0 正四面体形 正四面体形 sp3
NH3 3 1 四面体形 三角锥形 sp3
H2O 2 2 四面体形 V形 sp3
(2)杂化轨道数 = 中心原子价层电子对数 =σ键电子对数 + 孤电子对数
(1)杂化轨道用于形成σ键或用来容纳未参与成键的孤电子对
(3)形成π键的电子只能位于未杂化的原子轨道上。
应用VSEPR模型和杂化轨道理论解释多中心原子的结构。
已知:乙烯是平面分子,键角为120o,分子中含有碳碳双键。
如何来确定中心原子C的杂化类型呢?
2s
2p
2s
2p
sp2
3个sp2杂化轨道
跃迁
sp2杂化
sp2杂化
分子 中心原子价层电子对数 杂化轨道数 杂化类型
CH2=CH2 3 + 0=3 3 sp2杂化
乙烯 中心原子C的sp2杂化
乙炔是直线形分子,键角为180°,分子中含有碳碳三键。
乙炔分子的碳原子采用什么杂化?它的杂化轨道用于形成什么化学键?怎么理解它存在碳碳三键?
2s
2p
2s
2p
sp
2个sp杂化轨道
跃迁
sp杂化
sp杂化
分子 中心原子价层电子对数 杂化轨道数 杂化类型
CH≡CH 2 + 0=2 2 sp杂化
乙炔 中心原子C的sp杂化
链接高考1:分析乙烯、乙炔、苯分子中碳原子的杂化轨道类型。
sp2杂化
sp杂化
sp2杂化
‖
C
H
—
C
C
C
C
C
—
H
H
H
H
H
‖
‖
链接高考2:分析N的杂化类型。
H2N—C≡N
sp3、 sp杂化
sp2杂化
sp3杂化
分子的
空间结构
VSEPR模型
预测
解释
杂化轨道理论
肉眼不能看到分子,那么科学家是怎样知道分子的结构的呢?
红外光谱仪
质谱仪
X射线衍射仪
红外光谱仪原理
分子中的原子不是固定不动的,而是不断地振动着的,分子的空间结构是分子中的原子处于平衡位置时的模型。
分子振动需要能量,所以当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基。
化学式:C2H6O
乙醇 CH3CH2OH 二甲醚 CH3OCH3
质谱仪原理
用质谱仪测定分子的相对分子质量,在质谱图中质荷比最大的数据代表所测物质的相对分子质量。
第二章 分子结构与性质
第二节 分子的空间结构
第 1-3 课时
种类
σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
“头碰头”
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
π键
p-p π键
“肩并肩”
原子轨道的重叠方式:
镜面对称
电子云的对称方式:
种类
特征
饱和性
方向性
共价键
-
键能、键长、键角
键参数:
【回顾】2-1 共价键
多样的分子空间结构
1.双原子分子
O2
HCl
2.三原子分子
3.四原子分子
4.五原子分子
CO2
H2O
CH2O
NH3
CH4
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
【思考】为什么甲烷分子的空间结构是正四面体形而不是正方形?
C
H
H
H
H
··
··
··
··
空间结构:正四面体形 键角:109°28′
中心原子
价层电子对数
电子对互斥
气球空间互斥
空间结构
2
3
4
平面三角形
(VSEPR )理想模型
直线形
正四面体形
(VSEPR )理想模型
中心原子
价层电子对数
空间结构
分子种类
2 3 4 5 6
直线形 平面三角形 四面体形 三角双锥形 八面体形
化学式 电子式 空间结构模型
CO2
H2O
CH2O
NH3
CH4
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
(2)两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。
成键电子对
孤电子对
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对(σ键电子对 + 孤电子对)
由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
化学式 电子式 空间结构模型
CO2
H2O
CH2O
NH3
CH4
(2)两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。
成键电子对
孤电子对
(VSEPR )模型的应用:预测分子的空间结构
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
H2O
NH3
CH4
2+2=4
3+1=4
4+0=4
价层电子对互斥模型( VSEPR model)理论能比较简便地定性预测分子的空间结构,其基本观点是:
(1)分子中的中心原子的价层电子对(σ键电子对 + 孤电子对)
由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
(2)两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。
化学式 电子式 空间结构模型
H2O
NH3
CH4
(3)相较成键电子对,孤电子对有较大的排斥力
成键电子对
孤电子对
键角
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
(VSEPR )模型的应用:预测分子的空间结构
SO2
(2)VSEPR理想模型
中心原子价层电子对数 VSEPR理想模型
2 直线形
3 平面三角形
4 正四面体形
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
BeCl2 H2S NCl3
① σ键电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
ABn型分子,n为与中心原子结合的数量,也等于A与B之间结合的σ键个数。σ键电子对数=n
微粒种类 中心原子价层电子对数 VSEPR理想模型 微粒空间结构
σ键电子对 孤电子对 SO2
SO42-
NH4+
② 孤电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
方法一:根据电子式直接确定
方法二:公式计算中心原子上的孤电子对数
CH4
×(4-4×1)=0
NH3
×(5-3×1)=1
H2O
×(6-2×1)=2
2
1
2
1
2
1
=
—
2
1
(a – xb)
中心原子的价电子数
中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
② 孤电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
微粒种类 中心原子价层电子对数 VSEPR理想模型 微粒空间结构
σ键电子对 孤电子对 SO2 2
SO42- 4
NH4+ 4
方法一:根据电子式直接确定
方法二:公式计算中心原子上的孤电子对数
=
—
2
1
(a – xb)
中心原子的价电子数
中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
注意:
①价层电子对互斥模型对分子空间结构的预测少有失误,但它不能用于预测以过渡金属为中心原子的分子或离子【如Ni(CO)4等】。
②一般适用于ABn型分子,对于复杂结构【如P4O10等】无法判断。
(VSEPR )模型的应用:预测分子的空间结构
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
(1)中心原子的价层电子对(σ键电子对 + 孤电子对)
(VSEPR )模型的应用:预测分子的空间结构
(2)VSEPR理想模型
中心原子价层电子对数 VSEPR
理想模型名称
2 直线形
3 平面三角形
4 正四面体形
5 三角双锥形
6 正八面体形
价层电子对数
VSEPR
理想模型
分子的
空间结构
略去
孤电子对
三角双锥形
正八面体形
【巩固练习】
微粒 中心原子价层电子对数 VSEPR 理想模型名称 微粒
空间结构名称
σ键电子对 孤电子对 BeCl2
BF3
CH4
NH3
H2O
【思考】如何解释CH4的空间结构是正四面体形?
碳原子的价层电子排布:2s22p2
2s
2p
2s
2p
x
y
z
杂化轨道理论
鲍林
在形成分子时:
中心原子中能量相近的轨道发生混杂,混杂时保持轨道总数不变
重新分配能量和调整空间伸展方向,组成能量相等、方向不同的新原子轨道
杂化轨道理论
2p
2s
2s
2p
sp3
4个 sp3 杂化轨道
跃迁
sp3杂化
基态
激发态
甲烷分子中C原子的1个2s轨道与3个2p轨道形成4个相同的sp3杂化轨道,夹角109°28′。
甲烷分子中碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-Hσ键,呈正四面体形。
CH4
2s2p轨道
2s
2p
2s
2p
sp2
3个sp2杂化轨道
跃迁
sp2杂化
BF3
2s2p轨道
2s
2p
2s
2p
sp
2个sp杂化轨道
跃迁
sp杂化
BeCl2
杂化轨道理论
微粒 中心原子价层电子对数 VSEPR 理想模型名称 微粒 空间结构名称 中心原子杂化类型
σ键电子对 孤电子对 BeCl2 2 0 直线形 直线形 sp
BF3 3 0 平面三角形 平面三角形 sp2
CH4 4 0 正四面体形 正四面体形 sp3
【思考】中心原子杂化轨道数、类型与中心原子价层电子对数、VSEPR模型的关系?
在学习价层电子对互斥模型时,知道NH3和H2O的VSEPR模型跟CH4一样也是四面体形。尝试用杂化轨道理论来解释NH3、H2O的空间结构。
sp3杂化
2s
2p
NH3
氮原子的3个sp3杂化轨道与3个氢原子的1s原子轨道重叠形成3个N-Hσ键,其中1个sp3杂化轨道中占有孤电子对。
2s
2p
H2O
sp3杂化
氧原子的2个sp3杂化轨道与2个氢原子的1s原子轨道重叠形成2个N-Hσ键,其中2个sp3杂化轨道中占有孤电子对。
微粒 中心原子价层电子对数 VSEPR 理想模型名称 微粒 空间结构名称 中心原子杂化类型
σ键电子对 孤电子对 BeCl2 2 0 直线形 直线形 sp
BF3 3 0 平面三角形 平面三角形 sp2
CH4 4 0 正四面体形 正四面体形 sp3
NH3 3 1 四面体形 三角锥形 sp3
H2O 2 2 四面体形 V形 sp3
(2)杂化轨道数 = 中心原子价层电子对数 =σ键电子对数 + 孤电子对数
(1)杂化轨道用于形成σ键或用来容纳未参与成键的孤电子对
(3)形成π键的电子只能位于未杂化的原子轨道上。
应用VSEPR模型和杂化轨道理论解释多中心原子的结构。
已知:乙烯是平面分子,键角为120o,分子中含有碳碳双键。
如何来确定中心原子C的杂化类型呢?
2s
2p
2s
2p
sp2
3个sp2杂化轨道
跃迁
sp2杂化
sp2杂化
分子 中心原子价层电子对数 杂化轨道数 杂化类型
CH2=CH2 3 + 0=3 3 sp2杂化
乙烯 中心原子C的sp2杂化
乙炔是直线形分子,键角为180°,分子中含有碳碳三键。
乙炔分子的碳原子采用什么杂化?它的杂化轨道用于形成什么化学键?怎么理解它存在碳碳三键?
2s
2p
2s
2p
sp
2个sp杂化轨道
跃迁
sp杂化
sp杂化
分子 中心原子价层电子对数 杂化轨道数 杂化类型
CH≡CH 2 + 0=2 2 sp杂化
乙炔 中心原子C的sp杂化
链接高考1:分析乙烯、乙炔、苯分子中碳原子的杂化轨道类型。
sp2杂化
sp杂化
sp2杂化
‖
C
H
—
C
C
C
C
C
—
H
H
H
H
H
‖
‖
链接高考2:分析N的杂化类型。
H2N—C≡N
sp3、 sp杂化
sp2杂化
sp3杂化
分子的
空间结构
VSEPR模型
预测
解释
杂化轨道理论
肉眼不能看到分子,那么科学家是怎样知道分子的结构的呢?
红外光谱仪
质谱仪
X射线衍射仪
红外光谱仪原理
分子中的原子不是固定不动的,而是不断地振动着的,分子的空间结构是分子中的原子处于平衡位置时的模型。
分子振动需要能量,所以当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基。
化学式:C2H6O
乙醇 CH3CH2OH 二甲醚 CH3OCH3
质谱仪原理
用质谱仪测定分子的相对分子质量,在质谱图中质荷比最大的数据代表所测物质的相对分子质量。
