实验活动5 不同价态含硫物质的转化 课件(共30张PPT)
文档属性
| 名称 | 实验活动5 不同价态含硫物质的转化 课件(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-01 00:00:00 | ||
图片预览

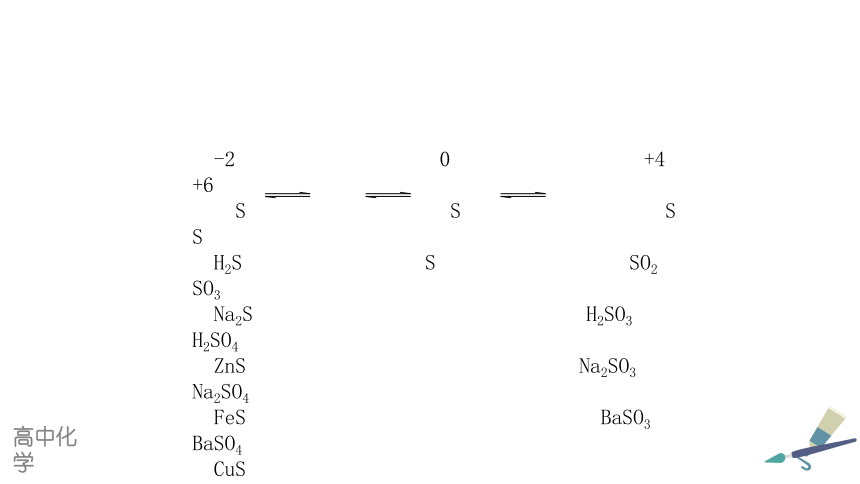





文档简介
(共30张PPT)
不同价态含硫物质的转化
您的正文已经简明扼要,但信息却错综复杂,需要用更多的文字来表述。
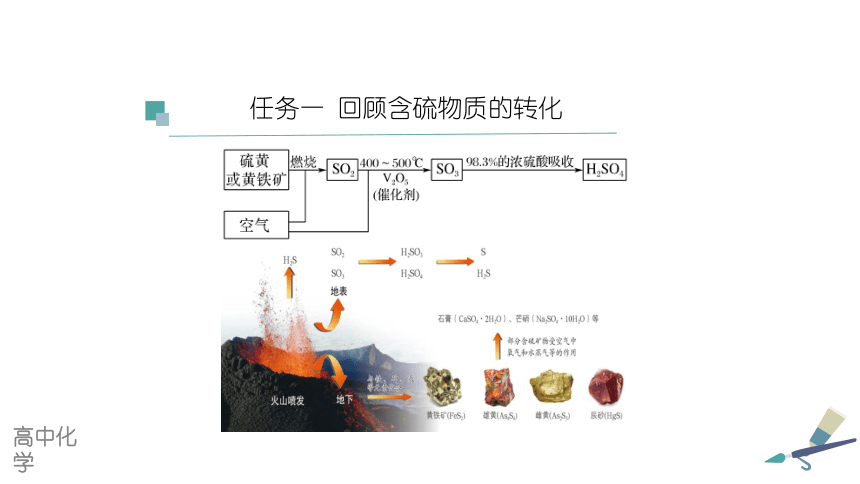
任务一 回顾含硫物质的转化
高中化学
-2 0 +4 +6
S S S S
H2S S SO2 SO3
Na2S H2SO3 H2SO4
ZnS Na2SO3 Na2SO4
FeS BaSO3 BaSO4
CuS CuSO4
HgS
高中化学
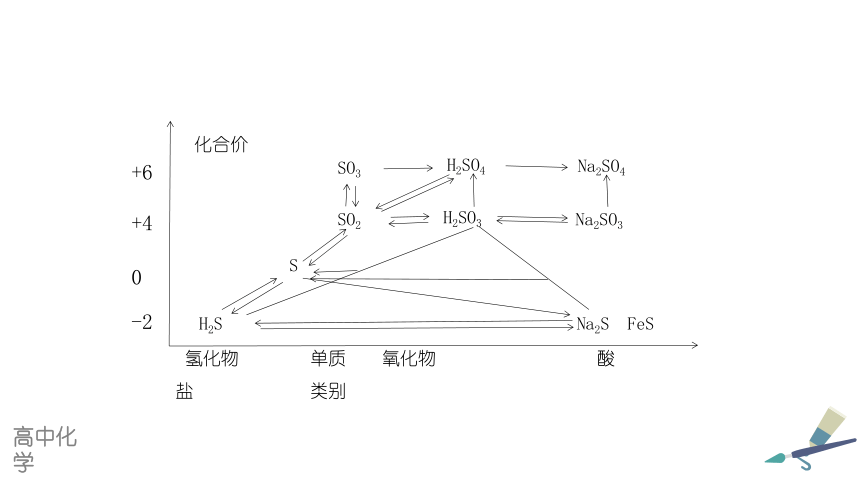
氢化物 单质 氧化物 酸 盐 类别
H2S
S
SO2
SO3
H2SO4
H2SO3
Na2SO4
Na2SO3
Na2S FeS
化合价
-2
0
+4
+6
高中化学
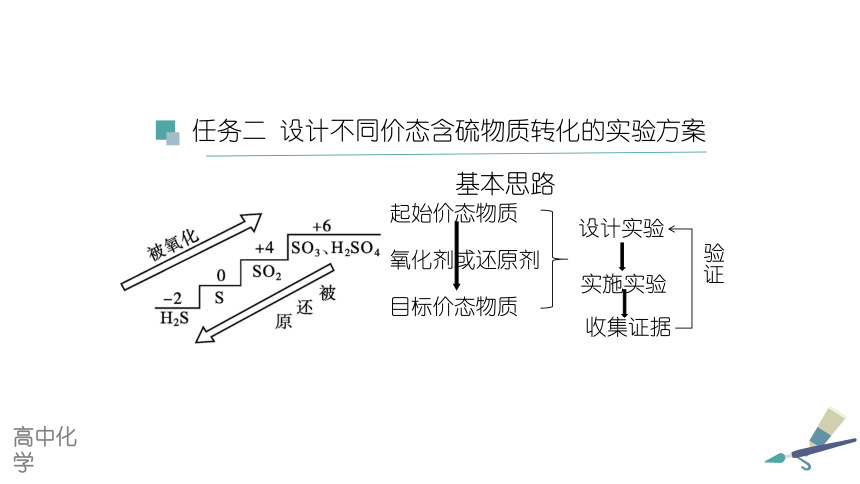
基本思路
任务二 设计不同价态含硫物质转化的实验方案
起始价态物质
目标价态物质
氧化剂或还原剂
设计实验
实施实验
收集证据
验证
高中化学
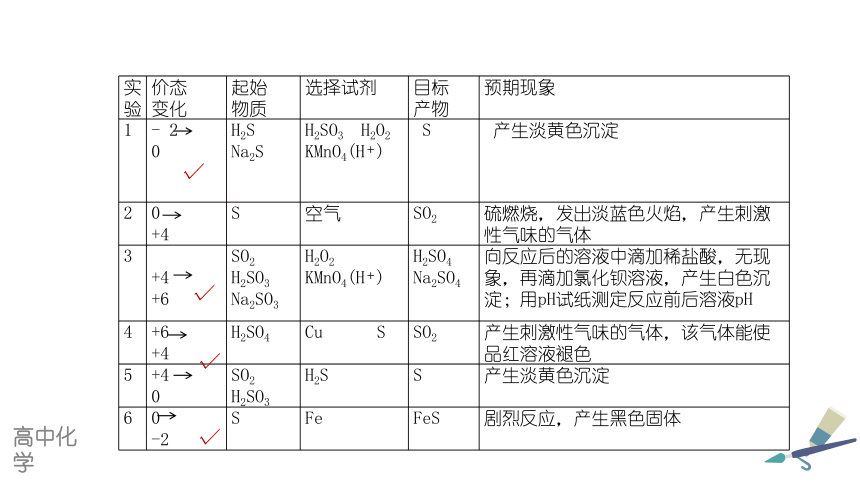
实验 价态 变化 起始 物质 选择试剂 目标 产物 预期现象
1 - 2 0 H2S Na2S H2SO3 H2O2 KMnO4(H+) S 产生淡黄色沉淀
2 0 +4 S 空气 SO2 硫燃烧,发出淡蓝色火焰,产生刺激性气味的气体
3 +4 +6 SO2 H2SO3 Na2SO3 H2O2 KMnO4(H+) H2SO4 Na2SO4 向反应后的溶液中滴加稀盐酸,无现象,再滴加氯化钡溶液,产生白色沉淀;用pH试纸测定反应前后溶液pH
4 +6 +4 H2SO4 Cu S SO2 产生刺激性气味的气体,该气体能使品红溶液褪色
5 +4 0 SO2 H2SO3 H2S S 产生淡黄色沉淀
6 0 -2 S Fe FeS 剧烈反应,产生黑色固体
√
√
√
√
高中化学
1.仪器:试管、注射器、托盘天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、T型管、止水夹、石棉网、三脚架、玻璃棒、药匙、棉花、镊子、表面皿、火柴、紫色石蕊试纸、滤纸。
2.药品:浓硫酸、稀硫酸、铜片、硫粉、铁粉、Na2S溶液、酸性KMnO4溶液、30%H2O2溶液、碘水、NaOH溶液、Na2SO3溶液、品红溶液、溴百里香酚蓝试剂、酚酞。
任务三 实施不同价态含硫物质转化的实验方案
实验用品
高中化学
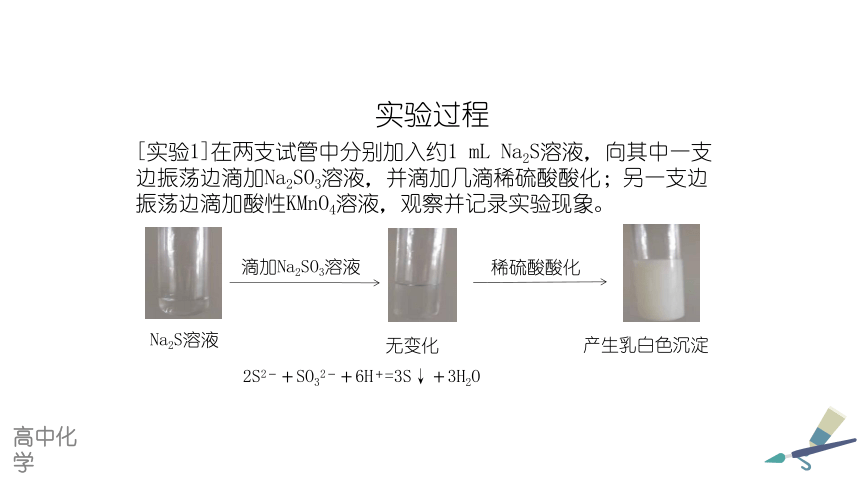
[实验1]在两支试管中分别加入约1 mL Na2S溶液,向其中一支边振荡边滴加Na2SO3溶液,并滴加稀硫酸酸化;另一支边振荡边滴加酸性KMnO4溶液,观察并记录实验现象。
实验过程
高中化学
高中化学
[实验1]在两支试管中分别加入约1 mL Na2S溶液,向其中一支边振荡边滴加Na2SO3溶液,并滴加几滴稀硫酸酸化;另一支边振荡边滴加酸性KMnO4溶液,观察并记录实验现象。
实验过程
滴加Na2SO3溶液
稀硫酸酸化
无变化
产生乳白色沉淀
Na2S溶液
2S2-+SO32-+6H+=3S↓+3H2O
高中化学
滴加酸性
KMnO4溶液
Na2S溶液
产生肉红色沉淀
思考:Na2S溶液中逐滴滴加酸性KMnO4溶液为什么没有产生浅黄色沉淀呢?
[资料卡]已知:Na2S白色固体,易溶于水和稀酸中,硫化钠溶液能溶解单质硫生成多硫化物,Na2S+(x-1)S=Na2Sx,多硫化物的溶液一般显黄色,随着x值的增加由黄色、棕色至红色。FeS黑色固体,难溶于水,易溶于稀酸中;MnS肉红色固体,难溶于水,易溶于稀酸中。
开始时滴加酸性KMnO4溶液少,生成的Mn2+与剩余的S2-结合为肉红色沉淀MnS,生成的S与S2-结合为Sx2-
高中化学
在试管中加入约1 mL 酸性KMnO4溶液边振荡边滴加Na2S溶液,观察并记录实验现象。
滴加Na2S溶液
酸性KMnO4溶液
紫红色褪去,
产生浅黄色沉淀
开始时硫化钠溶液少,产生的硫单质,
硫单质与锰离子不反应。
Na2S溶液和酸性KMnO4溶液滴加顺序不同,现象不同,你认为哪种滴加方式更合适呢?说明化学反应与什么有关?
向酸性KMnO4溶液滴加Na2S溶液更利于观察到浅黄色沉淀,否则产生肉红色沉淀会干扰浅黄色沉淀的观察。
化学反应的进行与滴加顺序有关。
高中化学
[实验2]在一支试管中加入约1 mL Na2SO3溶液,边振荡边逐滴滴加酸性KMnO4溶液,在另一支试管中加入约1 mL 酸性KMnO4溶液,边振荡边逐滴滴加Na2SO3溶液,观察并记录实验现象,得出实验结论。
实验过程
高中化学
[实验2]在一支试管中加入约1 mL Na2SO3溶液,边振荡边逐滴滴加酸性KMnO4溶液,在另一支试管中加入约1 mL 酸性KMnO4溶液,边振荡边逐滴滴加Na2SO3溶液,观察并记录实验现象,得出实验结论。
实验过程
Na2SO3溶液
滴加过量稀酸性KMnO4溶液
滴加少量稀酸性KMnO4溶液
无色
高中化学
[实验2]在一支试管中加入约1 mL Na2SO3溶液,边振荡边逐滴滴加酸性KMnO4溶液,在另一支试管中加入约1 mL 酸性KMnO4溶液,边振荡边逐滴滴加Na2SO3溶液,观察并记录实验现象,得出实验结论。
实验过程
滴加Na2SO3溶液
酸性KMnO4溶液
紫红色褪去
高中化学
实验现象:第一支试管中先无现象,多滴加酸性KMnO4溶液,溶液呈浅红色;第二支试管中紫红色颜色褪去。
实验结论:5+2+6H+=5+2Mn2++3H2O
思考:滴加顺序不同,实验现象不同,哪种更利于观察?
当无色溶液和有色溶液混合进行反应时,向有色溶液中滴加无色溶液更利于观察颜色变化。
高中化学
实验1和实验2均是溶液和溶液之间的反应,实验注意事项是取少量溶液时,大约取1mL,即1滴管;取多量溶液时,可以采用倾倒法,但不能超过试管的三分之一。向试管中滴加溶液时,胶头滴管要垂直悬空滴加,仔细观察试管中溶液颜色的变化,根据颜色的变化判断反应的原理。
实验注意事项
高中化学
[实验3]如图所示连接仪器装置,向试管中加入1 mL浓硫酸和一小块铜片,大试管口内壁依次贴有湿紫色石蕊试纸、沾有品红溶液的滤纸、酸性KMnO4溶液的滤纸、碘水的滤纸。加热,观察记录实验现象,得出实验结论;检验与双氧水溶液反应的产物;写出相应的化学方程式或离子方程式。
实验过程
高中化学
实验现象:铜片逐渐溶解,有气泡生成,溶液变绿,
紫色石蕊试纸变红,含品红滤纸红色褪去,含酸性KMnO4溶液的滤纸紫红色褪去,含碘水的滤纸棕色
褪去。
实验结论:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
SO2使品红溶液褪色,SO2具有漂白性;
SO2使酸性KMnO4溶液、碘水褪色,SO2具有还原性
5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
SO2+I2+2H2O = 2HI+H2SO4
SO2+I2+2H2O=4H++2I-+SO42-
高中化学
检验SO2与双氧水溶液反应的产物,写出相关方程式。
滴加稀盐酸
滴加BaCl2溶液
无现象
产生难溶于稀盐酸的白色沉淀
SO2+H2O2 = H2SO4 SO42-+Ba2+ = BaSO4↓
高中化学
思考:铜与稀硫酸是否反应?在什么条件下与浓硫酸反应?说明浓硫酸具有什么性质?稀硫酸与浓硫酸的微观构成的区别是什么呢?
在金属活动性顺序表中,铜排在氢之后,不能置换出稀硫酸中的氢;铜与浓硫酸在常温下难反应,在加热下反应,说明该反应与温度、浓度有关;硫酸是强电解质,在水中完全电离出H+、SO42-,主要体现酸性,而浓硫酸主要以分子形式存在,+6价的硫具有强氧化性,又与金属反应,说明浓硫酸具有酸性,该反应体现浓硫酸的强氧化性和酸性。
高中化学
思考:若把铜换成换成C、S,反应能否发生?若能,写出化学方程式,体现浓硫酸什么性质?
C+2H2SO4 CO2↑+2SO2↑+2H2O
S+2H2SO4 3SO2↑+2H2O
浓硫酸具有强氧化性。
高中化学
实验3是固体和溶液的反应。搭实验装置后要检查装置的气密性,再进行实验。取少量固体时,以铺满试管底部为准,先加固体,再加液体。试管口向上倾斜,与桌面呈45度。加热时,先均匀加热试管,再固定加热,产生的气体通入溶液,反应结束时,一般是先停止通入气体,再停止加热,防止引起倒吸现象。
实验注意事项
高中化学
[实验4]将1.0g硫粉和2.0 g铁粉均匀混合,放在石棉网(或陶土网)上堆成条状,用灼热的玻璃棒触及混合粉末的一端,当混合物成红热状态时,移开玻璃棒,观察并记录实验现象,得出实验结论。
实验过程
高中化学
实验现象:反应剧烈,全部混合物呈红热状态,
冷却后得到黑色的固体。
实验结论:Fe+S FeS
该实验的可能产物是什么呢?
FeS Fe3O4 SO2
高中化学
实验4是固体和固体的反应。称量一定质量固体时,先确定砝码和游码的读数,当固体质量小于5.0克时,直接移动游码到一定读数,左物右码原则,向左盘中加固体时,即将平衡时,左手轻轻敲打右手手腕,让固体慢慢滑落,直至平衡。
实验注意事项
高中化学
实验过程
高中化学
以上4个实验实现不同价态含硫物质转化的条件是:溶液的酸碱性、滴加顺序、温度、浓度、气体通入的速度。化学反应条件还有压强、光照、接触面等。
任务四 组建不同价态含硫物质连续性转化实验
[资料卡]硫化亚铁难溶于水,能溶于稀酸,与稀酸反应产生具有臭鸡蛋气味的气体H2S 。
高中化学
实验现象:硫粉与浓硫酸缓慢反应,紫色石蕊试纸变红,品红滤纸红色褪去,酸性KMnO4溶液紫红色褪去,碘水的棕色褪去;稀硫酸与硫化亚铁快速反应,产生气泡,双氧水溶液中产生乳白色沉淀,酸性高锰酸钾溶液颜色褪去,产生乳白色沉淀;中间的中号试管中产生浅乳白色沉淀。
实验结论:S+2H2SO4(浓) 3SO2↑+2H2O
FeS+H2SO4=FeSO4+H2S↑
H2S+H2O2=S↓+2H2O
SO2+2H2S=3S↓+2H2O
H2S具有还原性, SO2具有还原性和氧化性,浓硫酸具有强氧化性。
高中化学
小结:
最低价态
还原性
中间价态
还原性、氧化性
最高价态
氧化性
化合价降低,选还原剂 化合价升高,选氧化剂
-2 0 +4 +6
S S S S
高中化学
起始价态物质
目标价态物质
氧化剂或还原剂
设计实验
实施实验
收集证据
验证
实验流程
高中化学
不同价态含硫物质的转化
您的正文已经简明扼要,但信息却错综复杂,需要用更多的文字来表述。
任务一 回顾含硫物质的转化
高中化学
-2 0 +4 +6
S S S S
H2S S SO2 SO3
Na2S H2SO3 H2SO4
ZnS Na2SO3 Na2SO4
FeS BaSO3 BaSO4
CuS CuSO4
HgS
高中化学
氢化物 单质 氧化物 酸 盐 类别
H2S
S
SO2
SO3
H2SO4
H2SO3
Na2SO4
Na2SO3
Na2S FeS
化合价
-2
0
+4
+6
高中化学
基本思路
任务二 设计不同价态含硫物质转化的实验方案
起始价态物质
目标价态物质
氧化剂或还原剂
设计实验
实施实验
收集证据
验证
高中化学
实验 价态 变化 起始 物质 选择试剂 目标 产物 预期现象
1 - 2 0 H2S Na2S H2SO3 H2O2 KMnO4(H+) S 产生淡黄色沉淀
2 0 +4 S 空气 SO2 硫燃烧,发出淡蓝色火焰,产生刺激性气味的气体
3 +4 +6 SO2 H2SO3 Na2SO3 H2O2 KMnO4(H+) H2SO4 Na2SO4 向反应后的溶液中滴加稀盐酸,无现象,再滴加氯化钡溶液,产生白色沉淀;用pH试纸测定反应前后溶液pH
4 +6 +4 H2SO4 Cu S SO2 产生刺激性气味的气体,该气体能使品红溶液褪色
5 +4 0 SO2 H2SO3 H2S S 产生淡黄色沉淀
6 0 -2 S Fe FeS 剧烈反应,产生黑色固体
√
√
√
√
高中化学
1.仪器:试管、注射器、托盘天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、T型管、止水夹、石棉网、三脚架、玻璃棒、药匙、棉花、镊子、表面皿、火柴、紫色石蕊试纸、滤纸。
2.药品:浓硫酸、稀硫酸、铜片、硫粉、铁粉、Na2S溶液、酸性KMnO4溶液、30%H2O2溶液、碘水、NaOH溶液、Na2SO3溶液、品红溶液、溴百里香酚蓝试剂、酚酞。
任务三 实施不同价态含硫物质转化的实验方案
实验用品
高中化学
[实验1]在两支试管中分别加入约1 mL Na2S溶液,向其中一支边振荡边滴加Na2SO3溶液,并滴加稀硫酸酸化;另一支边振荡边滴加酸性KMnO4溶液,观察并记录实验现象。
实验过程
高中化学
高中化学
[实验1]在两支试管中分别加入约1 mL Na2S溶液,向其中一支边振荡边滴加Na2SO3溶液,并滴加几滴稀硫酸酸化;另一支边振荡边滴加酸性KMnO4溶液,观察并记录实验现象。
实验过程
滴加Na2SO3溶液
稀硫酸酸化
无变化
产生乳白色沉淀
Na2S溶液
2S2-+SO32-+6H+=3S↓+3H2O
高中化学
滴加酸性
KMnO4溶液
Na2S溶液
产生肉红色沉淀
思考:Na2S溶液中逐滴滴加酸性KMnO4溶液为什么没有产生浅黄色沉淀呢?
[资料卡]已知:Na2S白色固体,易溶于水和稀酸中,硫化钠溶液能溶解单质硫生成多硫化物,Na2S+(x-1)S=Na2Sx,多硫化物的溶液一般显黄色,随着x值的增加由黄色、棕色至红色。FeS黑色固体,难溶于水,易溶于稀酸中;MnS肉红色固体,难溶于水,易溶于稀酸中。
开始时滴加酸性KMnO4溶液少,生成的Mn2+与剩余的S2-结合为肉红色沉淀MnS,生成的S与S2-结合为Sx2-
高中化学
在试管中加入约1 mL 酸性KMnO4溶液边振荡边滴加Na2S溶液,观察并记录实验现象。
滴加Na2S溶液
酸性KMnO4溶液
紫红色褪去,
产生浅黄色沉淀
开始时硫化钠溶液少,产生的硫单质,
硫单质与锰离子不反应。
Na2S溶液和酸性KMnO4溶液滴加顺序不同,现象不同,你认为哪种滴加方式更合适呢?说明化学反应与什么有关?
向酸性KMnO4溶液滴加Na2S溶液更利于观察到浅黄色沉淀,否则产生肉红色沉淀会干扰浅黄色沉淀的观察。
化学反应的进行与滴加顺序有关。
高中化学
[实验2]在一支试管中加入约1 mL Na2SO3溶液,边振荡边逐滴滴加酸性KMnO4溶液,在另一支试管中加入约1 mL 酸性KMnO4溶液,边振荡边逐滴滴加Na2SO3溶液,观察并记录实验现象,得出实验结论。
实验过程
高中化学
[实验2]在一支试管中加入约1 mL Na2SO3溶液,边振荡边逐滴滴加酸性KMnO4溶液,在另一支试管中加入约1 mL 酸性KMnO4溶液,边振荡边逐滴滴加Na2SO3溶液,观察并记录实验现象,得出实验结论。
实验过程
Na2SO3溶液
滴加过量稀酸性KMnO4溶液
滴加少量稀酸性KMnO4溶液
无色
高中化学
[实验2]在一支试管中加入约1 mL Na2SO3溶液,边振荡边逐滴滴加酸性KMnO4溶液,在另一支试管中加入约1 mL 酸性KMnO4溶液,边振荡边逐滴滴加Na2SO3溶液,观察并记录实验现象,得出实验结论。
实验过程
滴加Na2SO3溶液
酸性KMnO4溶液
紫红色褪去
高中化学
实验现象:第一支试管中先无现象,多滴加酸性KMnO4溶液,溶液呈浅红色;第二支试管中紫红色颜色褪去。
实验结论:5+2+6H+=5+2Mn2++3H2O
思考:滴加顺序不同,实验现象不同,哪种更利于观察?
当无色溶液和有色溶液混合进行反应时,向有色溶液中滴加无色溶液更利于观察颜色变化。
高中化学
实验1和实验2均是溶液和溶液之间的反应,实验注意事项是取少量溶液时,大约取1mL,即1滴管;取多量溶液时,可以采用倾倒法,但不能超过试管的三分之一。向试管中滴加溶液时,胶头滴管要垂直悬空滴加,仔细观察试管中溶液颜色的变化,根据颜色的变化判断反应的原理。
实验注意事项
高中化学
[实验3]如图所示连接仪器装置,向试管中加入1 mL浓硫酸和一小块铜片,大试管口内壁依次贴有湿紫色石蕊试纸、沾有品红溶液的滤纸、酸性KMnO4溶液的滤纸、碘水的滤纸。加热,观察记录实验现象,得出实验结论;检验与双氧水溶液反应的产物;写出相应的化学方程式或离子方程式。
实验过程
高中化学
实验现象:铜片逐渐溶解,有气泡生成,溶液变绿,
紫色石蕊试纸变红,含品红滤纸红色褪去,含酸性KMnO4溶液的滤纸紫红色褪去,含碘水的滤纸棕色
褪去。
实验结论:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
SO2使品红溶液褪色,SO2具有漂白性;
SO2使酸性KMnO4溶液、碘水褪色,SO2具有还原性
5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
SO2+I2+2H2O = 2HI+H2SO4
SO2+I2+2H2O=4H++2I-+SO42-
高中化学
检验SO2与双氧水溶液反应的产物,写出相关方程式。
滴加稀盐酸
滴加BaCl2溶液
无现象
产生难溶于稀盐酸的白色沉淀
SO2+H2O2 = H2SO4 SO42-+Ba2+ = BaSO4↓
高中化学
思考:铜与稀硫酸是否反应?在什么条件下与浓硫酸反应?说明浓硫酸具有什么性质?稀硫酸与浓硫酸的微观构成的区别是什么呢?
在金属活动性顺序表中,铜排在氢之后,不能置换出稀硫酸中的氢;铜与浓硫酸在常温下难反应,在加热下反应,说明该反应与温度、浓度有关;硫酸是强电解质,在水中完全电离出H+、SO42-,主要体现酸性,而浓硫酸主要以分子形式存在,+6价的硫具有强氧化性,又与金属反应,说明浓硫酸具有酸性,该反应体现浓硫酸的强氧化性和酸性。
高中化学
思考:若把铜换成换成C、S,反应能否发生?若能,写出化学方程式,体现浓硫酸什么性质?
C+2H2SO4 CO2↑+2SO2↑+2H2O
S+2H2SO4 3SO2↑+2H2O
浓硫酸具有强氧化性。
高中化学
实验3是固体和溶液的反应。搭实验装置后要检查装置的气密性,再进行实验。取少量固体时,以铺满试管底部为准,先加固体,再加液体。试管口向上倾斜,与桌面呈45度。加热时,先均匀加热试管,再固定加热,产生的气体通入溶液,反应结束时,一般是先停止通入气体,再停止加热,防止引起倒吸现象。
实验注意事项
高中化学
[实验4]将1.0g硫粉和2.0 g铁粉均匀混合,放在石棉网(或陶土网)上堆成条状,用灼热的玻璃棒触及混合粉末的一端,当混合物成红热状态时,移开玻璃棒,观察并记录实验现象,得出实验结论。
实验过程
高中化学
实验现象:反应剧烈,全部混合物呈红热状态,
冷却后得到黑色的固体。
实验结论:Fe+S FeS
该实验的可能产物是什么呢?
FeS Fe3O4 SO2
高中化学
实验4是固体和固体的反应。称量一定质量固体时,先确定砝码和游码的读数,当固体质量小于5.0克时,直接移动游码到一定读数,左物右码原则,向左盘中加固体时,即将平衡时,左手轻轻敲打右手手腕,让固体慢慢滑落,直至平衡。
实验注意事项
高中化学
实验过程
高中化学
以上4个实验实现不同价态含硫物质转化的条件是:溶液的酸碱性、滴加顺序、温度、浓度、气体通入的速度。化学反应条件还有压强、光照、接触面等。
任务四 组建不同价态含硫物质连续性转化实验
[资料卡]硫化亚铁难溶于水,能溶于稀酸,与稀酸反应产生具有臭鸡蛋气味的气体H2S 。
高中化学
实验现象:硫粉与浓硫酸缓慢反应,紫色石蕊试纸变红,品红滤纸红色褪去,酸性KMnO4溶液紫红色褪去,碘水的棕色褪去;稀硫酸与硫化亚铁快速反应,产生气泡,双氧水溶液中产生乳白色沉淀,酸性高锰酸钾溶液颜色褪去,产生乳白色沉淀;中间的中号试管中产生浅乳白色沉淀。
实验结论:S+2H2SO4(浓) 3SO2↑+2H2O
FeS+H2SO4=FeSO4+H2S↑
H2S+H2O2=S↓+2H2O
SO2+2H2S=3S↓+2H2O
H2S具有还原性, SO2具有还原性和氧化性,浓硫酸具有强氧化性。
高中化学
小结:
最低价态
还原性
中间价态
还原性、氧化性
最高价态
氧化性
化合价降低,选还原剂 化合价升高,选氧化剂
-2 0 +4 +6
S S S S
高中化学
起始价态物质
目标价态物质
氧化剂或还原剂
设计实验
实施实验
收集证据
验证
实验流程
高中化学
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
