【新思维】2024年中考科学复习 专题16 水和溶液(含答案)
文档属性
| 名称 | 【新思维】2024年中考科学复习 专题16 水和溶液(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 323.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-01 10:34:34 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024浙江中考科学复习 新思维 专题16 水和溶液
一、选择题
1. (2023 宁波)每年雨季,“城市看海”的新闻会不时地出现在网上。为治理城市内涝,上海正加快“海绵城市”建设,其直接影响的水循环环节是图中的( )
A.甲 B.乙 C.丙 D.丁
2. (2023北仑区)氢氧化钙的溶解度随温度升高而减小.要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水.其中措施正确的是( )
A.①②④ B.①③④ C.①③⑤ D.①②⑤
3. (2023北仑区)科学课上,老师用镊子夹取一大块干冰放入装有凉水的烧杯中,观察到水立刻剧烈“沸腾”,内部产生大量气泡,水面上方出现大量白雾。关于上述实验,下列分析正确的是( )
A.干冰升华要放出热量 B.气泡内主要是水蒸气
C.气泡内主要是二氧化碳气体 D.白雾是水沸腾产生的大量水蒸气汽化形成的
4. [2022·宁波]20℃时,将45g氯化钠均分成五份,依次加入到盛有100g水的烧杯中,充分溶解。实验数据如下表:
下列分析正确的是( )
A.实验③所得溶液的溶质质量分数最大 B.实验④所得溶液是氯化钠的不饱和溶液
C.20℃时,氯化钠的溶解度为36g/100g水
D.将实验①所得溶液蒸发50g水,冷却到20℃,溶液达到饱和
5. (2023江北区)联合国把每年的3月22日定为世界节水日,希望每一个人都“知水、护水、节水”。下列与水有关的说法正确的是( )
A.地球上水的总储量非常丰富,人均可用水资源十分充足
B.我国的水资源在空间分布上很不均匀,大量的淡水资源都集中在北方
C.水的再循环、减少水的使用及水的回收利用等都是护水、节水的好方法
D.浑浊的河水经过沉淀、过滤、吸附、消毒等净化处理后,水变成纯净物
6. (2023海曙区)如图所示,向小试管中加入适量下列物质,U形管中a、b液面出现高度差,且澄清石灰水(饱和氢氧化钙溶液)变浑浊的是( )
A.氢氧化钠 B.蔗糖 C.硝酸铵 D.氯化钠
7. (2023 宁波)如图是利用注射器进行电解水的创新实验,其中电极插入注射器筒内。下列说法中不正确的是( )
A.在水中加入少量氢氧化钠,作用是增强水的导电性
B.反应一段时间后,氢氧化钠溶液的质量分数减小
C.实验成功时,左边注射器收集到的气体体积约是右边的2倍
D.两个注射器内的原始液面、电极长度要保持一致
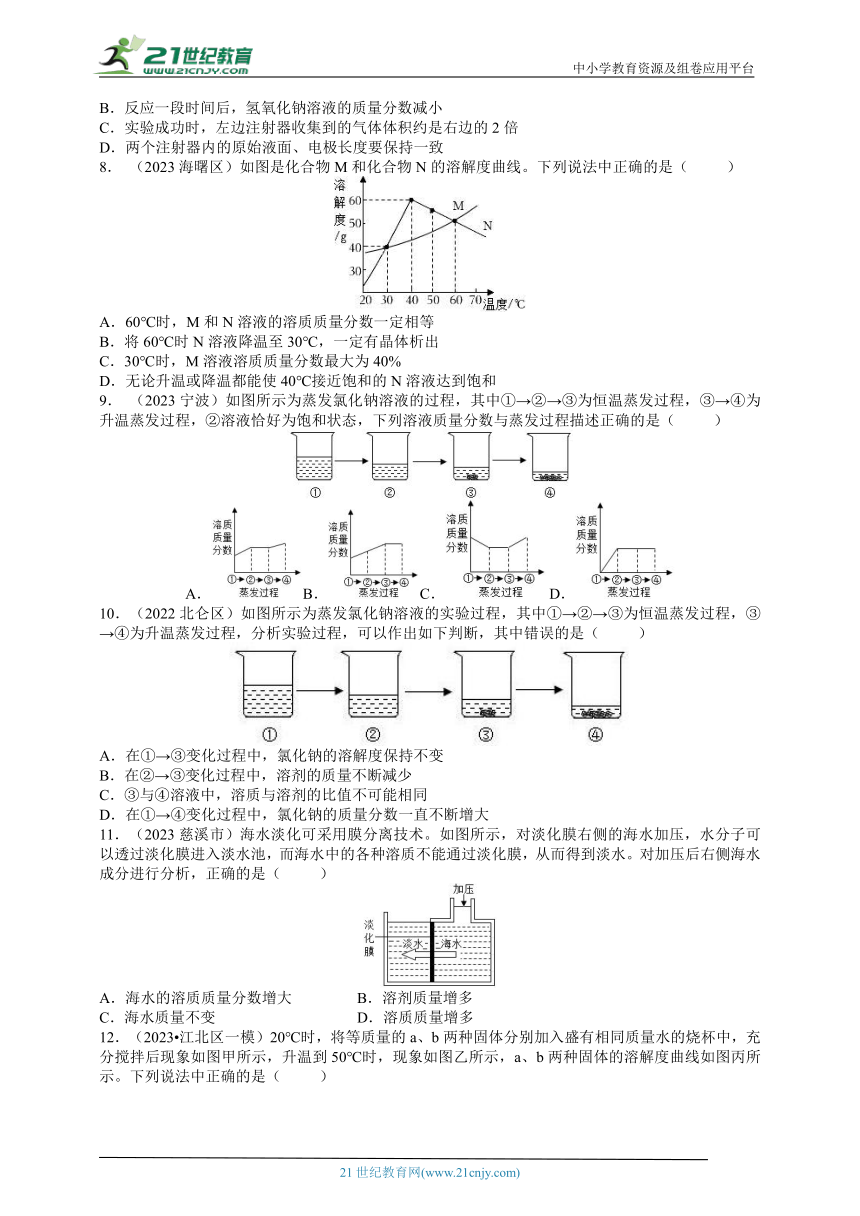
8. (2023海曙区)如图是化合物M和化合物N的溶解度曲线。下列说法中正确的是( )
A.60℃时,M和N溶液的溶质质量分数一定相等
B.将60℃时N溶液降温至30℃,一定有晶体析出
C.30℃时,M溶液溶质质量分数最大为40%
D.无论升温或降温都能使40℃接近饱和的N溶液达到饱和
9. (2023宁波)如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,下列溶液质量分数与蒸发过程描述正确的是( )
A.B.C. D.
10.(2022北仑区)如图所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,分析实验过程,可以作出如下判断,其中错误的是( )
A.在①→③变化过程中,氯化钠的溶解度保持不变
B.在②→③变化过程中,溶剂的质量不断减少
C.③与④溶液中,溶质与溶剂的比值不可能相同
D.在①→④变化过程中,氯化钠的质量分数一直不断增大
11.(2023慈溪市)海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入淡水池,而海水中的各种溶质不能通过淡化膜,从而得到淡水。对加压后右侧海水成分进行分析,正确的是( )
A.海水的溶质质量分数增大 B.溶剂质量增多
C.海水质量不变 D.溶质质量增多
12.(2023 江北区一模)20℃时,将等质量的a、b两种固体分别加入盛有相同质量水的烧杯中,充分搅拌后现象如图甲所示,升温到50℃时,现象如图乙所示,a、b两种固体的溶解度曲线如图丙所示。下列说法中正确的是( )
A.图甲中a、b两溶液中的溶质质量相等 B.图乙中a、b两溶液一定都是不饱和溶液
C.图丙中N表示a物质的溶解度曲线 D.30℃时a、b两溶液的溶质质量分数不相等
13.根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A. 无法判断a中溶液是否为饱和溶液 B. c中溶液溶质的质量分数为33.3%
C. b中溶液在加热过程中始终为饱和溶液 D. 用降温的的方法可获得大量氯化钠晶体
14.(2023慈溪市)向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。下列说法正确的是( )。
资料:A的溶解度
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
A.②中A的质量分数最大 B.③⑤中A的质量分数相等
C.②④⑤的溶液为饱和溶液 D.①③④⑤中没有固体存在
15.(2023北仑区)现要配制100g 12%的氯化钠溶液,称量过程中误将砝码(砝码盒中的砝码规格有50g、20g、10g、5g,称量时5g以下用游码)和称量物放反了,其他过程没有错误,则实际配制溶液中溶质的质量分数为( )
A.12% B.8% C.8.3% D.10%
二、填空题
16.(2023北仑区)一定温度下,取100克质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图所示。完成下列问题:
(1)配制100克质量分数为5%的NaCl溶液,不需要用到的仪器是 ;
A.集气瓶 B.烧杯 C.玻璃棒 D.量筒
(2)完成实验2操作后,甲、乙两烧杯中的溶液一定不饱和的是 烧杯中的溶液。比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是甲 乙(选填“大于”“等于”或“小于”)。
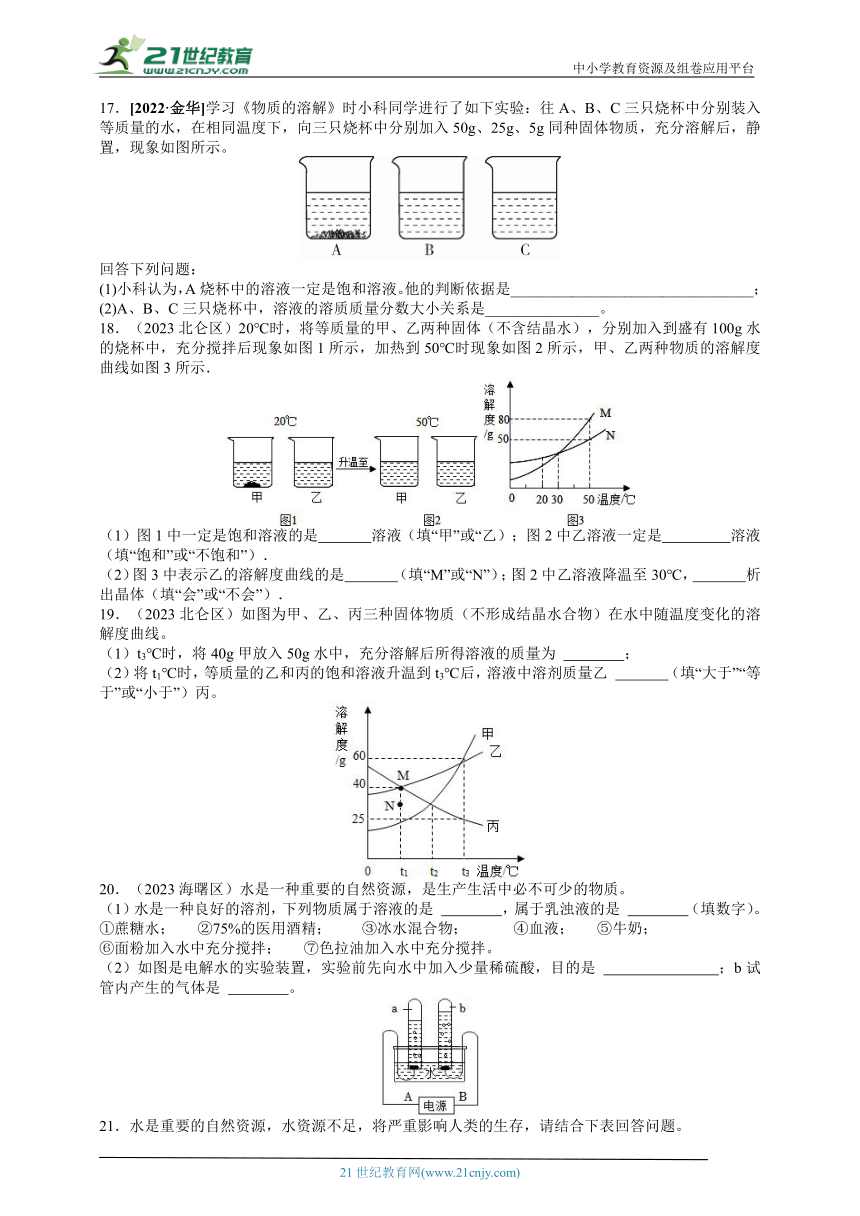
17.[2022·金华]学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯中分别加入50g、25g、5g同种固体物质,充分溶解后,静置,现象如图所示。
回答下列问题:
(1)小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是________________________________;
(2)A、B、C三只烧杯中,溶液的溶质质量分数大小关系是_______________。
18.(2023北仑区)20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示.
(1)图1中一定是饱和溶液的是 溶液(填“甲”或“乙);图2中乙溶液一定是 溶液(填“饱和”或“不饱和”).
(2)图3中表示乙的溶解度曲线的是 (填“M”或“N”);图2中乙溶液降温至30℃, 析出晶体(填“会”或“不会”).
19.(2023北仑区)如图为甲、乙、丙三种固体物质(不形成结晶水合物)在水中随温度变化的溶解度曲线。
(1)t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为 ;
(2)将t1℃时,等质量的乙和丙的饱和溶液升温到t3℃后,溶液中溶剂质量乙 (填“大于”“等于”或“小于”)丙。
20.(2023海曙区)水是一种重要的自然资源,是生产生活中必不可少的物质。
(1)水是一种良好的溶剂,下列物质属于溶液的是 ,属于乳浊液的是 (填数字)。
①蔗糖水; ②75%的医用酒精; ③冰水混合物; ④血液; ⑤牛奶;
⑥面粉加入水中充分搅拌; ⑦色拉油加入水中充分搅拌。
(2)如图是电解水的实验装置,实验前先向水中加入少量稀硫酸,目的是 ;b试管内产生的气体是 。
21.水是重要的自然资源,水资源不足,将严重影响人类的生存,请结合下表回答问题。
水资源紧缺程度 轻度缺水 中度缺水 重度缺水 极度缺水
人均水量(米3/年) 1700~3000 1000~1700 500~1000 <500
(1)我国北方人均水量约为720米3/年,水资源紧缺程度为 。
(2)研究表明:1节含汞、镉、铅等金属的干电池所造成的污染,可使60吨水无法饮用。若成年人每人每天饮水约2千克,则60吨水可供1个人饮用约 年。
22.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→ → →④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是 。
A.称取的食盐不纯,有杂质 B.配制好的溶液转移时,不小心有少量液体溅出
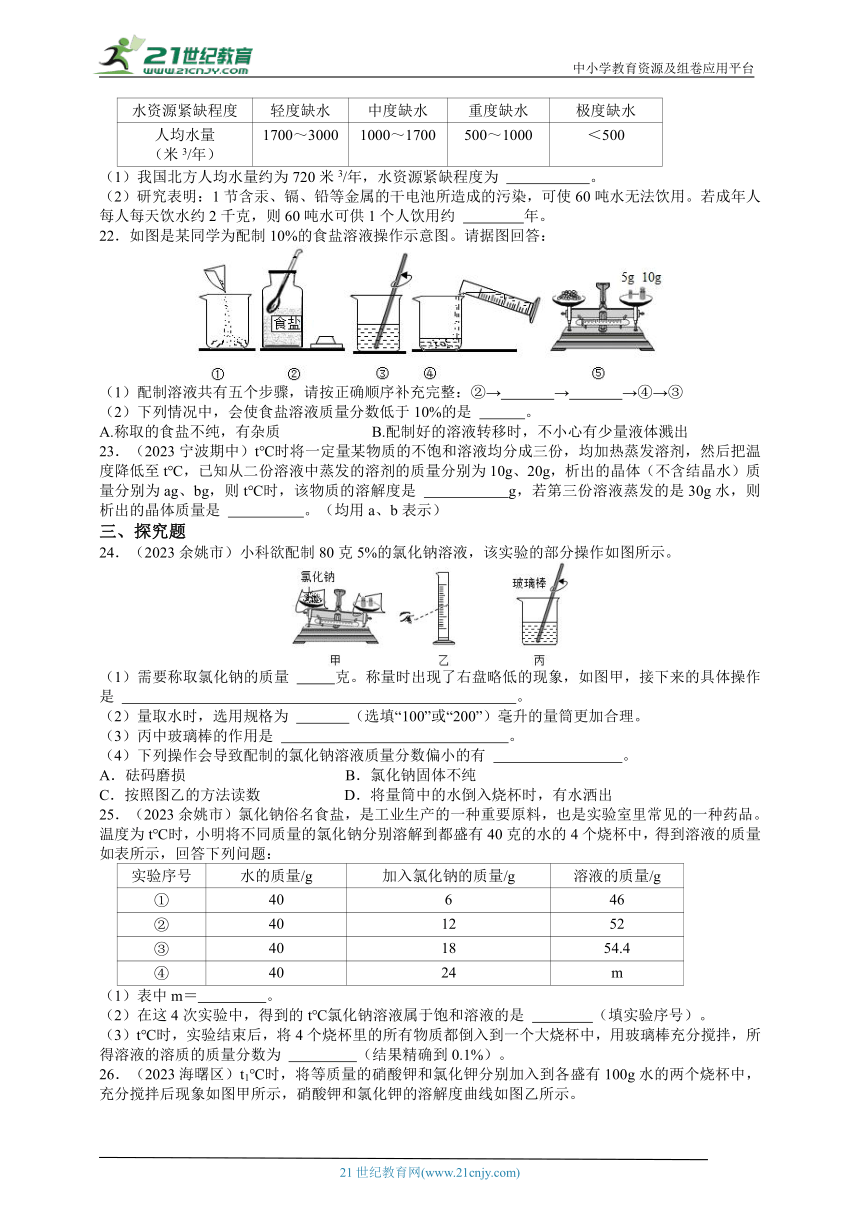
23.(2023宁波期中)t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为ag、bg,则t℃时,该物质的溶解度是 g,若第三份溶液蒸发的是30g水,则析出的晶体质量是 。(均用a、b表示)
三、探究题
24.(2023余姚市)小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。
(1)需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。
(2)量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。
(3)丙中玻璃棒的作用是 。
(4)下列操作会导致配制的氯化钠溶液质量分数偏小的有 。
A.砝码磨损 B.氯化钠固体不纯
C.按照图乙的方法读数 D.将量筒中的水倒入烧杯时,有水洒出
25.(2023余姚市)氯化钠俗名食盐,是工业生产的一种重要原料,也是实验室里常见的一种药品。温度为t℃时,小明将不同质量的氯化钠分别溶解到都盛有40克的水的4个烧杯中,得到溶液的质量如表所示,回答下列问题:
实验序号 水的质量/g 加入氯化钠的质量/g 溶液的质量/g
① 40 6 46
② 40 12 52
③ 40 18 54.4
④ 40 24 m
(1)表中m= 。
(2)在这4次实验中,得到的t℃氯化钠溶液属于饱和溶液的是 (填实验序号)。
(3)t℃时,实验结束后,将4个烧杯里的所有物质都倒入到一个大烧杯中,用玻璃棒充分搅拌,所得溶液的溶质的质量分数为 (结果精确到0.1%)。
26.(2023海曙区)t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。
(1)烧杯①中溶解的溶质是 。
(2)将t1℃时50g硝酸钾饱和溶液稀释成10%的溶液,需加水 g。
(3)关于图甲中烧杯内的物质,下列说法正确的是 。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
四、计算题
27.(2023宁波)某兴趣小组用硝酸钾进行了图甲所示的实验,硝酸钾溶解度与温度的关系如图乙。
(1)①中未溶解的硝酸钾质量为 克。
(2)②中硝酸钾溶液为 (选填“饱和”或“不饱和”)溶液。
(3)计算②中溶液的溶质质量分数。
28.(2023江北区)25℃,10克某盐加入一定量的水,完全溶解后,得到不饱和溶液,若蒸发12.5克水后得到浓度为20%的饱和溶液。
(1)计算25℃时某盐的溶解度。
(2)求原不饱和溶液的溶质的质量分数。
(3)25℃时若要使5克某盐从饱和溶液中析出来,需蒸发多少克水?
29.有100g 10%的食盐溶液,要使其质量分数变为20%,有三种方法,按要求填空:
(1)继续加入食盐,其质量为 g;
(2)蒸发水分,其质量为 g;
(3)与质量分数大于20%的浓食盐溶液混合,若混入25%的食盐溶液,其溶液质量为 g.
2024浙江中考科学复习 新思维 专题16 水和溶液(参考答案)
一、选择题
1. 【答案】C
【解析】【解答】解:A、甲表示蒸发、蒸腾,不直接影响,A错误;
B、乙表示地表径流,不直接影响,B错误;
C、丙表示下渗,是“海绵城市”建设中直接影响的水循环环节,C正确;
D、丁表示地下径流,不直接影响,D错误;
故选:C。
2. 【答案】D
【解析】【解答】解:向接近饱和的溶液中增加溶质或蒸发溶剂都可以使溶液变成饱和溶液,故把一瓶接近饱和的石灰水变成饱和,可以采取:①加入氢氧化钙、⑤蒸发水的方法;
由于氢氧化钙的溶解度随温度升高而减小,升高温度后氢氧化钙的溶解度变小,故把一瓶接近饱和的石灰水变成饱和,还可以采取②升高温度的方法。
故①②⑤符合题意。
故选:D。
3. 【答案】C
【解析】【解答】解:
A、升华需要吸收热量,故A错误;
BC、由题意可知,“气泡”内主要是干冰升华形成的二氧化碳气体,不是水蒸气,故B错误、C正确;
D、水面上方的白雾是空气中的水蒸气遇冷液化形成的小水滴,故D错误。
故选:C。
4. 【答案】C
【解析】[命题考向: 考查区别饱和溶液和非饱和溶液、溶解度的意义、溶质质量分数的计算。解析:由题可知,在20℃时,向100g水中加入45g氯化钠得到的溶液质量为136g,可得20℃时,氯化钠的溶解度为36g/100g水。由表可知,③、④为饱和溶液,溶质质量分数最大,此时溶质的质量分数=×100%=×100%≈26.47%。将实验①所得溶液蒸发50g水,冷却到20℃,所得溶质的质量分数=×100%=×100%≈15.25%<26.47%,此时溶液不是饱和溶液。]
故选C
5. 【答案】C
【解析】【分析】随着人口的增长,城市化、工业化以及灌溉对水的需求日益增加,21世纪将出现许多用水紧缺问题。在可供淡水有限的情况下,应积极采取措施保护宝贵的资源。
【解答】解:A、地球上水的总储量很大,但淡水含量还不到总水量的1%,且分布不均匀,因此淡水资源并不充裕,故A错误;
B、我国的水资源在空间分布上很不均匀,大量的淡水资源都集中在南方,故B错误;
C、水的再循环、减少水的使用及水的回收利用等都是护水、节水的好方法,故C正确;
D、浑浊的河水经过沉淀、过滤、吸附、消毒等净化处理后,水中仍含可溶性杂质,属于混合物,故D错误。
故选:C。
6. 【答案】A
【解析】【解答】解:向小试管中加入适量下列物质,U形管中a、b液面出现高度差,且澄清石灰水(饱和氢氧化钙溶液)变浑浊,氢氧化钙的溶解度随着温度的升高而减小,变浑浊,是因为温度升高,氢氧化钙的溶解度减小,有氢氧化钙析出。
A、氢氧化钠溶于水放出大量的热,使温度升高,故选项正确。
B、蔗糖溶于水温度几乎无变化,故选项错误。
C、硝酸铵溶于水吸热,使温度降低,故选项错误。
D、氯化钠溶于水温度几乎无变化,故选项错误。
故选:A。
7. 【答案】B
【解析】【分析】电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2。
【解答】解:A、由于氢氧化钠在水中能解离出自由移动的离子,在水中加入少量氢氧化钠,作用是增强水的导电性,该选项说法正确;
B、反应一段时间后,水减少,氢氧化钠的质量不变,氢氧化钠溶液的质量分数变大,该选项说法不正确;
C、实验成功时,左边注射器收集到的气体(氢气)体积约是右边(氧气)的2倍,该选项说法正确;
D、两个注射器内的原始液面、电极长度要保持一致,这样便于对比,该选项说法正确。
故选:B。
8. 【答案】D
【解析】【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,溶液中各种成分的变化程度。
【解答】解:A、60℃时,M和N溶液的状态不能确定,所以溶液的溶质质量分数不能确定,故A错误;
B、将60℃时N溶液降温至30℃,溶液的状态不能确定,所以不一定有晶体析出,故B错误;
C、30℃时,M物质的溶解度是40g,饱和溶液的溶质质量分数为:×100%≈28.6%,溶液溶质质量分数最大不会为40%,故C错误;
D、无论升温或降温都能使40℃接近饱和的N溶液达到饱和,故D正确。
故选:D。
9. 【答案】A
【解析】【分析】根据①溶液变化为②溶液,没有晶体析出,③是恒温蒸发情况下氯化钠的饱和溶液,④是升高温度后溶解度增大的饱和溶液进行解答。
【解答】解:在①→②过程中,氯化钠的溶解度不变,溶质质量分数变大,②与③都是同温度下的饱和溶液,所以溶质质量分数应该相等,③→④升温蒸发水分,此时溶解度变大,溶质的质量分数④>③,故A说法正确;
故选:A。
10.【答案】D
【解析】【分析】根据①溶液变化为②溶液,没有晶体析出,②③都是恒温蒸发情况下氯化钠的饱和溶液,④是升高温度后溶解度增大的饱和溶液进行解答。
【解答】解:A、在①→③变化过程中,为恒温蒸发过程,温度不变,氯化钠的溶解度保持不变,故A说法正确;
B、在②→③变化过程中,溶剂不断蒸发,溶剂的质量不断减少,故B说法正确;
C、在③→④过程中,升温蒸发水分,此时溶解度变大,溶质的质量分数④>③,溶质与溶剂的比值不相同,故C说法正确;
D、如果②为饱和溶液,在②→③过程中,氯化钠的溶解度不变,溶质质量分数不变,故D说法错误;
故选:D。
11.【答案】A
【解析】【解答】解:A、加压后,溶质不能通过淡化膜,加压后的右侧海水中溶质不变,溶剂质量减少,溶质质量分数增大,故选项说法正确。
B、加压后,水分子可以透过淡化膜进入左侧淡化,故加压后的右侧海水中溶剂的质量减少,故选项说法错误。
C、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后海水质量减少,故选项说法错误。
D、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后,右侧海水中溶质的质量不变,故该选项说法错误。
故选:A。
12.【答案】B
【解析】【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:A、20℃时,将等质量a、b两种固体,分别加入到盛有相同质量水的烧杯中,b固体完全溶解度,a固体没有完全溶解,所以图甲a、b溶液中的溶质质量不相等,故A错误;
B、由于图甲中可以知道20℃时a的溶解度小于b的溶解度,图乙无溶质剩余,所以b一定是不饱和溶液,而在50℃时,a的溶解度大于b的溶解度,所以a一定也是不饱和溶液,故B正确;
C、信息根据图甲中可以知道20℃时a的溶解度小于b的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,故M表示的是a物质的溶解度曲线,故C错误;
D、根据图丙可知两种物质的溶解度都随温度升高而增大,因此30℃时,a、b的溶解度都比20℃时大,且30℃时两物质的溶解度相等,当a中的物质完全溶解时,溶质的质量分数就会相等,故D错误。
故选:B。
13.【答案】C
【解析】【答案】C
【解析】
【详解】A、由图可知,20℃时氯化钠的溶解度约为36g,则此时20g水中最多溶解7.2g氯化钠,20℃将5g氯化钠放入20g水中,氯化钠固体会完全溶解形成不饱和溶液,选项错误;
B、100℃时,氯化钠的溶解度为40g,20g水中最多溶解氯化钠8g,则题目中加入的10g氯化钠只能溶解8g,所得溶液的溶质质量分数=×100%≈28.6%,选项错误;
C、b溶液的底部有固体剩余,溶液为饱和溶液,升温至100℃时,c溶液中只能溶解8g氯化钠,溶液为饱和溶液,即b中溶液在加热过程中始终为饱和溶液,选项正确;
D、氯化钠的溶解度随温度升高而增大,氮氯化钠的溶解度收温度影响较小,用降温的的方法不能获得大量氯化钠晶体,应选择蒸发结晶的方法来获得氯化钠晶体,选项错误;
故选C
14.【答案】D
【解析】【解答】解:A、由表格数据可知,A物质的溶解度随着温度的升高而增大,30℃时A的溶解度为41.4g,则25℃时A的溶解度小于41.4g;则②中A固体不能全部溶解;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g;50℃时A的溶解度为50.4g,所得溶液恰好饱和;则④⑤中A的质量分数最大,故选项说法错误。
B、③⑤中溶剂的质量相等,⑤中溶解的A固体多,③⑤中A的质量分数不相等,故选项说法错误。
C、根据A选项的分析,②⑤的溶液为饱和溶液;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g,为不饱和溶液,故选项说法错误。
D、20℃时A的溶解度为37.2g,A物质的溶解度随着温度的升高而增大,则①中固体能全部溶解;根据A选项的分析,③④⑤中没有固体存在,即①③④⑤中没有固体存在,故选项说法正确。
故选:D。
15.【答案】C
【解析】【解答】解:所需溶质质量为:100g×12%=12g,需水:88g,称量时10g是砝码质量,2g是游码,由左盘质量=右盘质量+游码质量,列式为:10g=物体质量+2g得出:物体质量=8g,故质量分数为:=8.3%。
故选:C。
二、填空题
16.【答案】(1)A;(2)甲;小于。
【解析】【解答】解:(1)配制100g质量分数为5%的NaCl溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,故不需要用到的仪器是集气瓶。
(2)向甲中加入5g水,向乙中加入5g氯化钠,则甲、乙两烧杯中的溶液一定不饱和的是甲,乙中加入5g氯化钠后可能会饱和。
溶液具有均一性,实验1中甲、乙的溶质质量分数相等,向甲中加入5g水,向乙中加入5g氯化钠,甲中溶质质量分数减小,乙中溶质质量分数增大,则大小关系是甲小于乙。
故答案为:(1)A;(2)甲;小于。
17.【答案】(1)A中有剩余固体(或A中有不溶解的固体等)(合理即可) (2)A≥B>C(或C【解析】[命题考向: 考查饱和溶液与不饱和溶液的区分、溶质质量分数的计算。
解析:(1)由图示可知,经充分溶解后,A烧杯底部仍有部分固体物质未被溶解,说明在当前温度下,A烧杯中的溶液不能继续溶解该种溶质,则一定是该物质的饱和溶液。(2)三只烧杯中有等质量的水,B、C烧杯中的溶液分别将25g、5g的固体物质全部溶解,说明在当前温度下,B烧杯中溶液的溶质质量分数一定大于C烧杯中溶液的溶质质量分数;根据题中条件,无法判断B烧杯中溶液是否达到饱和状态,因此A烧杯中溶液的溶质质量分数大于或等于B烧杯中溶液的溶质质量分数。]
答案为 (1)A中有剩余固体(或A中有不溶解的固体等)(合理即可) (2)A≥B>C(或C18.【答案】(1)甲;不饱和;(2)N;不会。
【解析】【分析】(1)根据烧杯底部是否有不溶解的固体存在以及温度升高后,溶解度的变化情况进行分析;
(2)根据图1中20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g水的烧杯中,甲有固体剩余,说明甲的溶解度小于乙,结合图3进行分析。
【解答】解:(1)图1中甲烧杯底部有不溶解的晶体存在,说明在该温度下甲溶液饱和,而乙溶液可能饱和也可能不饱和;因为两种物质的溶解度均随着温度的升高而增大,所以升温后所得图2中的乙一定不饱和;
(2)根据图1中信息可以知道20℃时甲的溶解度小于乙的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,所以N表示的是乙物质的溶解度曲线;因为乙在20℃时没有晶体存在,所以降温至30℃也不会出现晶体。
故答案为:(1)甲;不饱和;(2)N;不会。
19.【答案】(1)80g;(2)等于。
【解析】【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定形成溶液的质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:(1)t3℃时,甲的溶解度是60g,即在该温度下,100g水中最多溶解60g甲,则50g水中最多溶解30g甲,所以t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为80g;
(2)t1℃时,丙的溶解度等于乙的溶解度,所以等质量的乙和丙的饱和溶液中,甲、丙含有的溶剂多,升温到t3℃后,甲和乙的溶剂质量不变,还是甲等于乙。
故答案为:(1)80g;(2)等于。
20.【答案】(1)①②;⑤⑦;(2)增强水的导电性;氧气
【解析】【解答】解:(1)①蔗糖能溶于水形成的均一、稳定的混合物,因此蔗糖水属于溶液;
②75%的医用酒精是酒精溶于水形成的均一、稳定的混合物,因此蔗糖水属于溶液;
③冰水混合物中只含水一种物质,属于纯净物;
④血液是由血细胞、水组成的混合物,属于悬浊液;
⑤牛奶属于乳浊液;
⑥面粉加入水中充分搅拌得到的是悬浊液;
⑦色拉油加入水中充分搅拌得到的是乳浊液;
故答案为:(1)①②;⑤⑦;(2)增强水的导电性;氧气。
21.【答案】(1)重度缺水;(2)82。
【解析】【解答】解:(1)我国北方人均水量约为720米3/年,在500~1000区间内,水资源紧缺程度为重度缺水。
(2)若成年人每人每天饮水约2kg,则成年人每人每年的饮用量为2kg×365=730kg;则60吨(60000kg)水至少能供成年人同时饮用的人数为60000kg÷730kg/年≈82年。
故答案为:(1)重度缺水;(2)82。
22.【答案】(1)⑤;①;(2)A。
【解析】【解答】解:(1)配制100g16%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,正确顺序为:②→⑤→①→④→③。
(2)A.称取的食盐不纯,有杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故选项正确。
B.配制好的溶液转移时,不小心有少量液体溅出,溶液具有均一性,溶质质量分数不变,故选项错误。
故答案为:(1)⑤;①;(2)A。
23.【答案】10(b﹣a);(2b﹣a)g
【解析】【分析】t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为ag、bg,可将蒸发溶剂的质量为20g的一份,看成先蒸发10g水,析出ag晶体,再蒸发10g水,析出了bg﹣ag=(b﹣a)g晶体,进行分析解答。
【解答】解:t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为ag、bg,可将蒸发溶剂的质量为20g的一份,看成先蒸发10g水,析出ag晶体,形成了饱和溶液;再蒸发10g水,析出了bg﹣ag=(b﹣a)g晶体,即t℃时该物质的饱和溶液,蒸发10g水,析出(b﹣a)g晶体;则100g水中最多能溶解10(b﹣a)g溶质,则t℃时,该物质的溶解度是10(b﹣a)g。
若第三份溶液蒸发的是30g水,看成先蒸发20g水,析出bg晶体,再蒸发10g水,析出了(b﹣a)g晶体,则则析出的晶体质量是bg+(b﹣a)g=(2b﹣a)g。
故答案为:10(b﹣a);(2b﹣a)g。
三、探究题
24.【答案】(1)4;左盘增加氯化钠固体的质量直至天平平衡;(2)100;(3)搅拌,加速氯化钠的溶解速率; (4)ABC。
【解析】【解答】解:(1)溶质质量=溶液质量×溶质的质量,溶质氯化钠的质量是80g×5%=4g;天平称量正确的操作是左物右码,称量时出现右盘略低说明左盘所加氯化钠的质量偏小,应在左盘增加氯化钠固体的质量直至天平平衡;
(2)溶剂的质量=溶液质量﹣溶质质量,溶剂水的质量为80g﹣80g×5%=76g,水的密度为1g/ml,所以水的体积为76ml,应选100ml量筒;
(3)溶解过程中玻璃棒的作用是搅拌,加速氯化钠的溶解速率;
(4)溶质质量分数=×100%,溶质氯化钠的质量偏小会导致氯化钠溶液质量分数偏小,溶剂质量增加会导致氯化钠溶液质量分数偏小,A、砝码磨损会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,B、氯化钠固体不纯会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,C、仰视会导致所取水的质量增加,氯化钠溶液质量分数偏小,D、将量筒中的水倒入烧杯时,有水洒出,导致溶液质量偏小,氯化钠溶质质量分数偏大。
故答案为:(1)4;左盘增加氯化钠固体的质量直至天平平衡;(2)100;
(3)搅拌,加速氯化钠的溶解速率; (4)ABC。
25.【答案】(1)54.4。(2)③④。(3)26.5%。
【解析】【解答】解:(1)由表中数据可知,40g水中最多能够溶解14.4g,加入24g时溶解14.4g,因此表中m=54.4。
故答案为:54.4。
(2)由表中数据可知,40g水中最多能够溶解14.4g,在这4次实验中,得到的是t℃氯化钠溶液,属于饱和溶液的是③④。
故答案为:③④。
(3)由表中数据可知,水的质量是160g,加入的氯化钠质量是60g,160g水中最多溶解氯化钠质量:14.4g×4=57.6g,则所得溶液的溶质质量分数为:≈26.5%。
故答案为:26.5%。
故答案为:(1)54.4。(2)③④。(3)26.5%。
26.【答案】(1)氯化钾;(2)50(3)AD。
【解析】【解答】解:(1)烧杯①中溶解的溶质是氯化钾,因为该温度下氯化钾的溶解度大于硝酸钾;故答案为:氯化钾;
(2)将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,设需加水的质量为x;
(50g+x)×10%=50g×,x=50g;故答案为:50;
(3)A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数正确,因为烧杯①内溶液中溶质的质量大;
B.蒸发一定量的水,两烧杯中都一定有固体析出错误,烧杯①中不一定有固体析出;
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体错误,也可能没有剩余固体;
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等正确,因为它们中的溶质和溶剂的质量相等(不考虑水的蒸发);
故答案为:AD。
故答案为(1)氯化钾;(2)50(3)AD。
四、计算题
27.【答案】(1)8.4;(2)不饱和;(3)50%。
【解析】【解答】解:(1)20℃时,硝酸钾的溶解度为31.6g,含义是20℃时,100g水中最多溶解31.6g硝酸钾,溶液达到饱和状态,则①中未溶解的硝酸钾质量为40g﹣31.6g=8.4g。
(2)60℃时,硝酸钾的溶解度为110g,含义是60℃时,100g水中最多溶解110g硝酸钾,溶液达到饱和状态;升温至60℃,蒸发60g水,则最多能溶解的质量为×110g=44g,则②中溶解的硝酸钾的质量为40g,硝酸钾溶液为不饱和溶液。
(3)②中溶液的溶质质量分数为×100%=50%。
答:②中溶液的溶质质量分数为50%
故答案为:(1)8.4;(2)不饱和;(3)50%。
28.【答案】(1)25g;(2)16%;(3)20g。
【解析】【解答】解:(1)设物质的溶解度为S,饱和溶液中溶质质量分数为=20%,解得S=25g;
答:该物质在25℃时的溶解度为25g;
(2)设水原来的质量为x,则有×100%=20%,解得x=52.5g,所以蒸发前溶液中溶质质量分数为×100%=16%。
答:蒸发前溶液中溶质质量分数为16%。
(3)该物质在25℃时的溶解度为25g,设25℃时若要使5克某盐从饱和溶液中析出来,需蒸发水的质量为y。
y=20g。
答:25℃时若要使5克某盐从饱和溶液中析出来,需蒸发20g水。
故答案为:(1)25g;(2)16%;(3)20g。
29.【答案】(1)12.5;(2)50;(3)200.
【解析】【解答】解:(1)设继续加入的食盐的质量为x,
则100g×10%+x=(100g+x)×20% 解得x=12.5g
(2)设蒸发水的质量为y,则根据蒸发前后溶质的质量不变得,
100g×10%=(100g﹣y)×20% 解得y=50g
(3)设质量分数为25%的溶液为z,则10%的溶液中的溶质与25%的溶液中的溶质之和等于20%溶液中的溶质,100g×10%+z×25%=(100g+z)×20% 解得z=200g
故答案为:(1)12.5;(2)50;(3)200.
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024浙江中考科学复习 新思维 专题16 水和溶液
一、选择题
1. (2023 宁波)每年雨季,“城市看海”的新闻会不时地出现在网上。为治理城市内涝,上海正加快“海绵城市”建设,其直接影响的水循环环节是图中的( )
A.甲 B.乙 C.丙 D.丁
2. (2023北仑区)氢氧化钙的溶解度随温度升高而减小.要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水.其中措施正确的是( )
A.①②④ B.①③④ C.①③⑤ D.①②⑤
3. (2023北仑区)科学课上,老师用镊子夹取一大块干冰放入装有凉水的烧杯中,观察到水立刻剧烈“沸腾”,内部产生大量气泡,水面上方出现大量白雾。关于上述实验,下列分析正确的是( )
A.干冰升华要放出热量 B.气泡内主要是水蒸气
C.气泡内主要是二氧化碳气体 D.白雾是水沸腾产生的大量水蒸气汽化形成的
4. [2022·宁波]20℃时,将45g氯化钠均分成五份,依次加入到盛有100g水的烧杯中,充分溶解。实验数据如下表:
下列分析正确的是( )
A.实验③所得溶液的溶质质量分数最大 B.实验④所得溶液是氯化钠的不饱和溶液
C.20℃时,氯化钠的溶解度为36g/100g水
D.将实验①所得溶液蒸发50g水,冷却到20℃,溶液达到饱和
5. (2023江北区)联合国把每年的3月22日定为世界节水日,希望每一个人都“知水、护水、节水”。下列与水有关的说法正确的是( )
A.地球上水的总储量非常丰富,人均可用水资源十分充足
B.我国的水资源在空间分布上很不均匀,大量的淡水资源都集中在北方
C.水的再循环、减少水的使用及水的回收利用等都是护水、节水的好方法
D.浑浊的河水经过沉淀、过滤、吸附、消毒等净化处理后,水变成纯净物
6. (2023海曙区)如图所示,向小试管中加入适量下列物质,U形管中a、b液面出现高度差,且澄清石灰水(饱和氢氧化钙溶液)变浑浊的是( )
A.氢氧化钠 B.蔗糖 C.硝酸铵 D.氯化钠
7. (2023 宁波)如图是利用注射器进行电解水的创新实验,其中电极插入注射器筒内。下列说法中不正确的是( )
A.在水中加入少量氢氧化钠,作用是增强水的导电性
B.反应一段时间后,氢氧化钠溶液的质量分数减小
C.实验成功时,左边注射器收集到的气体体积约是右边的2倍
D.两个注射器内的原始液面、电极长度要保持一致
8. (2023海曙区)如图是化合物M和化合物N的溶解度曲线。下列说法中正确的是( )
A.60℃时,M和N溶液的溶质质量分数一定相等
B.将60℃时N溶液降温至30℃,一定有晶体析出
C.30℃时,M溶液溶质质量分数最大为40%
D.无论升温或降温都能使40℃接近饱和的N溶液达到饱和
9. (2023宁波)如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,下列溶液质量分数与蒸发过程描述正确的是( )
A.B.C. D.
10.(2022北仑区)如图所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,分析实验过程,可以作出如下判断,其中错误的是( )
A.在①→③变化过程中,氯化钠的溶解度保持不变
B.在②→③变化过程中,溶剂的质量不断减少
C.③与④溶液中,溶质与溶剂的比值不可能相同
D.在①→④变化过程中,氯化钠的质量分数一直不断增大
11.(2023慈溪市)海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入淡水池,而海水中的各种溶质不能通过淡化膜,从而得到淡水。对加压后右侧海水成分进行分析,正确的是( )
A.海水的溶质质量分数增大 B.溶剂质量增多
C.海水质量不变 D.溶质质量增多
12.(2023 江北区一模)20℃时,将等质量的a、b两种固体分别加入盛有相同质量水的烧杯中,充分搅拌后现象如图甲所示,升温到50℃时,现象如图乙所示,a、b两种固体的溶解度曲线如图丙所示。下列说法中正确的是( )
A.图甲中a、b两溶液中的溶质质量相等 B.图乙中a、b两溶液一定都是不饱和溶液
C.图丙中N表示a物质的溶解度曲线 D.30℃时a、b两溶液的溶质质量分数不相等
13.根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A. 无法判断a中溶液是否为饱和溶液 B. c中溶液溶质的质量分数为33.3%
C. b中溶液在加热过程中始终为饱和溶液 D. 用降温的的方法可获得大量氯化钠晶体
14.(2023慈溪市)向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。下列说法正确的是( )。
资料:A的溶解度
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
A.②中A的质量分数最大 B.③⑤中A的质量分数相等
C.②④⑤的溶液为饱和溶液 D.①③④⑤中没有固体存在
15.(2023北仑区)现要配制100g 12%的氯化钠溶液,称量过程中误将砝码(砝码盒中的砝码规格有50g、20g、10g、5g,称量时5g以下用游码)和称量物放反了,其他过程没有错误,则实际配制溶液中溶质的质量分数为( )
A.12% B.8% C.8.3% D.10%
二、填空题
16.(2023北仑区)一定温度下,取100克质量分数为5%的NaCl溶液,先按实验1将NaCl溶液分成两等份,再进行实验2操作,如图所示。完成下列问题:
(1)配制100克质量分数为5%的NaCl溶液,不需要用到的仪器是 ;
A.集气瓶 B.烧杯 C.玻璃棒 D.量筒
(2)完成实验2操作后,甲、乙两烧杯中的溶液一定不饱和的是 烧杯中的溶液。比较甲、乙两只烧杯中溶液的溶质质量分数,其大小关系是甲 乙(选填“大于”“等于”或“小于”)。
17.[2022·金华]学习《物质的溶解》时小科同学进行了如下实验:往A、B、C三只烧杯中分别装入等质量的水,在相同温度下,向三只烧杯中分别加入50g、25g、5g同种固体物质,充分溶解后,静置,现象如图所示。
回答下列问题:
(1)小科认为,A烧杯中的溶液一定是饱和溶液。他的判断依据是________________________________;
(2)A、B、C三只烧杯中,溶液的溶质质量分数大小关系是_______________。
18.(2023北仑区)20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示.
(1)图1中一定是饱和溶液的是 溶液(填“甲”或“乙);图2中乙溶液一定是 溶液(填“饱和”或“不饱和”).
(2)图3中表示乙的溶解度曲线的是 (填“M”或“N”);图2中乙溶液降温至30℃, 析出晶体(填“会”或“不会”).
19.(2023北仑区)如图为甲、乙、丙三种固体物质(不形成结晶水合物)在水中随温度变化的溶解度曲线。
(1)t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为 ;
(2)将t1℃时,等质量的乙和丙的饱和溶液升温到t3℃后,溶液中溶剂质量乙 (填“大于”“等于”或“小于”)丙。
20.(2023海曙区)水是一种重要的自然资源,是生产生活中必不可少的物质。
(1)水是一种良好的溶剂,下列物质属于溶液的是 ,属于乳浊液的是 (填数字)。
①蔗糖水; ②75%的医用酒精; ③冰水混合物; ④血液; ⑤牛奶;
⑥面粉加入水中充分搅拌; ⑦色拉油加入水中充分搅拌。
(2)如图是电解水的实验装置,实验前先向水中加入少量稀硫酸,目的是 ;b试管内产生的气体是 。
21.水是重要的自然资源,水资源不足,将严重影响人类的生存,请结合下表回答问题。
水资源紧缺程度 轻度缺水 中度缺水 重度缺水 极度缺水
人均水量(米3/年) 1700~3000 1000~1700 500~1000 <500
(1)我国北方人均水量约为720米3/年,水资源紧缺程度为 。
(2)研究表明:1节含汞、镉、铅等金属的干电池所造成的污染,可使60吨水无法饮用。若成年人每人每天饮水约2千克,则60吨水可供1个人饮用约 年。
22.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→ → →④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是 。
A.称取的食盐不纯,有杂质 B.配制好的溶液转移时,不小心有少量液体溅出
23.(2023宁波期中)t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为ag、bg,则t℃时,该物质的溶解度是 g,若第三份溶液蒸发的是30g水,则析出的晶体质量是 。(均用a、b表示)
三、探究题
24.(2023余姚市)小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。
(1)需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。
(2)量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。
(3)丙中玻璃棒的作用是 。
(4)下列操作会导致配制的氯化钠溶液质量分数偏小的有 。
A.砝码磨损 B.氯化钠固体不纯
C.按照图乙的方法读数 D.将量筒中的水倒入烧杯时,有水洒出
25.(2023余姚市)氯化钠俗名食盐,是工业生产的一种重要原料,也是实验室里常见的一种药品。温度为t℃时,小明将不同质量的氯化钠分别溶解到都盛有40克的水的4个烧杯中,得到溶液的质量如表所示,回答下列问题:
实验序号 水的质量/g 加入氯化钠的质量/g 溶液的质量/g
① 40 6 46
② 40 12 52
③ 40 18 54.4
④ 40 24 m
(1)表中m= 。
(2)在这4次实验中,得到的t℃氯化钠溶液属于饱和溶液的是 (填实验序号)。
(3)t℃时,实验结束后,将4个烧杯里的所有物质都倒入到一个大烧杯中,用玻璃棒充分搅拌,所得溶液的溶质的质量分数为 (结果精确到0.1%)。
26.(2023海曙区)t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。
(1)烧杯①中溶解的溶质是 。
(2)将t1℃时50g硝酸钾饱和溶液稀释成10%的溶液,需加水 g。
(3)关于图甲中烧杯内的物质,下列说法正确的是 。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
四、计算题
27.(2023宁波)某兴趣小组用硝酸钾进行了图甲所示的实验,硝酸钾溶解度与温度的关系如图乙。
(1)①中未溶解的硝酸钾质量为 克。
(2)②中硝酸钾溶液为 (选填“饱和”或“不饱和”)溶液。
(3)计算②中溶液的溶质质量分数。
28.(2023江北区)25℃,10克某盐加入一定量的水,完全溶解后,得到不饱和溶液,若蒸发12.5克水后得到浓度为20%的饱和溶液。
(1)计算25℃时某盐的溶解度。
(2)求原不饱和溶液的溶质的质量分数。
(3)25℃时若要使5克某盐从饱和溶液中析出来,需蒸发多少克水?
29.有100g 10%的食盐溶液,要使其质量分数变为20%,有三种方法,按要求填空:
(1)继续加入食盐,其质量为 g;
(2)蒸发水分,其质量为 g;
(3)与质量分数大于20%的浓食盐溶液混合,若混入25%的食盐溶液,其溶液质量为 g.
2024浙江中考科学复习 新思维 专题16 水和溶液(参考答案)
一、选择题
1. 【答案】C
【解析】【解答】解:A、甲表示蒸发、蒸腾,不直接影响,A错误;
B、乙表示地表径流,不直接影响,B错误;
C、丙表示下渗,是“海绵城市”建设中直接影响的水循环环节,C正确;
D、丁表示地下径流,不直接影响,D错误;
故选:C。
2. 【答案】D
【解析】【解答】解:向接近饱和的溶液中增加溶质或蒸发溶剂都可以使溶液变成饱和溶液,故把一瓶接近饱和的石灰水变成饱和,可以采取:①加入氢氧化钙、⑤蒸发水的方法;
由于氢氧化钙的溶解度随温度升高而减小,升高温度后氢氧化钙的溶解度变小,故把一瓶接近饱和的石灰水变成饱和,还可以采取②升高温度的方法。
故①②⑤符合题意。
故选:D。
3. 【答案】C
【解析】【解答】解:
A、升华需要吸收热量,故A错误;
BC、由题意可知,“气泡”内主要是干冰升华形成的二氧化碳气体,不是水蒸气,故B错误、C正确;
D、水面上方的白雾是空气中的水蒸气遇冷液化形成的小水滴,故D错误。
故选:C。
4. 【答案】C
【解析】[命题考向: 考查区别饱和溶液和非饱和溶液、溶解度的意义、溶质质量分数的计算。解析:由题可知,在20℃时,向100g水中加入45g氯化钠得到的溶液质量为136g,可得20℃时,氯化钠的溶解度为36g/100g水。由表可知,③、④为饱和溶液,溶质质量分数最大,此时溶质的质量分数=×100%=×100%≈26.47%。将实验①所得溶液蒸发50g水,冷却到20℃,所得溶质的质量分数=×100%=×100%≈15.25%<26.47%,此时溶液不是饱和溶液。]
故选C
5. 【答案】C
【解析】【分析】随着人口的增长,城市化、工业化以及灌溉对水的需求日益增加,21世纪将出现许多用水紧缺问题。在可供淡水有限的情况下,应积极采取措施保护宝贵的资源。
【解答】解:A、地球上水的总储量很大,但淡水含量还不到总水量的1%,且分布不均匀,因此淡水资源并不充裕,故A错误;
B、我国的水资源在空间分布上很不均匀,大量的淡水资源都集中在南方,故B错误;
C、水的再循环、减少水的使用及水的回收利用等都是护水、节水的好方法,故C正确;
D、浑浊的河水经过沉淀、过滤、吸附、消毒等净化处理后,水中仍含可溶性杂质,属于混合物,故D错误。
故选:C。
6. 【答案】A
【解析】【解答】解:向小试管中加入适量下列物质,U形管中a、b液面出现高度差,且澄清石灰水(饱和氢氧化钙溶液)变浑浊,氢氧化钙的溶解度随着温度的升高而减小,变浑浊,是因为温度升高,氢氧化钙的溶解度减小,有氢氧化钙析出。
A、氢氧化钠溶于水放出大量的热,使温度升高,故选项正确。
B、蔗糖溶于水温度几乎无变化,故选项错误。
C、硝酸铵溶于水吸热,使温度降低,故选项错误。
D、氯化钠溶于水温度几乎无变化,故选项错误。
故选:A。
7. 【答案】B
【解析】【分析】电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2。
【解答】解:A、由于氢氧化钠在水中能解离出自由移动的离子,在水中加入少量氢氧化钠,作用是增强水的导电性,该选项说法正确;
B、反应一段时间后,水减少,氢氧化钠的质量不变,氢氧化钠溶液的质量分数变大,该选项说法不正确;
C、实验成功时,左边注射器收集到的气体(氢气)体积约是右边(氧气)的2倍,该选项说法正确;
D、两个注射器内的原始液面、电极长度要保持一致,这样便于对比,该选项说法正确。
故选:B。
8. 【答案】D
【解析】【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,溶液中各种成分的变化程度。
【解答】解:A、60℃时,M和N溶液的状态不能确定,所以溶液的溶质质量分数不能确定,故A错误;
B、将60℃时N溶液降温至30℃,溶液的状态不能确定,所以不一定有晶体析出,故B错误;
C、30℃时,M物质的溶解度是40g,饱和溶液的溶质质量分数为:×100%≈28.6%,溶液溶质质量分数最大不会为40%,故C错误;
D、无论升温或降温都能使40℃接近饱和的N溶液达到饱和,故D正确。
故选:D。
9. 【答案】A
【解析】【分析】根据①溶液变化为②溶液,没有晶体析出,③是恒温蒸发情况下氯化钠的饱和溶液,④是升高温度后溶解度增大的饱和溶液进行解答。
【解答】解:在①→②过程中,氯化钠的溶解度不变,溶质质量分数变大,②与③都是同温度下的饱和溶液,所以溶质质量分数应该相等,③→④升温蒸发水分,此时溶解度变大,溶质的质量分数④>③,故A说法正确;
故选:A。
10.【答案】D
【解析】【分析】根据①溶液变化为②溶液,没有晶体析出,②③都是恒温蒸发情况下氯化钠的饱和溶液,④是升高温度后溶解度增大的饱和溶液进行解答。
【解答】解:A、在①→③变化过程中,为恒温蒸发过程,温度不变,氯化钠的溶解度保持不变,故A说法正确;
B、在②→③变化过程中,溶剂不断蒸发,溶剂的质量不断减少,故B说法正确;
C、在③→④过程中,升温蒸发水分,此时溶解度变大,溶质的质量分数④>③,溶质与溶剂的比值不相同,故C说法正确;
D、如果②为饱和溶液,在②→③过程中,氯化钠的溶解度不变,溶质质量分数不变,故D说法错误;
故选:D。
11.【答案】A
【解析】【解答】解:A、加压后,溶质不能通过淡化膜,加压后的右侧海水中溶质不变,溶剂质量减少,溶质质量分数增大,故选项说法正确。
B、加压后,水分子可以透过淡化膜进入左侧淡化,故加压后的右侧海水中溶剂的质量减少,故选项说法错误。
C、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后海水质量减少,故选项说法错误。
D、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后,右侧海水中溶质的质量不变,故该选项说法错误。
故选:A。
12.【答案】B
【解析】【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:A、20℃时,将等质量a、b两种固体,分别加入到盛有相同质量水的烧杯中,b固体完全溶解度,a固体没有完全溶解,所以图甲a、b溶液中的溶质质量不相等,故A错误;
B、由于图甲中可以知道20℃时a的溶解度小于b的溶解度,图乙无溶质剩余,所以b一定是不饱和溶液,而在50℃时,a的溶解度大于b的溶解度,所以a一定也是不饱和溶液,故B正确;
C、信息根据图甲中可以知道20℃时a的溶解度小于b的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,故M表示的是a物质的溶解度曲线,故C错误;
D、根据图丙可知两种物质的溶解度都随温度升高而增大,因此30℃时,a、b的溶解度都比20℃时大,且30℃时两物质的溶解度相等,当a中的物质完全溶解时,溶质的质量分数就会相等,故D错误。
故选:B。
13.【答案】C
【解析】【答案】C
【解析】
【详解】A、由图可知,20℃时氯化钠的溶解度约为36g,则此时20g水中最多溶解7.2g氯化钠,20℃将5g氯化钠放入20g水中,氯化钠固体会完全溶解形成不饱和溶液,选项错误;
B、100℃时,氯化钠的溶解度为40g,20g水中最多溶解氯化钠8g,则题目中加入的10g氯化钠只能溶解8g,所得溶液的溶质质量分数=×100%≈28.6%,选项错误;
C、b溶液的底部有固体剩余,溶液为饱和溶液,升温至100℃时,c溶液中只能溶解8g氯化钠,溶液为饱和溶液,即b中溶液在加热过程中始终为饱和溶液,选项正确;
D、氯化钠的溶解度随温度升高而增大,氮氯化钠的溶解度收温度影响较小,用降温的的方法不能获得大量氯化钠晶体,应选择蒸发结晶的方法来获得氯化钠晶体,选项错误;
故选C
14.【答案】D
【解析】【解答】解:A、由表格数据可知,A物质的溶解度随着温度的升高而增大,30℃时A的溶解度为41.4g,则25℃时A的溶解度小于41.4g;则②中A固体不能全部溶解;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g;50℃时A的溶解度为50.4g,所得溶液恰好饱和;则④⑤中A的质量分数最大,故选项说法错误。
B、③⑤中溶剂的质量相等,⑤中溶解的A固体多,③⑤中A的质量分数不相等,故选项说法错误。
C、根据A选项的分析,②⑤的溶液为饱和溶液;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g,为不饱和溶液,故选项说法错误。
D、20℃时A的溶解度为37.2g,A物质的溶解度随着温度的升高而增大,则①中固体能全部溶解;根据A选项的分析,③④⑤中没有固体存在,即①③④⑤中没有固体存在,故选项说法正确。
故选:D。
15.【答案】C
【解析】【解答】解:所需溶质质量为:100g×12%=12g,需水:88g,称量时10g是砝码质量,2g是游码,由左盘质量=右盘质量+游码质量,列式为:10g=物体质量+2g得出:物体质量=8g,故质量分数为:=8.3%。
故选:C。
二、填空题
16.【答案】(1)A;(2)甲;小于。
【解析】【解答】解:(1)配制100g质量分数为5%的NaCl溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,故不需要用到的仪器是集气瓶。
(2)向甲中加入5g水,向乙中加入5g氯化钠,则甲、乙两烧杯中的溶液一定不饱和的是甲,乙中加入5g氯化钠后可能会饱和。
溶液具有均一性,实验1中甲、乙的溶质质量分数相等,向甲中加入5g水,向乙中加入5g氯化钠,甲中溶质质量分数减小,乙中溶质质量分数增大,则大小关系是甲小于乙。
故答案为:(1)A;(2)甲;小于。
17.【答案】(1)A中有剩余固体(或A中有不溶解的固体等)(合理即可) (2)A≥B>C(或C
解析:(1)由图示可知,经充分溶解后,A烧杯底部仍有部分固体物质未被溶解,说明在当前温度下,A烧杯中的溶液不能继续溶解该种溶质,则一定是该物质的饱和溶液。(2)三只烧杯中有等质量的水,B、C烧杯中的溶液分别将25g、5g的固体物质全部溶解,说明在当前温度下,B烧杯中溶液的溶质质量分数一定大于C烧杯中溶液的溶质质量分数;根据题中条件,无法判断B烧杯中溶液是否达到饱和状态,因此A烧杯中溶液的溶质质量分数大于或等于B烧杯中溶液的溶质质量分数。]
答案为 (1)A中有剩余固体(或A中有不溶解的固体等)(合理即可) (2)A≥B>C(或C
【解析】【分析】(1)根据烧杯底部是否有不溶解的固体存在以及温度升高后,溶解度的变化情况进行分析;
(2)根据图1中20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g水的烧杯中,甲有固体剩余,说明甲的溶解度小于乙,结合图3进行分析。
【解答】解:(1)图1中甲烧杯底部有不溶解的晶体存在,说明在该温度下甲溶液饱和,而乙溶液可能饱和也可能不饱和;因为两种物质的溶解度均随着温度的升高而增大,所以升温后所得图2中的乙一定不饱和;
(2)根据图1中信息可以知道20℃时甲的溶解度小于乙的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,所以N表示的是乙物质的溶解度曲线;因为乙在20℃时没有晶体存在,所以降温至30℃也不会出现晶体。
故答案为:(1)甲;不饱和;(2)N;不会。
19.【答案】(1)80g;(2)等于。
【解析】【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定形成溶液的质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
【解答】解:(1)t3℃时,甲的溶解度是60g,即在该温度下,100g水中最多溶解60g甲,则50g水中最多溶解30g甲,所以t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为80g;
(2)t1℃时,丙的溶解度等于乙的溶解度,所以等质量的乙和丙的饱和溶液中,甲、丙含有的溶剂多,升温到t3℃后,甲和乙的溶剂质量不变,还是甲等于乙。
故答案为:(1)80g;(2)等于。
20.【答案】(1)①②;⑤⑦;(2)增强水的导电性;氧气
【解析】【解答】解:(1)①蔗糖能溶于水形成的均一、稳定的混合物,因此蔗糖水属于溶液;
②75%的医用酒精是酒精溶于水形成的均一、稳定的混合物,因此蔗糖水属于溶液;
③冰水混合物中只含水一种物质,属于纯净物;
④血液是由血细胞、水组成的混合物,属于悬浊液;
⑤牛奶属于乳浊液;
⑥面粉加入水中充分搅拌得到的是悬浊液;
⑦色拉油加入水中充分搅拌得到的是乳浊液;
故答案为:(1)①②;⑤⑦;(2)增强水的导电性;氧气。
21.【答案】(1)重度缺水;(2)82。
【解析】【解答】解:(1)我国北方人均水量约为720米3/年,在500~1000区间内,水资源紧缺程度为重度缺水。
(2)若成年人每人每天饮水约2kg,则成年人每人每年的饮用量为2kg×365=730kg;则60吨(60000kg)水至少能供成年人同时饮用的人数为60000kg÷730kg/年≈82年。
故答案为:(1)重度缺水;(2)82。
22.【答案】(1)⑤;①;(2)A。
【解析】【解答】解:(1)配制100g16%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,正确顺序为:②→⑤→①→④→③。
(2)A.称取的食盐不纯,有杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故选项正确。
B.配制好的溶液转移时,不小心有少量液体溅出,溶液具有均一性,溶质质量分数不变,故选项错误。
故答案为:(1)⑤;①;(2)A。
23.【答案】10(b﹣a);(2b﹣a)g
【解析】【分析】t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为ag、bg,可将蒸发溶剂的质量为20g的一份,看成先蒸发10g水,析出ag晶体,再蒸发10g水,析出了bg﹣ag=(b﹣a)g晶体,进行分析解答。
【解答】解:t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为ag、bg,可将蒸发溶剂的质量为20g的一份,看成先蒸发10g水,析出ag晶体,形成了饱和溶液;再蒸发10g水,析出了bg﹣ag=(b﹣a)g晶体,即t℃时该物质的饱和溶液,蒸发10g水,析出(b﹣a)g晶体;则100g水中最多能溶解10(b﹣a)g溶质,则t℃时,该物质的溶解度是10(b﹣a)g。
若第三份溶液蒸发的是30g水,看成先蒸发20g水,析出bg晶体,再蒸发10g水,析出了(b﹣a)g晶体,则则析出的晶体质量是bg+(b﹣a)g=(2b﹣a)g。
故答案为:10(b﹣a);(2b﹣a)g。
三、探究题
24.【答案】(1)4;左盘增加氯化钠固体的质量直至天平平衡;(2)100;(3)搅拌,加速氯化钠的溶解速率; (4)ABC。
【解析】【解答】解:(1)溶质质量=溶液质量×溶质的质量,溶质氯化钠的质量是80g×5%=4g;天平称量正确的操作是左物右码,称量时出现右盘略低说明左盘所加氯化钠的质量偏小,应在左盘增加氯化钠固体的质量直至天平平衡;
(2)溶剂的质量=溶液质量﹣溶质质量,溶剂水的质量为80g﹣80g×5%=76g,水的密度为1g/ml,所以水的体积为76ml,应选100ml量筒;
(3)溶解过程中玻璃棒的作用是搅拌,加速氯化钠的溶解速率;
(4)溶质质量分数=×100%,溶质氯化钠的质量偏小会导致氯化钠溶液质量分数偏小,溶剂质量增加会导致氯化钠溶液质量分数偏小,A、砝码磨损会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,B、氯化钠固体不纯会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,C、仰视会导致所取水的质量增加,氯化钠溶液质量分数偏小,D、将量筒中的水倒入烧杯时,有水洒出,导致溶液质量偏小,氯化钠溶质质量分数偏大。
故答案为:(1)4;左盘增加氯化钠固体的质量直至天平平衡;(2)100;
(3)搅拌,加速氯化钠的溶解速率; (4)ABC。
25.【答案】(1)54.4。(2)③④。(3)26.5%。
【解析】【解答】解:(1)由表中数据可知,40g水中最多能够溶解14.4g,加入24g时溶解14.4g,因此表中m=54.4。
故答案为:54.4。
(2)由表中数据可知,40g水中最多能够溶解14.4g,在这4次实验中,得到的是t℃氯化钠溶液,属于饱和溶液的是③④。
故答案为:③④。
(3)由表中数据可知,水的质量是160g,加入的氯化钠质量是60g,160g水中最多溶解氯化钠质量:14.4g×4=57.6g,则所得溶液的溶质质量分数为:≈26.5%。
故答案为:26.5%。
故答案为:(1)54.4。(2)③④。(3)26.5%。
26.【答案】(1)氯化钾;(2)50(3)AD。
【解析】【解答】解:(1)烧杯①中溶解的溶质是氯化钾,因为该温度下氯化钾的溶解度大于硝酸钾;故答案为:氯化钾;
(2)将t1℃时50g硝酸钾的饱和溶液稀释成10%的溶液,设需加水的质量为x;
(50g+x)×10%=50g×,x=50g;故答案为:50;
(3)A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数正确,因为烧杯①内溶液中溶质的质量大;
B.蒸发一定量的水,两烧杯中都一定有固体析出错误,烧杯①中不一定有固体析出;
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体错误,也可能没有剩余固体;
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等正确,因为它们中的溶质和溶剂的质量相等(不考虑水的蒸发);
故答案为:AD。
故答案为(1)氯化钾;(2)50(3)AD。
四、计算题
27.【答案】(1)8.4;(2)不饱和;(3)50%。
【解析】【解答】解:(1)20℃时,硝酸钾的溶解度为31.6g,含义是20℃时,100g水中最多溶解31.6g硝酸钾,溶液达到饱和状态,则①中未溶解的硝酸钾质量为40g﹣31.6g=8.4g。
(2)60℃时,硝酸钾的溶解度为110g,含义是60℃时,100g水中最多溶解110g硝酸钾,溶液达到饱和状态;升温至60℃,蒸发60g水,则最多能溶解的质量为×110g=44g,则②中溶解的硝酸钾的质量为40g,硝酸钾溶液为不饱和溶液。
(3)②中溶液的溶质质量分数为×100%=50%。
答:②中溶液的溶质质量分数为50%
故答案为:(1)8.4;(2)不饱和;(3)50%。
28.【答案】(1)25g;(2)16%;(3)20g。
【解析】【解答】解:(1)设物质的溶解度为S,饱和溶液中溶质质量分数为=20%,解得S=25g;
答:该物质在25℃时的溶解度为25g;
(2)设水原来的质量为x,则有×100%=20%,解得x=52.5g,所以蒸发前溶液中溶质质量分数为×100%=16%。
答:蒸发前溶液中溶质质量分数为16%。
(3)该物质在25℃时的溶解度为25g,设25℃时若要使5克某盐从饱和溶液中析出来,需蒸发水的质量为y。
y=20g。
答:25℃时若要使5克某盐从饱和溶液中析出来,需蒸发20g水。
故答案为:(1)25g;(2)16%;(3)20g。
29.【答案】(1)12.5;(2)50;(3)200.
【解析】【解答】解:(1)设继续加入的食盐的质量为x,
则100g×10%+x=(100g+x)×20% 解得x=12.5g
(2)设蒸发水的质量为y,则根据蒸发前后溶质的质量不变得,
100g×10%=(100g﹣y)×20% 解得y=50g
(3)设质量分数为25%的溶液为z,则10%的溶液中的溶质与25%的溶液中的溶质之和等于20%溶液中的溶质,100g×10%+z×25%=(100g+z)×20% 解得z=200g
故答案为:(1)12.5;(2)50;(3)200.
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
