5.1 硫及其化合物 测试题(含答案)2023-2024学年高一下学期人教版(2019)必修第二册
文档属性
| 名称 | 5.1 硫及其化合物 测试题(含答案)2023-2024学年高一下学期人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 402.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-01 14:47:01 | ||
图片预览



文档简介
5.1 硫及其化合物 测试题
一、单选题
1.据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫黄)能化金银钢铁,奇物”。硫与某些金属单质化合所得的产物可能是( )
A. B. C. D.
2.下列有关物质性质与用途具有对应关系的是( )
A.浓H2SO4有脱水性,可用作干燥剂
B.Na2CO3能与酸反应,可用作治疗胃酸过多
C.Fe2(SO4)3具有强氧化性,可用于自来水净化
D.铝合金的密度小、强度大,可制成飞机构件
3.下列不属于硫酸的化学性质的是( )
A.酸性 B.强还原性 C.脱水性 D.吸水性
4.用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是( )
A.实验服 B.橡胶手套
C.护目镜 D.防毒面罩
5.常温常压下,下列关于SO2性质的说法中,错误的是
A.无色气体 B.有刺激性气味
C.难溶于水 D.密度比空气大
6.硫单质能与许多金属单质和非金属单质发生反应。下列说法正确的是( )
A.硫蒸气与红热的铁丝反应后,残留的硫可用二硫化碳洗涤
B.硫蒸气与红热的铜丝反应生成黑色的CuS固体
C.硫单质在化合反应中只体现氧化性
D.硫元素广泛存在于自然界中,火山口附近的环境中硫元素只以游离态形式存在
7.对于反应2H2S+SO2=3S+2H2O,下列说法错误的是( )
A.反应中S元素的化合价既有升高又有降低
B.反应中SO2作氧化剂
C.每生成1molS转移4NA个电子
D.氧化产物与还原产物质量比为2:1
8.工业上利用黄铁矿制硫酸。某黄铁矿中的质量分数为a%(假设杂质不含硫元素),其燃烧过程转化率为75%,生成的转化率为80%,吸收率为98%,现有黄铁矿10t,能制备98%的硫酸( )
A. B. C. D.
9.不能证明S的非金属性比Cl弱的是( )
A.H2S的稳定性不如HCl
B.氯气和铁反应生成FeCl3,硫和铁反应生成FeS
C.氯气通入氢硫酸溶液中,有浅黄色浑浊
D.盐酸的酸性比氢硫酸强
10.化学与生活密切相关。下列说法错误的是( )
A.食品包装袋内常用铁粉作脱氧剂
B.青铜是我国使用最早的合金
C.燃煤中加入CaO可以减少温室气体的排放
D.向蔗糖中加入浓硫酸后会出现发黑现象
11.下列说法正确的是 ( )
A.二氧化硫和漂白粉都具有漂白作用,它们都能使溴水和高锰酸钾溶液褪色
B.过氧化钠和二氧化硫都具有漂白作用,它们都能使品红溶液褪色
C.二氧化硫和氯气都具有漂白作用,它们都能使石蕊试液先变红色再褪色
D.盐酸能使滴有酚酞的氢氧化钠溶液褪色,所以盐酸也有漂白性
12.下列7种溶液中,通入足量的SO2气体,溶液变浑浊的有( )
①Na2S溶液②Na2SiO3溶液③澄清石灰水④0.1mol/L Ca(ClO)2溶液⑤Ba(NO3)2溶液
⑥BaCl2溶液⑦酸性KMnO4溶液
A.3种 B.4种 C.5种 D.6种
13.连二亚硫酸钠(,也称为保险粉)是一种白色砂状结晶或淡黄色粉末状化学用品,隔绝空气条件下加热至300℃时发生分解,有亚硫酸盐生成,同时放出刺激性气味气体;在250℃时能被引燃;该物质不溶于乙醇,溶于氢氧化钠溶液,遇少量水或暴露在潮湿的空气中会发生剧烈反应并燃烧,同样有刺激性气味气体产生。下列关于说法错误的是( )
A.储存时应注意干燥并尽可能隔绝空气
B.遇水所发生的是放热反应,燃烧时会有产生
C.隔绝空气加热的反应为:
D.溶液可以和反应,但不能和酸性溶液反应
14.类比是学习化学的重要方法,下列说法中正确的是( )
A.SO2通入BaCl2溶液中无沉淀生成,则SO3通入BaCl2溶液中也无沉淀生成
B.MgO、Al2O3都是高熔点离子化合物,熔化时都能导电
C.CO2与SiO2都是第IVA族的最高价氧化物,则它们的物理性质也相似
D.加热条件下,Na与O2反应生成Na2O2,Li与O2反应也生成过氧化锂
15.下列物质不能用于吸收H2S的是( )
A.NaOH溶液 B.FeSO4溶液
C.CuCl2溶液 D.酸性KMnO4溶液
16.自然界与人类活动均对硫的循环产生影响。下列说法错误的是( )
A.火山口附近的硫单质会被O2直接氧化为SO3
B.大气中的SO2遇雨水形成H2SO4进入地面或海洋
C.工业排放尾气中的SO2可与CaO和O2反应生成CaSO4
D.水垢中的CaSO4可与饱和Na2CO3溶液反应生成CaCO3
17.向盐酸中滴入浓硫酸会产生白雾,对此现象的解释不合理的是( )
A.浓硫酸具有吸水性 B.浓硫酸具有脱水性
C.浓盐酸具有挥发性 D.氯化氢极易溶于水
18.物质类别和核心元素的价态是学习元素及其化合物性质的重要认识视角。如图是某元素的“价类二维图”,其中单质b是黄色固体,f、h均为正盐,且焰色都是黄色。下列说法不正确的是( )
A.d能使品红溶液褪色
B.a和c反应可以生成b
C.e的浓溶液可用铝槽车运输
D.b与过量的氧气反应也无法直接生成d
19.下列反应中,浓硫酸既表现强酸性,又表现强氧化性的是( )
A.硫和浓硫酸共热 B.铜和浓硫酸共热
C.食盐和浓硫酸共热 D.蔗糖中滴入浓硫酸
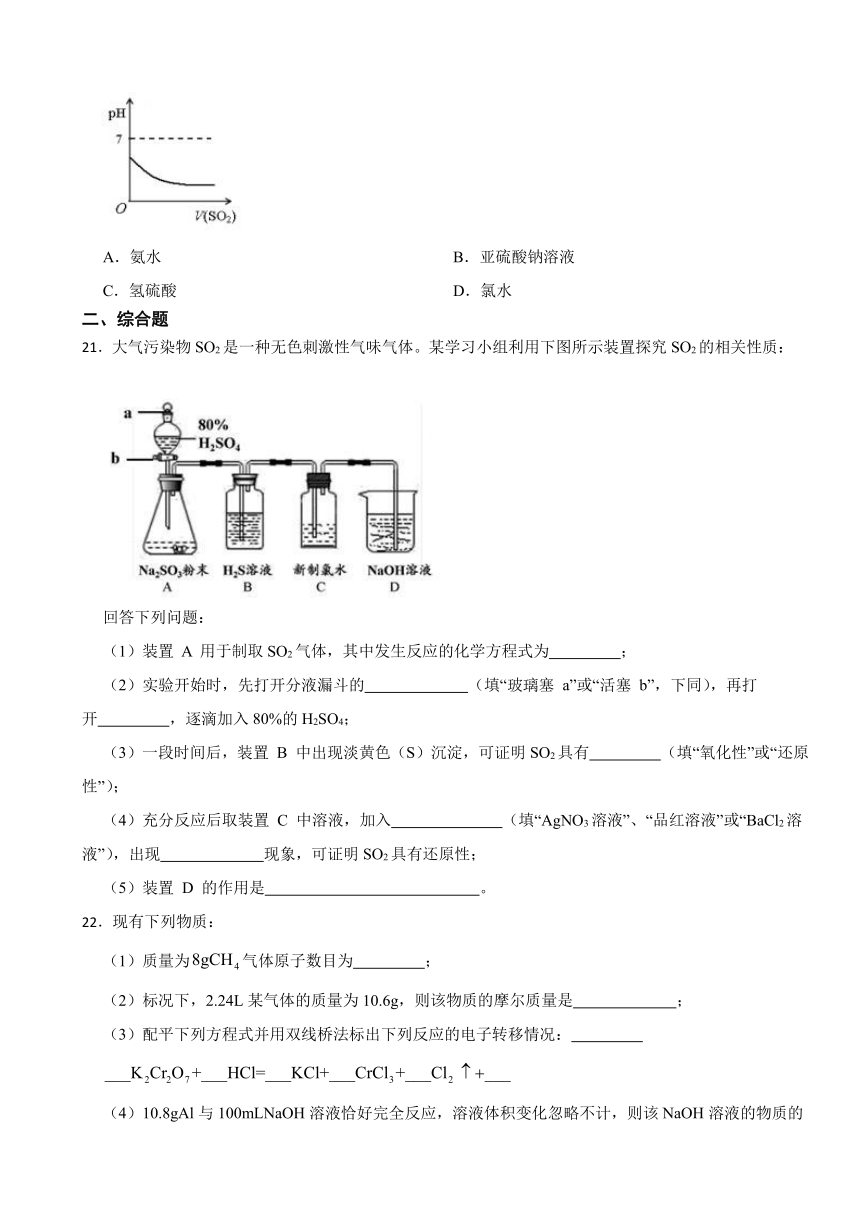
20.将 SO2 气体逐渐通入某溶液,溶液 pH 随通入 SO2气体体积变化如图所示,该溶液是( )
A.氨水 B.亚硫酸钠溶液
C.氢硫酸 D.氯水
二、综合题
21.大气污染物SO2是一种无色刺激性气味气体。某学习小组利用下图所示装置探究SO2的相关性质:
回答下列问题:
(1)装置 A 用于制取SO2气体,其中发生反应的化学方程式为 ;
(2)实验开始时,先打开分液漏斗的 (填“玻璃塞 a”或“活塞 b”,下同),再打开 ,逐滴加入80%的H2SO4;
(3)一段时间后,装置 B 中出现淡黄色(S)沉淀,可证明SO2具有 (填“氧化性”或“还原性”);
(4)充分反应后取装置 C 中溶液,加入 (填“AgNO3溶液”、“品红溶液”或“BaCl2溶液”),出现 现象,可证明SO2具有还原性;
(5)装置 D 的作用是 。
22.现有下列物质:
(1)质量为气体原子数目为 ;
(2)标况下,2.24L某气体的质量为10.6g,则该物质的摩尔质量是 ;
(3)配平下列方程式并用双线桥法标出下列反应的电子转移情况:
(4)10.8gAl与100mLNaOH溶液恰好完全反应,溶液体积变化忽略不计,则该NaOH溶液的物质的量浓度为 ,产生的在标准状况下的体积为 ;
(5)下列现象中浓硫酸主要表现出什么性质:用玻璃棒蘸浓硫酸滴在纸上时,纸变黑, ;把木炭放入热的浓硫酸中时,有气体放出, 。
23.硫化氢()、二氧化硫()是有害气体,可用多种方法进行脱除。
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的气体,发生反应:,计算25℃时,该反应的平衡常数为 。(已知25℃时,的,)
(2)某科研小组将微电池技术用于去除天然气中的,装置示意图如图,主要反应:(FeS难溶于水),室温时,pH=7的条件下,研究反应时间对的去除率的影响。
①装置中微电池负极的电极反应式为 。
②一段时间后,单位时间内的去除率降低,可能的原因是 。
(3)溶液脱除空气中并再生的原理如图所示。
将一定体积含的空气匀速通入溶液中,反应相同时间,初始浓度。及其pH与脱除率的关系如图所示。当,脱除率下降的原因是 。
(4)在恒容密闭容器中,用H2还原生成S的反应分两步完成(如图所示),该过程中部分物质的物质的量浓度随时间的变化关系如图所示:
依据上图描述H2还原生成S的过程: 。
24.按要求回答下列问题:
(1)请写出碳化硅的化学式
(2)请写出铜与稀硝酸反应的离子方程式
(3)试管内壁附着的硫单质可用热的苛性钠溶液洗涤除去,生成的产物中有 和 。请写出对应的化学反应方程式
25.游离态的硫存在于火山口附近或地壳的岩层中,火山喷发会释放、、等气体。回答下列问题:
(1)上述气体中 (填化学式)是形成酸雨的主要物质。
(2)的结构与类似,其电子式为 。
(3)S与Cu反应的化学方程式为 。
(4)能与反应,产物中氧化产物与还原产物的物质的量之比为 。
答案解析部分
1.【答案】A
2.【答案】D
3.【答案】B
4.【答案】D
5.【答案】C
6.【答案】A
7.【答案】C
8.【答案】A
9.【答案】D
10.【答案】C
11.【答案】B
12.【答案】B
13.【答案】D
14.【答案】B
15.【答案】B
16.【答案】A
17.【答案】B
18.【答案】A
19.【答案】B
20.【答案】D
21.【答案】(1)略
(2)玻璃塞 a;活塞 b
(3)氧化性
(4)BaCl2溶液;白色沉淀
(5)吸收尾气,防止污染空气
22.【答案】(1)2.5NA
(2)106g/mol
(3)
(4)4mol/L;13.44L
(5)脱水性;强氧化性
23.【答案】(1)
(2);生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢,铁的量因消耗而减少,形成微原电池的数量减少,化学反应速率减慢
(3)增大铁离子浓度,会促进硫化氢被氧化,生成的氢离子使溶液的pH降低,降低硫化氢的溶解度,前者影响小于后者时,硫化氢的去除率降低
(4)0~t1时间内,氢气与二氧化硫反应生成硫化氢气体,时间内二氧化硫与硫化氢反应生成硫单质
24.【答案】(1)
(2)
(3)
25.【答案】(1)
(2)
(3)2Cu+SCu2S
(4)2:1
一、单选题
1.据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫黄)能化金银钢铁,奇物”。硫与某些金属单质化合所得的产物可能是( )
A. B. C. D.
2.下列有关物质性质与用途具有对应关系的是( )
A.浓H2SO4有脱水性,可用作干燥剂
B.Na2CO3能与酸反应,可用作治疗胃酸过多
C.Fe2(SO4)3具有强氧化性,可用于自来水净化
D.铝合金的密度小、强度大,可制成飞机构件
3.下列不属于硫酸的化学性质的是( )
A.酸性 B.强还原性 C.脱水性 D.吸水性
4.用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是( )
A.实验服 B.橡胶手套
C.护目镜 D.防毒面罩
5.常温常压下,下列关于SO2性质的说法中,错误的是
A.无色气体 B.有刺激性气味
C.难溶于水 D.密度比空气大
6.硫单质能与许多金属单质和非金属单质发生反应。下列说法正确的是( )
A.硫蒸气与红热的铁丝反应后,残留的硫可用二硫化碳洗涤
B.硫蒸气与红热的铜丝反应生成黑色的CuS固体
C.硫单质在化合反应中只体现氧化性
D.硫元素广泛存在于自然界中,火山口附近的环境中硫元素只以游离态形式存在
7.对于反应2H2S+SO2=3S+2H2O,下列说法错误的是( )
A.反应中S元素的化合价既有升高又有降低
B.反应中SO2作氧化剂
C.每生成1molS转移4NA个电子
D.氧化产物与还原产物质量比为2:1
8.工业上利用黄铁矿制硫酸。某黄铁矿中的质量分数为a%(假设杂质不含硫元素),其燃烧过程转化率为75%,生成的转化率为80%,吸收率为98%,现有黄铁矿10t,能制备98%的硫酸( )
A. B. C. D.
9.不能证明S的非金属性比Cl弱的是( )
A.H2S的稳定性不如HCl
B.氯气和铁反应生成FeCl3,硫和铁反应生成FeS
C.氯气通入氢硫酸溶液中,有浅黄色浑浊
D.盐酸的酸性比氢硫酸强
10.化学与生活密切相关。下列说法错误的是( )
A.食品包装袋内常用铁粉作脱氧剂
B.青铜是我国使用最早的合金
C.燃煤中加入CaO可以减少温室气体的排放
D.向蔗糖中加入浓硫酸后会出现发黑现象
11.下列说法正确的是 ( )
A.二氧化硫和漂白粉都具有漂白作用,它们都能使溴水和高锰酸钾溶液褪色
B.过氧化钠和二氧化硫都具有漂白作用,它们都能使品红溶液褪色
C.二氧化硫和氯气都具有漂白作用,它们都能使石蕊试液先变红色再褪色
D.盐酸能使滴有酚酞的氢氧化钠溶液褪色,所以盐酸也有漂白性
12.下列7种溶液中,通入足量的SO2气体,溶液变浑浊的有( )
①Na2S溶液②Na2SiO3溶液③澄清石灰水④0.1mol/L Ca(ClO)2溶液⑤Ba(NO3)2溶液
⑥BaCl2溶液⑦酸性KMnO4溶液
A.3种 B.4种 C.5种 D.6种
13.连二亚硫酸钠(,也称为保险粉)是一种白色砂状结晶或淡黄色粉末状化学用品,隔绝空气条件下加热至300℃时发生分解,有亚硫酸盐生成,同时放出刺激性气味气体;在250℃时能被引燃;该物质不溶于乙醇,溶于氢氧化钠溶液,遇少量水或暴露在潮湿的空气中会发生剧烈反应并燃烧,同样有刺激性气味气体产生。下列关于说法错误的是( )
A.储存时应注意干燥并尽可能隔绝空气
B.遇水所发生的是放热反应,燃烧时会有产生
C.隔绝空气加热的反应为:
D.溶液可以和反应,但不能和酸性溶液反应
14.类比是学习化学的重要方法,下列说法中正确的是( )
A.SO2通入BaCl2溶液中无沉淀生成,则SO3通入BaCl2溶液中也无沉淀生成
B.MgO、Al2O3都是高熔点离子化合物,熔化时都能导电
C.CO2与SiO2都是第IVA族的最高价氧化物,则它们的物理性质也相似
D.加热条件下,Na与O2反应生成Na2O2,Li与O2反应也生成过氧化锂
15.下列物质不能用于吸收H2S的是( )
A.NaOH溶液 B.FeSO4溶液
C.CuCl2溶液 D.酸性KMnO4溶液
16.自然界与人类活动均对硫的循环产生影响。下列说法错误的是( )
A.火山口附近的硫单质会被O2直接氧化为SO3
B.大气中的SO2遇雨水形成H2SO4进入地面或海洋
C.工业排放尾气中的SO2可与CaO和O2反应生成CaSO4
D.水垢中的CaSO4可与饱和Na2CO3溶液反应生成CaCO3
17.向盐酸中滴入浓硫酸会产生白雾,对此现象的解释不合理的是( )
A.浓硫酸具有吸水性 B.浓硫酸具有脱水性
C.浓盐酸具有挥发性 D.氯化氢极易溶于水
18.物质类别和核心元素的价态是学习元素及其化合物性质的重要认识视角。如图是某元素的“价类二维图”,其中单质b是黄色固体,f、h均为正盐,且焰色都是黄色。下列说法不正确的是( )
A.d能使品红溶液褪色
B.a和c反应可以生成b
C.e的浓溶液可用铝槽车运输
D.b与过量的氧气反应也无法直接生成d
19.下列反应中,浓硫酸既表现强酸性,又表现强氧化性的是( )
A.硫和浓硫酸共热 B.铜和浓硫酸共热
C.食盐和浓硫酸共热 D.蔗糖中滴入浓硫酸
20.将 SO2 气体逐渐通入某溶液,溶液 pH 随通入 SO2气体体积变化如图所示,该溶液是( )
A.氨水 B.亚硫酸钠溶液
C.氢硫酸 D.氯水
二、综合题
21.大气污染物SO2是一种无色刺激性气味气体。某学习小组利用下图所示装置探究SO2的相关性质:
回答下列问题:
(1)装置 A 用于制取SO2气体,其中发生反应的化学方程式为 ;
(2)实验开始时,先打开分液漏斗的 (填“玻璃塞 a”或“活塞 b”,下同),再打开 ,逐滴加入80%的H2SO4;
(3)一段时间后,装置 B 中出现淡黄色(S)沉淀,可证明SO2具有 (填“氧化性”或“还原性”);
(4)充分反应后取装置 C 中溶液,加入 (填“AgNO3溶液”、“品红溶液”或“BaCl2溶液”),出现 现象,可证明SO2具有还原性;
(5)装置 D 的作用是 。
22.现有下列物质:
(1)质量为气体原子数目为 ;
(2)标况下,2.24L某气体的质量为10.6g,则该物质的摩尔质量是 ;
(3)配平下列方程式并用双线桥法标出下列反应的电子转移情况:
(4)10.8gAl与100mLNaOH溶液恰好完全反应,溶液体积变化忽略不计,则该NaOH溶液的物质的量浓度为 ,产生的在标准状况下的体积为 ;
(5)下列现象中浓硫酸主要表现出什么性质:用玻璃棒蘸浓硫酸滴在纸上时,纸变黑, ;把木炭放入热的浓硫酸中时,有气体放出, 。
23.硫化氢()、二氧化硫()是有害气体,可用多种方法进行脱除。
(1)实验室制取乙炔时,用硫酸铜溶液除去乙炔气体中混有的气体,发生反应:,计算25℃时,该反应的平衡常数为 。(已知25℃时,的,)
(2)某科研小组将微电池技术用于去除天然气中的,装置示意图如图,主要反应:(FeS难溶于水),室温时,pH=7的条件下,研究反应时间对的去除率的影响。
①装置中微电池负极的电极反应式为 。
②一段时间后,单位时间内的去除率降低,可能的原因是 。
(3)溶液脱除空气中并再生的原理如图所示。
将一定体积含的空气匀速通入溶液中,反应相同时间,初始浓度。及其pH与脱除率的关系如图所示。当,脱除率下降的原因是 。
(4)在恒容密闭容器中,用H2还原生成S的反应分两步完成(如图所示),该过程中部分物质的物质的量浓度随时间的变化关系如图所示:
依据上图描述H2还原生成S的过程: 。
24.按要求回答下列问题:
(1)请写出碳化硅的化学式
(2)请写出铜与稀硝酸反应的离子方程式
(3)试管内壁附着的硫单质可用热的苛性钠溶液洗涤除去,生成的产物中有 和 。请写出对应的化学反应方程式
25.游离态的硫存在于火山口附近或地壳的岩层中,火山喷发会释放、、等气体。回答下列问题:
(1)上述气体中 (填化学式)是形成酸雨的主要物质。
(2)的结构与类似,其电子式为 。
(3)S与Cu反应的化学方程式为 。
(4)能与反应,产物中氧化产物与还原产物的物质的量之比为 。
答案解析部分
1.【答案】A
2.【答案】D
3.【答案】B
4.【答案】D
5.【答案】C
6.【答案】A
7.【答案】C
8.【答案】A
9.【答案】D
10.【答案】C
11.【答案】B
12.【答案】B
13.【答案】D
14.【答案】B
15.【答案】B
16.【答案】A
17.【答案】B
18.【答案】A
19.【答案】B
20.【答案】D
21.【答案】(1)略
(2)玻璃塞 a;活塞 b
(3)氧化性
(4)BaCl2溶液;白色沉淀
(5)吸收尾气,防止污染空气
22.【答案】(1)2.5NA
(2)106g/mol
(3)
(4)4mol/L;13.44L
(5)脱水性;强氧化性
23.【答案】(1)
(2);生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢,铁的量因消耗而减少,形成微原电池的数量减少,化学反应速率减慢
(3)增大铁离子浓度,会促进硫化氢被氧化,生成的氢离子使溶液的pH降低,降低硫化氢的溶解度,前者影响小于后者时,硫化氢的去除率降低
(4)0~t1时间内,氢气与二氧化硫反应生成硫化氢气体,时间内二氧化硫与硫化氢反应生成硫单质
24.【答案】(1)
(2)
(3)
25.【答案】(1)
(2)
(3)2Cu+SCu2S
(4)2:1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
