第2章 化学键 化学反应规律 测试题(含解析)2023-2024学年高一下学期鲁科版(2019)化学必修第二册
文档属性
| 名称 | 第2章 化学键 化学反应规律 测试题(含解析)2023-2024学年高一下学期鲁科版(2019)化学必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 432.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-01 16:40:18 | ||
图片预览




文档简介
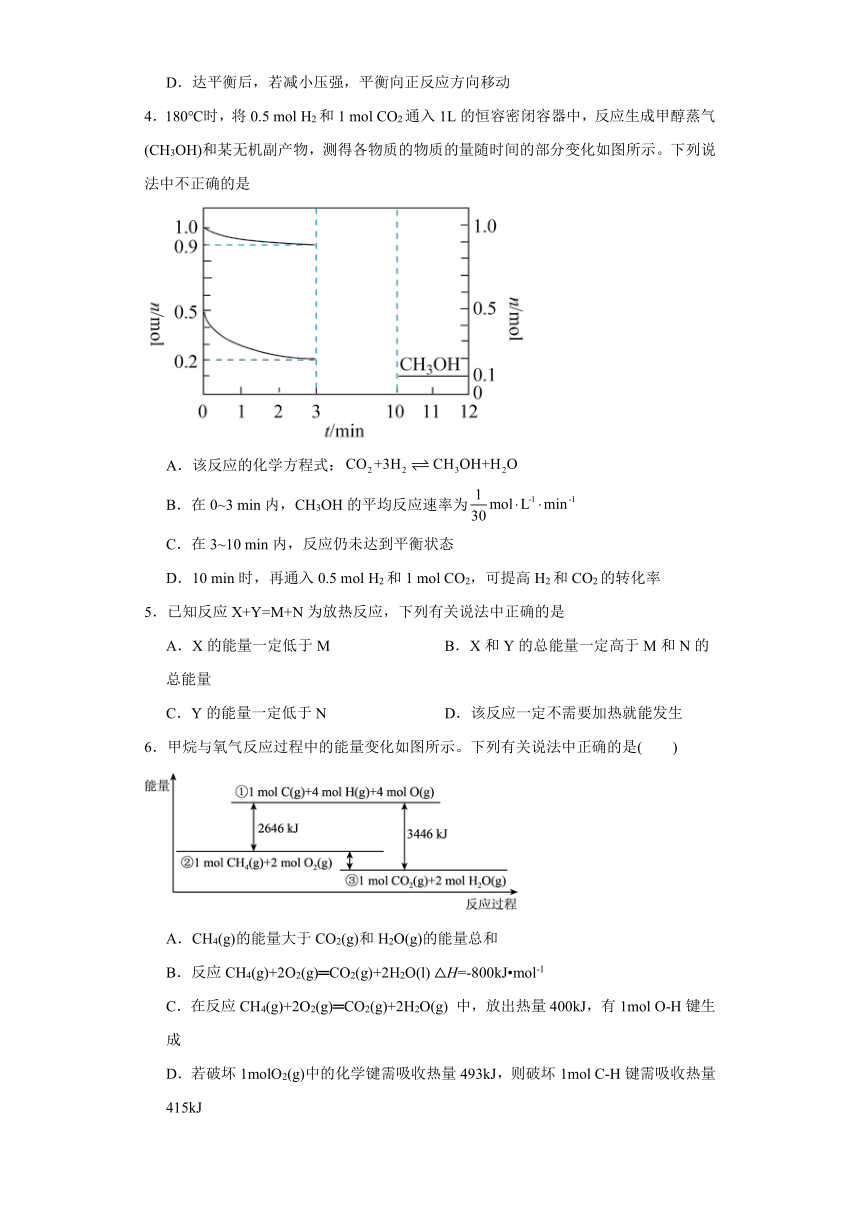
第2章 化学键 化学反应规律 测试题
一、单选题
1.NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述不正确的是
A.升高温度能加快化学反应速率
B.使用适当催化剂可以加快化学反应速率
C.增大压强对化学反应速率没有影响
D.改变压强对化学反应速率有影响
2.一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g)+B(g)C(g),△H>0,达到平衡后容器内压强是开始时的84%。若加入某种催化剂后反应的能量变化如图所示。下列说法正确的是( )
A.由图可知,加入催化剂之后,原反应分成了两步第二步反应较慢
B.若40s后达到平衡,则用A表示该反应的速率为0.01mol L-1 min-1
C.当容器不再改变时,不能说明该反应达到了平衡状态
D.达到平衡时,C的体积分数约为25%
3.如图所示为800℃时A、B、C三种气体在容积不变的密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是
A.2A(g)2B(g)+C(g)
B.混合气体的密度不再改变的状态为平衡状态
C.前2min A的分解速率为0.1mol L-1 min-1
D.达平衡后,若减小压强,平衡向正反应方向移动
4.180℃时,将0.5 mol H2和1 mol CO2通入1L的恒容密闭容器中,反应生成甲醇蒸气(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示。下列说法中不正确的是
A.该反应的化学方程式:
B.在0~3 min内,CH3OH的平均反应速率为
C.在3~10 min内,反应仍未达到平衡状态
D.10 min时,再通入0.5 mol H2和1 mol CO2,可提高H2和CO2的转化率
5.已知反应X+Y=M+N为放热反应,下列有关说法中正确的是
A.X的能量一定低于M B.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定低于N D.该反应一定不需要加热就能发生
6.甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )
A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-800kJ mol-1
C.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g) 中,放出热量400kJ,有1mol O-H键生成
D.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1mol C-H键需吸收热量415kJ
7.利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,若要提高NO的转化率,可采取的措施是
A.升高温度 B.分离出部分CO2和N2
C.增大容器体积 D.恒容时通入氦气
8.关于H2+Cl2=2HCl(反应条件略),下列说法不正确的是
A.反应放热 B.Cl-Cl→Cl+Cl,吸热
C.H+Cl→H Cl,吸热 D.HCl的总能量低于H2和Cl2的总能量
9.下列物质属于共价化合物的是
A.CaO B. C. D.
10.下列化学用语中正确的是
A.钠离子的电子式: B.Cl-的结构示意图:
C.质量数为35的核素氯: D.NaCl的形成过程:
11.南梁陶弘景在《本草经集注》中记载了石灰的制法与性质:“近山生石,青白色;作灶烧竟,以水沃之,即热蒸而解。”下列有关说法不正确的是
A.“青白色石”主要成分是CaCO3 B.“作灶烧竟”过程发生分解反应
C.“以水沃之”过程放出大量的热 D.“热蒸而解”表明石灰受热溶解
12.对于NaOH中化学键判断正确的是( )
A.既有金属键又有共价键 B.只有离子键
C.既有离子键又有共价键 D.只有共价键
13.表是一些共价键的键能(kJ/mol)数据,则以下表达肯定正确的是
共价键 键能 共价键 键能
H—H 436 H—F 565
C—F 427 H—S 339
C—Cl 330 H—Se 314
A.相同压强下,H2S的沸点比H2Se的沸点高
B.键长越短,共价键越牢固
C.同条件下CH3Cl比CH3F更易发生水解反应
D.H2(g)→2H(g)+436kJ
14.下列反应既属于离子反应,又属于氧化还原反应的放热反应是( )
A.铝片与稀盐酸反应 B.灼热的碳与CO2反应
C.Ba(OH)2·8H2O与NH4Cl固体反应 D.甲烷在氧气中的燃烧反应
15.在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:Cr2O72-+H2O 2CrO42-+2H+,下列说法正确的是( )
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是K=c2(CrO42-)c2(H+)/c(Cr2O72-)c(H2O)
二、填空题
16.下表列出① ~ ⑨九种元素在周期表中的位置:
主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 ⑤ ⑥
3 ① ③ ④ ⑦ ⑨
4 ② ⑧
(1)这九种元素化学性质最不活泼的元素名称是 。
(2) ①、②、③三种元素的高价氧化物对应的水化物,其中碱性最强的是 。(填化学式)
(3) ①、③、④三种元素按原子半径由大到小的顺序排列为 。(填元素符号)
(4) ③的原子序数为
(5)⑧在周期表中的位置
(6)⑦的最高价氧化物的水化物的化学式
(7)⑥元素氢化物的化学式是 ,该氢化物在常温下跟①发生反应的化学方程式是 。
(8)⑤的原子结构示意图为
(9)其单质在常温下为液态的非金属元素是 (填编号)
17.(1)在①NaCl、②NaOH、③Na2O2、④N2、⑤H2S、⑥H2O2中,只含有离子键的是 ;只含有极性键的是 ;只含有非极性键的是 ;既含有离子键,又含有极性键的是 ;既含有离子键,又含有非极性键的是 。
(2)请用电子式表示NaCl的形成过程: 。
(3)N2的结构式为: ;H2O2的结构式为: 。
18.化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应中的能量变化。
请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是 热反应,Ba(OH)2·8H2O与NH4Cl的反应是 热反应。反应过程 (填“①”或“②”)的能量变化可用下图表示。
(2)①中发生反应的离子方程式是 ;在该反应中,作为还原剂的物质是 (填化学式)。
19.在300℃时,将压入一个盛有催化剂的10L密闭容器中进行反应:,已知2min时,容器中剩余,回答下列问题:
(1)2min时的物质的量浓度是 。
(2)2min内平均反应速率: 。
(3)发生反应前容器中压强与发生反应后容器中压强之比为 。
20.在一个固定容积的密闭容器中通入amolN2与bmolH2的混合气体,保持温度不变,发生如下反应:N2(g)+3H2(g)2NH3(g)。
(1)若反应到某时刻t时,n(N2)=9mol,n(NH3)=2mol,则a= mol;
(2)反应达平衡时,混合气体的体积为448L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量 ;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平)= ;
(4)原混合气体中,a∶b= ;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)= 。
21.为治理雾霾天气,可采用多种方法实现工业废气脱硫。
Ⅰ.软锰矿浆(主要成分,含有少量铁、铝等氧化物)可脱除燃煤烟气中的,又可制得电池材料。主要流程如图:
(1)提高烟气吸收效率的可行措施有 (写出两点)。
(2)写出“沉锰”步骤发生反应的离子方程式: 。
(3)现将该烟气以的流量通入到装有的溶液的装置中,后,恰好完全反应。计算该烟气中含量: 。
II.活性是一种固体脱硫剂(无水无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性脱除沼气中的可转化成。
(4)“脱除沼气中”反应的化学方程式为 。
(5)工业上要求脱除过程温度不能超过,原因是 。
Ⅲ.有人设想利用电化学原理除去,并将化学能转化为电能。装置图如下。
(6)电池的正极是 。(填“a”或“b”)
(7)写出a电极的电极反应 。
参考答案:
1.C
【详解】A.升高温度能加快化学反应速率,A正确;
B.使用适当催化剂可以加快化学反应速率,B正确;
C.该反应是气体参与的反应,增大压强可以增大化学反应速率,C错误;
D.改变压强对化学反应速率有影响,D正确;
故选C。
2.B
【详解】A.活化能越大,反应速率越慢,第一步活化能较大,则反应较慢,A错误;
B.已知:结合达到平衡后容器内压强是开始时的84%,则
×100%=84%,x=0.8,用A表示该反应的速率为=0.01mol L-1 s-1,B正确;
C.由B项分析可知:一定,得出x是唯一的数值,故说明反应达到平衡状态,C错误;
D.由B项分析可知,平衡时,C的体积分数为C%=,D错误;
故答案为:B。
3.B
【详解】A.由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A2B+C,A正确;
B.反应混合物都是气体,容器的容积不变,所以混合气体的密度始终不变,因此不能据此判断反应为平衡状态,B错误;
C.前2 min 内A的浓度变化了0.2mol/L,所以A的分解速率V(A)=0.2mol/L÷2min= 0.1mol L-1 min-1,C正确;
D.达平衡后,若减小压强,化学平衡向气体体积增大的正反应方向移动,D正确;
故合理选项是B。
4.C
【详解】A.由图可知,氢气和二氧化碳的物质的量的变化量为(0.5-0.2)mol=0.3mol和(1.0-0.9)mol=0.1mol,由质量守恒定律可知氢气和二氧化碳反应生成甲醇和水的反应为CO2+3H2 CH3OH+H2O,故A正确;
B.由图可知,二氧化碳的物质的量的变化量为(1.0-0.9)mol=0.1mol,由反应方程式可知,甲醇的物质的量的变化量为0.1mol,则甲醇的平均反应速率为 mol·L-1·min-1,故B正确;
C.由图可知,0~3 min时二氧化碳的物质的量的变化量为(1.0-0.9)mol=0.1mol,10 min时甲醇的物质的量为0.1mol,由反应方程式可知,甲醇的物质的量的变化量为0.1mol可知,3 min时反应达到平衡,则在3~10 min内,反应达到平衡状态,故C错误;
D.由反应方程式可知,该反应是一个气体体积减小的反应,若10 min时,再通入0.5 mol H2和1 mol CO2相当于增大压强,增大压强,平衡向正反应方向移动,氢气和二氧化碳的转化率增大,故D正确;
故选C。
5.B
【分析】反应X+Y=M+N为放热反应,则反应物的总能量比生成物的总能量高,以此来解答。
【详解】A.反应物的总能量大于生成物的总能量,X的能量与Y的能量关系无法确定,故A错误;
B.该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,故B正确;
C.反应物的总能量大于生成物的总能量,Y的能量不一定高于N,故C错误;
D.反应的放热、吸热与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故D错误;
故答案选B。
6.D
【分析】从图中可以提取以下信息:1molCH4(g)+2molO2(g)断裂所有共价键,需要吸收2646kJ的热量;1molC(g)+4molH(g)+4molO(g)结合成1molCO2(g)+2molH2O(g),能放出3446kJ的热量。
【详解】A.从图中看出,CH4(g)和O2的总能量大于CO2(g)和H2O(g)的能量总和,但CH4(g)的能量不一定大于CO2(g)和H2O(g)的能量总和,A不正确;
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-800kJ mol-1,气态水变为液态会继续放热,B不正确;
C.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,则生成1molH2O,有2molO-H键生成,C不正确;
D.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量kJ=415kJ,D正确;
故选D。
【点睛】由反应前后的能量变化进行键能的计算时,需利用物质的结构式,明确各分子中所含共价键的种类和数目,解题时如果忽视了分子的结构,很容易得出错误的结论。
7.B
【详解】A.此反应为放热反应,温度升高,平衡逆向移动,一氧化氮转化率降低,A错误;
B.分离出二氧化碳和氮气,生成物浓度减少,平衡正向移动,一氧化氮转化率升高,B正确;
C.增大容器容积,压强降低,平衡逆向移动,一氧化氮转化率降低,C错误;
D.恒容时通入氦气,参与反应的各物质浓度不变,平衡不移动,一氧化氮转化率不变,D错误;
答案选B。
8.C
【详解】A. 形成化学键放出的热量多,大多化合反应是放热反应,故A正确;
B. Cl-Cl→Cl+Cl,拆开化学键,吸热,故B正确;
C. H+Cl→H Cl形成化学键放热,故C错误;
D. HCl的总能量低于H2和Cl2的总能量,反应放热,故D正确;
故选C。
9.D
【分析】离子化合物是阴阳离子间通过静电作用而形成的.共价化合物是不同非金属原子间利用共用电子对而形成的,共价化合物只含有共价键,据此解答。
【详解】A.CaO是通过离子键形成的离子化合物,选项A错误;
B.氯化铵通过离子键形成的离子化合物,选项B错误;
C.K2O是通过离子键形成的离子化合物,选项C错误;
D.CO2为共价化合物,分子中仅含共价键,选项D正确;
故选D。
10.B
【详解】A.钠离子的电子式为Na+,与题意不符,A错误;
B.Cl-核外电子数为18,核内质子数为17,则离子结构示意图:,符合题意,B正确;
C.Cl原子的质子数为17,质量数为35,则其核素:,与题意不符,C错误;
D.NaCl的形成过程:,与题意不符,D错误;
答案为B。
11.D
【详解】A.由题意可知,青白色石的主要成分是受热能发生分解反应生成氧化钙的碳酸钙,故A正确;
B.由题意可知,作灶烧竟的过程为碳酸钙受热发生分解反应生成氧化钙和二氧化碳,故B正确;
C.由题意可知,以水沃之的过程为氧化钙与水反应生成氢氧化钙,反应中会放出大量的热,故C正确;
D.热蒸而解表明石灰与与水反应生成氢氧化钙,故D错误;
故选D。
12.C
【详解】NaOH是离子化合物,含离子键,氢氧根离子内部存在氢氧极性共价键,故NaOH既有离子键又有共价键,答案为C。
13.C
【详解】A. 熔沸点与键能无关,H2S和H2Se均为分子晶体,且不含氢键,相对分子质量越大熔沸点越高,H2S的沸点比 H2Se的沸点低,故A错误;
B. H原子半径小于F原子,所以H-H键比H-F键键长要短,但H-F键键能更大,更牢固,故B错误;
C. C-F的键能比C-Cl大,C-F比C-Cl更稳定性,所以相同条件下CH3Cl比CH3F更易发生水解反应,故C正确;
D. 断键吸收能量,正确表达方式应为H2(g)→2H(g)-436kJ,故D错误;
故答案为C。
14.A
【详解】A.铝片与稀盐酸的反应属于离子反应,是置换反应,属于氧化还原反应,是放热反应,符合题意;
B.灼热的碳与CO2的反应不属于离子反应,属于氧化还原反应,属于吸热反应,不符合题意;
C.Ba(OH)2·8H2O与NH4Cl固体反应不属于氧化还原反应,是吸热反应,不符合题意;
D.甲烷在氧气中燃烧的反应不属于离子反应,属于氧化还原反应,属于放热反应,不符合题意;
答案选A。
15.C
【详解】A、CrO42-是黄色,Cr2O72-是橙红色,加入NaOH能中和氢离子,平衡正向浓度,CrO42-浓度增大,溶液呈黄色,故A错误;
B、该反应无化合价升降,不是氧化还原反应,故B错误;
C、加入浓硫酸,氢离子浓度增大,平衡逆向移动,根据勒夏特列原理,再次达到平衡后,氢离子浓度比原溶液大,故C正确;
D、水是纯液体,无浓度变化,不能列入平衡常数表达式中,K=c2(CrO42-)c2(H+)/c(Cr2O72-),故D错误。
16. 氩 KOH Na>Mg>Al 12 第四周期第ⅦA族 HClO4 H2O 2Na + 2H2O= 2NaOH+H2↑ ⑧
【分析】根据元素周期表的结构可知,①~⑨分别为Na、K、Mg、Al、C、O、Cl、Br、Ar。
【详解】(1)这九种元素中Ar为稀有气体元素,最外层已经达到8电子稳定结构,化学性质最不活泼,名称是氩。
(2) 元素的金属性越强,最高价氧化物对应的水化物的碱性越强。在元素周期表中,越靠近左下方的元素原子半径越大,越容易失去电子,金属性越强。①、②、③三种元素金属性最强的是K,所以KOH的碱性最强。
(3) 同一周期元素的电子层数相同,从左到右,质子数逐渐增多,原子核对核外电子的束缚力逐渐增强,原子半径逐渐减小。①、③、④三种元素位于同一周期,原子半径由大到小的顺序排列为Na>Mg>Al。
(4) ③为镁,原子序数为12。
(5)⑧是Br,和Cl是同一主族元素,位于Cl的下方,即在Cl的下一周期,则Br在周期表中的位置是第四周期第ⅦA族。
(6)⑦为Cl,其最高价为+7价,则最高价氧化物的水化物为HClO4。
(7)⑥是O,其简单氢化物是H2O,H2O在常温下跟Na发生置换反应,生成NaOH和氢气,化学方程式是2Na + 2H2O= 2NaOH+H2↑。
(8)⑤是C,核外有6个电子,根据能量最低原理,分两层排布,第一层排2个,第二层排4个,原子结构示意图为。
(9)溴单质在常温下为液态,是常温下呈液态的唯一的非金属单质,故填⑧。
17. ① ⑤ ④ ② ③ N≡N H-O-O-H
【分析】(1)金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,以此解答该题;
(2)根据离子键的形成原理分析解答;
(3)根据共价键的形成原理分析书写共价分子的结构式。
【详解】(1)NaCl中钠离子和氯离子之间只存在离子键; NaOH中钠离子和氢氧根离子之间存在离子键、O原子和氢原子之间存在极性共价键;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;N2中N原子之间只存在非极性共价键;H2S是共价化合物,S原子与H原子间存在极性共价键;H2O2中H原子和O原子之间存在极性共价键,O与O原子之间为非极性键;故答案为:①;⑤;④;②;③;
(2)氯化钠形成过程中,钠原子失去1个电子形成钠离子,氯原子得到1个电子形成氯离子,阴阳离子间通过离子键结合,用电子式表示为: ,故答案为: ;
(3)氮气分子中氮原子间通过氮氮叁键结合,结构式为:N≡N;双氧水分子中氧原子与氢原子间均以共价键结合,结构式为:H-O-O-H ,故答案为:N≡N;H-O-O-H。
18. 放 吸 ① 6H++2Al===2Al3++3H2↑ Al
【详解】(1)本题考查化学反应中能量变化,反应①:反应后温度升高,说明是放热反应,即铝和盐酸反应属于放热反应,反应②:反应温度降低,此反应是吸热反应,即Ba(OH)2·8H2O和NH4Cl属于吸热反应,反应物总能量大于生成物总能量,说明此反应是放热反应,即属于①;
(2)考查离子反应方程式的书写和氧化还原反应概念,反应①的离子方程式为2Al+6H+=2Al3++3H2↑,化合价升高的物质是还原剂,即Al是还原剂。
19.(1)0.2mol/L
(2)0.1mol/(L·min)
(3)3:4
【分析】由题意列三段式:。
【详解】(1)由三段式可知2min时的物质的量浓度是0.2mol/L;
(2)2min内平均反应速率:=0.1mol/(L·min);
(3)发生反应前容器中气体总物质的量为6mol,发生反应后容器中气体总物质的量为(0.2+0.2+0.4)mol/L×10L=8mol,同温同压下,气体压强比=气体总物质的量之比,则发生反应前容器中压强与发生反应后容器中压强之比=6mol:8mol=3:4。
20. 10 5mol 5:4 2:3 3:3:2
【详解】(1)根据题意列三段式有:
根据三段式可知a=(9+1)mol=10mol;
(2)混合气体的体积为448L(标况下),则混合气体的物质的量为=20mol,NH3的含量(体积分数)为25%,体积分数即物质的量分数,所以n(NH3)=20mol×25%=5mol;
(3)平衡时n(NH3)=5mol,列三段式有
则有(7.5+b-7.5+5)mol=20mol,解得b=15mol,则初始时气体的总物质的量为25mol,所以n(始)∶n(平)=25:20=5:4;
(4)根据2、3小题可知a=10mol,b=15mol,a:b=10:15=2:3;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=7.5:7.5:5=3:3:2。
【点睛】熟练掌握化学平衡中“三段式”的分析方法是解决本题的关键。
21.(1)采用逆流喷淋的方式;适当提高反应温度
(2)
(3)6.4
(4)
(5)防止脱水失去脱硫活性
(6)b
(7)
【分析】酸性软锰矿浆吸收烟气正的二氧化硫生成硫酸锰,加入碳酸锰调节pH生成氢氧化铁、氢氧化铝沉淀除去铁铝,滤液中加高锰酸钾把Mn2+氧化为二氧化锰,制得电池材料。
【详解】(1)根据影响反应速率的因素,提高烟气吸收效率的可行措施有:采用逆流喷淋的方式;适当提高反应温度;
(2)“沉锰”步骤中Mn2+被高锰酸钾氧化为二氧化锰,发生反应的离子方程式为
(3)现将该烟气以的流量通入到装有的溶液的装置中,发生反应,后恰好完全反应,则SO2的物质的量为,计算该烟气中含量。
(4)脱除沼气中的转化成,“脱除沼气中”反应的化学方程式为;
(5)无水无脱硫作用,工业上要求脱除过程温度不能超过,防止脱水失去脱硫活性;
(6)该电池,氧气得电子生成水,氧气发生还原反应,通入氧气的一极为正极,电池的正极是b;
(7)a电极二氧化硫失电子生成硫酸,a极是负极,电极反应为
一、单选题
1.NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述不正确的是
A.升高温度能加快化学反应速率
B.使用适当催化剂可以加快化学反应速率
C.增大压强对化学反应速率没有影响
D.改变压强对化学反应速率有影响
2.一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g)+B(g)C(g),△H>0,达到平衡后容器内压强是开始时的84%。若加入某种催化剂后反应的能量变化如图所示。下列说法正确的是( )
A.由图可知,加入催化剂之后,原反应分成了两步第二步反应较慢
B.若40s后达到平衡,则用A表示该反应的速率为0.01mol L-1 min-1
C.当容器不再改变时,不能说明该反应达到了平衡状态
D.达到平衡时,C的体积分数约为25%
3.如图所示为800℃时A、B、C三种气体在容积不变的密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是
A.2A(g)2B(g)+C(g)
B.混合气体的密度不再改变的状态为平衡状态
C.前2min A的分解速率为0.1mol L-1 min-1
D.达平衡后,若减小压强,平衡向正反应方向移动
4.180℃时,将0.5 mol H2和1 mol CO2通入1L的恒容密闭容器中,反应生成甲醇蒸气(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示。下列说法中不正确的是
A.该反应的化学方程式:
B.在0~3 min内,CH3OH的平均反应速率为
C.在3~10 min内,反应仍未达到平衡状态
D.10 min时,再通入0.5 mol H2和1 mol CO2,可提高H2和CO2的转化率
5.已知反应X+Y=M+N为放热反应,下列有关说法中正确的是
A.X的能量一定低于M B.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定低于N D.该反应一定不需要加热就能发生
6.甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )
A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-800kJ mol-1
C.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g) 中,放出热量400kJ,有1mol O-H键生成
D.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1mol C-H键需吸收热量415kJ
7.利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,若要提高NO的转化率,可采取的措施是
A.升高温度 B.分离出部分CO2和N2
C.增大容器体积 D.恒容时通入氦气
8.关于H2+Cl2=2HCl(反应条件略),下列说法不正确的是
A.反应放热 B.Cl-Cl→Cl+Cl,吸热
C.H+Cl→H Cl,吸热 D.HCl的总能量低于H2和Cl2的总能量
9.下列物质属于共价化合物的是
A.CaO B. C. D.
10.下列化学用语中正确的是
A.钠离子的电子式: B.Cl-的结构示意图:
C.质量数为35的核素氯: D.NaCl的形成过程:
11.南梁陶弘景在《本草经集注》中记载了石灰的制法与性质:“近山生石,青白色;作灶烧竟,以水沃之,即热蒸而解。”下列有关说法不正确的是
A.“青白色石”主要成分是CaCO3 B.“作灶烧竟”过程发生分解反应
C.“以水沃之”过程放出大量的热 D.“热蒸而解”表明石灰受热溶解
12.对于NaOH中化学键判断正确的是( )
A.既有金属键又有共价键 B.只有离子键
C.既有离子键又有共价键 D.只有共价键
13.表是一些共价键的键能(kJ/mol)数据,则以下表达肯定正确的是
共价键 键能 共价键 键能
H—H 436 H—F 565
C—F 427 H—S 339
C—Cl 330 H—Se 314
A.相同压强下,H2S的沸点比H2Se的沸点高
B.键长越短,共价键越牢固
C.同条件下CH3Cl比CH3F更易发生水解反应
D.H2(g)→2H(g)+436kJ
14.下列反应既属于离子反应,又属于氧化还原反应的放热反应是( )
A.铝片与稀盐酸反应 B.灼热的碳与CO2反应
C.Ba(OH)2·8H2O与NH4Cl固体反应 D.甲烷在氧气中的燃烧反应
15.在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:Cr2O72-+H2O 2CrO42-+2H+,下列说法正确的是( )
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是K=c2(CrO42-)c2(H+)/c(Cr2O72-)c(H2O)
二、填空题
16.下表列出① ~ ⑨九种元素在周期表中的位置:
主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 ⑤ ⑥
3 ① ③ ④ ⑦ ⑨
4 ② ⑧
(1)这九种元素化学性质最不活泼的元素名称是 。
(2) ①、②、③三种元素的高价氧化物对应的水化物,其中碱性最强的是 。(填化学式)
(3) ①、③、④三种元素按原子半径由大到小的顺序排列为 。(填元素符号)
(4) ③的原子序数为
(5)⑧在周期表中的位置
(6)⑦的最高价氧化物的水化物的化学式
(7)⑥元素氢化物的化学式是 ,该氢化物在常温下跟①发生反应的化学方程式是 。
(8)⑤的原子结构示意图为
(9)其单质在常温下为液态的非金属元素是 (填编号)
17.(1)在①NaCl、②NaOH、③Na2O2、④N2、⑤H2S、⑥H2O2中,只含有离子键的是 ;只含有极性键的是 ;只含有非极性键的是 ;既含有离子键,又含有极性键的是 ;既含有离子键,又含有非极性键的是 。
(2)请用电子式表示NaCl的形成过程: 。
(3)N2的结构式为: ;H2O2的结构式为: 。
18.化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应中的能量变化。
请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是 热反应,Ba(OH)2·8H2O与NH4Cl的反应是 热反应。反应过程 (填“①”或“②”)的能量变化可用下图表示。
(2)①中发生反应的离子方程式是 ;在该反应中,作为还原剂的物质是 (填化学式)。
19.在300℃时,将压入一个盛有催化剂的10L密闭容器中进行反应:,已知2min时,容器中剩余,回答下列问题:
(1)2min时的物质的量浓度是 。
(2)2min内平均反应速率: 。
(3)发生反应前容器中压强与发生反应后容器中压强之比为 。
20.在一个固定容积的密闭容器中通入amolN2与bmolH2的混合气体,保持温度不变,发生如下反应:N2(g)+3H2(g)2NH3(g)。
(1)若反应到某时刻t时,n(N2)=9mol,n(NH3)=2mol,则a= mol;
(2)反应达平衡时,混合气体的体积为448L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量 ;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平)= ;
(4)原混合气体中,a∶b= ;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)= 。
21.为治理雾霾天气,可采用多种方法实现工业废气脱硫。
Ⅰ.软锰矿浆(主要成分,含有少量铁、铝等氧化物)可脱除燃煤烟气中的,又可制得电池材料。主要流程如图:
(1)提高烟气吸收效率的可行措施有 (写出两点)。
(2)写出“沉锰”步骤发生反应的离子方程式: 。
(3)现将该烟气以的流量通入到装有的溶液的装置中,后,恰好完全反应。计算该烟气中含量: 。
II.活性是一种固体脱硫剂(无水无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性脱除沼气中的可转化成。
(4)“脱除沼气中”反应的化学方程式为 。
(5)工业上要求脱除过程温度不能超过,原因是 。
Ⅲ.有人设想利用电化学原理除去,并将化学能转化为电能。装置图如下。
(6)电池的正极是 。(填“a”或“b”)
(7)写出a电极的电极反应 。
参考答案:
1.C
【详解】A.升高温度能加快化学反应速率,A正确;
B.使用适当催化剂可以加快化学反应速率,B正确;
C.该反应是气体参与的反应,增大压强可以增大化学反应速率,C错误;
D.改变压强对化学反应速率有影响,D正确;
故选C。
2.B
【详解】A.活化能越大,反应速率越慢,第一步活化能较大,则反应较慢,A错误;
B.已知:结合达到平衡后容器内压强是开始时的84%,则
×100%=84%,x=0.8,用A表示该反应的速率为=0.01mol L-1 s-1,B正确;
C.由B项分析可知:一定,得出x是唯一的数值,故说明反应达到平衡状态,C错误;
D.由B项分析可知,平衡时,C的体积分数为C%=,D错误;
故答案为:B。
3.B
【详解】A.由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A2B+C,A正确;
B.反应混合物都是气体,容器的容积不变,所以混合气体的密度始终不变,因此不能据此判断反应为平衡状态,B错误;
C.前2 min 内A的浓度变化了0.2mol/L,所以A的分解速率V(A)=0.2mol/L÷2min= 0.1mol L-1 min-1,C正确;
D.达平衡后,若减小压强,化学平衡向气体体积增大的正反应方向移动,D正确;
故合理选项是B。
4.C
【详解】A.由图可知,氢气和二氧化碳的物质的量的变化量为(0.5-0.2)mol=0.3mol和(1.0-0.9)mol=0.1mol,由质量守恒定律可知氢气和二氧化碳反应生成甲醇和水的反应为CO2+3H2 CH3OH+H2O,故A正确;
B.由图可知,二氧化碳的物质的量的变化量为(1.0-0.9)mol=0.1mol,由反应方程式可知,甲醇的物质的量的变化量为0.1mol,则甲醇的平均反应速率为 mol·L-1·min-1,故B正确;
C.由图可知,0~3 min时二氧化碳的物质的量的变化量为(1.0-0.9)mol=0.1mol,10 min时甲醇的物质的量为0.1mol,由反应方程式可知,甲醇的物质的量的变化量为0.1mol可知,3 min时反应达到平衡,则在3~10 min内,反应达到平衡状态,故C错误;
D.由反应方程式可知,该反应是一个气体体积减小的反应,若10 min时,再通入0.5 mol H2和1 mol CO2相当于增大压强,增大压强,平衡向正反应方向移动,氢气和二氧化碳的转化率增大,故D正确;
故选C。
5.B
【分析】反应X+Y=M+N为放热反应,则反应物的总能量比生成物的总能量高,以此来解答。
【详解】A.反应物的总能量大于生成物的总能量,X的能量与Y的能量关系无法确定,故A错误;
B.该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,故B正确;
C.反应物的总能量大于生成物的总能量,Y的能量不一定高于N,故C错误;
D.反应的放热、吸热与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故D错误;
故答案选B。
6.D
【分析】从图中可以提取以下信息:1molCH4(g)+2molO2(g)断裂所有共价键,需要吸收2646kJ的热量;1molC(g)+4molH(g)+4molO(g)结合成1molCO2(g)+2molH2O(g),能放出3446kJ的热量。
【详解】A.从图中看出,CH4(g)和O2的总能量大于CO2(g)和H2O(g)的能量总和,但CH4(g)的能量不一定大于CO2(g)和H2O(g)的能量总和,A不正确;
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-800kJ mol-1,气态水变为液态会继续放热,B不正确;
C.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,则生成1molH2O,有2molO-H键生成,C不正确;
D.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量kJ=415kJ,D正确;
故选D。
【点睛】由反应前后的能量变化进行键能的计算时,需利用物质的结构式,明确各分子中所含共价键的种类和数目,解题时如果忽视了分子的结构,很容易得出错误的结论。
7.B
【详解】A.此反应为放热反应,温度升高,平衡逆向移动,一氧化氮转化率降低,A错误;
B.分离出二氧化碳和氮气,生成物浓度减少,平衡正向移动,一氧化氮转化率升高,B正确;
C.增大容器容积,压强降低,平衡逆向移动,一氧化氮转化率降低,C错误;
D.恒容时通入氦气,参与反应的各物质浓度不变,平衡不移动,一氧化氮转化率不变,D错误;
答案选B。
8.C
【详解】A. 形成化学键放出的热量多,大多化合反应是放热反应,故A正确;
B. Cl-Cl→Cl+Cl,拆开化学键,吸热,故B正确;
C. H+Cl→H Cl形成化学键放热,故C错误;
D. HCl的总能量低于H2和Cl2的总能量,反应放热,故D正确;
故选C。
9.D
【分析】离子化合物是阴阳离子间通过静电作用而形成的.共价化合物是不同非金属原子间利用共用电子对而形成的,共价化合物只含有共价键,据此解答。
【详解】A.CaO是通过离子键形成的离子化合物,选项A错误;
B.氯化铵通过离子键形成的离子化合物,选项B错误;
C.K2O是通过离子键形成的离子化合物,选项C错误;
D.CO2为共价化合物,分子中仅含共价键,选项D正确;
故选D。
10.B
【详解】A.钠离子的电子式为Na+,与题意不符,A错误;
B.Cl-核外电子数为18,核内质子数为17,则离子结构示意图:,符合题意,B正确;
C.Cl原子的质子数为17,质量数为35,则其核素:,与题意不符,C错误;
D.NaCl的形成过程:,与题意不符,D错误;
答案为B。
11.D
【详解】A.由题意可知,青白色石的主要成分是受热能发生分解反应生成氧化钙的碳酸钙,故A正确;
B.由题意可知,作灶烧竟的过程为碳酸钙受热发生分解反应生成氧化钙和二氧化碳,故B正确;
C.由题意可知,以水沃之的过程为氧化钙与水反应生成氢氧化钙,反应中会放出大量的热,故C正确;
D.热蒸而解表明石灰与与水反应生成氢氧化钙,故D错误;
故选D。
12.C
【详解】NaOH是离子化合物,含离子键,氢氧根离子内部存在氢氧极性共价键,故NaOH既有离子键又有共价键,答案为C。
13.C
【详解】A. 熔沸点与键能无关,H2S和H2Se均为分子晶体,且不含氢键,相对分子质量越大熔沸点越高,H2S的沸点比 H2Se的沸点低,故A错误;
B. H原子半径小于F原子,所以H-H键比H-F键键长要短,但H-F键键能更大,更牢固,故B错误;
C. C-F的键能比C-Cl大,C-F比C-Cl更稳定性,所以相同条件下CH3Cl比CH3F更易发生水解反应,故C正确;
D. 断键吸收能量,正确表达方式应为H2(g)→2H(g)-436kJ,故D错误;
故答案为C。
14.A
【详解】A.铝片与稀盐酸的反应属于离子反应,是置换反应,属于氧化还原反应,是放热反应,符合题意;
B.灼热的碳与CO2的反应不属于离子反应,属于氧化还原反应,属于吸热反应,不符合题意;
C.Ba(OH)2·8H2O与NH4Cl固体反应不属于氧化还原反应,是吸热反应,不符合题意;
D.甲烷在氧气中燃烧的反应不属于离子反应,属于氧化还原反应,属于放热反应,不符合题意;
答案选A。
15.C
【详解】A、CrO42-是黄色,Cr2O72-是橙红色,加入NaOH能中和氢离子,平衡正向浓度,CrO42-浓度增大,溶液呈黄色,故A错误;
B、该反应无化合价升降,不是氧化还原反应,故B错误;
C、加入浓硫酸,氢离子浓度增大,平衡逆向移动,根据勒夏特列原理,再次达到平衡后,氢离子浓度比原溶液大,故C正确;
D、水是纯液体,无浓度变化,不能列入平衡常数表达式中,K=c2(CrO42-)c2(H+)/c(Cr2O72-),故D错误。
16. 氩 KOH Na>Mg>Al 12 第四周期第ⅦA族 HClO4 H2O 2Na + 2H2O= 2NaOH+H2↑ ⑧
【分析】根据元素周期表的结构可知,①~⑨分别为Na、K、Mg、Al、C、O、Cl、Br、Ar。
【详解】(1)这九种元素中Ar为稀有气体元素,最外层已经达到8电子稳定结构,化学性质最不活泼,名称是氩。
(2) 元素的金属性越强,最高价氧化物对应的水化物的碱性越强。在元素周期表中,越靠近左下方的元素原子半径越大,越容易失去电子,金属性越强。①、②、③三种元素金属性最强的是K,所以KOH的碱性最强。
(3) 同一周期元素的电子层数相同,从左到右,质子数逐渐增多,原子核对核外电子的束缚力逐渐增强,原子半径逐渐减小。①、③、④三种元素位于同一周期,原子半径由大到小的顺序排列为Na>Mg>Al。
(4) ③为镁,原子序数为12。
(5)⑧是Br,和Cl是同一主族元素,位于Cl的下方,即在Cl的下一周期,则Br在周期表中的位置是第四周期第ⅦA族。
(6)⑦为Cl,其最高价为+7价,则最高价氧化物的水化物为HClO4。
(7)⑥是O,其简单氢化物是H2O,H2O在常温下跟Na发生置换反应,生成NaOH和氢气,化学方程式是2Na + 2H2O= 2NaOH+H2↑。
(8)⑤是C,核外有6个电子,根据能量最低原理,分两层排布,第一层排2个,第二层排4个,原子结构示意图为。
(9)溴单质在常温下为液态,是常温下呈液态的唯一的非金属单质,故填⑧。
17. ① ⑤ ④ ② ③ N≡N H-O-O-H
【分析】(1)金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,以此解答该题;
(2)根据离子键的形成原理分析解答;
(3)根据共价键的形成原理分析书写共价分子的结构式。
【详解】(1)NaCl中钠离子和氯离子之间只存在离子键; NaOH中钠离子和氢氧根离子之间存在离子键、O原子和氢原子之间存在极性共价键;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;N2中N原子之间只存在非极性共价键;H2S是共价化合物,S原子与H原子间存在极性共价键;H2O2中H原子和O原子之间存在极性共价键,O与O原子之间为非极性键;故答案为:①;⑤;④;②;③;
(2)氯化钠形成过程中,钠原子失去1个电子形成钠离子,氯原子得到1个电子形成氯离子,阴阳离子间通过离子键结合,用电子式表示为: ,故答案为: ;
(3)氮气分子中氮原子间通过氮氮叁键结合,结构式为:N≡N;双氧水分子中氧原子与氢原子间均以共价键结合,结构式为:H-O-O-H ,故答案为:N≡N;H-O-O-H。
18. 放 吸 ① 6H++2Al===2Al3++3H2↑ Al
【详解】(1)本题考查化学反应中能量变化,反应①:反应后温度升高,说明是放热反应,即铝和盐酸反应属于放热反应,反应②:反应温度降低,此反应是吸热反应,即Ba(OH)2·8H2O和NH4Cl属于吸热反应,反应物总能量大于生成物总能量,说明此反应是放热反应,即属于①;
(2)考查离子反应方程式的书写和氧化还原反应概念,反应①的离子方程式为2Al+6H+=2Al3++3H2↑,化合价升高的物质是还原剂,即Al是还原剂。
19.(1)0.2mol/L
(2)0.1mol/(L·min)
(3)3:4
【分析】由题意列三段式:。
【详解】(1)由三段式可知2min时的物质的量浓度是0.2mol/L;
(2)2min内平均反应速率:=0.1mol/(L·min);
(3)发生反应前容器中气体总物质的量为6mol,发生反应后容器中气体总物质的量为(0.2+0.2+0.4)mol/L×10L=8mol,同温同压下,气体压强比=气体总物质的量之比,则发生反应前容器中压强与发生反应后容器中压强之比=6mol:8mol=3:4。
20. 10 5mol 5:4 2:3 3:3:2
【详解】(1)根据题意列三段式有:
根据三段式可知a=(9+1)mol=10mol;
(2)混合气体的体积为448L(标况下),则混合气体的物质的量为=20mol,NH3的含量(体积分数)为25%,体积分数即物质的量分数,所以n(NH3)=20mol×25%=5mol;
(3)平衡时n(NH3)=5mol,列三段式有
则有(7.5+b-7.5+5)mol=20mol,解得b=15mol,则初始时气体的总物质的量为25mol,所以n(始)∶n(平)=25:20=5:4;
(4)根据2、3小题可知a=10mol,b=15mol,a:b=10:15=2:3;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=7.5:7.5:5=3:3:2。
【点睛】熟练掌握化学平衡中“三段式”的分析方法是解决本题的关键。
21.(1)采用逆流喷淋的方式;适当提高反应温度
(2)
(3)6.4
(4)
(5)防止脱水失去脱硫活性
(6)b
(7)
【分析】酸性软锰矿浆吸收烟气正的二氧化硫生成硫酸锰,加入碳酸锰调节pH生成氢氧化铁、氢氧化铝沉淀除去铁铝,滤液中加高锰酸钾把Mn2+氧化为二氧化锰,制得电池材料。
【详解】(1)根据影响反应速率的因素,提高烟气吸收效率的可行措施有:采用逆流喷淋的方式;适当提高反应温度;
(2)“沉锰”步骤中Mn2+被高锰酸钾氧化为二氧化锰,发生反应的离子方程式为
(3)现将该烟气以的流量通入到装有的溶液的装置中,发生反应,后恰好完全反应,则SO2的物质的量为,计算该烟气中含量。
(4)脱除沼气中的转化成,“脱除沼气中”反应的化学方程式为;
(5)无水无脱硫作用,工业上要求脱除过程温度不能超过,防止脱水失去脱硫活性;
(6)该电池,氧气得电子生成水,氧气发生还原反应,通入氧气的一极为正极,电池的正极是b;
(7)a电极二氧化硫失电子生成硫酸,a极是负极,电极反应为
