专题9 金属与人类文明 同步练习 (含解析) 2023-2024学年高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题9 金属与人类文明 同步练习 (含解析) 2023-2024学年高一下学期化学苏教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 339.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-01 16:46:01 | ||
图片预览




文档简介
专题9金属与人类文明
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.金属材料在日常生活、生产中有着广泛的运用,下列关于金属及冶炼方法中不正确的是
A.工业上金属Mg、Al都是用电解熔融的氯化物制得的
B.金属铬的制取:
C.用磁铁矿炼铁的反应中,被CO还原成Fe,转移
D.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
2.铝合金大量用于飞机制造,是因为
A.Al的活泼性弱 B.Al的还原性弱
C.Al合金密度小,强度大 D.常温下Al不与反应
3.下列物质不能由化合反应制取的是
A.Fe(OH)3 B.Al(OH)3 C.FeCl3 D.FeCl2
4.化学与生产、生活、科技、环境等息息相关。下列有关说法不正确的是
A.驰援武汉首次使用我国自主研发大飞机“运20”的机身材料采用了大量低密度、高强度的铝锂合金
B.葡萄酒中添加适量SO2可以起到抗氧化的作用
C.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是高纯度硅
D.推广使用煤液化技术可以减少温室气体二氧化碳的排放
5.常用作制取补血剂。下图为实验室里制备的流程,下列有关说法错误的是
A.滤液中含有的离子主要是、
B.若溶液变质,可利用溶液检验
C.检验是否被洗涤干净可选用溶液
D.产品在空气中高温分解可得到纯净的FeO
6.下列各组离子,能在指定溶液中大量共存的是
A.能使湿润的紫色石蕊试纸变红的溶液中:、、
B.能使酚酞变红的溶液中:、、
C.无色澄清透明溶液中:、、
D.含有的溶液中:、、
7.2021年10月16日凌晨,“神舟十三号”将翟志刚、王亚平、叶光富三名宇航员送到中国空间站,这是中国航天事业的巨大成功。下列说法错误的是
A.宇航员喜欢吃的“宫保鸡丁”主要成分是有机物
B.空间站广泛使用的钛合金,属于金属材料
C.中国空间站的太阳能电池板主要材料是
D.飞船返回舱外面是一层耐高温的陶瓷材料属于无机非金属材料
8.下列元素中,不属于碱金属元素的是
A.锂 B.钠 C.钙 D.钾
9.下列是制备Fe(OH)2的实验装置,其中制得的Fe(OH)2容易被氧化的是
A.
B.
C.
D.
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标况下,22.4LCl2溶于足量水,所得溶液中Cl2、Cl—、HClO和ClO—四种微粒总数为NA
B.1mol·L-1的Fe2(SO4)3溶液中,含有的SO数目为3NA
C.7.8过氧化钠与足量CO2反应转移电子数为0.1NA
D.1molFe在纯氧中完全燃烧生成Fe3O4,Fe失去8NA个电子
二、判断题
11.“长征七号”使用的燃料、材料、涂层等,都彰显出化学科学的巨大贡献。
12.CuO与NaOH溶液反应能生成Cu(OH)2。(______)
13.金属都能与盐酸发生置换反应。(______)
14.活泼的铝在空气中能稳定存在的原因是表层的铝在空气中反应生成了Al2O3。( )
15.钠、镁、铝等活泼金属的冶炼采用电解法。(______)
三、解答题
16.草酸亚铁晶体(FeC2O4·2H2O)可作为制备电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如下:
(1)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示) 。
(2)“转化”在如图所示的装置中进行,导管A的作用是 。
(3)检验“洗涤”完全的实验操作是 。
(4)草酸亚铁晶体在空气中易氧化,检验草酸亚铁晶体是否氧化变质的实验操作是 。
(5)在氩气中加热草酸亚铁晶体(FeC2O4 2H2O),FeC2O4 2H2O的质量变化曲线随温度升高出现两个失重“台阶”,如图所示。结合表格,计算第一阶段的质量损失率为 (保留4位有效数字),推断第二阶段产生气体的化学式为 。(质量损失率=×100%)
失重阶段 温度范围/℃ 质量损失率% 产物
第一阶段 室温~255 __________ FeC2O4
第二阶段 255-520 37.06 Fe3O4
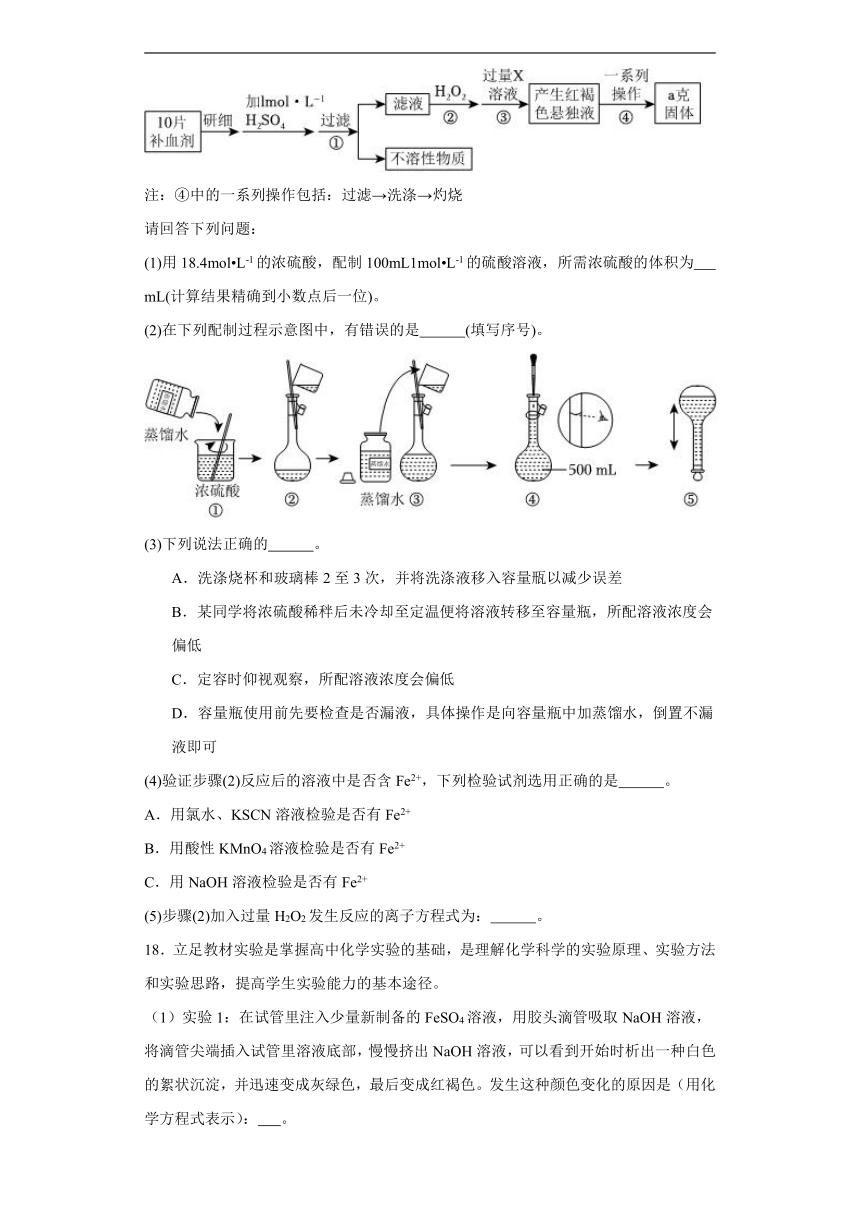
17.某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
注:④中的一系列操作包括:过滤→洗涤→灼烧
请回答下列问题:
(1)用18.4mol L-1的浓硫酸,配制100mL1mol L-1的硫酸溶液,所需浓硫酸的体积为 mL(计算结果精确到小数点后一位)。
(2)在下列配制过程示意图中,有错误的是 (填写序号)。
(3)下列说法正确的 。
A.洗涤烧杯和玻璃棒2至3次,并将洗涤液移入容量 以减少误差
B.某同学将浓硫酸稀秚后未冷却至定温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
(4)验证步骤(2)反应后的溶液中是否含Fe2+,下列检验试剂选用正确的是 。
A.用氯水、KSCN溶液检验是否有Fe2+
B.用酸性KMnO4溶液检验是否有Fe2+
C.用NaOH溶液检验是否有Fe2+
(5)步骤(2)加入过量H2O2发生反应的离子方程式为: 。
18.立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径。
(1)实验1:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色。发生这种颜色变化的原因是(用化学方程式表示): 。
(2)实验2:向一个盛有CuSO4溶液的小烧杯里投入一小块钠。观察实验现象。试写出钠和CuSO4溶液反应的化学方程式: ;
(3)实验3:在两支试管里分别加入5mL盐酸和5mLNaOH溶液,在各放入一小段铝片,观察实验现象。试写出铝和NaOH溶液反应的离子方程式: ;
(4)实验4:把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体。向反应后的溶液中加入酚酞试液,可以看到 ;
(5)实验5:往NaAlO2溶液通入少量的CO2,观察实验现象。写出反应的离子方程式: 。
参考答案:
1.A
【详解】A.工业上用电解熔融氧化铝的方法冶炼金属铝,故A错误;
B.金属铬是熔点高的金属,铝与氧化铬高温条件下发生铝热反应生成个和氧化铝,反应的化学方程式为,故B正确;
C.四氧化三铁与一氧化碳高温条件下反应生成铁和二氧化碳,1mol四氧化三铁钡一氧化碳还原时转移8mol电子,故C正确;
D.湿法炼铜与火法炼铜的反应中,铜元素的化合价降低被还原都发生还原反应,故D正确;
故选A。
2.C
【详解】由于铝合金具有密度小,强度大等优异性质,可大量用于飞机制造,故选C。
3.B
【详解】A.氢氧化亚铁、氧气、水发生化合反应生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,可实现转化,故A不符合题意;
B.结合铝及其化合物的性质,不能由化合反应制取Al(OH)3,故B符合题意;
C.铁与氯气发生化合反应生成氯化铁,可实现转化,故C不符合题意;
D.铁与氯化铁溶液发生化合反应生成氯化亚铁,可实现转化,故D不符合题意;
答案选B。
4.D
【详解】A. 铝锂合金具有低密度、高强度等优点,常用于制造飞机机身,A正确;
B. 二氧化硫具有还原性,葡萄酒中添加适量SO2可以起到抗氧化的作用,B正确;
C. 硅是常用的半导体,常用于计算机的芯片,C正确;
D. 推广使用煤液化技术可以减少二氧化硫等大气污染物的排放,不能减少温室气体二氧化碳的排放,D错误;
答案选D。
5.D
【详解】A.硫酸亚铁和碳酸氢铵反应生成碳酸铁、硫酸铵、二氧化碳和水,故滤液中含有的主要的离子为铵根离子和硫酸根离子,A项正确;
B.硫酸亚铁变质生成铁离子,用硫氰化钾检验,若变红则说明溶液变质,B项正确;
C.沉淀表面吸附硫酸根离子,用钡离子检验,C项正确;
D.碳酸亚铁高温容易被氧化生成三价铁,D项错误。
故选D。
6.B
【详解】A.能使湿润的紫色石蕊试纸变红的溶液中含有氢离子,与形成弱电解质,不能大量共存,故A不符合题意;
B.能使酚酞变红的溶液中含有大量氢氧根,各离子相互不反应,且与氢氧根也不反应,可以大量共存,故B符合题意;
C.为蓝色,不符合无色的要求,故C不符合题意;
D.碘离子与铁离子不能大量共存要发生氧化还原反应,不能大量共存,故D不符合题意。
答案选B。
7.C
【详解】A.宇航员喜欢吃的“宫保鸡丁”主要物质是鸡肉,鸡肉主要成分是蛋白质,属于有机物,故A正确;
B.钛合金是以钛元素为基础加入其他元素组成的合金,属于金属材料,故B正确;
C.太阳能电池板主要材料是单质,故C错误;
D.飞船返回舱外面是一层耐高温的陶瓷材料属于无机非金属材料,故D正确;
选C。
8.C
【详解】碱金属元素为第ⅠA族元素(除H元素外),因此锂、钠、钾属于碱金属元素,而钙是第ⅡA族元素,属于碱土金属,因此答案选C。
答案选C。
9.C
【详解】A.先滴加稀硫酸,与铁粉反应生成的H2排尽试管内的空气,再滴加NaOH溶液,可以生成Fe(OH)2沉淀,A不合题意;
B.先打开a处的止水夹,稀硫酸与铁粉反应生成的氢气将装置内的空气排尽,再关闭a处的止水夹,此时生成的气体将反应后的溶液压入试管B内,从而生成Fe(OH)2,B不合题意;
C.NaOH溶液滴入FeSO4溶液中,在NaOH溶液下落过程中会溶解空气,从而使生成的Fe(OH)2迅速氧化,C符合题意;
D.盛有NaOH的胶头滴管插入FeSO4溶液的液面下,且用苯液封,此时试管内的溶液中没有O2,生成的Fe(OH)2不会立即被氧化,D不合题意;
故选C。
10.C
【详解】A.溶于水的氯气部分与水反应生成盐酸和次氯酸,标况下,溶于足量水的22.4L氯气中氯原子的物质的量为×2=2mol,则由物料守恒可知,溶液中n(Cl2)+n(Cl—)+n(HClO)+n(ClO—)=2mol—n(Cl2),所得溶液中Cl2、Cl—、HClO和ClO—四种微粒总数大于NA小于2NA,故A错误;
B.缺溶液的体积,无法计算1mol/L硫酸铁溶液中硫酸铁的物质的量和含有的硫酸根离子的数目,故B错误;
C.过氧化钠与二氧化碳反应生成碳酸钠和氧气,则7.8过氧化钠与足量二氧化碳反应转移电子数为×1×NAmol—1=0.1NA,故C正确;
D.铁在氧气中燃烧生成四氧化三铁,1mol铁失去电子的数目为1mol××NAmol—1=NA,故D错误;
故选C。
11.正确
【详解】“长征七号”使用的燃料、材料、涂层等,更加轻质化、环保无污染等,都彰显出化学科学的巨大贡献,故正确。
12.错误
【详解】CuO属于碱性氧化物,不能与NaOH溶液反应,故错误。
13.错误
【详解】金属活动性排在H后面的金属不能与盐酸发生置换反应,如铜等,故错误。
14.正确
【详解】铝在空气中与氧气反应生成一层致密的氧化膜,氧化铝;
故答案为:正确。
15.正确
【详解】钠、镁、铝等活泼金属的冶炼采用电解其相应的熔融物得到,故答案为:正确。
16.(1)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2)平衡压强,使H2C2O4溶液顺利滴入三颈烧瓶中
(3)取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全
(4)取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质
(5) 20.00% CO、CO2
【分析】由题给流程可知,硫酸亚铁溶液与氨水反应生成氢氧化亚铁沉淀和硫酸铵,硫酸亚铁溶液与草酸溶液反应生成二水草酸亚铁沉淀,过滤、用蒸馏水洗涤、烘干得到二水草酸亚铁。
【详解】(1)由分析可知,沉淀步骤得到还原性强的氢氧化亚铁沉淀易与水和空气中的氧气反应生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)由实验装置图可知,滴液漏斗中导管A的作用是平衡压强,便于草酸溶液顺利滴入三颈烧瓶中,故答案为:平衡压强,使H2C2O4溶液顺利滴入三颈烧瓶中;
(3)由分析可知,反应制得的二水草酸亚铁沉淀表面附有可溶性杂质硫酸铵,检验洗涤完全实际上是检验洗涤液中不存在硫酸根离子,具体操作为取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全,故答案为:取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全;
(4)检验草酸亚铁晶体是否氧化变质实际上就是晶体溶于稀硫酸所得溶液中是否存在铜离子,具体操作为取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质,故答案为:取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质;
(5)由表格数据可知,第一阶段发生的反应为二水草酸亚铁受热失去结晶水生成草酸亚铁,则第一阶段的质量损失率为×100%=20%;第二阶段发生的反应为氩气氛围中草酸亚铁受热分解得到四氧化三铁,由得失电子数目守恒可知,一氧化碳和二氧化碳,反应生成的气体为一氧化碳和二氧化碳,反应的化学方程式为3FeC2O4Fe3O4+4CO↑+2CO2↑,故答案为:20%;CO、CO2。
17.(1)5.4
(2)①④
(3)AC
(4)B
(5)H2O2+2Fe2++2H+=2Fe3++2H2O
【分析】补血剂研细后加入稀硫酸溶解,过滤后得到不溶物和滤液,滤液中加入H2O2,将Fe2+氧化为Fe3+,然后加入过量X得到红褐色悬浊液,则X为碱性溶液,红褐色物质为Fe(OH)3,通过一系列操作得到的固体为红棕色固体Fe2O3。据此解答。
【详解】(1)溶液稀释前后溶质的物质的量不变,所需浓硫酸的体积为≈5.4mL,故答案为:5.4;
(2)在下列配制过程示意图中,有错误的是①④,稀释浓硫酸,应该将浓硫酸倒入蒸馏水中并不断搅拌,定容时,视线要与凹液面最低处相切,故答案为:①④;
(3)A.烧杯内壁沾有溶质,洗涤烧杯和玻璃棒2至3次,并将洗涤液移入容量瓶以减少误差,故A正确;
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,配制溶液体积偏小,所配溶液浓度会偏高,故B错误;
C.定容时仰视观察,溶液体积偏大,所配溶液浓度会偏低,故C正确;
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液,然后正放,将容量瓶的瓶塞旋转180后,再倒置不漏液即可,故D错误;
故答案为:AC;
(4)A. 步骤②反应后的溶液中含有铁离子,用氯水、KSCN溶液不能检验是否有Fe2+,A错误;
B. 验证步骤②反应后的溶液中是否含Fe2+,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,B正确;
C. 步骤②反应后的溶液中含有铁离子,加入氢氧化钠溶液产生红褐色沉淀,掩盖住白色沉淀氢氧化亚铁,不能用NaOH溶液检验是否有Fe2+,C错误;
故答案为:B;
(5)步骤②加入过量H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O。
18. 4Fe(OH)2+O2 +2H2O=4Fe(OH)3 2Na+2H2O+CuSO4=Cu(OH)2+H2↑+Na2SO4 2Al+2H2O+2OH-=2AlO2-+3H2↑ 溶液先变红,后变为无色 2AlO2-+CO2+3H2O=2Al(OH)3 +CO32-
【分析】(1)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁;
(2)往CuSO4溶液中投入一小块钠,反应后出现蓝色沉淀,但没有红色物质析出;
(3)铝和NaOH溶液反应生成偏铝酸钠和氢气;;
(4)过氧化钠和水反应生成氢氧化钠溶液和氧气;过氧化钠具有强氧化性,具有漂白性有机色素;
(5)NaAlO2溶液中通入少量CO2,生成氢氧化铝沉淀和碳酸钠。
【详解】(1)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁,反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)往CuSO4溶液中投入一小块钠,反应后出现蓝色沉淀,但没有红色物质析出是因为钠先与水反应生成氢氧化钠和氢气,氢氧化钠溶液再与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,则钠和CuSO4溶液反应的化学方程式为2Na+2H2O+CuSO4=Cu(OH)2+H2↑+Na2SO4;
(3)铝和NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑;
(4)把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,木条复燃证明为氧气,向反应后的溶液中加入酚酞试液溶液变红,证明生成了碱为氢氧化钠溶液,随后褪色,过氧化钠具有强氧化性能把有机色素氧化为无色物质;
(5)NaAlO2溶液中通入少量CO2,生成碳酸根离子,发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-。
【点睛】考查离子方程式的书写,明确发生的反应并熟悉离子反应方程式的书写方法是解答本题的关键。离子方程式是指用实际参加反应的离子符号表示离子反应的式子,离子方程式的书写步骤一般为:①“写”:写出有关反应的化学方程式;②“拆”:可溶性的电解质用离子符号表示,其它难溶的物质、气体、水等仍用化学式表示;③“删”:删去方程式两边不参加反应的离子; ④“查”:检查式子两边的各种原子的个数及电荷数是否相等
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.金属材料在日常生活、生产中有着广泛的运用,下列关于金属及冶炼方法中不正确的是
A.工业上金属Mg、Al都是用电解熔融的氯化物制得的
B.金属铬的制取:
C.用磁铁矿炼铁的反应中,被CO还原成Fe,转移
D.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
2.铝合金大量用于飞机制造,是因为
A.Al的活泼性弱 B.Al的还原性弱
C.Al合金密度小,强度大 D.常温下Al不与反应
3.下列物质不能由化合反应制取的是
A.Fe(OH)3 B.Al(OH)3 C.FeCl3 D.FeCl2
4.化学与生产、生活、科技、环境等息息相关。下列有关说法不正确的是
A.驰援武汉首次使用我国自主研发大飞机“运20”的机身材料采用了大量低密度、高强度的铝锂合金
B.葡萄酒中添加适量SO2可以起到抗氧化的作用
C.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是高纯度硅
D.推广使用煤液化技术可以减少温室气体二氧化碳的排放
5.常用作制取补血剂。下图为实验室里制备的流程,下列有关说法错误的是
A.滤液中含有的离子主要是、
B.若溶液变质,可利用溶液检验
C.检验是否被洗涤干净可选用溶液
D.产品在空气中高温分解可得到纯净的FeO
6.下列各组离子,能在指定溶液中大量共存的是
A.能使湿润的紫色石蕊试纸变红的溶液中:、、
B.能使酚酞变红的溶液中:、、
C.无色澄清透明溶液中:、、
D.含有的溶液中:、、
7.2021年10月16日凌晨,“神舟十三号”将翟志刚、王亚平、叶光富三名宇航员送到中国空间站,这是中国航天事业的巨大成功。下列说法错误的是
A.宇航员喜欢吃的“宫保鸡丁”主要成分是有机物
B.空间站广泛使用的钛合金,属于金属材料
C.中国空间站的太阳能电池板主要材料是
D.飞船返回舱外面是一层耐高温的陶瓷材料属于无机非金属材料
8.下列元素中,不属于碱金属元素的是
A.锂 B.钠 C.钙 D.钾
9.下列是制备Fe(OH)2的实验装置,其中制得的Fe(OH)2容易被氧化的是
A.
B.
C.
D.
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标况下,22.4LCl2溶于足量水,所得溶液中Cl2、Cl—、HClO和ClO—四种微粒总数为NA
B.1mol·L-1的Fe2(SO4)3溶液中,含有的SO数目为3NA
C.7.8过氧化钠与足量CO2反应转移电子数为0.1NA
D.1molFe在纯氧中完全燃烧生成Fe3O4,Fe失去8NA个电子
二、判断题
11.“长征七号”使用的燃料、材料、涂层等,都彰显出化学科学的巨大贡献。
12.CuO与NaOH溶液反应能生成Cu(OH)2。(______)
13.金属都能与盐酸发生置换反应。(______)
14.活泼的铝在空气中能稳定存在的原因是表层的铝在空气中反应生成了Al2O3。( )
15.钠、镁、铝等活泼金属的冶炼采用电解法。(______)
三、解答题
16.草酸亚铁晶体(FeC2O4·2H2O)可作为制备电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如下:
(1)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示) 。
(2)“转化”在如图所示的装置中进行,导管A的作用是 。
(3)检验“洗涤”完全的实验操作是 。
(4)草酸亚铁晶体在空气中易氧化,检验草酸亚铁晶体是否氧化变质的实验操作是 。
(5)在氩气中加热草酸亚铁晶体(FeC2O4 2H2O),FeC2O4 2H2O的质量变化曲线随温度升高出现两个失重“台阶”,如图所示。结合表格,计算第一阶段的质量损失率为 (保留4位有效数字),推断第二阶段产生气体的化学式为 。(质量损失率=×100%)
失重阶段 温度范围/℃ 质量损失率% 产物
第一阶段 室温~255 __________ FeC2O4
第二阶段 255-520 37.06 Fe3O4
17.某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
注:④中的一系列操作包括:过滤→洗涤→灼烧
请回答下列问题:
(1)用18.4mol L-1的浓硫酸,配制100mL1mol L-1的硫酸溶液,所需浓硫酸的体积为 mL(计算结果精确到小数点后一位)。
(2)在下列配制过程示意图中,有错误的是 (填写序号)。
(3)下列说法正确的 。
A.洗涤烧杯和玻璃棒2至3次,并将洗涤液移入容量 以减少误差
B.某同学将浓硫酸稀秚后未冷却至定温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
(4)验证步骤(2)反应后的溶液中是否含Fe2+,下列检验试剂选用正确的是 。
A.用氯水、KSCN溶液检验是否有Fe2+
B.用酸性KMnO4溶液检验是否有Fe2+
C.用NaOH溶液检验是否有Fe2+
(5)步骤(2)加入过量H2O2发生反应的离子方程式为: 。
18.立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径。
(1)实验1:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色。发生这种颜色变化的原因是(用化学方程式表示): 。
(2)实验2:向一个盛有CuSO4溶液的小烧杯里投入一小块钠。观察实验现象。试写出钠和CuSO4溶液反应的化学方程式: ;
(3)实验3:在两支试管里分别加入5mL盐酸和5mLNaOH溶液,在各放入一小段铝片,观察实验现象。试写出铝和NaOH溶液反应的离子方程式: ;
(4)实验4:把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体。向反应后的溶液中加入酚酞试液,可以看到 ;
(5)实验5:往NaAlO2溶液通入少量的CO2,观察实验现象。写出反应的离子方程式: 。
参考答案:
1.A
【详解】A.工业上用电解熔融氧化铝的方法冶炼金属铝,故A错误;
B.金属铬是熔点高的金属,铝与氧化铬高温条件下发生铝热反应生成个和氧化铝,反应的化学方程式为,故B正确;
C.四氧化三铁与一氧化碳高温条件下反应生成铁和二氧化碳,1mol四氧化三铁钡一氧化碳还原时转移8mol电子,故C正确;
D.湿法炼铜与火法炼铜的反应中,铜元素的化合价降低被还原都发生还原反应,故D正确;
故选A。
2.C
【详解】由于铝合金具有密度小,强度大等优异性质,可大量用于飞机制造,故选C。
3.B
【详解】A.氢氧化亚铁、氧气、水发生化合反应生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,可实现转化,故A不符合题意;
B.结合铝及其化合物的性质,不能由化合反应制取Al(OH)3,故B符合题意;
C.铁与氯气发生化合反应生成氯化铁,可实现转化,故C不符合题意;
D.铁与氯化铁溶液发生化合反应生成氯化亚铁,可实现转化,故D不符合题意;
答案选B。
4.D
【详解】A. 铝锂合金具有低密度、高强度等优点,常用于制造飞机机身,A正确;
B. 二氧化硫具有还原性,葡萄酒中添加适量SO2可以起到抗氧化的作用,B正确;
C. 硅是常用的半导体,常用于计算机的芯片,C正确;
D. 推广使用煤液化技术可以减少二氧化硫等大气污染物的排放,不能减少温室气体二氧化碳的排放,D错误;
答案选D。
5.D
【详解】A.硫酸亚铁和碳酸氢铵反应生成碳酸铁、硫酸铵、二氧化碳和水,故滤液中含有的主要的离子为铵根离子和硫酸根离子,A项正确;
B.硫酸亚铁变质生成铁离子,用硫氰化钾检验,若变红则说明溶液变质,B项正确;
C.沉淀表面吸附硫酸根离子,用钡离子检验,C项正确;
D.碳酸亚铁高温容易被氧化生成三价铁,D项错误。
故选D。
6.B
【详解】A.能使湿润的紫色石蕊试纸变红的溶液中含有氢离子,与形成弱电解质,不能大量共存,故A不符合题意;
B.能使酚酞变红的溶液中含有大量氢氧根,各离子相互不反应,且与氢氧根也不反应,可以大量共存,故B符合题意;
C.为蓝色,不符合无色的要求,故C不符合题意;
D.碘离子与铁离子不能大量共存要发生氧化还原反应,不能大量共存,故D不符合题意。
答案选B。
7.C
【详解】A.宇航员喜欢吃的“宫保鸡丁”主要物质是鸡肉,鸡肉主要成分是蛋白质,属于有机物,故A正确;
B.钛合金是以钛元素为基础加入其他元素组成的合金,属于金属材料,故B正确;
C.太阳能电池板主要材料是单质,故C错误;
D.飞船返回舱外面是一层耐高温的陶瓷材料属于无机非金属材料,故D正确;
选C。
8.C
【详解】碱金属元素为第ⅠA族元素(除H元素外),因此锂、钠、钾属于碱金属元素,而钙是第ⅡA族元素,属于碱土金属,因此答案选C。
答案选C。
9.C
【详解】A.先滴加稀硫酸,与铁粉反应生成的H2排尽试管内的空气,再滴加NaOH溶液,可以生成Fe(OH)2沉淀,A不合题意;
B.先打开a处的止水夹,稀硫酸与铁粉反应生成的氢气将装置内的空气排尽,再关闭a处的止水夹,此时生成的气体将反应后的溶液压入试管B内,从而生成Fe(OH)2,B不合题意;
C.NaOH溶液滴入FeSO4溶液中,在NaOH溶液下落过程中会溶解空气,从而使生成的Fe(OH)2迅速氧化,C符合题意;
D.盛有NaOH的胶头滴管插入FeSO4溶液的液面下,且用苯液封,此时试管内的溶液中没有O2,生成的Fe(OH)2不会立即被氧化,D不合题意;
故选C。
10.C
【详解】A.溶于水的氯气部分与水反应生成盐酸和次氯酸,标况下,溶于足量水的22.4L氯气中氯原子的物质的量为×2=2mol,则由物料守恒可知,溶液中n(Cl2)+n(Cl—)+n(HClO)+n(ClO—)=2mol—n(Cl2),所得溶液中Cl2、Cl—、HClO和ClO—四种微粒总数大于NA小于2NA,故A错误;
B.缺溶液的体积,无法计算1mol/L硫酸铁溶液中硫酸铁的物质的量和含有的硫酸根离子的数目,故B错误;
C.过氧化钠与二氧化碳反应生成碳酸钠和氧气,则7.8过氧化钠与足量二氧化碳反应转移电子数为×1×NAmol—1=0.1NA,故C正确;
D.铁在氧气中燃烧生成四氧化三铁,1mol铁失去电子的数目为1mol××NAmol—1=NA,故D错误;
故选C。
11.正确
【详解】“长征七号”使用的燃料、材料、涂层等,更加轻质化、环保无污染等,都彰显出化学科学的巨大贡献,故正确。
12.错误
【详解】CuO属于碱性氧化物,不能与NaOH溶液反应,故错误。
13.错误
【详解】金属活动性排在H后面的金属不能与盐酸发生置换反应,如铜等,故错误。
14.正确
【详解】铝在空气中与氧气反应生成一层致密的氧化膜,氧化铝;
故答案为:正确。
15.正确
【详解】钠、镁、铝等活泼金属的冶炼采用电解其相应的熔融物得到,故答案为:正确。
16.(1)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2)平衡压强,使H2C2O4溶液顺利滴入三颈烧瓶中
(3)取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全
(4)取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质
(5) 20.00% CO、CO2
【分析】由题给流程可知,硫酸亚铁溶液与氨水反应生成氢氧化亚铁沉淀和硫酸铵,硫酸亚铁溶液与草酸溶液反应生成二水草酸亚铁沉淀,过滤、用蒸馏水洗涤、烘干得到二水草酸亚铁。
【详解】(1)由分析可知,沉淀步骤得到还原性强的氢氧化亚铁沉淀易与水和空气中的氧气反应生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)由实验装置图可知,滴液漏斗中导管A的作用是平衡压强,便于草酸溶液顺利滴入三颈烧瓶中,故答案为:平衡压强,使H2C2O4溶液顺利滴入三颈烧瓶中;
(3)由分析可知,反应制得的二水草酸亚铁沉淀表面附有可溶性杂质硫酸铵,检验洗涤完全实际上是检验洗涤液中不存在硫酸根离子,具体操作为取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全,故答案为:取最后一次洗涤滤液少许于试管中,先滴加盐酸酸化,再滴加BaCl2溶液,若无白色沉淀生成,则已洗涤完全;
(4)检验草酸亚铁晶体是否氧化变质实际上就是晶体溶于稀硫酸所得溶液中是否存在铜离子,具体操作为取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质,故答案为:取少量草酸亚铁晶体于试管中,加入稀硫酸溶解后并滴加KSCN溶液,若溶液变红色,则草酸亚铁晶体已氧化变质;若不变红色,则草酸亚铁晶体未氧化变质;
(5)由表格数据可知,第一阶段发生的反应为二水草酸亚铁受热失去结晶水生成草酸亚铁,则第一阶段的质量损失率为×100%=20%;第二阶段发生的反应为氩气氛围中草酸亚铁受热分解得到四氧化三铁,由得失电子数目守恒可知,一氧化碳和二氧化碳,反应生成的气体为一氧化碳和二氧化碳,反应的化学方程式为3FeC2O4Fe3O4+4CO↑+2CO2↑,故答案为:20%;CO、CO2。
17.(1)5.4
(2)①④
(3)AC
(4)B
(5)H2O2+2Fe2++2H+=2Fe3++2H2O
【分析】补血剂研细后加入稀硫酸溶解,过滤后得到不溶物和滤液,滤液中加入H2O2,将Fe2+氧化为Fe3+,然后加入过量X得到红褐色悬浊液,则X为碱性溶液,红褐色物质为Fe(OH)3,通过一系列操作得到的固体为红棕色固体Fe2O3。据此解答。
【详解】(1)溶液稀释前后溶质的物质的量不变,所需浓硫酸的体积为≈5.4mL,故答案为:5.4;
(2)在下列配制过程示意图中,有错误的是①④,稀释浓硫酸,应该将浓硫酸倒入蒸馏水中并不断搅拌,定容时,视线要与凹液面最低处相切,故答案为:①④;
(3)A.烧杯内壁沾有溶质,洗涤烧杯和玻璃棒2至3次,并将洗涤液移入容量瓶以减少误差,故A正确;
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,配制溶液体积偏小,所配溶液浓度会偏高,故B错误;
C.定容时仰视观察,溶液体积偏大,所配溶液浓度会偏低,故C正确;
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液,然后正放,将容量瓶的瓶塞旋转180后,再倒置不漏液即可,故D错误;
故答案为:AC;
(4)A. 步骤②反应后的溶液中含有铁离子,用氯水、KSCN溶液不能检验是否有Fe2+,A错误;
B. 验证步骤②反应后的溶液中是否含Fe2+,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,B正确;
C. 步骤②反应后的溶液中含有铁离子,加入氢氧化钠溶液产生红褐色沉淀,掩盖住白色沉淀氢氧化亚铁,不能用NaOH溶液检验是否有Fe2+,C错误;
故答案为:B;
(5)步骤②加入过量H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O。
18. 4Fe(OH)2+O2 +2H2O=4Fe(OH)3 2Na+2H2O+CuSO4=Cu(OH)2+H2↑+Na2SO4 2Al+2H2O+2OH-=2AlO2-+3H2↑ 溶液先变红,后变为无色 2AlO2-+CO2+3H2O=2Al(OH)3 +CO32-
【分析】(1)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁;
(2)往CuSO4溶液中投入一小块钠,反应后出现蓝色沉淀,但没有红色物质析出;
(3)铝和NaOH溶液反应生成偏铝酸钠和氢气;;
(4)过氧化钠和水反应生成氢氧化钠溶液和氧气;过氧化钠具有强氧化性,具有漂白性有机色素;
(5)NaAlO2溶液中通入少量CO2,生成氢氧化铝沉淀和碳酸钠。
【详解】(1)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁,反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)往CuSO4溶液中投入一小块钠,反应后出现蓝色沉淀,但没有红色物质析出是因为钠先与水反应生成氢氧化钠和氢气,氢氧化钠溶液再与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,则钠和CuSO4溶液反应的化学方程式为2Na+2H2O+CuSO4=Cu(OH)2+H2↑+Na2SO4;
(3)铝和NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑;
(4)把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,木条复燃证明为氧气,向反应后的溶液中加入酚酞试液溶液变红,证明生成了碱为氢氧化钠溶液,随后褪色,过氧化钠具有强氧化性能把有机色素氧化为无色物质;
(5)NaAlO2溶液中通入少量CO2,生成碳酸根离子,发生反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-。
【点睛】考查离子方程式的书写,明确发生的反应并熟悉离子反应方程式的书写方法是解答本题的关键。离子方程式是指用实际参加反应的离子符号表示离子反应的式子,离子方程式的书写步骤一般为:①“写”:写出有关反应的化学方程式;②“拆”:可溶性的电解质用离子符号表示,其它难溶的物质、气体、水等仍用化学式表示;③“删”:删去方程式两边不参加反应的离子; ④“查”:检查式子两边的各种原子的个数及电荷数是否相等
