【真题】2023年南通市中考化学试卷(含解析)
文档属性
| 名称 | 【真题】2023年南通市中考化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 587.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-01 17:03:02 | ||
图片预览




文档简介
南通市2023年初中毕业、升学考试
化学试卷
1.近代著名实业家张謇在南通办教育、建纱厂,留下了宝贵遗产。纱厂生产的棉纱属于()
A.塑料 B.纤维 C.橡胶 D.合金
2.同时含有氮、磷、钾中两种或三种元素的化肥属于复合肥。下列属于复合肥的是()
A.KNO3B.Ca3(PO4)2C.KClD.NH4HCO3
3.“粗盐中难溶性杂质的去除”涉及的实验操作中不正确的是()
A.溶解粗盐 B.过滤杂质
C.蒸发结晶 D.熄灭酒精灯
4.含碳物质种类丰富、应用广泛。下列物质的性质与用途具有对应关系的是()
A.活性炭具有吸附性,可用于水的净化
B.一氧化碳具有毒性,可用于高炉炼铁
C.碳酸氢钠受热易分解,可用于治疗胃酸过多症
D.聚氯乙烯塑料热稳定性差,可用作电线外面的绝缘层
阅读下列材料,完成下面小题。
大气臭氧层是地球的太阳镜,能吸收紫外线,保护生物。大气平流层中同时发生氧气与臭氧的相互转化,经过漫长时间形成臭氧层。氧气与臭氧的相互转化如图所示。
5.下列有关空气、氧气和臭氧的说法正确的是()
A.空气中含量最高的是氧气 B.可用向下排空气法收集氧气
C.葡萄糖在人体内的缓慢氧化需要氧气 D.氧气比臭氧更容易吸收太阳紫外线
6.关于反应箱中氧气与臭氧的相互转化,下列说法不正确的是()
A.气体总质量保持不变 B.元素种类保持不变
C.分子总数保持不变 D.原子总数保持不变
7.学习小组通过下列实验探究CuSO4溶液的性质。
实验Ⅰ:把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质。
实验Ⅱ:向CuSO4溶液中滴加少量NaOH溶液,出现沉淀。
下列说法正确的是()
A.实验Ⅰ中溶液颜色不变 B.实验Ⅰ说明Al的活动性比Cu的强
C.实验Ⅱ中只发生物理变化 D.实验Ⅱ中沉淀为CuO
8.常温下,工业可利用Na2SO4+KCl→NaCl+ K2SO4(未配平)原理制备K2SO4。Na2SO4、KCl、NaCl和K2SO4的溶解度曲线如图所示。
下列说法正确的是()
A.KCl的溶解度一定大于NaCl的溶解度
B.Na2SO4的溶解度随温度的升高一直增大
C.60℃时,Na2SO4、KCl溶液中溶质的质量分数一定相等
D.该制备反应利用了常温下K2SO4溶解度相对较小的性质
9.下列实验方案能达到实验目的的是()
A.稀释浓硫酸:将水直接倒入盛有浓硫酸的烧杯中
B.探究氨分子运动现象:按图所示装置进行实验
C.配制质量分数为5%的氯化钠溶液:将5g氯化钠溶于100g水
D.验证牛奶中含有锌元素:向牛奶中加入稀硫酸,观察是否有气泡产生
10.已知常温下Ca(OH)2溶解度为0.17g。向一定量饱和Ca(OH)2溶液中滴加盐酸,溶液pH随V(盐酸)变化的曲线如图所示。为检测某生石灰样品中钙元素含量,实验如下:
步骤1:取0.60g样品于锥形瓶中,向其中加入200mL蒸馏水,盖上表面皿充分振荡。
步骤2:向冷却后的锥形瓶中滴入几滴酚酞,再逐滴加入稀盐酸至反应完全。反应完全时锥形瓶内溶液红色恰好褪去。经换算,消耗m(HCl)=0.73g。
下列说法正确的是()
A.步骤1中充分振荡后得到澄清透明的溶液
B.步骤2中红色恰好褪去时,消耗V3mL盐酸
C.步骤2中化学反应方程式为2HCl+CaO=CaCl2+H2O
D.该样品中钙元素的质量分数为66.67%
第Ⅱ卷(非选择题共110分)
第Ⅱ卷共17小题,共110分。第21至25题为化学试题,第26至37题为物理试题。答案请按要求书写在答题卡上。
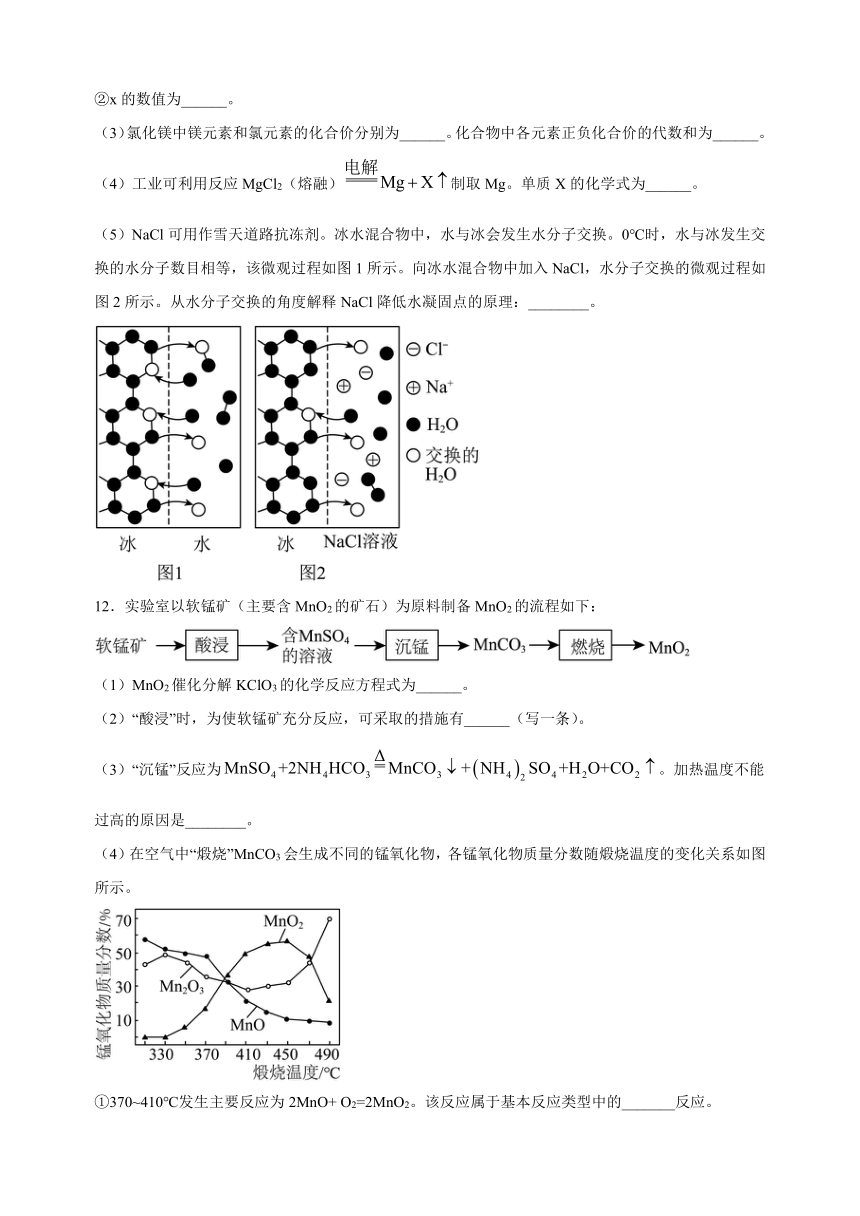
11.海水中含有大量的氯化钠、氯化镁等,研究它们的组成和性质具有重要意义。
(1)构成水分子的微粒是氢原子和______。海水晒盐时,液态水蒸发为水蒸气的过程中,水分子的结构______(填“发生”或“没有”)改变。
(2)钠原子的结构示意图为,氯原子的结构示意图为。
①钠原子转变为钠离子时,发生变化的是______(填“质子数”或“电子数”)。
②x的数值为______。
(3)氯化镁中镁元素和氯元素的化合价分别为______。化合物中各元素正负化合价的代数和为______。
(4)工业可利用反应MgCl2(熔融)制取Mg。单质X的化学式为______。
(5)NaCl可用作雪天道路抗冻剂。冰水混合物中,水与冰会发生水分子交换。0℃时,水与冰发生交换的水分子数目相等,该微观过程如图1所示。向冰水混合物中加入NaCl,水分子交换的微观过程如图2所示。从水分子交换的角度解释NaCl降低水凝固点的原理:________。
12.实验室以软锰矿(主要含MnO2的矿石)为原料制备MnO2的流程如下:
(1)MnO2催化分解KClO3的化学反应方程式为______。
(2)“酸浸”时,为使软锰矿充分反应,可采取的措施有______(写一条)。
(3)“沉锰”反应为。加热温度不能过高的原因是________。
(4)在空气中“煅烧”MnCO3会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图所示。
①370~410℃发生主要反应为2MnO+ O2=2MnO2。该反应属于基本反应类型中的_______反应。
②已知酒精灯外焰的最高温度可达600℃以上。称取一定质量的MnO2,与KClO3混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。MnO2质量减少的主要原因是________。
13.学习小组用石蜡自制蜡烛并探究其燃烧。
(1)剪去易拉罐的盖子,在中间吊一根棉线作烛芯,将其置于盛有冷水的水槽中。向易拉罐中倒入液态石蜡并添加少量硬脂酸。充分冷却,从易拉罐中取出蜡烛。
①蜡烛属于______(填“混合物”或“纯净物”)。
②将易拉罐置于冷水槽中,有助于液态石蜡凝固,这是利用了金属的______性。
(2)点燃蜡烛,火焰明亮,烛芯周围有液体产生。
①能说明蜡烛燃烧时放出热量的现象是_______________。
②正二十二烷(C22H46)是石蜡的成分之一。正二十二烷完全燃烧的产物与甲烷的相同。写出正二十二烷完全燃烧的化学反应方程式:__________________。
(3)在燃着的蜡烛上方扣一个烧杯,一段时间后蜡烛熄灭,烧杯内壁出现水雾,烧杯底部变黑且干燥(如图所示)。资料显示,蜡烛不完全燃烧产生的炭黑具有超疏水性,水滴在其表面不易附着聚集,利用这种性质可以制作超疏水性材料。
①蜡烛熄灭的可能原因有_____________________。
②铁质水管覆盖超疏水性材料可提高水管的抗腐蚀性,其原理是__________________。
14.学习小组制取CO2和SO2,并探究其水溶液的性质。
Ⅰ.制取CO2和SO2
在常温、气体压强为101kPa时,1体积水里最多能溶解大约1体积CO2或40体积SO2。学习小组利用图1所示装置制取CO2和SO2。
(1)利用该装置制取CO2的化学反应方程式为_______________。
(2)不能用排水法收集SO2的理由是________________________。
Ⅱ.探究CO2和SO2水溶液的性质
(3)在通风橱中分别向100 mL H2O中通入CO2和SO2至饱和,用pH计测定饱和溶液pH,静置2h后,再次读取溶液pH。结果如下表所示。
饱和溶液pH 静置2h后溶液pH
CO2水溶液 3.94 4.12
SO2水溶液 0.88 0.79
①测定pH最简便的方法是使用pH试纸,操作时玻璃棒的作用是______(填字母)。
A.搅拌B.引流C.蘸取溶液
②静置2h后,CO2水溶液酸性______(填“增强”或“减弱”)。
③有同学根据溶液的pH认为CO2也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:_____________________。
(4)取静置后的SO2水溶液于试管中,向其中滴加过量Ba(OH)2溶液,有沉淀产生。
【提出问题】该沉淀是什么
【查阅资料】
①SO2水溶液、BaSO3都能与O2发生氧化反应。
②BaSO3和BaSO4都难溶于水。
③BaSO3能溶于浓度较大的盐酸,BaSO4不溶于盐酸。
【提出猜想】沉淀可能为BaSO4或BaSO4、BaSO3的混合物。
【实验验证】请设计实验验证沉淀中一定含有BaSO4。简述实验过程(包括操作和现象):______。(实验中须使用的试剂:10%的盐酸)
(5)煤燃烧排放的SO2可能导致酸雨。南通市2021年酸雨发生率为1.7%,比2020年减少1%。你了解的本地决策部门为降低SO2排放做出的举措有______(写一条)。
(6)酸雨对环境的影响因地区地质而异。图2中河流受酸雨损害的程度较小的原因是______。
15.化学储氢材料研发是当下科技研究的热点之一。
(1)下列化学储氢材料中含氢量最高的是______(填字母)。
A.NH3 B.N2H4 C.CH4
(2)我国科学家发明了一种将甲烷中的氢转化为氢气的工艺(原理如图所示)。
总反应的化学反应方程式为CH4+H2O=CO+3H2。
①反应器Ⅰ中的化学反应方程式为__________________。
②当甲烷的转化率()为80%时,理论上1.0吨甲烷与足量水蒸气反应生成氢气的总质量是______吨。(请将计算过程写到答题卡上)
参考答案
1.B
【解析】
【分析】棉纱是一种纤维,还有少量的其他物质,比如糖类、氨基酸等。
A.由分析可知,棉纱属于纤维,不属于塑料,故选项不符合题意;
B.由分析可知,棉纱属于纤维,故选项符合题意;
C.由分析可知,棉纱属于纤维,不属于橡胶,故选项不符合题意;
D.由分析可知,棉纱属于纤维,不属于合金,故不符合题意,故选B。
2.A
【解析】
A、中含有N、P、K中的氮元素和钾元素,属于复合肥,故选项符合题意;
B、中含有N、P、K中的磷元素,属于磷肥,故选项不符合题意;
C、中含有N、P、K中的钾元素,属于钾肥,故选项不符合题意;
D、中含有N、P、K中的氮元素,属于氮肥,故选项不符合题意。
故选A。
3.D
【解析】
A、溶解粗盐时,用玻璃棒不断搅拌,能加速溶解,该选项操作正确;
B、过滤时,应遵循“一贴二低三靠”,该选项操作正确;
C、蒸发时,应用酒精灯外焰加热,且用玻璃棒不断搅拌,该选项操作正确;
D、禁止用嘴吹灭酒精灯,应用灯帽盖灭,该选项操作不正确。
故选D。
4.A
【解析】
A.活性炭内部疏松多孔的结构可以吸附水中溶解的杂质,如除臭去色等,可用于水的净化,故A正确;
B.一氧化碳具有还原性,可用于高炉炼铁,故B错误;
C.碳酸氢钠水溶液显碱性,能与胃酸成分盐酸反应生成氯化钠、水和二氧化碳,可用于治疗胃酸过多症,故C错误;
D.聚氯乙烯塑料具有良好的耐腐蚀性和绝缘性,可用作电线外面的绝缘层,故D错误。
故选:A。
5.C 6.C
【解析】
【5题详解】
A、空气中含量最高的是氮气。A不正确;
B、由于氧气密度比空气大,所以可用向上排空气法收集氧气。B不正确;
C、葡萄糖在人体缓慢氧化的反应可表示为:葡萄糖+氧气二氧化碳+水,所以葡萄糖在人体内的缓慢氧化需要氧气。C正确;
D、大气臭氧层是地球的太阳镜,能吸收紫外线,保护生物。所以氧气不如臭氧容易吸收太阳紫外线。D不正确。
综上所述:选择C。
【6题详解】
根据质量守恒定律及反应箱中的化学方程式可知,反应箱中氧气与臭氧的相互转化过程中,气体总质量保持不变;元素种类保持不变;原子总数保持不变。反应前后分子总数发生变化。
A、气体总质量保持不变。A正确;
B、元素种类保持不变。B正确;
C、反应前后分子总数发生变化。分子总数不是保持不变。C不正确;
D、原子总数保持不变。D正确。
综上所述:选择C。
7.B
【解析】
【详解】A、把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质,铝和硫酸铜反应生成硫酸铝和铜,溶液颜色由蓝色逐渐变为无色,错误;
B、把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质,说明Al能置换出Cu,Al的活动性比Cu的强,正确;
C、实验Ⅱ中氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,有新物质生成,发生了化学变化,错误;
D、实验Ⅱ中氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,实验Ⅱ中沉淀为氢氧化铜,错误。
故选B。
8.D
【解析】
【详解】A、由溶解度曲线图可知,KCl的溶解度不一定大于NaCl的溶解度,故选项说法不正确;
B、由溶解度曲线图可知,的溶解度先随温度的升高而增大,后又随温度的升高而减少,故选项说法不正确;
C、60℃时,、KCl交于一点,说明该温度下两物质的溶解度相等,所以此时两物质的饱和溶液中溶质的质量分数一定相等,由于未指明溶液的状态,不能比较两种溶液溶质的质量分数的大小,故选项说法不正确;
D、根据反应原理:硫酸钠与氯化钾反应生成氯化钠和硫酸钾,由于常温下溶解度相对较小,硫酸钾会结晶析出,因此可制备硫酸钾,故选项说法正确。
故选D。
9.B
【解析】
【详解】A.稀释浓硫酸,一定要把浓硫酸沿容器壁慢慢注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散,将水直接倒入盛有浓硫酸的烧杯中会引起液滴飞溅,造成危险,故A错误;
B.探究氨分子运动现象,按图所示装置进行实验,可观察到湿润的红色石蕊试纸变蓝,说明分子在不断地运动,故B正确;
C.配制质量分数为5%的氯化钠溶液:应将5g氯化钠溶于95g水中,故C错误;
D.活泼金属镁、铝、锌、铁等金属单质都会与稀硫酸反应,产生气泡,则向牛奶中加入稀硫酸,观察到有气泡产生不能验证牛奶中含有锌元素,故D错误。
故选:B。
10.D
【解析】
【详解】A、由题意可知,常温下溶解度为0.17g。取0.60g样品于锥形瓶中,氧化钙和水反应生成氢氧化钙,生成的氢氧化钙的质量>0.6g,向其中加入200mL蒸馏水,200g的水最多溶解0.34g的氢氧化钙,所以生成氢氧化钙不能完全溶解,步骤1中充分振荡后不能得到澄清透明的溶液,故A错误;
B、反应完全时锥形瓶内溶液红色恰好褪去,此时溶液呈中性,pH=7,则消耗 mL盐酸,故B错误;
C、步骤2中是氢氧化钙和稀盐酸反应生成氯化钙和水,化学反应方程式为,故C错误;
D、在该反应过程中,氢氧化钙和稀盐酸反应生成氯化钙和水,根据质量守恒定律可知,钙元素质量不变,则有,该样品中钙元素的质量分数为,故D正确。
故选D。
第Ⅱ卷共17小题,共110分。第21至25题为化学试题,第26至37题为物理试题。答案请按要求书写在答题卡上。
11.(1)①.氧原子##O ②.没有(2)①.电子数②.8
(3)①.+2价、-1价②.0 (4)
(5)冰交换到NaCl溶液中的水分子数目比NaCl溶液交换到冰中的水分子数目多
【解析】
【小问1详解】水分子是由氢原子和氧原子构成的;
液态水蒸发为水蒸气的过程中,没有新物质生成属于物理变化因此水分子本身没有改变;
【小问2详解】
①钠原子最外层电子数是1,化学反应时易失去一个电子转变为钠离子,发生变化的是电子数;
②如图原子核内质子数等于核外电子数,则17=2+x+7,x=8
【小问3详解】
化合物中元素化合价代数和为0,氯化镁中镁元素化合价为+2即啊,氯元素化合价为-1价;
【小问4详解】
质量守恒定律反应前后原子的种类和个数不变,反应前有1个Mg,2个Cl,反应后有1个Mg,故X的化学式是Cl2;
【小问5详解】
如图所示,冰交换到NaCl溶液中的水分子数目比NaCl溶液交换到冰中的水分子数目多,因此NaCl可用作雪天道路抗冻剂。
12.(1)
(2)搅拌;粉碎;加热;适当提高酸的浓度等
(3)防止分解
(4)①.化合②.温度高于450℃时,会分解成和O2
【解析】
【小问1详解】
加热条件下MnO2催化分解KClO3生成氯化钾和氧气,化学反应方程式为。故填:。
【小问2详解】
“酸浸”时,搅拌、粉碎、加热、适当提高酸的浓度等措施,都能使软锰矿充分反应。故填:搅拌;粉碎;加热;适当提高酸的浓度等。
【小问3详解】
由于反应物NH4HCO3受热易分解,所以为防止NH4HCO3分解,“沉锰”反应加热温度不能过高。故填:防止NH4HCO3分解。
【小问4详解】
①370~410℃发生主要反应为。该反应符合化合反应多变一的特征,所以该反应属于基本反应类型中的化合反应。故填:化合。
②酒精灯外焰的最高温度可达600℃以上。据图可知,温度高于450℃时,MnO2会分解成Mn2O3和O2,所以MnO2质量减少。故填:温度高于450℃时,MnO2会分解成Mn2O3和O2。
13.(1)①.混合物②.导热
(2)①.烛芯周围有液体产生②.
(3)①.氧气浓度降低,不再支持蜡烛燃烧;燃烧产生二氧化碳,将可燃物与氧气隔绝②.超疏水性材料隔绝了水、氧气与铁接触
【解析】
【小问1详解】
①蜡烛是由多种物质组成,属于混合物;
②将易拉罐置于冷水槽中,有助于液态石蜡凝固,这是利用了金属的导热性,使石蜡温度快速下降;
【小问2详解】
①蜡烛受热熔化成液体,能说明蜡烛燃烧时放出热量的现象是烛芯周围有液体产生;
②甲烷在空气中燃烧生成水和二氧化碳,正二十二烷()是石蜡的成分之一。正二十二烷完全燃烧的产物与甲烷的相同,正二十二烷完全燃烧生成二氧化碳和水,反应的化学反应方程式:;
【小问3详解】
①蜡烛燃烧是蜡烛与空气中氧气反应生成二氧化碳和水,燃着的蜡烛熄灭可能原因有氧气浓度降低,不再支持蜡烛燃烧;燃烧产生二氧化碳,将可燃物与氧气隔绝;
②根据“超疏水性,水滴在其表面不易附着聚集”可知,铁质水管覆盖超疏水性材料可提高水管的抗腐蚀性,其原理是超疏水性材料隔绝了水、氧气与铁的接触。
14.(1)
(2)常温、气体压强为101kPa时,SO2在水中溶解度较大
(3)①.C ②.减弱③.不正确,常压下,空气中CO2的压强达不到101kPa,无法形成CO2的饱和溶液
(4)向产生沉淀的试管中滴加过量的10%的盐酸,沉淀不消失
(5)出台政策鼓励企业自主减排;推广使用清洁能源,减少煤、石油等化石燃料的使用;扩大烟花爆竹禁放区域;淘汰旧标燃油机动车,推广新能源车等
(6)河床中的CaCO3能与酸反应,降低河流酸性
【解析】
【小问1详解】
图1装置中稀硫酸能与碳酸钠反应生产硫酸钠、二氧化碳和水,利用此反应可制取二氧化碳,反应的化学方程式为:;
【小问2详解】
在常温、气体压强为101kPa时,1体积水里最多能溶解大约40体积SO2,SO2在水中溶解度较大,因此不能用排水法收集SO2;
【小问3详解】
①测定pH时,要用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,再与标准比色卡对比来确定pH,因此操作时玻璃棒的作用为蘸取溶液,故选C;
②静置2h后,CO2水溶液的pH由3.94增大为4.12,pH增大,溶液酸性减弱;
③常压下,空气中CO2的压强达不到101kPa,无法形成CO2的饱和溶液,因此CO2不是造成酸雨的重要因素;
【小问4详解】
BaSO3能溶于浓度较大的盐酸,BaSO4不溶于盐酸,因此向产生沉淀的试管中滴加过量的10%的盐酸,沉淀不消失,说明沉淀中一定含有BaSO4;
【小问5详解】
煤燃烧排放的SO2可能导致酸雨,因此为降低SO2排放,可出台相关政策鼓励企业自主减排;推广使用清洁能源,减少煤、石油等化石燃料的使用;扩大烟花爆竹禁放区域;淘汰旧标燃油机动车,推广新能源车等;
【小问6详解】
石灰石河床的主要成分为碳酸钙,碳酸钙能与酸反应,降低河流酸性,因此河流受酸雨损害的程度较小。
15.(1)C
(2)①.②.0.3
解:设理论上1.0吨甲烷和足量水蒸气反应生成氢气的质量为x
答:理论上1.0吨甲烷和足量水蒸气反应生成氢气的质量为0.3吨。
【解析】
【小问1详解】
A、NH3中氮元素和氢元素质量比是
B、N2H4中氮元素和氢元素质量比是
C、CH4中碳元素和氢元素质量比是12:4=36:12;
故甲烷中氢元素质量分数最大,故选:C;
【小问2详解】
①根据题意,该反应是H2O和Ce2O3在400℃时反应生成CeO2和H2,化学方程式为:;
②根据化学方程式计算,见答案。
化学试卷
1.近代著名实业家张謇在南通办教育、建纱厂,留下了宝贵遗产。纱厂生产的棉纱属于()
A.塑料 B.纤维 C.橡胶 D.合金
2.同时含有氮、磷、钾中两种或三种元素的化肥属于复合肥。下列属于复合肥的是()
A.KNO3B.Ca3(PO4)2C.KClD.NH4HCO3
3.“粗盐中难溶性杂质的去除”涉及的实验操作中不正确的是()
A.溶解粗盐 B.过滤杂质
C.蒸发结晶 D.熄灭酒精灯
4.含碳物质种类丰富、应用广泛。下列物质的性质与用途具有对应关系的是()
A.活性炭具有吸附性,可用于水的净化
B.一氧化碳具有毒性,可用于高炉炼铁
C.碳酸氢钠受热易分解,可用于治疗胃酸过多症
D.聚氯乙烯塑料热稳定性差,可用作电线外面的绝缘层
阅读下列材料,完成下面小题。
大气臭氧层是地球的太阳镜,能吸收紫外线,保护生物。大气平流层中同时发生氧气与臭氧的相互转化,经过漫长时间形成臭氧层。氧气与臭氧的相互转化如图所示。
5.下列有关空气、氧气和臭氧的说法正确的是()
A.空气中含量最高的是氧气 B.可用向下排空气法收集氧气
C.葡萄糖在人体内的缓慢氧化需要氧气 D.氧气比臭氧更容易吸收太阳紫外线
6.关于反应箱中氧气与臭氧的相互转化,下列说法不正确的是()
A.气体总质量保持不变 B.元素种类保持不变
C.分子总数保持不变 D.原子总数保持不变
7.学习小组通过下列实验探究CuSO4溶液的性质。
实验Ⅰ:把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质。
实验Ⅱ:向CuSO4溶液中滴加少量NaOH溶液,出现沉淀。
下列说法正确的是()
A.实验Ⅰ中溶液颜色不变 B.实验Ⅰ说明Al的活动性比Cu的强
C.实验Ⅱ中只发生物理变化 D.实验Ⅱ中沉淀为CuO
8.常温下,工业可利用Na2SO4+KCl→NaCl+ K2SO4(未配平)原理制备K2SO4。Na2SO4、KCl、NaCl和K2SO4的溶解度曲线如图所示。
下列说法正确的是()
A.KCl的溶解度一定大于NaCl的溶解度
B.Na2SO4的溶解度随温度的升高一直增大
C.60℃时,Na2SO4、KCl溶液中溶质的质量分数一定相等
D.该制备反应利用了常温下K2SO4溶解度相对较小的性质
9.下列实验方案能达到实验目的的是()
A.稀释浓硫酸:将水直接倒入盛有浓硫酸的烧杯中
B.探究氨分子运动现象:按图所示装置进行实验
C.配制质量分数为5%的氯化钠溶液:将5g氯化钠溶于100g水
D.验证牛奶中含有锌元素:向牛奶中加入稀硫酸,观察是否有气泡产生
10.已知常温下Ca(OH)2溶解度为0.17g。向一定量饱和Ca(OH)2溶液中滴加盐酸,溶液pH随V(盐酸)变化的曲线如图所示。为检测某生石灰样品中钙元素含量,实验如下:
步骤1:取0.60g样品于锥形瓶中,向其中加入200mL蒸馏水,盖上表面皿充分振荡。
步骤2:向冷却后的锥形瓶中滴入几滴酚酞,再逐滴加入稀盐酸至反应完全。反应完全时锥形瓶内溶液红色恰好褪去。经换算,消耗m(HCl)=0.73g。
下列说法正确的是()
A.步骤1中充分振荡后得到澄清透明的溶液
B.步骤2中红色恰好褪去时,消耗V3mL盐酸
C.步骤2中化学反应方程式为2HCl+CaO=CaCl2+H2O
D.该样品中钙元素的质量分数为66.67%
第Ⅱ卷(非选择题共110分)
第Ⅱ卷共17小题,共110分。第21至25题为化学试题,第26至37题为物理试题。答案请按要求书写在答题卡上。
11.海水中含有大量的氯化钠、氯化镁等,研究它们的组成和性质具有重要意义。
(1)构成水分子的微粒是氢原子和______。海水晒盐时,液态水蒸发为水蒸气的过程中,水分子的结构______(填“发生”或“没有”)改变。
(2)钠原子的结构示意图为,氯原子的结构示意图为。
①钠原子转变为钠离子时,发生变化的是______(填“质子数”或“电子数”)。
②x的数值为______。
(3)氯化镁中镁元素和氯元素的化合价分别为______。化合物中各元素正负化合价的代数和为______。
(4)工业可利用反应MgCl2(熔融)制取Mg。单质X的化学式为______。
(5)NaCl可用作雪天道路抗冻剂。冰水混合物中,水与冰会发生水分子交换。0℃时,水与冰发生交换的水分子数目相等,该微观过程如图1所示。向冰水混合物中加入NaCl,水分子交换的微观过程如图2所示。从水分子交换的角度解释NaCl降低水凝固点的原理:________。
12.实验室以软锰矿(主要含MnO2的矿石)为原料制备MnO2的流程如下:
(1)MnO2催化分解KClO3的化学反应方程式为______。
(2)“酸浸”时,为使软锰矿充分反应,可采取的措施有______(写一条)。
(3)“沉锰”反应为。加热温度不能过高的原因是________。
(4)在空气中“煅烧”MnCO3会生成不同的锰氧化物,各锰氧化物质量分数随煅烧温度的变化关系如图所示。
①370~410℃发生主要反应为2MnO+ O2=2MnO2。该反应属于基本反应类型中的_______反应。
②已知酒精灯外焰的最高温度可达600℃以上。称取一定质量的MnO2,与KClO3混合均匀,充分加热后冷却,溶解、过滤、洗涤、烘干后称量,发现固体质量减少。MnO2质量减少的主要原因是________。
13.学习小组用石蜡自制蜡烛并探究其燃烧。
(1)剪去易拉罐的盖子,在中间吊一根棉线作烛芯,将其置于盛有冷水的水槽中。向易拉罐中倒入液态石蜡并添加少量硬脂酸。充分冷却,从易拉罐中取出蜡烛。
①蜡烛属于______(填“混合物”或“纯净物”)。
②将易拉罐置于冷水槽中,有助于液态石蜡凝固,这是利用了金属的______性。
(2)点燃蜡烛,火焰明亮,烛芯周围有液体产生。
①能说明蜡烛燃烧时放出热量的现象是_______________。
②正二十二烷(C22H46)是石蜡的成分之一。正二十二烷完全燃烧的产物与甲烷的相同。写出正二十二烷完全燃烧的化学反应方程式:__________________。
(3)在燃着的蜡烛上方扣一个烧杯,一段时间后蜡烛熄灭,烧杯内壁出现水雾,烧杯底部变黑且干燥(如图所示)。资料显示,蜡烛不完全燃烧产生的炭黑具有超疏水性,水滴在其表面不易附着聚集,利用这种性质可以制作超疏水性材料。
①蜡烛熄灭的可能原因有_____________________。
②铁质水管覆盖超疏水性材料可提高水管的抗腐蚀性,其原理是__________________。
14.学习小组制取CO2和SO2,并探究其水溶液的性质。
Ⅰ.制取CO2和SO2
在常温、气体压强为101kPa时,1体积水里最多能溶解大约1体积CO2或40体积SO2。学习小组利用图1所示装置制取CO2和SO2。
(1)利用该装置制取CO2的化学反应方程式为_______________。
(2)不能用排水法收集SO2的理由是________________________。
Ⅱ.探究CO2和SO2水溶液的性质
(3)在通风橱中分别向100 mL H2O中通入CO2和SO2至饱和,用pH计测定饱和溶液pH,静置2h后,再次读取溶液pH。结果如下表所示。
饱和溶液pH 静置2h后溶液pH
CO2水溶液 3.94 4.12
SO2水溶液 0.88 0.79
①测定pH最简便的方法是使用pH试纸,操作时玻璃棒的作用是______(填字母)。
A.搅拌B.引流C.蘸取溶液
②静置2h后,CO2水溶液酸性______(填“增强”或“减弱”)。
③有同学根据溶液的pH认为CO2也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:_____________________。
(4)取静置后的SO2水溶液于试管中,向其中滴加过量Ba(OH)2溶液,有沉淀产生。
【提出问题】该沉淀是什么
【查阅资料】
①SO2水溶液、BaSO3都能与O2发生氧化反应。
②BaSO3和BaSO4都难溶于水。
③BaSO3能溶于浓度较大的盐酸,BaSO4不溶于盐酸。
【提出猜想】沉淀可能为BaSO4或BaSO4、BaSO3的混合物。
【实验验证】请设计实验验证沉淀中一定含有BaSO4。简述实验过程(包括操作和现象):______。(实验中须使用的试剂:10%的盐酸)
(5)煤燃烧排放的SO2可能导致酸雨。南通市2021年酸雨发生率为1.7%,比2020年减少1%。你了解的本地决策部门为降低SO2排放做出的举措有______(写一条)。
(6)酸雨对环境的影响因地区地质而异。图2中河流受酸雨损害的程度较小的原因是______。
15.化学储氢材料研发是当下科技研究的热点之一。
(1)下列化学储氢材料中含氢量最高的是______(填字母)。
A.NH3 B.N2H4 C.CH4
(2)我国科学家发明了一种将甲烷中的氢转化为氢气的工艺(原理如图所示)。
总反应的化学反应方程式为CH4+H2O=CO+3H2。
①反应器Ⅰ中的化学反应方程式为__________________。
②当甲烷的转化率()为80%时,理论上1.0吨甲烷与足量水蒸气反应生成氢气的总质量是______吨。(请将计算过程写到答题卡上)
参考答案
1.B
【解析】
【分析】棉纱是一种纤维,还有少量的其他物质,比如糖类、氨基酸等。
A.由分析可知,棉纱属于纤维,不属于塑料,故选项不符合题意;
B.由分析可知,棉纱属于纤维,故选项符合题意;
C.由分析可知,棉纱属于纤维,不属于橡胶,故选项不符合题意;
D.由分析可知,棉纱属于纤维,不属于合金,故不符合题意,故选B。
2.A
【解析】
A、中含有N、P、K中的氮元素和钾元素,属于复合肥,故选项符合题意;
B、中含有N、P、K中的磷元素,属于磷肥,故选项不符合题意;
C、中含有N、P、K中的钾元素,属于钾肥,故选项不符合题意;
D、中含有N、P、K中的氮元素,属于氮肥,故选项不符合题意。
故选A。
3.D
【解析】
A、溶解粗盐时,用玻璃棒不断搅拌,能加速溶解,该选项操作正确;
B、过滤时,应遵循“一贴二低三靠”,该选项操作正确;
C、蒸发时,应用酒精灯外焰加热,且用玻璃棒不断搅拌,该选项操作正确;
D、禁止用嘴吹灭酒精灯,应用灯帽盖灭,该选项操作不正确。
故选D。
4.A
【解析】
A.活性炭内部疏松多孔的结构可以吸附水中溶解的杂质,如除臭去色等,可用于水的净化,故A正确;
B.一氧化碳具有还原性,可用于高炉炼铁,故B错误;
C.碳酸氢钠水溶液显碱性,能与胃酸成分盐酸反应生成氯化钠、水和二氧化碳,可用于治疗胃酸过多症,故C错误;
D.聚氯乙烯塑料具有良好的耐腐蚀性和绝缘性,可用作电线外面的绝缘层,故D错误。
故选:A。
5.C 6.C
【解析】
【5题详解】
A、空气中含量最高的是氮气。A不正确;
B、由于氧气密度比空气大,所以可用向上排空气法收集氧气。B不正确;
C、葡萄糖在人体缓慢氧化的反应可表示为:葡萄糖+氧气二氧化碳+水,所以葡萄糖在人体内的缓慢氧化需要氧气。C正确;
D、大气臭氧层是地球的太阳镜,能吸收紫外线,保护生物。所以氧气不如臭氧容易吸收太阳紫外线。D不正确。
综上所述:选择C。
【6题详解】
根据质量守恒定律及反应箱中的化学方程式可知,反应箱中氧气与臭氧的相互转化过程中,气体总质量保持不变;元素种类保持不变;原子总数保持不变。反应前后分子总数发生变化。
A、气体总质量保持不变。A正确;
B、元素种类保持不变。B正确;
C、反应前后分子总数发生变化。分子总数不是保持不变。C不正确;
D、原子总数保持不变。D正确。
综上所述:选择C。
7.B
【解析】
【详解】A、把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质,铝和硫酸铜反应生成硫酸铝和铜,溶液颜色由蓝色逐渐变为无色,错误;
B、把一根砂纸打磨过的Al丝浸入CuSO4溶液中,一段时间后观察到Al丝表面出现红色物质,说明Al能置换出Cu,Al的活动性比Cu的强,正确;
C、实验Ⅱ中氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,有新物质生成,发生了化学变化,错误;
D、实验Ⅱ中氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,实验Ⅱ中沉淀为氢氧化铜,错误。
故选B。
8.D
【解析】
【详解】A、由溶解度曲线图可知,KCl的溶解度不一定大于NaCl的溶解度,故选项说法不正确;
B、由溶解度曲线图可知,的溶解度先随温度的升高而增大,后又随温度的升高而减少,故选项说法不正确;
C、60℃时,、KCl交于一点,说明该温度下两物质的溶解度相等,所以此时两物质的饱和溶液中溶质的质量分数一定相等,由于未指明溶液的状态,不能比较两种溶液溶质的质量分数的大小,故选项说法不正确;
D、根据反应原理:硫酸钠与氯化钾反应生成氯化钠和硫酸钾,由于常温下溶解度相对较小,硫酸钾会结晶析出,因此可制备硫酸钾,故选项说法正确。
故选D。
9.B
【解析】
【详解】A.稀释浓硫酸,一定要把浓硫酸沿容器壁慢慢注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散,将水直接倒入盛有浓硫酸的烧杯中会引起液滴飞溅,造成危险,故A错误;
B.探究氨分子运动现象,按图所示装置进行实验,可观察到湿润的红色石蕊试纸变蓝,说明分子在不断地运动,故B正确;
C.配制质量分数为5%的氯化钠溶液:应将5g氯化钠溶于95g水中,故C错误;
D.活泼金属镁、铝、锌、铁等金属单质都会与稀硫酸反应,产生气泡,则向牛奶中加入稀硫酸,观察到有气泡产生不能验证牛奶中含有锌元素,故D错误。
故选:B。
10.D
【解析】
【详解】A、由题意可知,常温下溶解度为0.17g。取0.60g样品于锥形瓶中,氧化钙和水反应生成氢氧化钙,生成的氢氧化钙的质量>0.6g,向其中加入200mL蒸馏水,200g的水最多溶解0.34g的氢氧化钙,所以生成氢氧化钙不能完全溶解,步骤1中充分振荡后不能得到澄清透明的溶液,故A错误;
B、反应完全时锥形瓶内溶液红色恰好褪去,此时溶液呈中性,pH=7,则消耗 mL盐酸,故B错误;
C、步骤2中是氢氧化钙和稀盐酸反应生成氯化钙和水,化学反应方程式为,故C错误;
D、在该反应过程中,氢氧化钙和稀盐酸反应生成氯化钙和水,根据质量守恒定律可知,钙元素质量不变,则有,该样品中钙元素的质量分数为,故D正确。
故选D。
第Ⅱ卷共17小题,共110分。第21至25题为化学试题,第26至37题为物理试题。答案请按要求书写在答题卡上。
11.(1)①.氧原子##O ②.没有(2)①.电子数②.8
(3)①.+2价、-1价②.0 (4)
(5)冰交换到NaCl溶液中的水分子数目比NaCl溶液交换到冰中的水分子数目多
【解析】
【小问1详解】水分子是由氢原子和氧原子构成的;
液态水蒸发为水蒸气的过程中,没有新物质生成属于物理变化因此水分子本身没有改变;
【小问2详解】
①钠原子最外层电子数是1,化学反应时易失去一个电子转变为钠离子,发生变化的是电子数;
②如图原子核内质子数等于核外电子数,则17=2+x+7,x=8
【小问3详解】
化合物中元素化合价代数和为0,氯化镁中镁元素化合价为+2即啊,氯元素化合价为-1价;
【小问4详解】
质量守恒定律反应前后原子的种类和个数不变,反应前有1个Mg,2个Cl,反应后有1个Mg,故X的化学式是Cl2;
【小问5详解】
如图所示,冰交换到NaCl溶液中的水分子数目比NaCl溶液交换到冰中的水分子数目多,因此NaCl可用作雪天道路抗冻剂。
12.(1)
(2)搅拌;粉碎;加热;适当提高酸的浓度等
(3)防止分解
(4)①.化合②.温度高于450℃时,会分解成和O2
【解析】
【小问1详解】
加热条件下MnO2催化分解KClO3生成氯化钾和氧气,化学反应方程式为。故填:。
【小问2详解】
“酸浸”时,搅拌、粉碎、加热、适当提高酸的浓度等措施,都能使软锰矿充分反应。故填:搅拌;粉碎;加热;适当提高酸的浓度等。
【小问3详解】
由于反应物NH4HCO3受热易分解,所以为防止NH4HCO3分解,“沉锰”反应加热温度不能过高。故填:防止NH4HCO3分解。
【小问4详解】
①370~410℃发生主要反应为。该反应符合化合反应多变一的特征,所以该反应属于基本反应类型中的化合反应。故填:化合。
②酒精灯外焰的最高温度可达600℃以上。据图可知,温度高于450℃时,MnO2会分解成Mn2O3和O2,所以MnO2质量减少。故填:温度高于450℃时,MnO2会分解成Mn2O3和O2。
13.(1)①.混合物②.导热
(2)①.烛芯周围有液体产生②.
(3)①.氧气浓度降低,不再支持蜡烛燃烧;燃烧产生二氧化碳,将可燃物与氧气隔绝②.超疏水性材料隔绝了水、氧气与铁接触
【解析】
【小问1详解】
①蜡烛是由多种物质组成,属于混合物;
②将易拉罐置于冷水槽中,有助于液态石蜡凝固,这是利用了金属的导热性,使石蜡温度快速下降;
【小问2详解】
①蜡烛受热熔化成液体,能说明蜡烛燃烧时放出热量的现象是烛芯周围有液体产生;
②甲烷在空气中燃烧生成水和二氧化碳,正二十二烷()是石蜡的成分之一。正二十二烷完全燃烧的产物与甲烷的相同,正二十二烷完全燃烧生成二氧化碳和水,反应的化学反应方程式:;
【小问3详解】
①蜡烛燃烧是蜡烛与空气中氧气反应生成二氧化碳和水,燃着的蜡烛熄灭可能原因有氧气浓度降低,不再支持蜡烛燃烧;燃烧产生二氧化碳,将可燃物与氧气隔绝;
②根据“超疏水性,水滴在其表面不易附着聚集”可知,铁质水管覆盖超疏水性材料可提高水管的抗腐蚀性,其原理是超疏水性材料隔绝了水、氧气与铁的接触。
14.(1)
(2)常温、气体压强为101kPa时,SO2在水中溶解度较大
(3)①.C ②.减弱③.不正确,常压下,空气中CO2的压强达不到101kPa,无法形成CO2的饱和溶液
(4)向产生沉淀的试管中滴加过量的10%的盐酸,沉淀不消失
(5)出台政策鼓励企业自主减排;推广使用清洁能源,减少煤、石油等化石燃料的使用;扩大烟花爆竹禁放区域;淘汰旧标燃油机动车,推广新能源车等
(6)河床中的CaCO3能与酸反应,降低河流酸性
【解析】
【小问1详解】
图1装置中稀硫酸能与碳酸钠反应生产硫酸钠、二氧化碳和水,利用此反应可制取二氧化碳,反应的化学方程式为:;
【小问2详解】
在常温、气体压强为101kPa时,1体积水里最多能溶解大约40体积SO2,SO2在水中溶解度较大,因此不能用排水法收集SO2;
【小问3详解】
①测定pH时,要用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,再与标准比色卡对比来确定pH,因此操作时玻璃棒的作用为蘸取溶液,故选C;
②静置2h后,CO2水溶液的pH由3.94增大为4.12,pH增大,溶液酸性减弱;
③常压下,空气中CO2的压强达不到101kPa,无法形成CO2的饱和溶液,因此CO2不是造成酸雨的重要因素;
【小问4详解】
BaSO3能溶于浓度较大的盐酸,BaSO4不溶于盐酸,因此向产生沉淀的试管中滴加过量的10%的盐酸,沉淀不消失,说明沉淀中一定含有BaSO4;
【小问5详解】
煤燃烧排放的SO2可能导致酸雨,因此为降低SO2排放,可出台相关政策鼓励企业自主减排;推广使用清洁能源,减少煤、石油等化石燃料的使用;扩大烟花爆竹禁放区域;淘汰旧标燃油机动车,推广新能源车等;
【小问6详解】
石灰石河床的主要成分为碳酸钙,碳酸钙能与酸反应,降低河流酸性,因此河流受酸雨损害的程度较小。
15.(1)C
(2)①.②.0.3
解:设理论上1.0吨甲烷和足量水蒸气反应生成氢气的质量为x
答:理论上1.0吨甲烷和足量水蒸气反应生成氢气的质量为0.3吨。
【解析】
【小问1详解】
A、NH3中氮元素和氢元素质量比是
B、N2H4中氮元素和氢元素质量比是
C、CH4中碳元素和氢元素质量比是12:4=36:12;
故甲烷中氢元素质量分数最大,故选:C;
【小问2详解】
①根据题意,该反应是H2O和Ce2O3在400℃时反应生成CeO2和H2,化学方程式为:;
②根据化学方程式计算,见答案。
同课章节目录
