化学人教版(2019)必修第二册6.2化学反应与电能(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2化学反应与电能(共28张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 48.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-02 08:48:42 | ||
图片预览





文档简介
(共28张PPT)
§6.2 化学反应与电能
化学能
热能
化学能
电能
化学能
机械能
太阳能
化学能
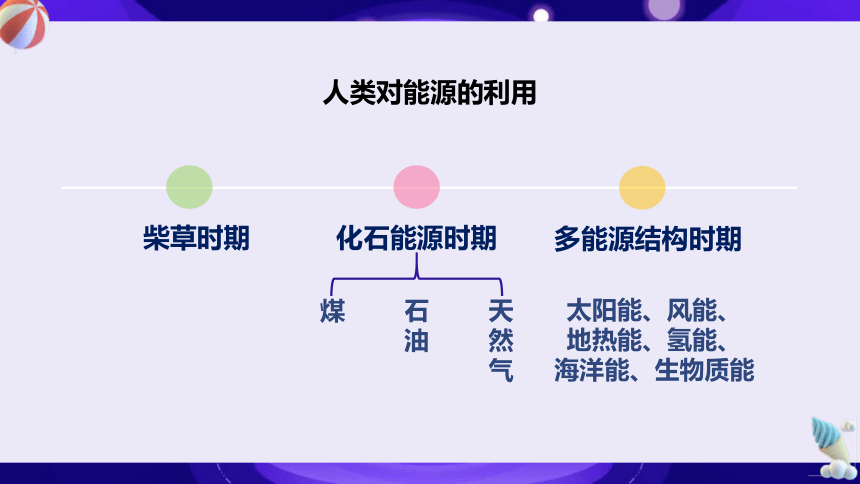
人类对能源的利用
柴草时期
化石能源时期
多能源结构时期
煤
石油
天然气
太阳能、风能、
地热能、氢能、
海洋能、生物质能
人类对能源的利用
人类对能源的利用
各式各样的电器
我们的生活很难离开电力
电是从哪里来的?
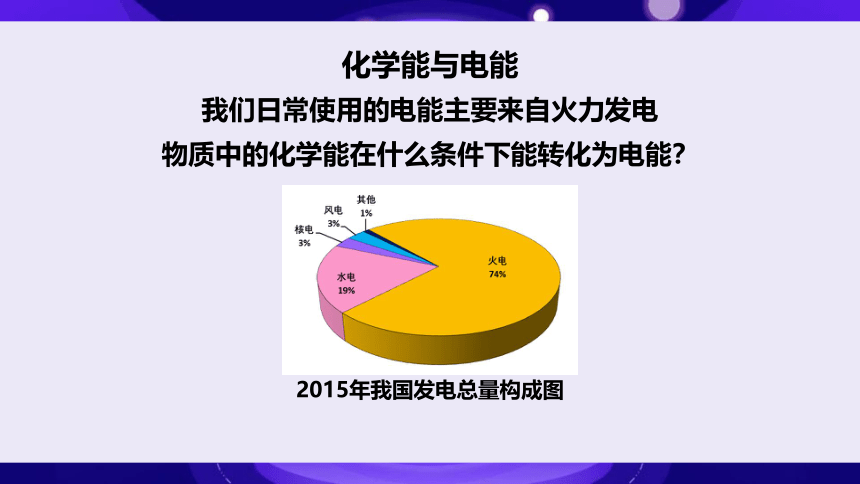
化学能与电能
我们日常使用的电能主要来自火力发电
2015年我国发电总量构成图
物质中的化学能在什么条件下能转化为电能?
蒸汽热能
机械能
燃料化学能
电能
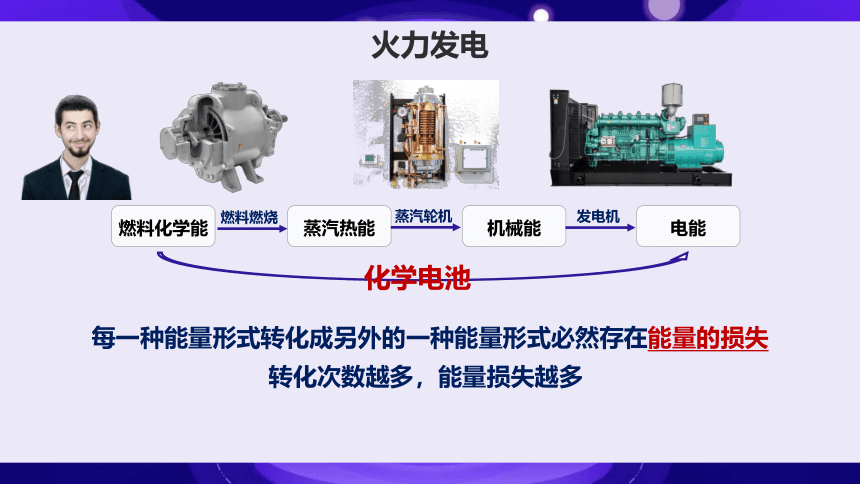
火力发电
每一种能量形式转化成另外的一种能量形式必然存在能量的损失
燃料燃烧
蒸汽轮机
发电机
转化次数越多,能量损失越多
化学电池
1799年意大利物理学家伏特发明了世界上第一个发电器,也就是电池组,伏特电堆开创了电学发展的新时代。
伏
特
电
堆
电池发展史
19世纪,英国化学家尼克尔森和卡莱尔利用伏特电池成功的电解了水,证明了水是由氢和氧两种元素组成的化合物。
英国化学家戴维,利用串联起来的伏特电池组,通过电解法发现了几种活泼的金属元素。比如金属钠和金属钾。
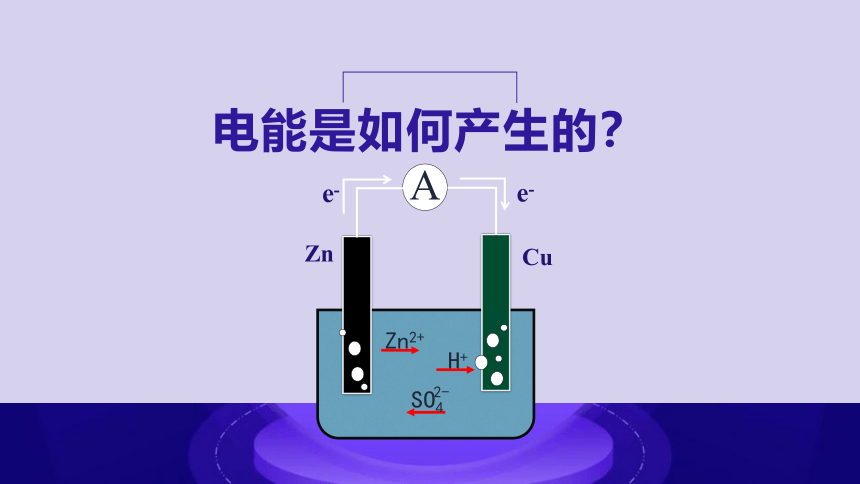
电能是如何产生的?
e-
e-
Cu
A
Zn
Zn2+
H+
SO4
2-
Zn
H2
Zn2+
H+
总反应:
操作1:将锌片放入稀硫酸中
SO42—
氧化反应:Zn – 2e- = Zn2+
现象:
①浸泡在稀硫酸中的锌逐渐溶解;
②浸泡在稀硫酸中的锌表面有大量气泡产生。
同时同地
(有点挤)
我要下去
让我上去占座
Zn
H2
Zn2+
H+
操作2:将锌片和铜片同时放入稀硫酸中
SO42—
现象:
Cu
浸泡在稀硫酸中的铜片表面无明显现象。
在同一电解质溶液中,
不同金属失去电子的能力是不一样的!
Zn
Zn2+
H+
操作3:将稀硫酸中的锌片和铜片用导线和电流计连接
SO42—
现象:
Cu
铜片上有气泡产生,串联的电流表指针发生偏转
思考:铜片上的氢气是如何产生的?
H2
A
铜片:
还原反应
锌片:
Zn – 2e- = Zn2+
氧化反应
e-
e-
这种把化学能转化为电能的装置
→原电池
Zn
Zn2+
H+
对比两组装置
SO42—
Cu
H2
A
还原反应
氧化反应
e-
e-
Zn
H2
Cu
Zn2+
H+
SO42—
Zn – 2e- = Zn2+
同时异地
(加快反应速率)
Zn
Zn2+
H+
原电池小结
SO42—
Cu
H2
A
e-
e-
铜片:
锌片:
Zn – 2e- = Zn2+
正极
得电子
还原反应
负极
失电子
氧化反应
电子流动方向:
负极→导线→正极
离子移动方向:
阳离子→正极
阴离子→负极
总反应:
电子不下水
离子不上岸
正正
负负
原电池的构成要素
同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题]影响自制电池效果的因素有哪些?
[查阅资源]电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究]Ⅰ.按如图连接水果电池。
原电池的构成要素
Ⅱ.实验记录如下:
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
原电池的构成要素
[反思与探讨]
(3)水果电池中,水果的作用是__________________。
(4)对比实验①②③可知构成水果电池的电极必须具备的条件为__________________________________,构成水果电池的其他要素还有___________________________、_________________、__________________。
提供电解质溶液
两极金属活动性不同
能自发进行的氧化还原反应
形成闭合回路
有电解质溶液
Zn
稀硫酸
Cu
A
Zn
酒精
Cu
A
电流表指针不偏转
原电池的构成要素一:离子导体和电子导体
Zn
稀硫酸
玻璃
A
Zn
稀硫酸
C
A
Zn
稀硫酸
Zn
A
电流表指针偏转
电流表指针不偏转
电流表指针不偏转
原电池的构成要素二:合适的电极材料
原电池的构成要素三:自发进行的氧化还原反应
2.合适的电极材料
(电极是氧化反应和还原反应分别进行的场所)
3.自发进行的氧化还原反应
1.电子导体(导线)和离子导体(电解质溶液或熔融电解质)
原电池的构成要素
简记:两极、一液、一线、一反应
下列装置中能够组成原电池的有哪些?其他不能构成原电池的请分别说明理由。
应用体验一
短路
Fe+Cu2+=Fe2++Cu
如图所示电流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C可以分别为Fe、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
应用体验二
C
如将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出
B.负极附近Cl-的浓度逐渐减小
C.正极附近Cl-的浓度逐渐增大
D.溶液中Cl-的浓度基本不变
应用体验三
D
(1)若a、b相连,a为负极。
(2)若c、d相连,d上有气泡逸出。
(3)若a、c相连时,a的质量减少。
(4)若b、d相连,b为正极。
把a、b、c、d 4种金属浸入到稀硫酸中,用导线两两相连可以组成各种原电池,请根据下列信息,判断四种金属的活动性顺序。
应用体验四
a > b
c > d
a > c
d > b
a > c>b>d
某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。试根据表中的实验现象回答下列问题:
应用体验五
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Al、Mg 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、C(石墨) 稀盐酸 偏向石墨
4 Al、Mg 氢氧化钠溶液 偏向Mg
5 Al、Zn 浓硝酸 偏向Al
(1)实验1、2中Al 所作的电极(正极或负极)是否相同?______(填“是”或“否”)。
(2)由实验3完成下列填空:
①铝为_____极,电极反应式:_______________________;
②石墨为_____极,电极反应式:_____________________;
③电池总反应式:__________________________。
(3)实验4中铝作负极还是正极?_______,
理由是___________________________________________________________。
写出铝电极的电极反应式:_______________________________________。
(4)解释实验5中电流表指针偏向铝的原因:___________________________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:__________________________________________。
应用体验五
否
负
2Al-6e-===2Al3+
正
6H++6e-===3H2↑
2Al+6H+===2Al3++3H2↑
负极
Al与NaOH溶液自发进行氧化还原反应,而Mg与NaOH溶液不反应
Al-3e-+4OH-===[Al(OH)4]—
①另一个电极材料的活动性;②电解质溶液
Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应被氧化,Al是原电池的正极
§6.2 化学反应与电能
化学能
热能
化学能
电能
化学能
机械能
太阳能
化学能
人类对能源的利用
柴草时期
化石能源时期
多能源结构时期
煤
石油
天然气
太阳能、风能、
地热能、氢能、
海洋能、生物质能
人类对能源的利用
人类对能源的利用
各式各样的电器
我们的生活很难离开电力
电是从哪里来的?
化学能与电能
我们日常使用的电能主要来自火力发电
2015年我国发电总量构成图
物质中的化学能在什么条件下能转化为电能?
蒸汽热能
机械能
燃料化学能
电能
火力发电
每一种能量形式转化成另外的一种能量形式必然存在能量的损失
燃料燃烧
蒸汽轮机
发电机
转化次数越多,能量损失越多
化学电池
1799年意大利物理学家伏特发明了世界上第一个发电器,也就是电池组,伏特电堆开创了电学发展的新时代。
伏
特
电
堆
电池发展史
19世纪,英国化学家尼克尔森和卡莱尔利用伏特电池成功的电解了水,证明了水是由氢和氧两种元素组成的化合物。
英国化学家戴维,利用串联起来的伏特电池组,通过电解法发现了几种活泼的金属元素。比如金属钠和金属钾。
电能是如何产生的?
e-
e-
Cu
A
Zn
Zn2+
H+
SO4
2-
Zn
H2
Zn2+
H+
总反应:
操作1:将锌片放入稀硫酸中
SO42—
氧化反应:Zn – 2e- = Zn2+
现象:
①浸泡在稀硫酸中的锌逐渐溶解;
②浸泡在稀硫酸中的锌表面有大量气泡产生。
同时同地
(有点挤)
我要下去
让我上去占座
Zn
H2
Zn2+
H+
操作2:将锌片和铜片同时放入稀硫酸中
SO42—
现象:
Cu
浸泡在稀硫酸中的铜片表面无明显现象。
在同一电解质溶液中,
不同金属失去电子的能力是不一样的!
Zn
Zn2+
H+
操作3:将稀硫酸中的锌片和铜片用导线和电流计连接
SO42—
现象:
Cu
铜片上有气泡产生,串联的电流表指针发生偏转
思考:铜片上的氢气是如何产生的?
H2
A
铜片:
还原反应
锌片:
Zn – 2e- = Zn2+
氧化反应
e-
e-
这种把化学能转化为电能的装置
→原电池
Zn
Zn2+
H+
对比两组装置
SO42—
Cu
H2
A
还原反应
氧化反应
e-
e-
Zn
H2
Cu
Zn2+
H+
SO42—
Zn – 2e- = Zn2+
同时异地
(加快反应速率)
Zn
Zn2+
H+
原电池小结
SO42—
Cu
H2
A
e-
e-
铜片:
锌片:
Zn – 2e- = Zn2+
正极
得电子
还原反应
负极
失电子
氧化反应
电子流动方向:
负极→导线→正极
离子移动方向:
阳离子→正极
阴离子→负极
总反应:
电子不下水
离子不上岸
正正
负负
原电池的构成要素
同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
[提出问题]影响自制电池效果的因素有哪些?
[查阅资源]电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
[实验探究]Ⅰ.按如图连接水果电池。
原电池的构成要素
Ⅱ.实验记录如下:
序号 电极 电极间距 水果种类 电流表示数(μA)
① Cu—Al 2.0 cm 西红柿 78.5
② Cu—Fe 2.0 cm 西红柿 70.3
③ Al—Al 2.0 cm 西红柿 0
④ Cu—Al 2.0 cm 柠檬 45.7
⑤ Cu—Al 1.0 cm 柠檬 98.4
⑥ 石墨棒—Al 1.0 cm 柠檬 104.5
原电池的构成要素
[反思与探讨]
(3)水果电池中,水果的作用是__________________。
(4)对比实验①②③可知构成水果电池的电极必须具备的条件为__________________________________,构成水果电池的其他要素还有___________________________、_________________、__________________。
提供电解质溶液
两极金属活动性不同
能自发进行的氧化还原反应
形成闭合回路
有电解质溶液
Zn
稀硫酸
Cu
A
Zn
酒精
Cu
A
电流表指针不偏转
原电池的构成要素一:离子导体和电子导体
Zn
稀硫酸
玻璃
A
Zn
稀硫酸
C
A
Zn
稀硫酸
Zn
A
电流表指针偏转
电流表指针不偏转
电流表指针不偏转
原电池的构成要素二:合适的电极材料
原电池的构成要素三:自发进行的氧化还原反应
2.合适的电极材料
(电极是氧化反应和还原反应分别进行的场所)
3.自发进行的氧化还原反应
1.电子导体(导线)和离子导体(电解质溶液或熔融电解质)
原电池的构成要素
简记:两极、一液、一线、一反应
下列装置中能够组成原电池的有哪些?其他不能构成原电池的请分别说明理由。
应用体验一
短路
Fe+Cu2+=Fe2++Cu
如图所示电流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C可以分别为Fe、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
应用体验二
C
如将铁片和银片用导线连接置于同一稀盐酸中,经过一段时间后,下列叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出
B.负极附近Cl-的浓度逐渐减小
C.正极附近Cl-的浓度逐渐增大
D.溶液中Cl-的浓度基本不变
应用体验三
D
(1)若a、b相连,a为负极。
(2)若c、d相连,d上有气泡逸出。
(3)若a、c相连时,a的质量减少。
(4)若b、d相连,b为正极。
把a、b、c、d 4种金属浸入到稀硫酸中,用导线两两相连可以组成各种原电池,请根据下列信息,判断四种金属的活动性顺序。
应用体验四
a > b
c > d
a > c
d > b
a > c>b>d
某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。试根据表中的实验现象回答下列问题:
应用体验五
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Al、Mg 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、C(石墨) 稀盐酸 偏向石墨
4 Al、Mg 氢氧化钠溶液 偏向Mg
5 Al、Zn 浓硝酸 偏向Al
(1)实验1、2中Al 所作的电极(正极或负极)是否相同?______(填“是”或“否”)。
(2)由实验3完成下列填空:
①铝为_____极,电极反应式:_______________________;
②石墨为_____极,电极反应式:_____________________;
③电池总反应式:__________________________。
(3)实验4中铝作负极还是正极?_______,
理由是___________________________________________________________。
写出铝电极的电极反应式:_______________________________________。
(4)解释实验5中电流表指针偏向铝的原因:___________________________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:__________________________________________。
应用体验五
否
负
2Al-6e-===2Al3+
正
6H++6e-===3H2↑
2Al+6H+===2Al3++3H2↑
负极
Al与NaOH溶液自发进行氧化还原反应,而Mg与NaOH溶液不反应
Al-3e-+4OH-===[Al(OH)4]—
①另一个电极材料的活动性;②电解质溶液
Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应被氧化,Al是原电池的正极
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
