安徽省安徽师范大学附属中学2023-2024学年高二下学期4月测试化学试题(含答案)
文档属性
| 名称 | 安徽省安徽师范大学附属中学2023-2024学年高二下学期4月测试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 981.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-02 16:24:41 | ||
图片预览


文档简介
安徽师范大学附属中学2023-2024学年高二下学期4月测试
化学试题
2024.04.01
已知部分原子的相对原子质量:C 12;O 16;Ca 40;Ga 70;As 75
第I卷(选择题)
一、单选题(本大题共16个小题,每小题4分,满分64分。在每小题给出的四个选项中,只有一个正确选项。)
1.三星堆两次考古挖掘举世震惊,二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化、青铜艺术史上的诸多空白。下列有关说法错误的是( )
A.铜元素位于周期表的ds区
B.与铜元素最外层电子数相同的前四周期元素还有四种
C.测定出土文物年代的是C的一种核素
D.青铜中含有的锡的价电子排布式为:
2.氢元素及其化合物在自然界广泛存在且具有重要应用。、、是氢元素的3种核素,基态H原子的核外电子排布,使得H既可以形成又可以形成,还能形成、、、、等重要化合物,下列说法正确的是( )
A.、、互为同素异形体
B.分子中的化学键均为极性共价键
C.和的中心原子轨道杂化类型相同
D.晶体中存在Ca与之间的强烈相互作用
3.下列化学用语或表述正确的是( )
A.沸点:对羟基苯甲醛邻羟基苯甲醛 B.硅原子轨道电子云图:
C.酸性: D.基态Se的简化电子排布式为:
4.关于反应,下列说法正确的是( )
A.属于非极性分子 B.分子间的范德华力强于氢键
C.的VSEPR模型和空间结构一致 D.HClO的电子式为
5.下列事实与解释不对应的是( )
选项 事实 解释
A 第一电离能: Na与K位于同一主族,原子半径:,原子核对外层电子的吸引能力:
B 晶体中每个分子紧邻的分子数:硫化氢晶体(12个)冰(4个) 冰中水分子间主要以氢键结合,硫化氢晶体中硫化氢分子间主要以范德华力结合
C 分子的极性: N—H键的极性大于C—H键的极性
D 熔点: 属于离子晶体,属于分子晶体
A.A B.B C.C D.D
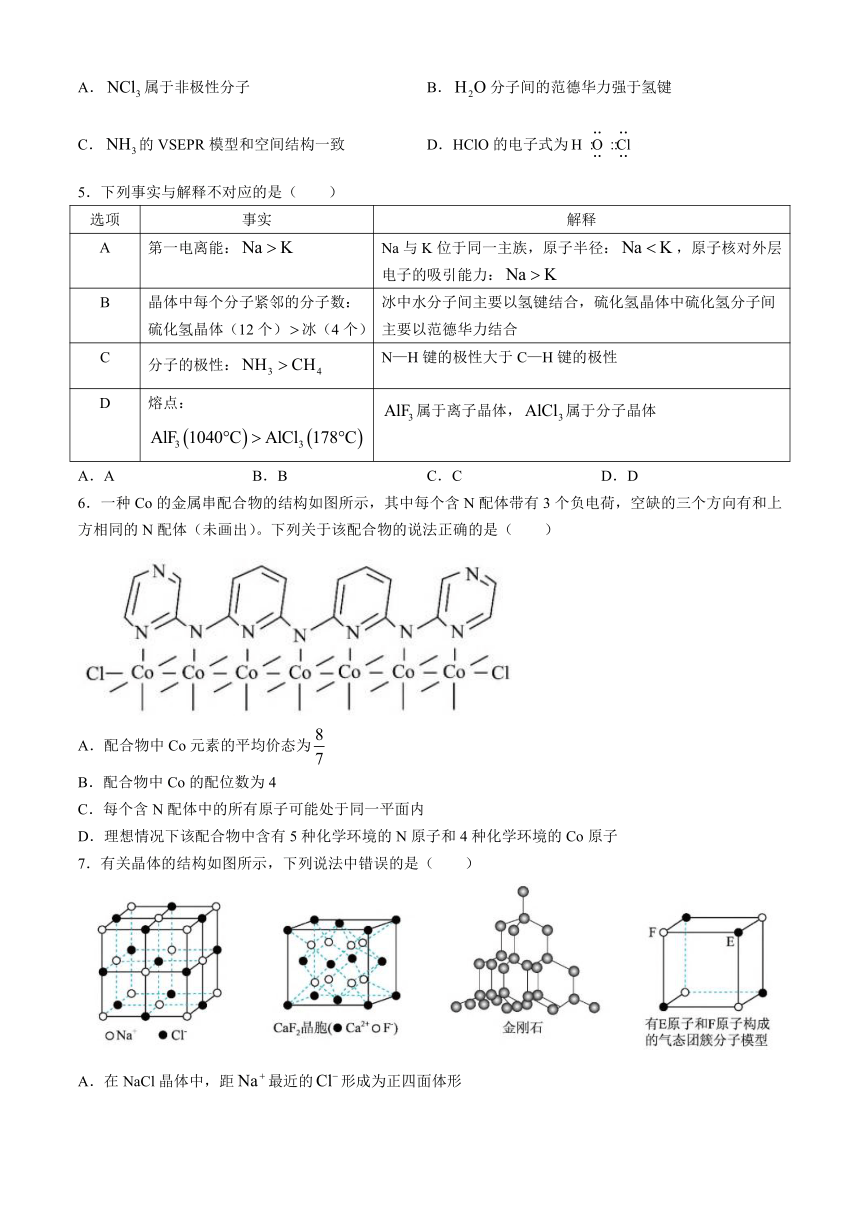
6.一种Co的金属串配合物的结构如图所示,其中每个含N配体带有3个负电荷,空缺的三个方向有和上方相同的N配体(未画出)。下列关于该配合物的说法正确的是( )
A.配合物中Co元素的平均价态为
B.配合物中Co的配位数为4
C.每个含N配体中的所有原子可能处于同一平面内
D.理想情况下该配合物中含有5种化学环境的N原子和4种化学环境的Co原子
7.有关晶体的结构如图所示,下列说法中错误的是( )
A.在NaCl晶体中,距最近的形成为正四面体形
B.在晶体中,每个晶胞平均占有4个
C.在金刚石晶体中,碳原子与碳碳键个数的比为
D.该气态团簇分子的分子式为或
8.X、Y、Z和W为原子序数依次增大的短周期主族元素,X、Z同主族且能形成离子化合物,Y的最外层电子数是X、Z质子数之和的一半,W原子的核外电子数为偶数。四种元素组成的一种化合物M具有下列性质:白色沉淀溶液褪色并产生气泡。下列说法正确的是( )
A.原子半径: B.M使溴水褪色体现其氧化性
C.Y与X、Z、W均能形成具有漂白性的物质 D.单质的氧化性:
9.氮化钛为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。TiN晶体的晶胞结构如图所示(白球代表N,黑球代表Ti)。已知a点原子的分数坐标为。下列说法正确的是( )
A.基态Ti原子的价层电子排布式为
B.晶体中距离N最近的N有6个
C.该晶胞中含有6个Ti原子和4个N原子
D.该晶胞中b点原子的分数坐标为
10.某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是( )
A.W与X的化合物为极性分子 B.第一电离能
C.Q的氧化物是两性氧化物 D.该阴离子中含有配位键
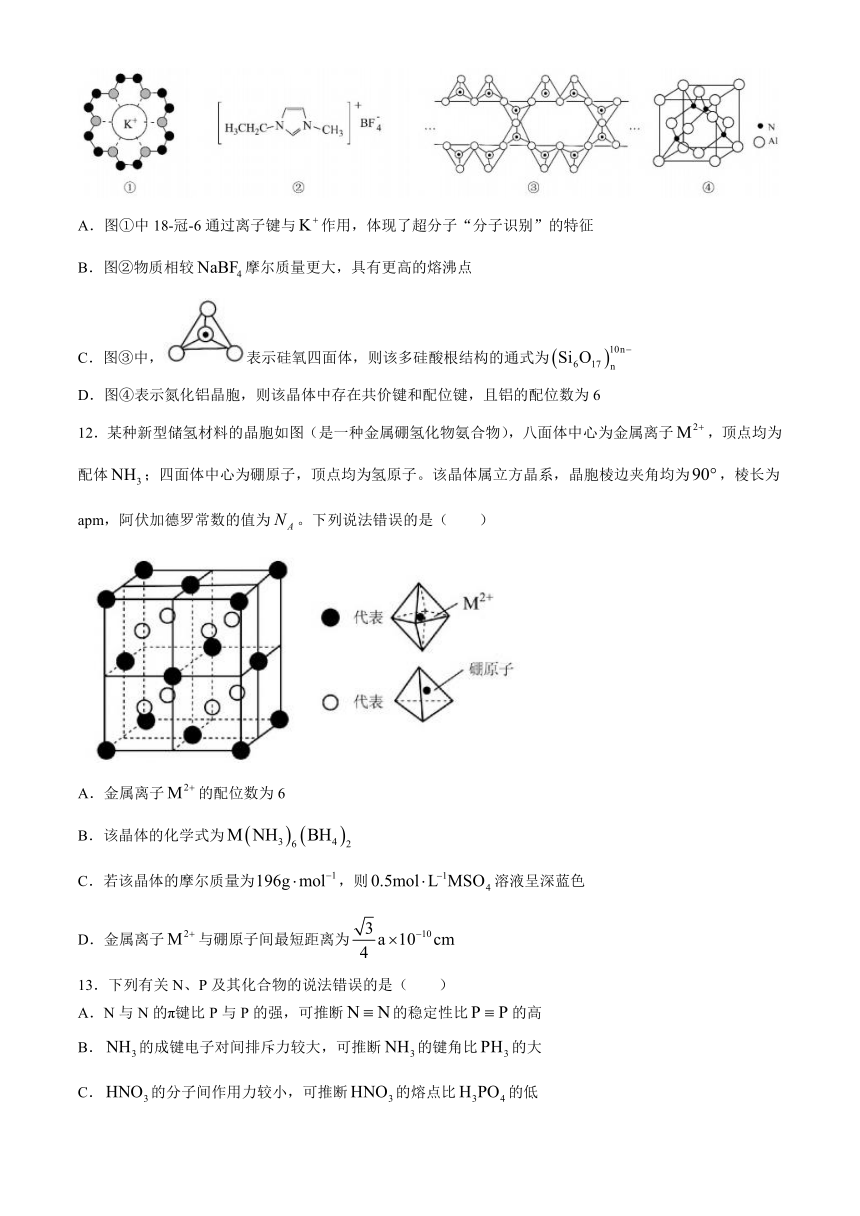
11.下列有关物质结构的说法正确的是( )
A.图①中18-冠-6通过离子键与作用,体现了超分子“分子识别”的特征
B.图②物质相较摩尔质量更大,具有更高的熔沸点
C.图③中,表示硅氧四面体,则该多硅酸根结构的通式为
D.图④表示氮化铝晶胞,则该晶体中存在共价键和配位键,且铝的配位数为6
12.某种新型储氢材料的晶胞如图(是一种金属硼氢化物氨合物),八面体中心为金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。该晶体属立方晶系,晶胞棱边夹角均为,棱长为apm,阿伏加德罗常数的值为。下列说法错误的是( )
A.金属离子的配位数为6
B.该晶体的化学式为
C.若该晶体的摩尔质量为,则溶液呈深蓝色
D.金属离子与硼原子间最短距离为
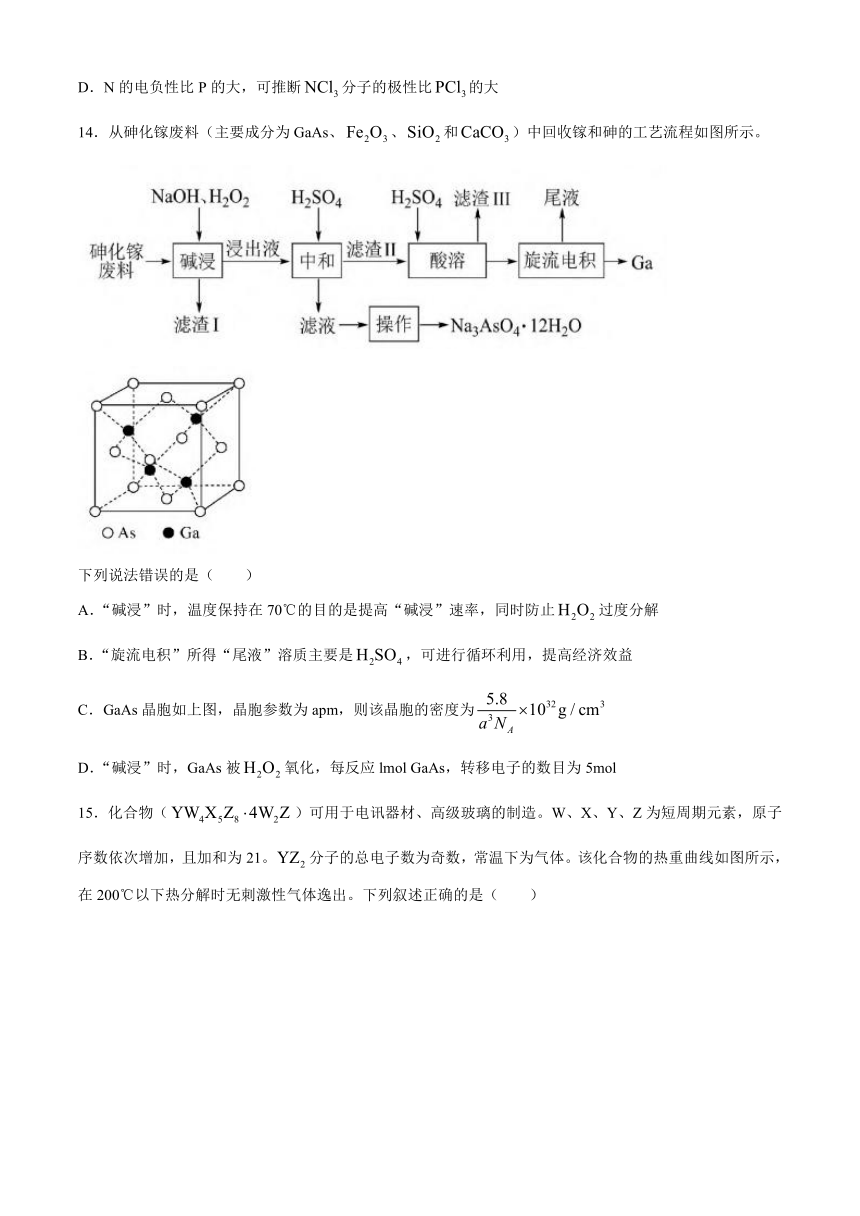
13.下列有关N、P及其化合物的说法错误的是( )
A.N与N的π键比P与P的强,可推断的稳定性比的高
B.的成键电子对间排斥力较大,可推断的键角比的大
C.的分子间作用力较小,可推断的熔点比的低
D.N的电负性比P的大,可推断分子的极性比的大
14.从砷化镓废料(主要成分为GaAs、、和)中回收镓和砷的工艺流程如图所示。
下列说法错误的是( )
A.“碱浸”时,温度保持在70℃的目的是提高“碱浸”速率,同时防止过度分解
B.“旋流电积”所得“尾液”溶质主要是,可进行循环利用,提高经济效益
C.GaAs晶胞如上图,晶胞参数为apm,则该晶胞的密度为
D.“碱浸”时,GaAs被氧化,每反应lmol GaAs,转移电子的数目为5mol
15.化合物()可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物的酸性:
C.100~200℃阶段热分解失去4个
D.500℃热分解后生成固体化合物
16.烟气脱硫可有效减少引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知25℃时,几种酸的电离常数:,,,,(乳酸)。研究发现:乳酸和乙醇胺()作用得到的离子液体——乙醇胺乳酸盐([MEA]L),既可脱硫,也可吸收。下列说法错误的是( )
A.液态时的导电性:乳酸
B.乳酸和乙醇胺中均含有σ键、π键和氢键
C.是直线形非极性分子,是V形极性分子
D.相同条件下,[MEA]L能吸收气体的体积:
二、非选择题(本大题共2个小题,满分36分,其中17题16分,18题20分。)
17.(每空2分)钢渣是钢铁行业的固体废弃物,含有、、FeO、和等物质。一种以钢渣粉为原料固定并制备的工艺流程如图所示。
已知在稀盐酸和混合溶液中不易被浸出。回答下列问题:
(1)V的价层电子轨道表示式为________;它位于元素周期表的________区。
(2)浸出过程1不使用稀硫酸代替稀盐酸的原因是________;
(3)为避免引入杂质离子,氧化剂A应为________(举1例)。
(4)滤液C的溶质可循环利用,试剂B应为________。
(5)富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随pH变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为________。该培烧反应的化学方程式是________________________。
(6)微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知,,,,该晶体密度为________(列出计算式,阿伏加德罗常数的值为)。
18.(每空2分)元素化学是化学的基石,不同的元素往往呈现出五彩缤纷的特性。回答下列问题:
(1)、、的沸点由高到低的顺序为________,还原性由强到弱的顺序为________。
(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:_。
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是_。
A. B. C. D.
(4)已知,的N原子杂化方式为________;比较键角:中的________中的(填“”、“”或“”),请说明理由________。
(5)的晶体结构可以看成I型结构和II型结构的组合,已知I型结构中As原子在内部,每个I型和II型结构可近似为边长相等的立方体。一个的晶胞中I型结构和II型结构的比例是________;
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如左图,沿x、y、z轴方向的投影均为右图。
①X的化学式为________。
②设X的最简式的式量为,晶体密度为,则化合物X中相邻K之间的最短距离为________nm(列出计算式,阿伏伽德罗常数的值为)。
参考答案
一、选择题(每题4分)
1-5:BCBDC 6-10:DACDA 11-16:CCDDDB
二、填空题(每空2分)
17、
(1) d区
(2)稀硫酸与反应形成微溶于水的覆盖在钢渣表面,阻碍反应物向钢渣扩散
(3)或氯水(任意答对1个即可)
(4)氨水
(5)
(6)
18、(1)、、 、、
(2)
(3)AD(选对一个得1分,错选不得分)
(4)有孤电子对,孤电子对对成键电子排斥力大,键角变小
(5)
(6)
化学试题
2024.04.01
已知部分原子的相对原子质量:C 12;O 16;Ca 40;Ga 70;As 75
第I卷(选择题)
一、单选题(本大题共16个小题,每小题4分,满分64分。在每小题给出的四个选项中,只有一个正确选项。)
1.三星堆两次考古挖掘举世震惊,二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化、青铜艺术史上的诸多空白。下列有关说法错误的是( )
A.铜元素位于周期表的ds区
B.与铜元素最外层电子数相同的前四周期元素还有四种
C.测定出土文物年代的是C的一种核素
D.青铜中含有的锡的价电子排布式为:
2.氢元素及其化合物在自然界广泛存在且具有重要应用。、、是氢元素的3种核素,基态H原子的核外电子排布,使得H既可以形成又可以形成,还能形成、、、、等重要化合物,下列说法正确的是( )
A.、、互为同素异形体
B.分子中的化学键均为极性共价键
C.和的中心原子轨道杂化类型相同
D.晶体中存在Ca与之间的强烈相互作用
3.下列化学用语或表述正确的是( )
A.沸点:对羟基苯甲醛邻羟基苯甲醛 B.硅原子轨道电子云图:
C.酸性: D.基态Se的简化电子排布式为:
4.关于反应,下列说法正确的是( )
A.属于非极性分子 B.分子间的范德华力强于氢键
C.的VSEPR模型和空间结构一致 D.HClO的电子式为
5.下列事实与解释不对应的是( )
选项 事实 解释
A 第一电离能: Na与K位于同一主族,原子半径:,原子核对外层电子的吸引能力:
B 晶体中每个分子紧邻的分子数:硫化氢晶体(12个)冰(4个) 冰中水分子间主要以氢键结合,硫化氢晶体中硫化氢分子间主要以范德华力结合
C 分子的极性: N—H键的极性大于C—H键的极性
D 熔点: 属于离子晶体,属于分子晶体
A.A B.B C.C D.D
6.一种Co的金属串配合物的结构如图所示,其中每个含N配体带有3个负电荷,空缺的三个方向有和上方相同的N配体(未画出)。下列关于该配合物的说法正确的是( )
A.配合物中Co元素的平均价态为
B.配合物中Co的配位数为4
C.每个含N配体中的所有原子可能处于同一平面内
D.理想情况下该配合物中含有5种化学环境的N原子和4种化学环境的Co原子
7.有关晶体的结构如图所示,下列说法中错误的是( )
A.在NaCl晶体中,距最近的形成为正四面体形
B.在晶体中,每个晶胞平均占有4个
C.在金刚石晶体中,碳原子与碳碳键个数的比为
D.该气态团簇分子的分子式为或
8.X、Y、Z和W为原子序数依次增大的短周期主族元素,X、Z同主族且能形成离子化合物,Y的最外层电子数是X、Z质子数之和的一半,W原子的核外电子数为偶数。四种元素组成的一种化合物M具有下列性质:白色沉淀溶液褪色并产生气泡。下列说法正确的是( )
A.原子半径: B.M使溴水褪色体现其氧化性
C.Y与X、Z、W均能形成具有漂白性的物质 D.单质的氧化性:
9.氮化钛为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。TiN晶体的晶胞结构如图所示(白球代表N,黑球代表Ti)。已知a点原子的分数坐标为。下列说法正确的是( )
A.基态Ti原子的价层电子排布式为
B.晶体中距离N最近的N有6个
C.该晶胞中含有6个Ti原子和4个N原子
D.该晶胞中b点原子的分数坐标为
10.某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是( )
A.W与X的化合物为极性分子 B.第一电离能
C.Q的氧化物是两性氧化物 D.该阴离子中含有配位键
11.下列有关物质结构的说法正确的是( )
A.图①中18-冠-6通过离子键与作用,体现了超分子“分子识别”的特征
B.图②物质相较摩尔质量更大,具有更高的熔沸点
C.图③中,表示硅氧四面体,则该多硅酸根结构的通式为
D.图④表示氮化铝晶胞,则该晶体中存在共价键和配位键,且铝的配位数为6
12.某种新型储氢材料的晶胞如图(是一种金属硼氢化物氨合物),八面体中心为金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。该晶体属立方晶系,晶胞棱边夹角均为,棱长为apm,阿伏加德罗常数的值为。下列说法错误的是( )
A.金属离子的配位数为6
B.该晶体的化学式为
C.若该晶体的摩尔质量为,则溶液呈深蓝色
D.金属离子与硼原子间最短距离为
13.下列有关N、P及其化合物的说法错误的是( )
A.N与N的π键比P与P的强,可推断的稳定性比的高
B.的成键电子对间排斥力较大,可推断的键角比的大
C.的分子间作用力较小,可推断的熔点比的低
D.N的电负性比P的大,可推断分子的极性比的大
14.从砷化镓废料(主要成分为GaAs、、和)中回收镓和砷的工艺流程如图所示。
下列说法错误的是( )
A.“碱浸”时,温度保持在70℃的目的是提高“碱浸”速率,同时防止过度分解
B.“旋流电积”所得“尾液”溶质主要是,可进行循环利用,提高经济效益
C.GaAs晶胞如上图,晶胞参数为apm,则该晶胞的密度为
D.“碱浸”时,GaAs被氧化,每反应lmol GaAs,转移电子的数目为5mol
15.化合物()可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物的酸性:
C.100~200℃阶段热分解失去4个
D.500℃热分解后生成固体化合物
16.烟气脱硫可有效减少引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知25℃时,几种酸的电离常数:,,,,(乳酸)。研究发现:乳酸和乙醇胺()作用得到的离子液体——乙醇胺乳酸盐([MEA]L),既可脱硫,也可吸收。下列说法错误的是( )
A.液态时的导电性:乳酸
B.乳酸和乙醇胺中均含有σ键、π键和氢键
C.是直线形非极性分子,是V形极性分子
D.相同条件下,[MEA]L能吸收气体的体积:
二、非选择题(本大题共2个小题,满分36分,其中17题16分,18题20分。)
17.(每空2分)钢渣是钢铁行业的固体废弃物,含有、、FeO、和等物质。一种以钢渣粉为原料固定并制备的工艺流程如图所示。
已知在稀盐酸和混合溶液中不易被浸出。回答下列问题:
(1)V的价层电子轨道表示式为________;它位于元素周期表的________区。
(2)浸出过程1不使用稀硫酸代替稀盐酸的原因是________;
(3)为避免引入杂质离子,氧化剂A应为________(举1例)。
(4)滤液C的溶质可循环利用,试剂B应为________。
(5)富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随pH变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为________。该培烧反应的化学方程式是________________________。
(6)微细碳酸钙广泛应用于医药、食品等领域,某种碳酸钙晶胞如图所示。已知,,,,该晶体密度为________(列出计算式,阿伏加德罗常数的值为)。
18.(每空2分)元素化学是化学的基石,不同的元素往往呈现出五彩缤纷的特性。回答下列问题:
(1)、、的沸点由高到低的顺序为________,还原性由强到弱的顺序为________。
(2)H、B、N、F四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:_。
(3)金元素形成的部分离子氧化性很强,化学家们推测可能和“6s惰性电子对”效应有关,即失去6s电子对的离子会具有很强的氧化性。下列选项中具有此效应的离子是_。
A. B. C. D.
(4)已知,的N原子杂化方式为________;比较键角:中的________中的(填“”、“”或“”),请说明理由________。
(5)的晶体结构可以看成I型结构和II型结构的组合,已知I型结构中As原子在内部,每个I型和II型结构可近似为边长相等的立方体。一个的晶胞中I型结构和II型结构的比例是________;
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如左图,沿x、y、z轴方向的投影均为右图。
①X的化学式为________。
②设X的最简式的式量为,晶体密度为,则化合物X中相邻K之间的最短距离为________nm(列出计算式,阿伏伽德罗常数的值为)。
参考答案
一、选择题(每题4分)
1-5:BCBDC 6-10:DACDA 11-16:CCDDDB
二、填空题(每空2分)
17、
(1) d区
(2)稀硫酸与反应形成微溶于水的覆盖在钢渣表面,阻碍反应物向钢渣扩散
(3)或氯水(任意答对1个即可)
(4)氨水
(5)
(6)
18、(1)、、 、、
(2)
(3)AD(选对一个得1分,错选不得分)
(4)有孤电子对,孤电子对对成键电子排斥力大,键角变小
(5)
(6)
同课章节目录
