2024年化学 中考 第4讲 水和溶液(含答案)
文档属性
| 名称 | 2024年化学 中考 第4讲 水和溶液(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 991.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-02 23:06:14 | ||
图片预览


文档简介
第4讲 水和溶液
命题点1 自然界的水
1. 下列说法正确的是( )
A.地球上的水资源取之不尽、用之不竭
B.水体有自净能力,无需担心污染问题
C.为了保护水资源,应禁止使用农药或化肥
D.水中氮、磷等过多会造成水体富营养化
2.(易错易混)下列有关说法错误的是( )
A.软水中一定不含钙镁化合物
B.长期饮用蒸馏水不利于身体健康
C.单一操作相对净化程度较高的是蒸馏
D.自来水厂用沉淀、过滤、吸附、杀菌消毒方法净水
[知识逐点过]
1.爱护水资源
原因 地球上总水储量很大,但可利用的淡水资源有限
措施 节约用水 生活上:一水多用,如用淘米水浇花等 农业上:改大水漫灌为喷灌、滴灌等 工业上:使用新技术、改革工艺、循环利用水等 国家节水标志
防治水体污染 生活上:生活污水逐步实现集中处理和排放 农业上:提倡使用农家肥,合理使用农药、化肥 工业上:工业废水处理达标后再排放
2.水的净化方法
方法 作用
沉淀 加入絮凝剂(明矾),使水中悬浮的不溶性杂质沉降下来
过滤 除去水中的________杂质
吸附 利用活性炭的________性除去水中的色素和异味
杀菌消毒 加入杀菌剂(漂白粉、ClO2等)除去水中的病毒和细菌
蒸馏 除去水中所有杂质(净化程度最高)
【备考补充】自来水生产流程:取水→沉淀→过滤→吸附→消毒→配水
3.硬水和软水
硬水 软水
概念 含较多可溶性钙、镁化合物的水 不含或含较少可溶性钙、镁化合物的水
鉴别 取水样,加入等量的______,振荡,产生泡沫较多、浮渣较少的是______;产生泡沫较少、浮渣较多的是______
降低水的硬度 生活中:________;实验室:________
4.水的组成
(1)氢气的性质及用途:①物理性质:无色、无味的气体,密度比空气________,难溶于水。
②化学性质:a.可燃性:氢气燃烧,产生________火焰,放热,反应的化学方程式为________________________,常用作燃料;b.还原性:氢气还原氧化铜,观察到黑色固体变为红色,反应的化学方程式为______________,常用于冶炼金属。
(2)探究水的组成
[教材实验到重难考法]
实验2 探究水的组成
例 1 实验课上,甲、乙两组同学分别在老师的指导下进行如下两组实验,探究水的组成。
(人教上P79图4-24) (人教上P80图4-25)
图1 图2
[教材基础要点巩固]
甲组:利用氢气燃烧探究水的组成,如图1所示。
【反应原理】
(1)实验中发生反应的化学方程式为__________________________。
【实验操作及现象】
(2)在带尖嘴的导管口点燃纯净的氢气,观察到纯净的氢气在空气中燃烧发出_______火焰,烧杯内壁_______。
乙组:利用电解水探究水的组成,如图2所示。
【反应原理】
(3)实验中发生反应的化学方程式为____________________。
【实验现象】
(4)实验接通电源后,可观察到两个电极均有________产生,一段时间后玻璃管a、b中产生气体的体积比约为________。
【产物检验】
(5)同学们将燃着的木条分别靠近a、b玻璃管尖嘴处,a管口观察到的现象为____________________,说明气体为____;b管口观察到的现象为__________________,说明气体为________。
【甲、乙组实验的结论及拓展】
(6)图1、图2两组实验均可证明水由________组成;实验中玻璃管a、b中产生气体的质量比约为____。
[重难考法提升]
实验结束后,甲、乙两组同学对乙组的实验进行进一步探究。
考法1 误差分析
(7)某同学用碳棒作电极进行电解水实验,测得正负极产生的气体的体积比略小于理论值,对产生此现象原因的猜想不合理的是______(填字母)。
A.部分氧气溶于水 B.部分氧气与电极反应
C.部分氧气与氢气反应重新生成了水
考法2 定量分析
(8)已知图2实验产生气体的体积比,要确定水分子中氢、氧原子个数比,还需要的数据有______ (填字母)。
a.水的相对分子质量 b.氢气、氧气的密度 c.氢原子、氧原子的质量
考法3 微观分析
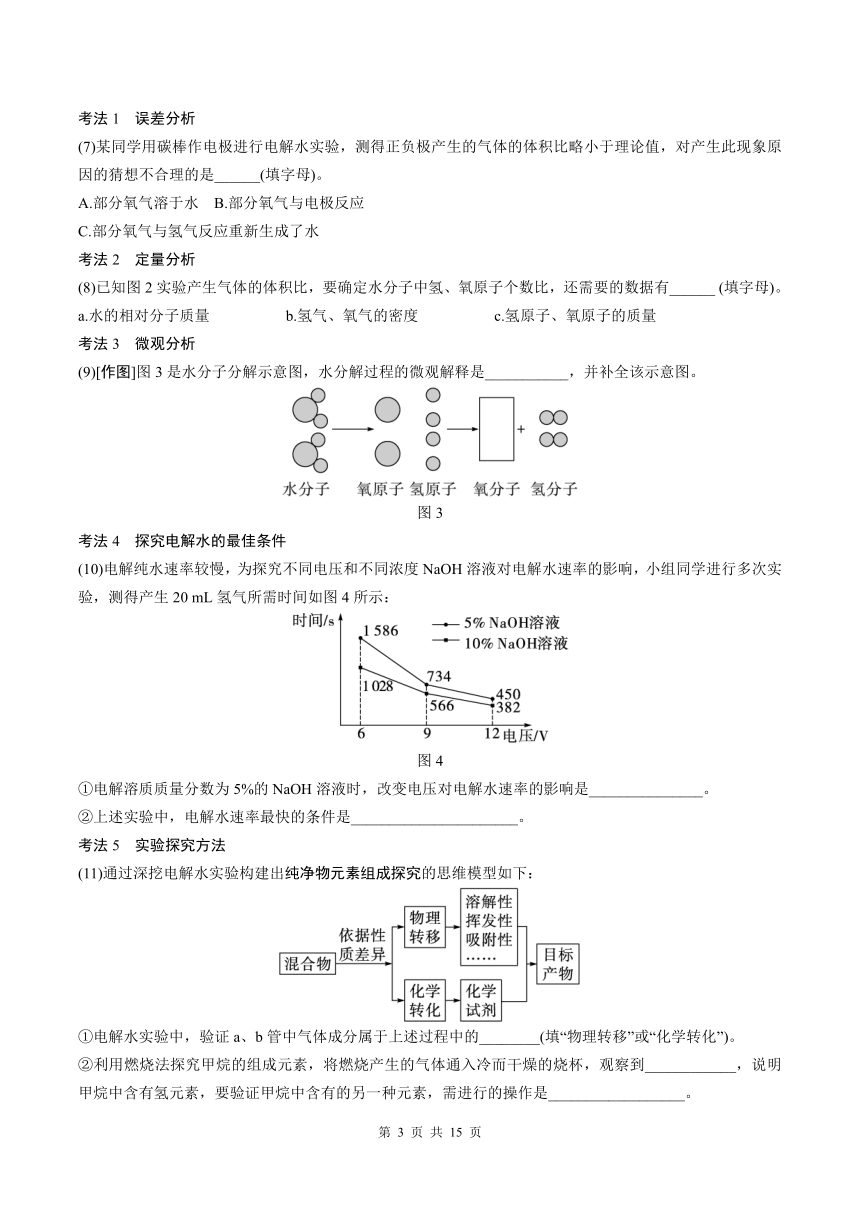
(9)[作图]图3是水分子分解示意图,水分解过程的微观解释是___________,并补全该示意图。
图3
考法4 探究电解水的最佳条件
(10)电解纯水速率较慢,为探究不同电压和不同浓度NaOH溶液对电解水速率的影响,小组同学进行多次实验,测得产生20 mL氢气所需时间如图4所示:
图4
①电解溶质质量分数为5%的NaOH溶液时,改变电压对电解水速率的影响是_______________。
②上述实验中,电解水速率最快的条件是______________________。
考法5 实验探究方法
(11)通过深挖电解水实验构建出纯净物元素组成探究的思维模型如下:
①电解水实验中,验证a、b管中气体成分属于上述过程中的________(填“物理转移”或“化学转化”)。
②利用燃烧法探究甲烷的组成元素,将燃烧产生的气体通入冷而干燥的烧杯,观察到____________,说明甲烷中含有氢元素,要验证甲烷中含有的另一种元素,需进行的操作是__________________。
[实验整合——与水有关的实验]
[分析]
水在初中化学实验中用途广泛,包括①作反应物;②作溶剂;③作洗涤剂;④作润滑剂;⑤作冷却剂;⑥作吸收剂;⑦热水提供热量;⑧隔绝空气或氧气等。将与水有关的实验整合对比分析,提高复习效率。
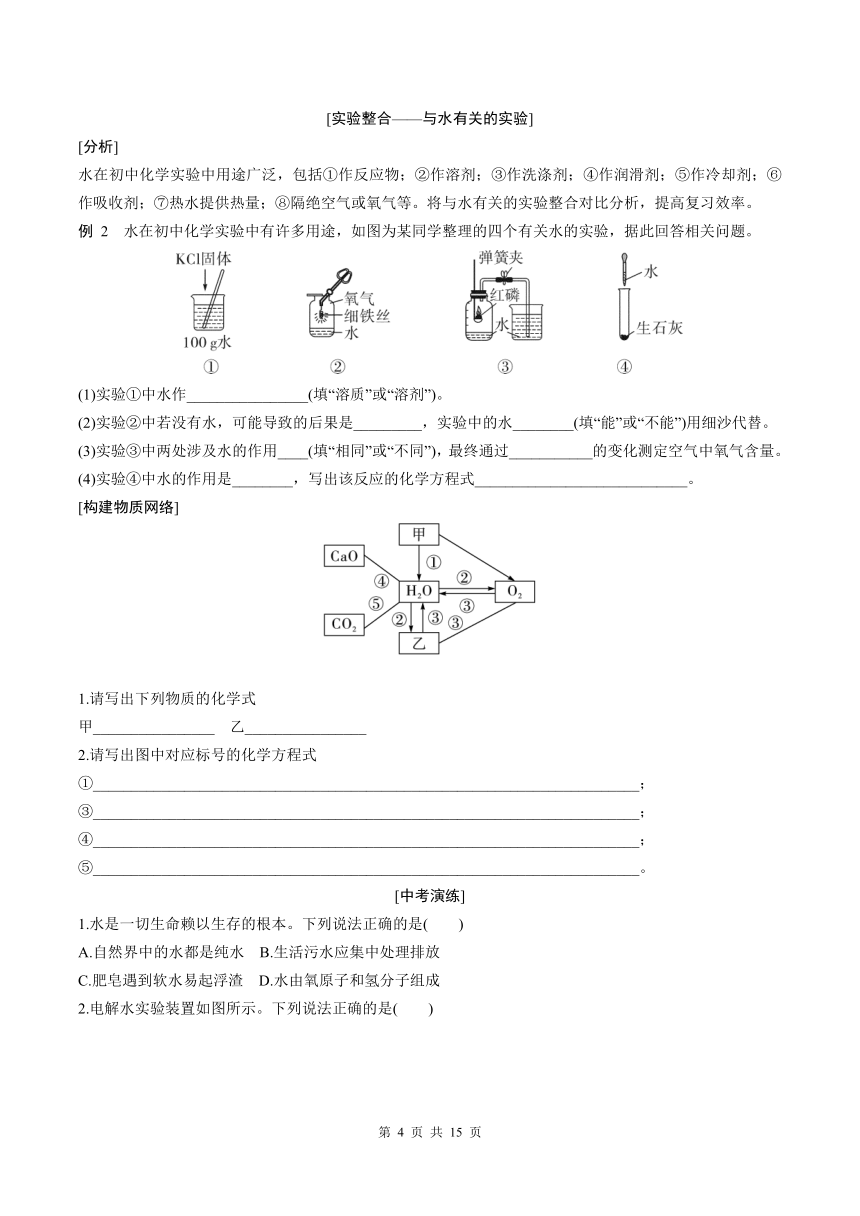
例 2 水在初中化学实验中有许多用途,如图为某同学整理的四个有关水的实验,据此回答相关问题。
(1)实验①中水作________________(填“溶质”或“溶剂”)。
(2)实验②中若没有水,可能导致的后果是_________,实验中的水________(填“能”或“不能”)用细沙代替。
(3)实验③中两处涉及水的作用____(填“相同”或“不同”),最终通过___________的变化测定空气中氧气含量。
(4)实验④中水的作用是________,写出该反应的化学方程式____________________________。
[构建物质网络]
1.请写出下列物质的化学式
甲________________ 乙________________
2.请写出图中对应标号的化学方程式
①________________________________________________________________________;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________。
[中考演练]
1.水是一切生命赖以生存的根本。下列说法正确的是( )
A.自然界中的水都是纯水 B.生活污水应集中处理排放
C.肥皂遇到软水易起浮渣 D.水由氧原子和氢分子组成
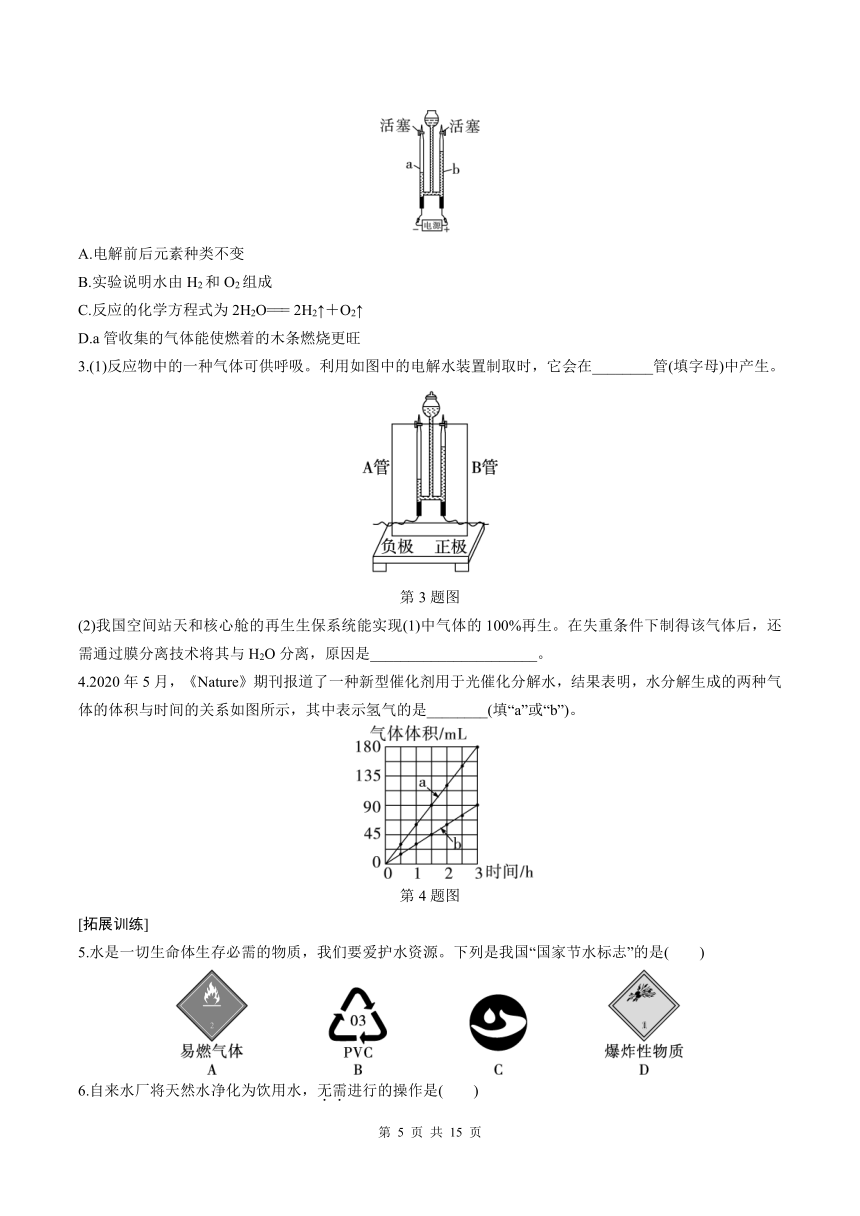
2.电解水实验装置如图所示。下列说法正确的是( )
A.电解前后元素种类不变
B.实验说明水由H2和O2组成
C.反应的化学方程式为2H2O=== 2H2↑+O2↑
D.a管收集的气体能使燃着的木条燃烧更旺
3.(1)反应物中的一种气体可供呼吸。利用如图中的电解水装置制取时,它会在________管(填字母)中产生。
第3题图
(2)我国空间站天和核心舱的再生生保系统能实现(1)中气体的100%再生。在失重条件下制得该气体后,还需通过膜分离技术将其与H2O分离,原因是______________________。
4.2020年5月,《Nature》期刊报道了一种新型催化剂用于光催化分解水,结果表明,水分解生成的两种气体的体积与时间的关系如图所示,其中表示氢气的是________(填“a”或“b”)。
第4题图
[拓展训练]
5.水是一切生命体生存必需的物质,我们要爱护水资源。下列是我国“国家节水标志”的是( )
6.自来水厂将天然水净化为饮用水,无需进行的操作是( )
A.降温结晶 B.絮凝沉降 C.杀菌消毒 D.细沙滤水
7.某学习小组制作的净水器如图,关于该净水器的说法正确的是( )
第7题图
A.能把自来水变成纯净物
B.能除尽水中的可溶性杂质
C.能除去水中的色素和异味
D.净水时水最后流经小卵石
8.木无本必枯,水无源必竭。未来黑科技——空气取水净水器,可收集空气中的水蒸气,经高效过滤冷凝成液态水,再通过净化处理得到高品质的生活饮用水。其主要工作原理如图所示。
第8题图
(1)国家自来水水质标准规定:“含铁≤0.3 mg·L-1, 含铜≤1.0 mg·L-1”,这里的“铁、铜”指的是_______(填字母)。
A.单质 B.原子 C.离子 D.元素
(2)物质的结构决定性质,性质决定用途。活性炭可用于净水是因为其具有__________的结构。
(3)RO反渗透膜,能截留水中细菌、病毒以及________(填离子符号)等多种金属离子,而降低水的硬度。可用________检验得到的水是软水。
(4)ClO2是一种常见的自来水消毒剂,工业上用X制取ClO2的化学方程式为:X+2NaClO2=== 2NaCl+2ClO2,则X的化学式是________,此过程中发生了________(填“物理”或“化学”)变化。
命题点2 溶液及溶解度
1.(易错易混)下列有关溶液的说法正确的是 ( )
A.长久放置不分层的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色、澄清的
D.溶质一定是固体,溶剂一定是液体
2.在试管中加入以下某种固体,当向试管内滴入适量的水时,观察到U形管内液面左高右低的是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.氧化钙
3.下列除污方法与原理不相符的是( )
A.用汽油洗去衣服上的油渍——溶解
B.用盐酸除去装石灰水瓶内的白膜——溶解
C.用洗洁精除去餐具上的油污——乳化
D.用食醋除去暖水瓶中的水垢——化学反应
4.下列有关溶解度的说法正确的是( )
A.物质的溶解度都随温度的升高而增大
B.物质溶解度大小与溶质质量、溶剂质量的多少无关
C.打开汽水瓶盖后有气泡冒出,是因为压强减小,气体溶解度增大
D.30 ℃时,某物质的饱和溶液中溶质质量分数为20%,则其溶解度为20 g
5. (易错易混)下列说法正确的是( )
A.饱和氯化钠溶液不能再溶解任何溶质
B.饱和溶液升温都能变成不饱和溶液
C.溶液析出晶体后质量分数不一定减小
D.饱和溶液的溶质质量分数一定大于不饱和溶液
[知识逐点过]
1.溶液的组成及特征
概念 一种或几种物质________到另一种物质里,形成________的、________的混合物
特征 均一性、________性
组成 a.________:被溶解的物质,可以是固体或液体或气体; b.溶剂:能溶解其他物质的物质;_________是最常用的溶剂,汽油、酒精等也可以作溶剂
2.物质溶解时的吸热或放热现象
类型 概念 举例
吸热 一些物质溶于水后,溶液温度降低 ______________________________
放热 一些物质溶于水后,溶液温度升高 _________________、浓H2SO4
吸放热不明显 一些物质溶于水后,溶液温度变化不明显 NaCl固体
3.除污方法及原理
方法 原理 举例
乳化 乳化剂作用于污垢,发生乳化,从而去除污垢 用洗涤剂去除餐具上的油渍
溶解 利用溶解原理使污垢溶解于溶剂而除去 用汽油洗去衣服上的油渍
化学反应 利用化学反应使污垢与某些物质发生化学反应,从而去除污垢 用食醋除去水壶中的水垢
4.饱和溶液与不饱和溶液(6年3考)
判断方法
相互转化 a.对大多数物质(溶解度随温度升高而增大) b.对Ca(OH)2等溶解度随温度升高而减小的物质:温度变化相反,其余方式相同
5.物质的溶解度
固体溶解度 概念 在一定____下,某固态物质在____g溶剂里达到____状态时所溶解的质量
四要素 条件:________;标准:________;状态________;单位________
影响因素 内因:溶质和溶剂的性质 外因:温度
与溶解性的关系 20 ℃时:
气体溶解度 概念 某气体在压强为101 kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积
影响因素 内因:溶质和溶剂的性质 外因:a.温度:压强一定,气体的溶解度随温度的升高而________;b.压强:温度一定,气体的溶解度随压强的增大而________
6.结晶方法
概念 溶质从溶液中析出形成晶体的过程
方法 蒸发结晶:适用于溶解度受温度影响变化________的物质,如氯化钠(NaCl) 降温结晶(或冷却热饱和溶液):适用于溶解度随温度升高而增大,且溶解度受温度影响变化较________的物质,如硝酸钾(KNO3)
[中考演练]
1.如图是硼酸的溶解度曲线,下列说法正确的是( )
A.a点的硼酸溶液中溶质的质量分数为10%
B.将a点的硼酸溶液升温至t2 ℃时,仍是饱和溶液
C.将b点的硼酸溶液降温至t1 ℃时,有晶体析出
D.t2 ℃时,向50 g水中加入20 g硼酸后充分搅拌,可得70 g溶液
2.根据如图,判断下列说法正确的是( )
A.t1 ℃时,50 g甲能完全溶于50 g水
B.乙的溶解度随温度升高而降低
C.t2 ℃时,丙和丁的溶解度相同
D.加压或升温能增加戊的溶解度
3.如图为两物质的溶解度曲线。请回答:
(1)50 ℃时Na2Cr2O7的溶解度为________g,60 ℃时溶解度:Na2Cr2O7________Na2SO4(填“<”“=”或“>”)。
(2)在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃,析出Na2Cr2O7________g(假设不含结晶水)。
[拓展训练]
4.把少量下列物质分别放入水中,充分搅拌,不能得到溶液的是( )
A.白糖 B.白酒 C.白醋 D.花生油
5.(2023永州)下列溶液中,溶剂不是水的是( )
A.稀硫酸
B.生理盐水
C.蔗糖溶液
D.碘的酒精溶液
6.化学老师带领学生在实验室开展“自制简易冰袋”的探究活动,下列用来制作冰袋最佳的固体物质是( )
A.氢氧化钠
B.硝酸铵
C.生石灰
D.氯化钠
7.40 ℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量
B.溶质的质量
C.溶液中溶质的质量分数
D.食盐的溶解度
8.[中华优秀传统文化]《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”即“石碱”由草木灰提取。下列有关说法不正确的是( )
A.“以水淋汁”包含溶解过程
B.“石碱”的主要成分不可能是NaOH
C.“石碱”发面时会产生气体
D.“石碱”去油污的原理和汽油去油污的原理相同
9.向 5 mL碘的水溶液(黄色)中加入 2 mL汽油(无色),振荡静置,实验现象如图所示,由该实验不能得出的结论是( )
A.汽油的密度比水小,且不溶于水
B.汽油易挥发,沸点比水低
C.碘在汽油中的溶解性比在水中强
D.碘在不同溶剂中形成的溶液颜色可能不同
10.20 ℃时,取一定量CuSO4固体溶解在水中,按如图所示进行操作。
(1)甲、乙、丙三种溶液,一定属于饱和溶液的是________。
(2)将硫酸铜的不饱和溶液转化为饱和溶液可采取的方法是______________。
11.化学兴趣小组探究碳酸氢钠、氯化钾、氯化钠和氯化铵的溶解性时,查阅资料如下:
表1 物质在不同温度时的溶解度
温度/℃ 0 10 20 30
溶解度/g NaHCO3 6.9 8.2 9.6 11.1
KCl 27.6 31.0 34.0 37.0
NaCl 35.7 35.8 36.0 36.3
NH4Cl 29.4 33.3 37.2 41.4
表2 溶解度的相对大小(20 ℃)
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易溶
回答下列问题:
(1)10 ℃时,NaCl的溶解度为________。
(2)根据20 ℃时上述四种物质的溶解度,判断其中属于“可溶”的物质是________。
(3)将30 ℃时上述四种物质的饱和溶液各a g分别降温到0 ℃,析出固体质量最大的物质是__________。
命题点3 溶液浓度及溶液配制
[知识逐点过]
1.溶液的质量分数
(1)概念:溶液中________质量与________质量之比。
(2)公式:a.所有溶液:溶质质量分数=×100%=×100%
b.饱和溶液:溶质质量分数=×100%
2.溶液稀释
(1)依据:稀释前后,溶质的________不变。
(2)公式:浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数
[教材实验到重难考法]
实验3 一定溶质质量分数的氯化钠溶液的配制
例 如图是某兴趣小组配制50 g溶质质量分数为6%的氯化钠溶液,请回答下列问题。
[教材基础要点巩固]
【实验仪器】
(1)托盘天平、烧杯、________、药匙、量筒、________。
【实验步骤】
(2)计算:所需氯化钠固体的质量为____g,所需水的体积为____mL。(水的密度可近似看作1 g /mL)。
(3)称量:用托盘天平称量氯化钠时,发现指针偏向左边,此时应进行的操作是______________(填“移走部分药品”或“增加砝码”)。
(4)量取:选用____(填“10”“50”或“100”)mL的量筒量取所需的水,并倒入盛有氯化钠的烧杯中。
(5)溶解:溶解过程中玻璃棒的作用是__________________________。
(6)装瓶贴标签:将上述配制好的溶液转移至________(填“广口瓶”或“细口瓶”)中,盖好瓶塞并贴上标签,请将标签内容补充完整。
[重难考法提升]
考法1 偏差分析
(7)若经测定,利用上述方法所配制溶液的溶质质量分数小于6%,其原因可能是________(填序号,后同),若发现溶液的溶质质量分数大于6%,其原因可能是________。
a.砝码生锈或沾有污渍
b.氯化钠固体中含有杂质
c.称量时“左码右物”,并且使用了游码
d.转移氯化钠时,称量纸上有残留固体
e.量取水时俯视读数
f.烧杯内壁有水珠
g.将量取的水倒入烧杯中时有水溅出 h.配好的溶液转移到试剂瓶时有液体洒出
考法2 溶液稀释
(8)小红提出还可以用浓度更高的氯化钠溶液配制6%的氯化钠溶液。
①实验步骤为计算、量取、________、装瓶;该过程中不需要的仪器是________(填序号)。
a.烧杯 b.药匙 c.玻璃棒 d.量筒
②若用10%的氯化钠溶液配制,则需要溶液质量为____g,需要加水的质量为____g。若量取水时仰视读数,导致所配制的氯化钠溶液的质量分数______(填“>”“<”或“=”)6%。
[中考演练]
项目学习小组在实验室将树叶放入溶质质量分数为10%的NaOH溶液中煮沸,叶肉变黄时取出,洗刷干净后制成叶脉书签。请回答第1题。
1.配制NaOH溶液不需用到的仪器是( )
A.烧杯 B.量筒 C.漏斗 D.玻璃棒
2.实验室配制质量分数为6%的NaCl溶液,除托盘天平、玻璃棒、药匙、量筒、胶头滴管外,还需要的仪器是( )
A.烧杯 B.酒精灯 C.铁架台 D.蒸发皿
3.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量________gNaCl,需加水________mL。
(2)若称量NaCl固体时指针向右偏转,则应__________________________直到天平平衡。
(3)取上述溶液10 g加水稀释到________g,可得到5%的NaCl溶液。
[拓展训练]
4.为制作叶脉书签,某同学在实验室配制10%的NaOH溶液,部分操作如下,其中正确的是( )
5.溶液在生活中应用广泛。
(1)75%的医用酒精可用于消毒,其溶质是________。
(2)生理盐水能维持人体细胞正常的生理功能。注射用的某生理盐水标签如图,回答下列问题。
①构成氯化钠的微观粒子是________(填粒子符号)。
②若要配制500 mL如图标签规格的生理盐水,需要氯化钠固体的质量为______g,水的体积为____mL(密度为1 g /cm3)。若用量筒量取水时,仰视读数,会使所配溶液的溶质质量分数________(填“偏大”或“偏小”)。
③若将该生理盐水倒出一半,剩余溶液的溶质质量分数为________。
第4讲
命题点1
1.D 2.A
知识逐点过
2.不溶性 吸附
3.肥皂水 软水 硬水 煮沸 蒸馏
4.(1)①小 ②a.淡蓝色 2H2+O2 2H2O
b.H2+CuO Cu+H2O
教材实验到重难考法
例 1 (1) 2H2+O2 2H2O (2)淡蓝色 有水珠(或水雾) (3) 2H2O 2H2↑+O2↑ (4)气泡 2∶1
(5)气体燃烧,产生淡蓝色火焰 氢气(或H2) 木条燃烧更旺 氧气(或O2)
(6) 氢、氧元素(或H、O) 1∶8 (7)C (8)bc (9)每个水分子分解成2个氢原子和1个氧原子,2个氢原子结合成1个氢分子,2个氧原子结合成1个氧分子
(10)①电压越高,电解水速率越快(合理即可)
②12 V电压、10% NaOH溶液 (11)①化学转化
②烧杯内壁有水雾产生 将燃烧产生的气体通入澄清石灰水中,观察到澄清石灰水变浑浊,则可确定甲烷中含有C元素
例 2 (1)溶剂 (2)铁丝燃烧时产生的高温熔融物溅落使集气瓶炸裂 能 (3)不同 集气瓶中水的体积
(4)作反应物 CaO+H2O=== Ca(OH)2
构建物质网络
1.H2O2 H2
2.①2H2O2 2H2O+O2↑
③2H2+O2 2H2O
④CaO+H2O=== Ca(OH)2
⑤CO2+H2O ===H2CO3
中考演练
1.B 2.A
3.(1)B (2)在失重状态下,氧气与水处于混合状态,不易分离
4.a
5.C 6.A 7.C
8.(1)D (2)疏松多孔 (3)Ca2+、Mg2+ 肥皂水
(4)Cl2 化学
命题点2
1. B 2.B 3.B 4.B 5.C
知识逐点过
1.分散 均一 稳定 稳定 溶质 水
2.硝酸铵固体(合理即可) 氢氧化钠固体(合理即可)
4.①溶质 ②溶剂 ③降低 ④溶剂 ⑤升高
5.温度 100 饱和 一定温度 100 g溶剂 达到饱和
g 减小 增大
6.不大 大
中考演练
1.C 2.C 3.(1)110 > (2)50
4.D 5.D 6.B 7.D 8.D 9.B
10.(1)甲 (2)蒸发溶剂(或增加溶质或降低温度)
11.(1)35.8 g (2)NaHCO3(写名称给分) (3)NH4Cl(写名称给分)
命题点3
知识逐点过
1.(1)溶质 溶液
(2)①溶质 ②溶液 ③溶质 ④溶质 ⑤溶剂(可与前一空互换)
2.(1)质量
教材实验到重难考法
例 (1) 玻璃棒 胶头滴管(可与前一空互换) (2)3 47 (3)移走部分药品 (4)50 (5)搅拌,加快氯化钠的溶解 (6)细口瓶
(7)bcdf aeg (8)①混匀 b ②30 20 <
中考演练
1.C 2.A
3.(1)7.5 42.5 (2)继续向左侧托盘添加氯化钠固体
(3)30
4.C
5.(1)酒精(或乙醇) (2)①Na+和Cl- ②4.5 495.5
偏小 ③0.9%
命题点1 自然界的水
1. 下列说法正确的是( )
A.地球上的水资源取之不尽、用之不竭
B.水体有自净能力,无需担心污染问题
C.为了保护水资源,应禁止使用农药或化肥
D.水中氮、磷等过多会造成水体富营养化
2.(易错易混)下列有关说法错误的是( )
A.软水中一定不含钙镁化合物
B.长期饮用蒸馏水不利于身体健康
C.单一操作相对净化程度较高的是蒸馏
D.自来水厂用沉淀、过滤、吸附、杀菌消毒方法净水
[知识逐点过]
1.爱护水资源
原因 地球上总水储量很大,但可利用的淡水资源有限
措施 节约用水 生活上:一水多用,如用淘米水浇花等 农业上:改大水漫灌为喷灌、滴灌等 工业上:使用新技术、改革工艺、循环利用水等 国家节水标志
防治水体污染 生活上:生活污水逐步实现集中处理和排放 农业上:提倡使用农家肥,合理使用农药、化肥 工业上:工业废水处理达标后再排放
2.水的净化方法
方法 作用
沉淀 加入絮凝剂(明矾),使水中悬浮的不溶性杂质沉降下来
过滤 除去水中的________杂质
吸附 利用活性炭的________性除去水中的色素和异味
杀菌消毒 加入杀菌剂(漂白粉、ClO2等)除去水中的病毒和细菌
蒸馏 除去水中所有杂质(净化程度最高)
【备考补充】自来水生产流程:取水→沉淀→过滤→吸附→消毒→配水
3.硬水和软水
硬水 软水
概念 含较多可溶性钙、镁化合物的水 不含或含较少可溶性钙、镁化合物的水
鉴别 取水样,加入等量的______,振荡,产生泡沫较多、浮渣较少的是______;产生泡沫较少、浮渣较多的是______
降低水的硬度 生活中:________;实验室:________
4.水的组成
(1)氢气的性质及用途:①物理性质:无色、无味的气体,密度比空气________,难溶于水。
②化学性质:a.可燃性:氢气燃烧,产生________火焰,放热,反应的化学方程式为________________________,常用作燃料;b.还原性:氢气还原氧化铜,观察到黑色固体变为红色,反应的化学方程式为______________,常用于冶炼金属。
(2)探究水的组成
[教材实验到重难考法]
实验2 探究水的组成
例 1 实验课上,甲、乙两组同学分别在老师的指导下进行如下两组实验,探究水的组成。
(人教上P79图4-24) (人教上P80图4-25)
图1 图2
[教材基础要点巩固]
甲组:利用氢气燃烧探究水的组成,如图1所示。
【反应原理】
(1)实验中发生反应的化学方程式为__________________________。
【实验操作及现象】
(2)在带尖嘴的导管口点燃纯净的氢气,观察到纯净的氢气在空气中燃烧发出_______火焰,烧杯内壁_______。
乙组:利用电解水探究水的组成,如图2所示。
【反应原理】
(3)实验中发生反应的化学方程式为____________________。
【实验现象】
(4)实验接通电源后,可观察到两个电极均有________产生,一段时间后玻璃管a、b中产生气体的体积比约为________。
【产物检验】
(5)同学们将燃着的木条分别靠近a、b玻璃管尖嘴处,a管口观察到的现象为____________________,说明气体为____;b管口观察到的现象为__________________,说明气体为________。
【甲、乙组实验的结论及拓展】
(6)图1、图2两组实验均可证明水由________组成;实验中玻璃管a、b中产生气体的质量比约为____。
[重难考法提升]
实验结束后,甲、乙两组同学对乙组的实验进行进一步探究。
考法1 误差分析
(7)某同学用碳棒作电极进行电解水实验,测得正负极产生的气体的体积比略小于理论值,对产生此现象原因的猜想不合理的是______(填字母)。
A.部分氧气溶于水 B.部分氧气与电极反应
C.部分氧气与氢气反应重新生成了水
考法2 定量分析
(8)已知图2实验产生气体的体积比,要确定水分子中氢、氧原子个数比,还需要的数据有______ (填字母)。
a.水的相对分子质量 b.氢气、氧气的密度 c.氢原子、氧原子的质量
考法3 微观分析
(9)[作图]图3是水分子分解示意图,水分解过程的微观解释是___________,并补全该示意图。
图3
考法4 探究电解水的最佳条件
(10)电解纯水速率较慢,为探究不同电压和不同浓度NaOH溶液对电解水速率的影响,小组同学进行多次实验,测得产生20 mL氢气所需时间如图4所示:
图4
①电解溶质质量分数为5%的NaOH溶液时,改变电压对电解水速率的影响是_______________。
②上述实验中,电解水速率最快的条件是______________________。
考法5 实验探究方法
(11)通过深挖电解水实验构建出纯净物元素组成探究的思维模型如下:
①电解水实验中,验证a、b管中气体成分属于上述过程中的________(填“物理转移”或“化学转化”)。
②利用燃烧法探究甲烷的组成元素,将燃烧产生的气体通入冷而干燥的烧杯,观察到____________,说明甲烷中含有氢元素,要验证甲烷中含有的另一种元素,需进行的操作是__________________。
[实验整合——与水有关的实验]
[分析]
水在初中化学实验中用途广泛,包括①作反应物;②作溶剂;③作洗涤剂;④作润滑剂;⑤作冷却剂;⑥作吸收剂;⑦热水提供热量;⑧隔绝空气或氧气等。将与水有关的实验整合对比分析,提高复习效率。
例 2 水在初中化学实验中有许多用途,如图为某同学整理的四个有关水的实验,据此回答相关问题。
(1)实验①中水作________________(填“溶质”或“溶剂”)。
(2)实验②中若没有水,可能导致的后果是_________,实验中的水________(填“能”或“不能”)用细沙代替。
(3)实验③中两处涉及水的作用____(填“相同”或“不同”),最终通过___________的变化测定空气中氧气含量。
(4)实验④中水的作用是________,写出该反应的化学方程式____________________________。
[构建物质网络]
1.请写出下列物质的化学式
甲________________ 乙________________
2.请写出图中对应标号的化学方程式
①________________________________________________________________________;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________。
[中考演练]
1.水是一切生命赖以生存的根本。下列说法正确的是( )
A.自然界中的水都是纯水 B.生活污水应集中处理排放
C.肥皂遇到软水易起浮渣 D.水由氧原子和氢分子组成
2.电解水实验装置如图所示。下列说法正确的是( )
A.电解前后元素种类不变
B.实验说明水由H2和O2组成
C.反应的化学方程式为2H2O=== 2H2↑+O2↑
D.a管收集的气体能使燃着的木条燃烧更旺
3.(1)反应物中的一种气体可供呼吸。利用如图中的电解水装置制取时,它会在________管(填字母)中产生。
第3题图
(2)我国空间站天和核心舱的再生生保系统能实现(1)中气体的100%再生。在失重条件下制得该气体后,还需通过膜分离技术将其与H2O分离,原因是______________________。
4.2020年5月,《Nature》期刊报道了一种新型催化剂用于光催化分解水,结果表明,水分解生成的两种气体的体积与时间的关系如图所示,其中表示氢气的是________(填“a”或“b”)。
第4题图
[拓展训练]
5.水是一切生命体生存必需的物质,我们要爱护水资源。下列是我国“国家节水标志”的是( )
6.自来水厂将天然水净化为饮用水,无需进行的操作是( )
A.降温结晶 B.絮凝沉降 C.杀菌消毒 D.细沙滤水
7.某学习小组制作的净水器如图,关于该净水器的说法正确的是( )
第7题图
A.能把自来水变成纯净物
B.能除尽水中的可溶性杂质
C.能除去水中的色素和异味
D.净水时水最后流经小卵石
8.木无本必枯,水无源必竭。未来黑科技——空气取水净水器,可收集空气中的水蒸气,经高效过滤冷凝成液态水,再通过净化处理得到高品质的生活饮用水。其主要工作原理如图所示。
第8题图
(1)国家自来水水质标准规定:“含铁≤0.3 mg·L-1, 含铜≤1.0 mg·L-1”,这里的“铁、铜”指的是_______(填字母)。
A.单质 B.原子 C.离子 D.元素
(2)物质的结构决定性质,性质决定用途。活性炭可用于净水是因为其具有__________的结构。
(3)RO反渗透膜,能截留水中细菌、病毒以及________(填离子符号)等多种金属离子,而降低水的硬度。可用________检验得到的水是软水。
(4)ClO2是一种常见的自来水消毒剂,工业上用X制取ClO2的化学方程式为:X+2NaClO2=== 2NaCl+2ClO2,则X的化学式是________,此过程中发生了________(填“物理”或“化学”)变化。
命题点2 溶液及溶解度
1.(易错易混)下列有关溶液的说法正确的是 ( )
A.长久放置不分层的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色、澄清的
D.溶质一定是固体,溶剂一定是液体
2.在试管中加入以下某种固体,当向试管内滴入适量的水时,观察到U形管内液面左高右低的是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.氧化钙
3.下列除污方法与原理不相符的是( )
A.用汽油洗去衣服上的油渍——溶解
B.用盐酸除去装石灰水瓶内的白膜——溶解
C.用洗洁精除去餐具上的油污——乳化
D.用食醋除去暖水瓶中的水垢——化学反应
4.下列有关溶解度的说法正确的是( )
A.物质的溶解度都随温度的升高而增大
B.物质溶解度大小与溶质质量、溶剂质量的多少无关
C.打开汽水瓶盖后有气泡冒出,是因为压强减小,气体溶解度增大
D.30 ℃时,某物质的饱和溶液中溶质质量分数为20%,则其溶解度为20 g
5. (易错易混)下列说法正确的是( )
A.饱和氯化钠溶液不能再溶解任何溶质
B.饱和溶液升温都能变成不饱和溶液
C.溶液析出晶体后质量分数不一定减小
D.饱和溶液的溶质质量分数一定大于不饱和溶液
[知识逐点过]
1.溶液的组成及特征
概念 一种或几种物质________到另一种物质里,形成________的、________的混合物
特征 均一性、________性
组成 a.________:被溶解的物质,可以是固体或液体或气体; b.溶剂:能溶解其他物质的物质;_________是最常用的溶剂,汽油、酒精等也可以作溶剂
2.物质溶解时的吸热或放热现象
类型 概念 举例
吸热 一些物质溶于水后,溶液温度降低 ______________________________
放热 一些物质溶于水后,溶液温度升高 _________________、浓H2SO4
吸放热不明显 一些物质溶于水后,溶液温度变化不明显 NaCl固体
3.除污方法及原理
方法 原理 举例
乳化 乳化剂作用于污垢,发生乳化,从而去除污垢 用洗涤剂去除餐具上的油渍
溶解 利用溶解原理使污垢溶解于溶剂而除去 用汽油洗去衣服上的油渍
化学反应 利用化学反应使污垢与某些物质发生化学反应,从而去除污垢 用食醋除去水壶中的水垢
4.饱和溶液与不饱和溶液(6年3考)
判断方法
相互转化 a.对大多数物质(溶解度随温度升高而增大) b.对Ca(OH)2等溶解度随温度升高而减小的物质:温度变化相反,其余方式相同
5.物质的溶解度
固体溶解度 概念 在一定____下,某固态物质在____g溶剂里达到____状态时所溶解的质量
四要素 条件:________;标准:________;状态________;单位________
影响因素 内因:溶质和溶剂的性质 外因:温度
与溶解性的关系 20 ℃时:
气体溶解度 概念 某气体在压强为101 kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积
影响因素 内因:溶质和溶剂的性质 外因:a.温度:压强一定,气体的溶解度随温度的升高而________;b.压强:温度一定,气体的溶解度随压强的增大而________
6.结晶方法
概念 溶质从溶液中析出形成晶体的过程
方法 蒸发结晶:适用于溶解度受温度影响变化________的物质,如氯化钠(NaCl) 降温结晶(或冷却热饱和溶液):适用于溶解度随温度升高而增大,且溶解度受温度影响变化较________的物质,如硝酸钾(KNO3)
[中考演练]
1.如图是硼酸的溶解度曲线,下列说法正确的是( )
A.a点的硼酸溶液中溶质的质量分数为10%
B.将a点的硼酸溶液升温至t2 ℃时,仍是饱和溶液
C.将b点的硼酸溶液降温至t1 ℃时,有晶体析出
D.t2 ℃时,向50 g水中加入20 g硼酸后充分搅拌,可得70 g溶液
2.根据如图,判断下列说法正确的是( )
A.t1 ℃时,50 g甲能完全溶于50 g水
B.乙的溶解度随温度升高而降低
C.t2 ℃时,丙和丁的溶解度相同
D.加压或升温能增加戊的溶解度
3.如图为两物质的溶解度曲线。请回答:
(1)50 ℃时Na2Cr2O7的溶解度为________g,60 ℃时溶解度:Na2Cr2O7________Na2SO4(填“<”“=”或“>”)。
(2)在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃,析出Na2Cr2O7________g(假设不含结晶水)。
[拓展训练]
4.把少量下列物质分别放入水中,充分搅拌,不能得到溶液的是( )
A.白糖 B.白酒 C.白醋 D.花生油
5.(2023永州)下列溶液中,溶剂不是水的是( )
A.稀硫酸
B.生理盐水
C.蔗糖溶液
D.碘的酒精溶液
6.化学老师带领学生在实验室开展“自制简易冰袋”的探究活动,下列用来制作冰袋最佳的固体物质是( )
A.氢氧化钠
B.硝酸铵
C.生石灰
D.氯化钠
7.40 ℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量
B.溶质的质量
C.溶液中溶质的质量分数
D.食盐的溶解度
8.[中华优秀传统文化]《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”即“石碱”由草木灰提取。下列有关说法不正确的是( )
A.“以水淋汁”包含溶解过程
B.“石碱”的主要成分不可能是NaOH
C.“石碱”发面时会产生气体
D.“石碱”去油污的原理和汽油去油污的原理相同
9.向 5 mL碘的水溶液(黄色)中加入 2 mL汽油(无色),振荡静置,实验现象如图所示,由该实验不能得出的结论是( )
A.汽油的密度比水小,且不溶于水
B.汽油易挥发,沸点比水低
C.碘在汽油中的溶解性比在水中强
D.碘在不同溶剂中形成的溶液颜色可能不同
10.20 ℃时,取一定量CuSO4固体溶解在水中,按如图所示进行操作。
(1)甲、乙、丙三种溶液,一定属于饱和溶液的是________。
(2)将硫酸铜的不饱和溶液转化为饱和溶液可采取的方法是______________。
11.化学兴趣小组探究碳酸氢钠、氯化钾、氯化钠和氯化铵的溶解性时,查阅资料如下:
表1 物质在不同温度时的溶解度
温度/℃ 0 10 20 30
溶解度/g NaHCO3 6.9 8.2 9.6 11.1
KCl 27.6 31.0 34.0 37.0
NaCl 35.7 35.8 36.0 36.3
NH4Cl 29.4 33.3 37.2 41.4
表2 溶解度的相对大小(20 ℃)
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易溶
回答下列问题:
(1)10 ℃时,NaCl的溶解度为________。
(2)根据20 ℃时上述四种物质的溶解度,判断其中属于“可溶”的物质是________。
(3)将30 ℃时上述四种物质的饱和溶液各a g分别降温到0 ℃,析出固体质量最大的物质是__________。
命题点3 溶液浓度及溶液配制
[知识逐点过]
1.溶液的质量分数
(1)概念:溶液中________质量与________质量之比。
(2)公式:a.所有溶液:溶质质量分数=×100%=×100%
b.饱和溶液:溶质质量分数=×100%
2.溶液稀释
(1)依据:稀释前后,溶质的________不变。
(2)公式:浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数
[教材实验到重难考法]
实验3 一定溶质质量分数的氯化钠溶液的配制
例 如图是某兴趣小组配制50 g溶质质量分数为6%的氯化钠溶液,请回答下列问题。
[教材基础要点巩固]
【实验仪器】
(1)托盘天平、烧杯、________、药匙、量筒、________。
【实验步骤】
(2)计算:所需氯化钠固体的质量为____g,所需水的体积为____mL。(水的密度可近似看作1 g /mL)。
(3)称量:用托盘天平称量氯化钠时,发现指针偏向左边,此时应进行的操作是______________(填“移走部分药品”或“增加砝码”)。
(4)量取:选用____(填“10”“50”或“100”)mL的量筒量取所需的水,并倒入盛有氯化钠的烧杯中。
(5)溶解:溶解过程中玻璃棒的作用是__________________________。
(6)装瓶贴标签:将上述配制好的溶液转移至________(填“广口瓶”或“细口瓶”)中,盖好瓶塞并贴上标签,请将标签内容补充完整。
[重难考法提升]
考法1 偏差分析
(7)若经测定,利用上述方法所配制溶液的溶质质量分数小于6%,其原因可能是________(填序号,后同),若发现溶液的溶质质量分数大于6%,其原因可能是________。
a.砝码生锈或沾有污渍
b.氯化钠固体中含有杂质
c.称量时“左码右物”,并且使用了游码
d.转移氯化钠时,称量纸上有残留固体
e.量取水时俯视读数
f.烧杯内壁有水珠
g.将量取的水倒入烧杯中时有水溅出 h.配好的溶液转移到试剂瓶时有液体洒出
考法2 溶液稀释
(8)小红提出还可以用浓度更高的氯化钠溶液配制6%的氯化钠溶液。
①实验步骤为计算、量取、________、装瓶;该过程中不需要的仪器是________(填序号)。
a.烧杯 b.药匙 c.玻璃棒 d.量筒
②若用10%的氯化钠溶液配制,则需要溶液质量为____g,需要加水的质量为____g。若量取水时仰视读数,导致所配制的氯化钠溶液的质量分数______(填“>”“<”或“=”)6%。
[中考演练]
项目学习小组在实验室将树叶放入溶质质量分数为10%的NaOH溶液中煮沸,叶肉变黄时取出,洗刷干净后制成叶脉书签。请回答第1题。
1.配制NaOH溶液不需用到的仪器是( )
A.烧杯 B.量筒 C.漏斗 D.玻璃棒
2.实验室配制质量分数为6%的NaCl溶液,除托盘天平、玻璃棒、药匙、量筒、胶头滴管外,还需要的仪器是( )
A.烧杯 B.酒精灯 C.铁架台 D.蒸发皿
3.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量________gNaCl,需加水________mL。
(2)若称量NaCl固体时指针向右偏转,则应__________________________直到天平平衡。
(3)取上述溶液10 g加水稀释到________g,可得到5%的NaCl溶液。
[拓展训练]
4.为制作叶脉书签,某同学在实验室配制10%的NaOH溶液,部分操作如下,其中正确的是( )
5.溶液在生活中应用广泛。
(1)75%的医用酒精可用于消毒,其溶质是________。
(2)生理盐水能维持人体细胞正常的生理功能。注射用的某生理盐水标签如图,回答下列问题。
①构成氯化钠的微观粒子是________(填粒子符号)。
②若要配制500 mL如图标签规格的生理盐水,需要氯化钠固体的质量为______g,水的体积为____mL(密度为1 g /cm3)。若用量筒量取水时,仰视读数,会使所配溶液的溶质质量分数________(填“偏大”或“偏小”)。
③若将该生理盐水倒出一半,剩余溶液的溶质质量分数为________。
第4讲
命题点1
1.D 2.A
知识逐点过
2.不溶性 吸附
3.肥皂水 软水 硬水 煮沸 蒸馏
4.(1)①小 ②a.淡蓝色 2H2+O2 2H2O
b.H2+CuO Cu+H2O
教材实验到重难考法
例 1 (1) 2H2+O2 2H2O (2)淡蓝色 有水珠(或水雾) (3) 2H2O 2H2↑+O2↑ (4)气泡 2∶1
(5)气体燃烧,产生淡蓝色火焰 氢气(或H2) 木条燃烧更旺 氧气(或O2)
(6) 氢、氧元素(或H、O) 1∶8 (7)C (8)bc (9)每个水分子分解成2个氢原子和1个氧原子,2个氢原子结合成1个氢分子,2个氧原子结合成1个氧分子
(10)①电压越高,电解水速率越快(合理即可)
②12 V电压、10% NaOH溶液 (11)①化学转化
②烧杯内壁有水雾产生 将燃烧产生的气体通入澄清石灰水中,观察到澄清石灰水变浑浊,则可确定甲烷中含有C元素
例 2 (1)溶剂 (2)铁丝燃烧时产生的高温熔融物溅落使集气瓶炸裂 能 (3)不同 集气瓶中水的体积
(4)作反应物 CaO+H2O=== Ca(OH)2
构建物质网络
1.H2O2 H2
2.①2H2O2 2H2O+O2↑
③2H2+O2 2H2O
④CaO+H2O=== Ca(OH)2
⑤CO2+H2O ===H2CO3
中考演练
1.B 2.A
3.(1)B (2)在失重状态下,氧气与水处于混合状态,不易分离
4.a
5.C 6.A 7.C
8.(1)D (2)疏松多孔 (3)Ca2+、Mg2+ 肥皂水
(4)Cl2 化学
命题点2
1. B 2.B 3.B 4.B 5.C
知识逐点过
1.分散 均一 稳定 稳定 溶质 水
2.硝酸铵固体(合理即可) 氢氧化钠固体(合理即可)
4.①溶质 ②溶剂 ③降低 ④溶剂 ⑤升高
5.温度 100 饱和 一定温度 100 g溶剂 达到饱和
g 减小 增大
6.不大 大
中考演练
1.C 2.C 3.(1)110 > (2)50
4.D 5.D 6.B 7.D 8.D 9.B
10.(1)甲 (2)蒸发溶剂(或增加溶质或降低温度)
11.(1)35.8 g (2)NaHCO3(写名称给分) (3)NH4Cl(写名称给分)
命题点3
知识逐点过
1.(1)溶质 溶液
(2)①溶质 ②溶液 ③溶质 ④溶质 ⑤溶剂(可与前一空互换)
2.(1)质量
教材实验到重难考法
例 (1) 玻璃棒 胶头滴管(可与前一空互换) (2)3 47 (3)移走部分药品 (4)50 (5)搅拌,加快氯化钠的溶解 (6)细口瓶
(7)bcdf aeg (8)①混匀 b ②30 20 <
中考演练
1.C 2.A
3.(1)7.5 42.5 (2)继续向左侧托盘添加氯化钠固体
(3)30
4.C
5.(1)酒精(或乙醇) (2)①Na+和Cl- ②4.5 495.5
偏小 ③0.9%
同课章节目录
