2024年化学 中考 第5讲 金属与金属矿物(含答案)
文档属性
| 名称 | 2024年化学 中考 第5讲 金属与金属矿物(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-02 23:04:13 | ||
图片预览


文档简介
第5讲 金属与金属矿物
命题点1 金属材料
1. (易错易混)下列有关金属材料的说法正确的是( )
A.含有金属元素的物质都属于金属材料
B.银是导电性最好的金属,常用作导线
C.合金组成改变,性能也会发生改变
D.金属能导电,则能导电的物质一定是金属
2. (易错易混)下列有关合金的说法正确的是( )
A.钢、氧化铁均属于合金
B.合金中只有金属元素
C.合金属于合成材料
D.黄铜比纯铜硬度大
[知识逐点过]
1.金属材料:包括________和________。
2.纯金属的物理性质及用途
物理性质及用途
共性 a.有金属光泽,如制作各种饰品; b.________性,如用铜丝作导线; c.________性,如用铁锅做饭; d.________性,如铝能制成铝箔
特性 颜色:大多数金属呈银白色(铁在粉末状时呈黑色),但铜呈________色,金呈黄色 状态:常温下,大多数金属都是固体,而汞是液体
3.合金(6年4考)
概念 在金属中加热熔合某些金属或非金属,制得具有______特征的物质
性能 与其组分金属相比,合金的硬度和强度______、抗腐蚀性______、熔点______
常见的合金 a.铁合金:生铁和钢都属于铁合金,两者性能不同的原因是_________________; b.钛合金:与人体具有良好的“相容性”,因此可用于制造人造骨等; c.其他合金:黄铜(铜锌合金)、青铜、铝合金等
[拓展训练]
1.判断下列说法的正误:
(1)铜具有良好的导电性,可制作导线(2019.8C)( )
(2)铝合金的硬度比纯铝大(2022.12D)( )
(3)火星车使用的新型镁锂合金属于金属材料,实现了探测器的轻量化[2021.16(1)] ( )
2.大国工匠秦世俊展现数控技术所使用的0.01 mm铝箔,是由铝块加工而成,这体现了铝具有( )
A.密度小 B.导电性 C.导热性 D.延展性
3.我省武威市出土的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品,其制作材料主要是( )
A.合成材料 B.金属材料 C.天然材料 D.复合材料
4.下列对钛及其合金性质与用途对应关系的描述,错误的是( )
A.钛的导热性好——导线
B.钛合金强度高、耐腐蚀——医疗器械
C.钛合金具有生物相容性——人造骨骼
D.钛合金强度高、耐高温——航空航天材料
5.金属在生产和生活中应用极为广泛。
(1)“百炼成钢”,生铁和钢的本质区别是________________。
(2)下列生活用品利用金属良好导热性的是________(填字母序号)。
a.镀铬水龙头 b.铸铁暖气片 c.包糖果的铝箔
(3)焊接钢轨的反应原理是铝与氧化铁在高温条件下反应生成铁和氧化铝,该反应的化学方程式为____________。
命题点2 金属的冶炼
[知识逐点过]
1.金属的存在形式:在自然界中除少数不活泼的金属如金、银等有单质形式存在外,其余都以化合物的形式存在。
2.常见的矿石:赤铁矿________(填主要成分的化学式,后同);磁铁矿________;铝土矿Al2O3。
3.高炉炼铁
(1)原理
主要原理:________________________(写化学方程式)。
(2)原料:铁矿石、焦炭、石灰石和空气。
【特别提醒】各原料的作用:a.焦炭:提供热量,产生还原剂一氧化碳,涉及的化学方程式为______________、_____________。b.石灰石:将铁矿石中的二氧化硅转变为炉渣。
4.实验室模拟炼铁:一氧化碳还原氧化铁(详见教材实验到重难考法)
[教材实验到重难考法]
实验4 实验室模拟金属的冶炼
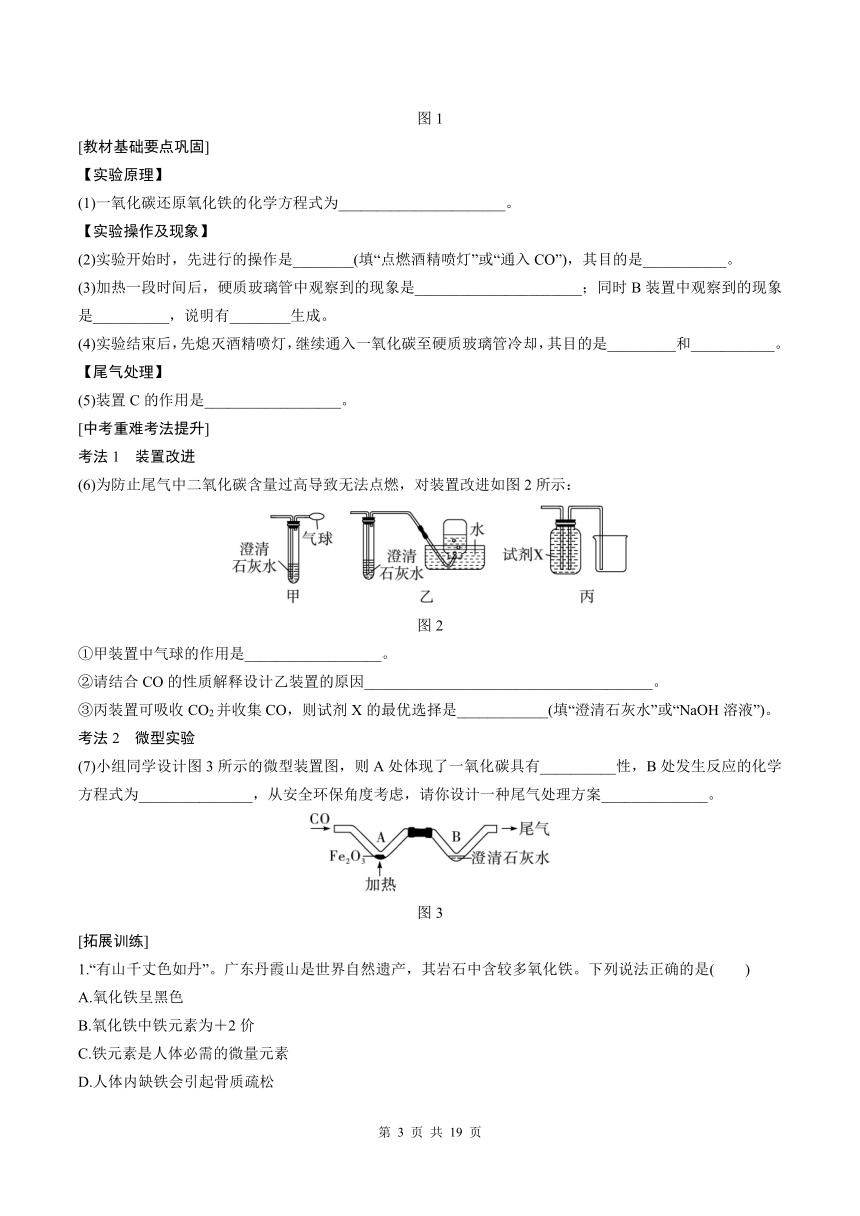
例 如图1为实验室模拟工业炼铁的装置,请回答下列问题:
(人教下P16图8-20)
图1
[教材基础要点巩固]
【实验原理】
(1)一氧化碳还原氧化铁的化学方程式为______________________。
【实验操作及现象】
(2)实验开始时,先进行的操作是________(填“点燃酒精喷灯”或“通入CO”),其目的是___________。
(3)加热一段时间后,硬质玻璃管中观察到的现象是______________________;同时B装置中观察到的现象是__________,说明有________生成。
(4)实验结束后,先熄灭酒精喷灯,继续通入一氧化碳至硬质玻璃管冷却,其目的是_________和___________。
【尾气处理】
(5)装置C的作用是__________________。
[中考重难考法提升]
考法1 装置改进
(6)为防止尾气中二氧化碳含量过高导致无法点燃,对装置改进如图2所示:
图2
①甲装置中气球的作用是__________________。
②请结合CO的性质解释设计乙装置的原因______________________________________。
③丙装置可吸收CO2并收集CO,则试剂X的最优选择是____________(填“澄清石灰水”或“NaOH溶液”)。
考法2 微型实验
(7)小组同学设计图3所示的微型装置图,则A处体现了一氧化碳具有__________性,B处发生反应的化学方程式为_______________,从安全环保角度考虑,请你设计一种尾气处理方案______________。
图3
[拓展训练]
1.“有山千丈色如丹”。广东丹霞山是世界自然遗产,其岩石中含较多氧化铁。下列说法正确的是( )
A.氧化铁呈黑色
B.氧化铁中铁元素为+2价
C.铁元素是人体必需的微量元素
D.人体内缺铁会引起骨质疏松
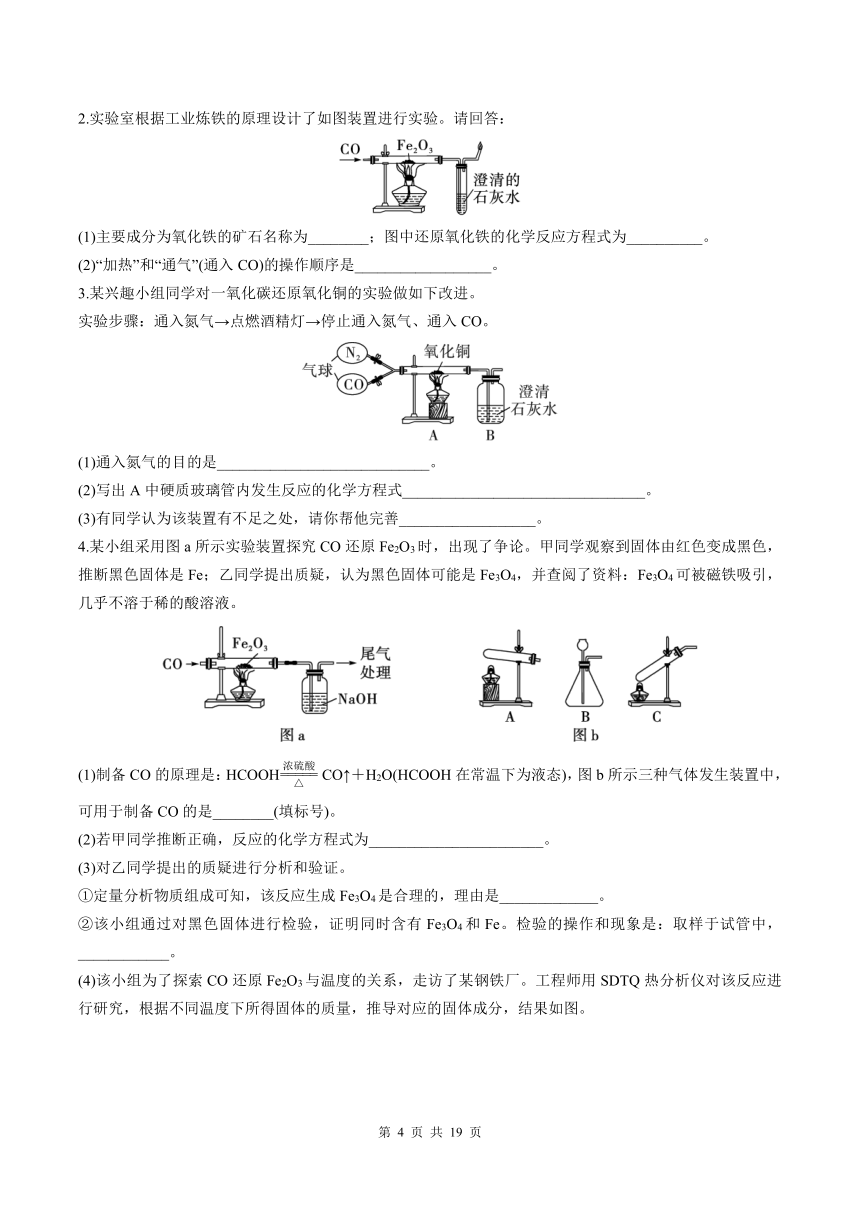
2.实验室根据工业炼铁的原理设计了如图装置进行实验。请回答:
(1)主要成分为氧化铁的矿石名称为________;图中还原氧化铁的化学反应方程式为__________。
(2)“加热”和“通气”(通入CO)的操作顺序是__________________。
3.某兴趣小组同学对一氧化碳还原氧化铜的实验做如下改进。
实验步骤:通入氮气→点燃酒精灯→停止通入氮气、通入CO。
(1)通入氮气的目的是____________________________。
(2)写出A中硬质玻璃管内发生反应的化学方程式________________________________。
(3)有同学认为该装置有不足之处,请你帮他完善__________________。
4.某小组采用图a所示实验装置探究CO还原Fe2O3时,出现了争论。甲同学观察到固体由红色变成黑色,推断黑色固体是Fe;乙同学提出质疑,认为黑色固体可能是Fe3O4,并查阅了资料:Fe3O4可被磁铁吸引,几乎不溶于稀的酸溶液。
(1)制备CO的原理是:HCOOH CO↑+H2O(HCOOH在常温下为液态),图b所示三种气体发生装置中,可用于制备CO的是________(填标号)。
(2)若甲同学推断正确,反应的化学方程式为_______________________。
(3)对乙同学提出的质疑进行分析和验证。
①定量分析物质组成可知,该反应生成Fe3O4是合理的,理由是_____________。
②该小组通过对黑色固体进行检验,证明同时含有Fe3O4和Fe。检验的操作和现象是:取样于试管中,____________。
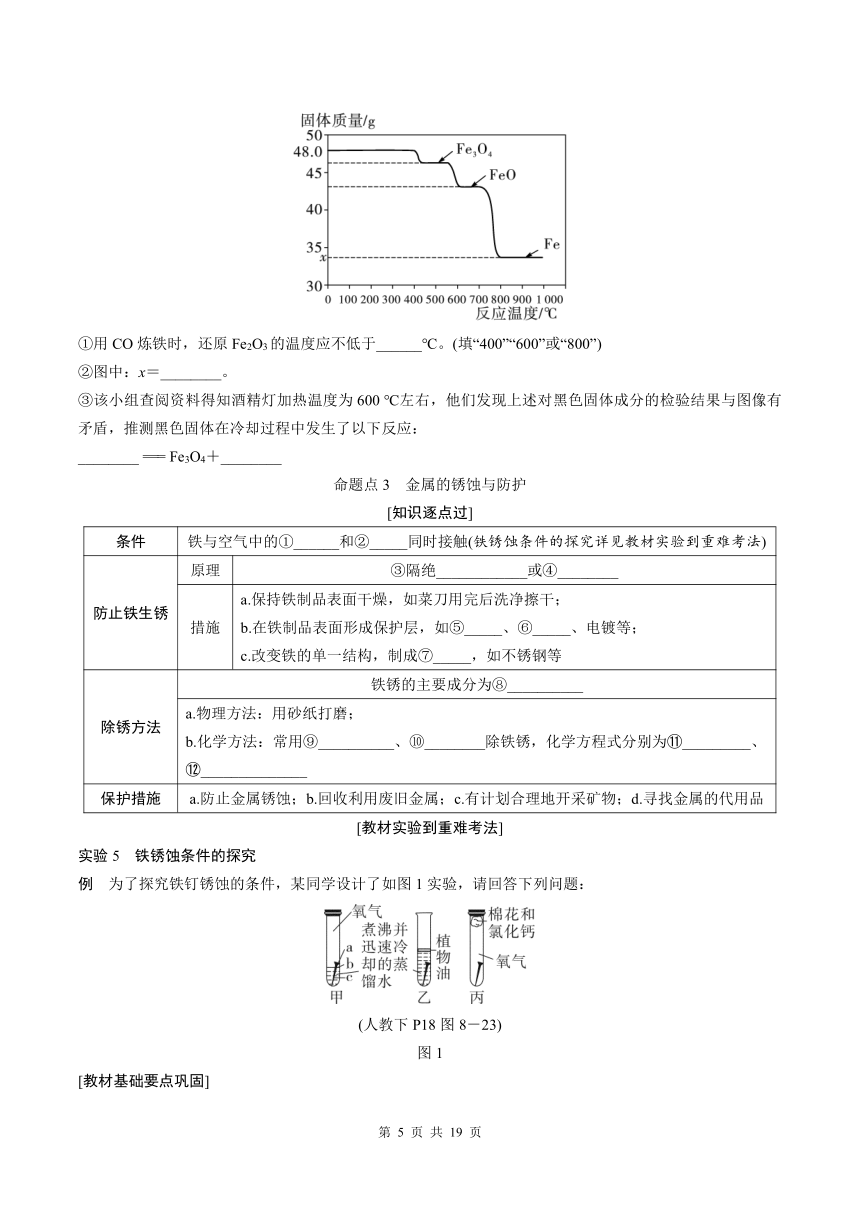
(4)该小组为了探索CO还原Fe2O3与温度的关系,走访了某钢铁厂。工程师用SDTQ热分析仪对该反应进行研究,根据不同温度下所得固体的质量,推导对应的固体成分,结果如图。
①用CO炼铁时,还原Fe2O3的温度应不低于______℃。(填“400”“600”或“800”)
②图中:x=________。
③该小组查阅资料得知酒精灯加热温度为600 ℃左右,他们发现上述对黑色固体成分的检验结果与图像有矛盾,推测黑色固体在冷却过程中发生了以下反应:
________ === Fe3O4+________
命题点3 金属的锈蚀与防护
[知识逐点过]
条件 铁与空气中的①______和②_____同时接触(铁锈蚀条件的探究详见教材实验到重难考法)
防止铁生锈 原理 ③隔绝____________或④________
措施 a.保持铁制品表面干燥,如菜刀用完后洗净擦干; b.在铁制品表面形成保护层,如⑤_____、⑥_____、电镀等; c.改变铁的单一结构,制成⑦_____,如不锈钢等
除锈方法 铁锈的主要成分为⑧__________
a.物理方法:用砂纸打磨; b.化学方法:常用⑨__________、⑩________除铁锈,化学方程式分别为 _________、 ______________
保护措施 a.防止金属锈蚀;b.回收利用废旧金属;c.有计划合理地开采矿物;d.寻找金属的代用品
[教材实验到重难考法]
实验5 铁锈蚀条件的探究
例 为了探究铁钉锈蚀的条件,某同学设计了如图1实验,请回答下列问题:
(人教下P18图8-23)
图1
[教材基础要点巩固]
【实验现象及分析】
(1)一周后,甲试管中铁钉生锈,且________(填“a”“b”或“c”)处锈蚀最严重;乙、丙试管中铁钉不生锈。
(2)对比试管______(填序号)中的现象,说明铁生锈需要与氧气接触;对比试管甲、丙中的现象,说明铁生锈需要与____接触。
【实验结论】
(3)通过上述实验可知,铁锈蚀的条件是与__________、__________同时接触。
【实验反思】
(4)实验前,将铁钉打磨光亮的目的是______________________。
(5)实验中所用的蒸馏水须经过煮沸并迅速冷却,目的是__________________。
(6)乙试管中植物油的作用是__________;丙试管中棉花和氯化钙的作用是____________。
[中考重难考法提升]
考法1 异常现象分析
(7)将乙试管再放置3天后,发现铁钉表面出现了少量锈迹,产生这种现象的原因是______________。
考法2 铁锈蚀速率的影响因素
(8)[数字化实验]同学们通过数字化传感器进一步研究铁锈蚀的影响因素,实验记录如下。下列分析不正确的是________(填字母)。
实验装置 序号 其他试剂 一段时间后O2的含量
① 干燥剂 21%
② 10滴水 15%
③ 10滴水和1.0 g食盐 8%
A.②③中O2含量减少表明铁已锈蚀
B.①②证明水对铁锈蚀有影响
C.②③证明食盐能加快铁锈蚀
D.①②③证明炭粉对铁锈蚀有影响
考法3 创新装置
(9)同学们完成上述实验后,又设计了图2实验探究铁锈蚀条件。一段时间后观察到干燥的钢丝棉不生锈,潮湿的钢丝棉生锈,证明钢铁锈蚀条件之一是与________接触;图2实验装置较图1的优点是__________。
图2
考法4 实验探究方法
(10)[思维模型]通过对铁锈蚀条件的探究,可构建出有关控制变量法的思维模型如下:
对比图1实验中甲、乙试管,可知变量为______________。
[拓展训练]
1.判断下列说法的正误:
(1)铁器在干燥的空气中不易生锈(2018.11C)( )
(2)铁制品表面刷漆可防止生锈(2020.10D)( )
2.探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气 C.甲和丙:空气 D.甲和丁:水
3.对铁生锈与燃烧条件的实验探究如图所示。下列说法正确的是( )
A.对比①②可探究:接触氧气是否为铁生锈的条件之一
B.对比②③可探究:接触水是否为铁生锈的条件之一
C.对比①④可探究:温度达到着火点是否为铁燃烧的条件之一
D.对比③④可探究:接触氧气是否为铁燃烧的条件之一
4.2017年冬天,某小伙子为了取暖在卫生间里贴满了“暖宝宝”(该产品的部分说明书为:“暖身更暖心,升温快。发热成分:高纯度铁粉、水、盐……;发热时间:10小时;平均温度:52 ℃”),他把门窗关闭以防暖气泄漏。几分钟后,他失去意识而倒地,幸而被门外的朋友及时救起。请回答:
(1)铁氧化发热,主要生成物的化学式为________;盐是催化剂,其质量和____________不变。
(2)该小伙子失去意识并不是温度过高和身体本身的原因,而是________________________。
5.下列防锈方法中,与其他三种方法原理不同的是( )
A.表面涂油
B.表面刷漆
C.覆盖塑料
D.制成合金
6.下列做法不能有效保护金属资源的是( )
A.防止金属腐蚀
B.寻找金属的代用品
C.回收利用废旧金属
D.肆意开采金属矿物
7.常德滨湖公园的“金刚塔”,俗称“铁树”,始建于北宋建隆年间。由于常德天气潮湿多雨,加上“金刚塔”主要成分为铁,导致表面局部锈蚀严重,需作保护处理。
(1)铁生锈的条件为____________,铁锈主要成分为________(填化学式)。
(2)常德“金刚塔”表面局部锈蚀严重,以下合理的除锈措施是________(填序号)。
A.直接喷洒稀盐酸 B.小心打磨生锈处 C.用水清洗
(3)请你写出一种防止铁制品锈蚀的措施______________________________________。
8.某兴趣小组进行铁腐蚀的实验探究。
【实验探究】该小组利用如下装置对铁钉锈蚀的条件进行探究,一段时间后,在A和B中没有观察到明显现象,C和D中铁钉有锈蚀。
(1)B中将蒸馏水煮沸的目的是____________________。
(2)ABD对比,说明铁钉锈蚀需要的物质是__________;C中的铁钉比D中的锈蚀更严重,原因是_________。
【拓展探究】(3)为进一步探究铁钉锈蚀过程中气态物质的变化,该小组按示意图E所示装置完成以下实验。恒温下,向锥形瓶中加入少量稀盐酸,同时测量锥形瓶内气体压强随时间的变化,直至反应完全。
①测量过程中要保持恒温,理由是__________________________________________。
②请在图F中绘制整个反应过程中锥形瓶内气体压强的变化趋势。
命题点4 金属的化学性质
1.下列有关金属的说法正确的是( )
A.“真金不怕火炼”说明金的熔点高
B.不可用铁质容器配制波尔多液
C.(易错易混)铁可与稀盐酸反应生成FeCl3
D.将铜片插入稀硫酸中,铜片表面有气泡冒出
2.A是目前世界年产量最高的金属,回答下列问题:
(1)反应①的现象是____________________________________。
(2)反应②的基本反应类型是______________________。
(3)写出D的一种用途________,反应③可证明A的金属活动性比D____(填“强”或“弱”)。
(4)反应④的化学方程式为______________________________。
[知识逐点过]
1.金属与氧气反应
(1)通式:金属+氧气―→金属氧化物(化合反应)
(2)举例
金属 现象 化学方程式
铝 常温下在空气中表面变暗 ①____________________________
镁 发出耀眼的②________,放出大量的热,生成白色固体 ③____________________________
铁 ④_______________________________________________ ⑤____________________________
铜 生成黑色固体 ⑥____________________________
2.金属与酸反应
(1)条件:参加反应的金属的活动性必须排在________之前。
(2)通式:金属+稀盐酸/稀硫酸―→盐+氢气(置换反应)。
(3)举例(以与稀盐酸的反应为例)
金属 现象 化学方程式
镁 剧烈反应,有大量气泡产生 ____________________________
锌 反应较剧烈,有较多气泡产生 ____________________________
铁 有少量气泡产生,溶液由无色逐渐变为____________ ____________________________
3.金属与金属盐溶液反应
(1)条件:①金属活动性比盐溶液中的金属强,K、Ca、Na除外;②反应中盐必须可溶。
(2)通式:金属+盐―→新金属+新盐(置换反应)。
(3)举例
反应物 现象 化学方程式
铁丝与硫酸铜溶液 铁丝表面附着①____色固体,溶液由蓝色逐渐变为浅绿色 ②_____________
铜丝与硝酸银溶液 铜丝表面有银白色固体生成,溶液由无色逐渐变为③______色 ④_____________
[构建物质网络]
一、与铁相关的反应与转化
1.请写出下列物质的化学式
甲____________ 乙______________
2.请写出图中对应标号的化学方程式
①________________________________________________________________________;
②________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________。
二、与铜相关的转化
1.请写出下列物质的化学式:甲________
2.请写出图中对应标号的化学方程式
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
[拓展训练]
1.取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是( )
2.写出铝与稀盐酸反应的化学方程式______________,其反应类型是____________。
3.硫酸锌(ZnSO4)可用于治疗锌缺乏引起的食欲不振、生长发育迟缓等病症。下列选项中的两种物质,不能直接反应制得硫酸锌的是( )
A.Zn和H2SO4 B.ZnO和H2SO4
C.ZnCO3和H2SO4 D.Zn和Na2SO4
4.“——”表示物质可以发生反应,“―→”表示物质可以转换,下列琴琴同学说法不正确的是( )
A.①的现象是有气泡产生
B.②可用于碳的不完全燃烧
C.③可用于工业炼铁
D.隔绝氧气或者水可以防止④的发生
5.钴(Co)的金属活动性与铁相似,钴的化合物相关性质如下。下列预测合理的是( )
物质 CoO Co(OH)2 CoCl2 CoCO3
在水中的溶解性 难溶,灰绿色固体 难溶,粉红色固体 易溶,溶液呈粉红色 难溶,粉红色固体
A.Co能从MgCl2溶液中置换出Mg B.CoO能与盐酸反应得到粉红色溶液
C.CoCO3能与盐酸反应生成H2 D.Co(OH)2可由Co与NaOH溶液反应制得
6.在初中化学“金属的性质”中有如下实验,将无锈铁钉浸入CuSO4溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是____________________。
【进行实验】如图将一端缠绕的铝丝浸入CuSO4溶液中,观察现象。
(2)铝丝表面未出现红色物质,原因是____________________。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
序号 实验现象 结论与解释
① 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 CuSO4溶液呈弱酸性,与Al反应产生的气体是________;蓝绿色物质成分待探究
② 24 h后,铝丝仍光亮;48 h后,铝丝表面出现少量红色物质 红色物质是________,说明Al能和CuSO4溶液反应,但反应较慢
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;
②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体,向其中加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为____________________________________________。
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是________(填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是________(填序号)。
A.食醋 B.食用油 C.面粉 D.咸菜
命题点5 金属活动性顺序的判断、验证和探究
[知识逐点过]
1.金属活动性顺序的判断
常见金属的活动性顺序
金属活动性的规律 a.金属的位置越靠前,它的活动性就越⑦________ b.位于氢前的金属能置换出稀盐酸、稀硫酸中的氢 c.位于⑧________的金属能把位于⑨________的金属从它们化合物的溶液里置换出来(K、Ca、Na除外)
金属活动性的判断 a.在自然界中的存在形式:以__________形式存在比以 ________形式存在的金属活动性强 b.人类开发利用的时间:金属活动性越 ____的金属开发利用的越晚 c.金属活动性顺序:金属的位置越靠前,它的活动性越 ________ d.与酸的反应:能与酸反应的金属比不能与酸反应的金属的活动性 _____ e.与金属盐溶液的反应:若置换反应能发生,则该金属单质的活动性强于盐溶液中的金属;若置换反应不能发生,则该金属单质的活动性弱于盐溶液中的金属
2.金属活动性顺序的验证和探究(详见教材实验到重难考法)
[教材实验到重难考法]
实验6 金属活动性顺序的验证及探究
例 如图是某兴趣小组为验证铁、铜、银的金属活动性顺序,设计了两组实验,请回答下列问题。
[教材基础要点巩固]
【实验原理】
(1)实验A、B中发生反应的化学方程式分别为____________________、______________________________。
【实验现象】
(2)实验A、B中所观察到的现象分别是____________________________、__________________________。
【实验结论】
(3)上述三种金属的活动性顺序由强到弱为_________________________________。,
【实验反思】
(4)实验前打磨金属丝表面的目的是______________。
[方法指导]
[中考重难考法提升]
考法1 实验方案设计
(5)下列实验方案也能达到上述实验目的的是______(填字母)。
A.将铁丝、铜丝分别放入硝酸银溶液中
B.将铁丝、铜丝和银丝分别放入稀盐酸中
C.将铜丝分别放入硝酸亚铁、硝酸银溶液中
D.先向硝酸银溶液中加入足量铜粉,充分反应后再加入铁粉,观察现象
[方法指导]
考法2 陌生金属活动性顺序的探究
(6)水龙头的制作中常用到金属铬,同学们对铬、铜、镁三种金属的活动性顺序进行了探究。
【查阅资料】已知Cr2+的盐溶液呈蓝色
【作出猜想】上述三种金属的活动性顺序是:
猜想一:Cr>Mg>Cu 猜想二:Mg>Cr>Cu 猜想三:______________。
【进行实验】取两片大小、形状完全相同且已打磨好的铬片和铜片,进行下列实验:
实验编号 实验1 实验2
实验操作
实验现象 A中铬片表面有气泡出现;B中_________________ 无明显现象
实验结论 猜想________正确
[方法指导] 金属活动性顺序的探究(以Mg、Cu、Cr为例) 第一步:排列已知金属的活动性顺序,Mg>Cu 第二步:猜想陌生金属可能在的位置(前、中、后) Cr(前)>Mg>Cu Mg>Cr(中)>Cu Mg>Cu>Cr(后) 第三步:设计实验验证。 【归纳总结】比较金属活动性强弱的常见方法有:①金属与氧气反应的难易和剧烈程度;②金属与酸溶液是否反应;③金属与金属盐溶液是否反应。
[拓展训练]
1.利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A.铁+稀盐酸 B.铜+稀盐酸 C.银+稀盐酸 D.铜+硝酸银溶液
2.室温下,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的________(填“强”或“弱”)。
3.铁和铜在自然环境中都能被腐蚀。下列不能说明铁比铜活泼的事实是( )
A.历史上铜比铁使用更早
B.铁的文物比铜的稀有
C.氧化铁能与盐酸反应而铜单质不能
D.铁能与硫酸铜溶液反应
4.现有 X、Y、Z三种金属,如果把Y和Z分别放入硝酸银溶液中,过一会儿,在 Y表面有银析出,而Z没有变化;如果把 X和 Y分别放入稀硫酸中,X溶解并产生气泡,Y不反应。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )
A.Z、Y、X B.X、Z、Y C.X、Y、Z D.Y、X、Z
5.为验证铜、银、铁的金属活动性顺序,同学们设计了如图所示的6个实验。图中,“―→”表示将金属加入到盐溶液。
(1)⑤中,反应的化学方程式为____________________________。
(2)设计②的目的是________________________。
(3)仅由④和⑥不能得出铜、银、铁的金属活动性顺序,理由是______________________。
6.M是生产生活中常见的金属。张老师带领化学兴趣小组的同学欲探究M 与铜、铝的活动性顺序。
【查阅资料】MSO4溶液是无色液体。
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小玉的猜想是Al>Cu>M;小静的猜想是Al>M>Cu;你的猜想是__________。
【设计与实验一】小影取长短、粗细相同的 M丝、铜丝、铝丝和编号为①②③的3支试管,进行如表的实验(试管中均盛有相同体积、相同浓度的稀盐酸):
实验操作 M丝插入试管①中 铜丝插入试管②中 铝丝插入试管③中 实验结论
刚开始的现象 有少量气泡产生 无气泡 无气泡 M>Cu;M>Al
几分钟后的现象 有少量气泡产生 无气泡 有大量气泡产生 ________
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因是________________________________,因而无气泡产生。
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取长短、粗细相同、打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是______________________________________。
(2)试管丙中反应的化学方程式为________________________________。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管__________(填试管编号)中的实验,也可以得出正确的结论。
【拓展与延伸】如果只用两种金属和一种溶液来探究三种金属的活动性强弱,则该溶液是________(填化学式)溶液。
第5讲
命题点1
1.C 2.D
知识逐点过
1.纯金属 合金
2.导电 导热 延展 紫红
3.金属 更大 更强 更低 含碳量不同
[拓展训练]
1.(1)√ (2)√ (3)√
2.D 3.B 4.A
5.(1)含碳量不同 (2)b (3)2Al+Fe2O3 2Fe+Al2O3
命题点2
知识逐点过
2.Fe2O3 Fe3O4
3.(1)3CO+Fe2O3 2Fe+3CO2
【特别提醒】a.C+O2CO2 CO2+C 2CO
教材实验到重难考法
例 (1)3CO+Fe2O3 2Fe+3CO2 (2)通入CO 排尽装置中的空气,防止加热时发生爆炸 (3)红棕色粉末逐渐变为黑色 澄清石灰水变浑浊 二氧化碳(或CO2) (4)防止生成的铁再次被氧化 防止石灰水倒吸使硬质玻璃管炸裂 (5)尾气处理
(6) ①收集尾气 ②一氧化碳难溶于水也不与水反应,可用排水法收集(合理即可) ③NaOH溶液 (7)还原 CO2+Ca(OH)2 === CaCO3↓+H2O 在装置末端放置一只点燃的酒精灯(或在装置尾部系一只气球等,合理即可)
[拓展训练]
1.C
2.(1)赤铁矿 3CO+Fe2O3 2Fe+3CO2 (2)先通气再加热
3.(1)排尽装置内空气,防止加热CO与空气的混合气体时发生爆炸 (2)CO+CuO Cu+CO2
(3)增加尾气处理装置
4.(1)C (2)Fe2O3+3CO 2Fe+3CO2 (3)①Fe3O4中氧元素质量分数比Fe2O3中的低,Fe2O3发生还原反应也可能生成Fe3O4(合理即可) ②加入足量稀盐酸,观察到有气泡产生,溶液由无色变为浅绿色,试管底部有黑色固体剩余(合理即可) (4)①800
②33.6 ③4FeO Fe
命题点3
知识逐点过
①氧气(或O2) ②水蒸气(或H2O) ③空气(或氧气或O2) ④水(或H2O) ⑤刷漆(合理即可)
⑥涂油(合理即可) ⑦合金
⑧Fe2O3(或氧化铁) ⑨稀盐酸 ⑩稀硫酸
Fe2O3+6HCl=== 2FeCl3+3H2O
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
教材实验到重难考法
例 (1)b (2)甲、乙 水 (3)氧气(或空气) 水
(4)除去铁钉表面的氧化物和污物 (5)除去水中溶解的氧气 (6)隔绝空气(或氧气) 作干燥剂
(7)空气中的氧气进入水中(或植物油不能完全隔绝空气或氧气,合理即可)
(8)D (9)水 节约药品(或更有对比性等,合理即可) (10)是否与氧气(或空气)接触
[拓展训练]
1.(1)√ (2)√
2.D 3.C
4.(1)Fe2O3 化学性质 (2)铁氧化消耗O2,导致缺氧
5.D 6.D
7.(1)铁与氧气(或空气)和水接触 Fe2O3 (2)B (3)刷漆(或涂油、保持铁制品表面干燥等,合理即可)
8.(1)除去水中溶解的氧气 (2)水和氧气(或H2O和O2) C中O2更充足(合理即可) (3)①排除温度变化对压强的影响(合理即可)
②(合理即可)
命题点4
1.B
2.(1)剧烈燃烧,火星四射,放出大量的热,生成黑色固体 (2)置换反应 (3)作导线(合理即可) 强
(4)3CO+Fe2O3 2Fe+3CO2
知识逐点过
1.(2)①4Al+3O2=== 2Al2O3 ②白光 ③2Mg+O2 2MgO
④剧烈燃烧,火星四射,放出大量的热,生成黑色固体 ⑤3Fe+2O2 Fe3O4 ⑥2Cu+O2 2CuO
2.(1)氢(或H) (3)Mg+2HCl=== MgCl2+H2↑ Zn+2HCl=== ZnCl2+H2↑ 浅绿色
Fe+2HCl=== FeCl2+H2↑
3.(3)①红 ②Fe+CuSO4=== FeSO4+Cu ③蓝
④Cu+2AgNO3=== Cu(NO3)2+2Ag
构建物质网络
一、1.Cu(NO3)2(合理即可) Fe2O3
2.①3Fe+2O2 Fe3O4
②Fe+H2SO4=== FeSO4+H2↑
④Fe+Cu(NO3)2=== Fe(NO3)2+Cu(与甲物质对应)
⑤3CO+Fe2O3 2Fe+3CO2
⑥Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
二、1.CuO 2.①2Cu+O2 2CuO ②H2+CuO Cu+H2O(合理即可)
③Cu(NO3)2+2NaOH=== Cu(OH)2↓+2NaNO3(合理即可)
[拓展训练]
1.B
2.2Al+6HCl===2AlCl3+3H2↑ 置换反应
3.D 4.A 5.B
6.(1)铝的金属活动性比铜强 (2)铝丝表面有一层致密的氧化铝薄膜(合理即可) (3)①H2(或氢气) ②Cu(或铜)
(4)Cu2(OH)2SO4+H2SO4===2CuSO4+2H2O
(5)NaCl(或其他含Cl-的可溶性盐等,合理即可) (6)AD
命题点5
知识逐点过
1.①Mg ②Fe ③Cu ④Ag ⑤强 ⑥弱 ⑦强
⑧前面 ⑨后面 ⑩化合物 单质 强 强
强
教材实验到重难考法
例 (1)Fe+CuSO4=== FeSO4+Cu Cu+2AgNO3=== Cu(NO3)2+2Ag (2)铁丝表面析出红色固体,溶液由蓝色逐渐变为浅绿色 铜丝表面析出固体,溶液由无色逐渐变为蓝色 (3)Fe>Cu>Ag(或铁>铜>银)
(4)除去金属丝表面的氧化物及污物 (5)CD
(6)【作出猜想】Mg>Cu>Cr 【进行实验】无明显现象
二
[拓展训练]
1.C 2.弱 3.C 4.C
5.(1)Fe+CuSO4 === FeSO4+Cu
(2)验证铜和银的金属活动性顺序
(3)无法验证铁和铜的金属活动性顺序
6.【猜想与假设】M>Al>Cu
【设计与实验一】Al>M>Cu
【交流与表达】金属铝丝未打磨,氧化铝先和稀盐酸反应生成氯化铝和水
【设计与实验二】(1)M丝表面析出红色固体,溶液由蓝色逐渐变为无色
(2)2Al+3CuSO4=== Al2(SO4)3+3Cu
【交流与表达】丙
【拓展与延伸】MSO4(合理即可)
命题点1 金属材料
1. (易错易混)下列有关金属材料的说法正确的是( )
A.含有金属元素的物质都属于金属材料
B.银是导电性最好的金属,常用作导线
C.合金组成改变,性能也会发生改变
D.金属能导电,则能导电的物质一定是金属
2. (易错易混)下列有关合金的说法正确的是( )
A.钢、氧化铁均属于合金
B.合金中只有金属元素
C.合金属于合成材料
D.黄铜比纯铜硬度大
[知识逐点过]
1.金属材料:包括________和________。
2.纯金属的物理性质及用途
物理性质及用途
共性 a.有金属光泽,如制作各种饰品; b.________性,如用铜丝作导线; c.________性,如用铁锅做饭; d.________性,如铝能制成铝箔
特性 颜色:大多数金属呈银白色(铁在粉末状时呈黑色),但铜呈________色,金呈黄色 状态:常温下,大多数金属都是固体,而汞是液体
3.合金(6年4考)
概念 在金属中加热熔合某些金属或非金属,制得具有______特征的物质
性能 与其组分金属相比,合金的硬度和强度______、抗腐蚀性______、熔点______
常见的合金 a.铁合金:生铁和钢都属于铁合金,两者性能不同的原因是_________________; b.钛合金:与人体具有良好的“相容性”,因此可用于制造人造骨等; c.其他合金:黄铜(铜锌合金)、青铜、铝合金等
[拓展训练]
1.判断下列说法的正误:
(1)铜具有良好的导电性,可制作导线(2019.8C)( )
(2)铝合金的硬度比纯铝大(2022.12D)( )
(3)火星车使用的新型镁锂合金属于金属材料,实现了探测器的轻量化[2021.16(1)] ( )
2.大国工匠秦世俊展现数控技术所使用的0.01 mm铝箔,是由铝块加工而成,这体现了铝具有( )
A.密度小 B.导电性 C.导热性 D.延展性
3.我省武威市出土的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品,其制作材料主要是( )
A.合成材料 B.金属材料 C.天然材料 D.复合材料
4.下列对钛及其合金性质与用途对应关系的描述,错误的是( )
A.钛的导热性好——导线
B.钛合金强度高、耐腐蚀——医疗器械
C.钛合金具有生物相容性——人造骨骼
D.钛合金强度高、耐高温——航空航天材料
5.金属在生产和生活中应用极为广泛。
(1)“百炼成钢”,生铁和钢的本质区别是________________。
(2)下列生活用品利用金属良好导热性的是________(填字母序号)。
a.镀铬水龙头 b.铸铁暖气片 c.包糖果的铝箔
(3)焊接钢轨的反应原理是铝与氧化铁在高温条件下反应生成铁和氧化铝,该反应的化学方程式为____________。
命题点2 金属的冶炼
[知识逐点过]
1.金属的存在形式:在自然界中除少数不活泼的金属如金、银等有单质形式存在外,其余都以化合物的形式存在。
2.常见的矿石:赤铁矿________(填主要成分的化学式,后同);磁铁矿________;铝土矿Al2O3。
3.高炉炼铁
(1)原理
主要原理:________________________(写化学方程式)。
(2)原料:铁矿石、焦炭、石灰石和空气。
【特别提醒】各原料的作用:a.焦炭:提供热量,产生还原剂一氧化碳,涉及的化学方程式为______________、_____________。b.石灰石:将铁矿石中的二氧化硅转变为炉渣。
4.实验室模拟炼铁:一氧化碳还原氧化铁(详见教材实验到重难考法)
[教材实验到重难考法]
实验4 实验室模拟金属的冶炼
例 如图1为实验室模拟工业炼铁的装置,请回答下列问题:
(人教下P16图8-20)
图1
[教材基础要点巩固]
【实验原理】
(1)一氧化碳还原氧化铁的化学方程式为______________________。
【实验操作及现象】
(2)实验开始时,先进行的操作是________(填“点燃酒精喷灯”或“通入CO”),其目的是___________。
(3)加热一段时间后,硬质玻璃管中观察到的现象是______________________;同时B装置中观察到的现象是__________,说明有________生成。
(4)实验结束后,先熄灭酒精喷灯,继续通入一氧化碳至硬质玻璃管冷却,其目的是_________和___________。
【尾气处理】
(5)装置C的作用是__________________。
[中考重难考法提升]
考法1 装置改进
(6)为防止尾气中二氧化碳含量过高导致无法点燃,对装置改进如图2所示:
图2
①甲装置中气球的作用是__________________。
②请结合CO的性质解释设计乙装置的原因______________________________________。
③丙装置可吸收CO2并收集CO,则试剂X的最优选择是____________(填“澄清石灰水”或“NaOH溶液”)。
考法2 微型实验
(7)小组同学设计图3所示的微型装置图,则A处体现了一氧化碳具有__________性,B处发生反应的化学方程式为_______________,从安全环保角度考虑,请你设计一种尾气处理方案______________。
图3
[拓展训练]
1.“有山千丈色如丹”。广东丹霞山是世界自然遗产,其岩石中含较多氧化铁。下列说法正确的是( )
A.氧化铁呈黑色
B.氧化铁中铁元素为+2价
C.铁元素是人体必需的微量元素
D.人体内缺铁会引起骨质疏松
2.实验室根据工业炼铁的原理设计了如图装置进行实验。请回答:
(1)主要成分为氧化铁的矿石名称为________;图中还原氧化铁的化学反应方程式为__________。
(2)“加热”和“通气”(通入CO)的操作顺序是__________________。
3.某兴趣小组同学对一氧化碳还原氧化铜的实验做如下改进。
实验步骤:通入氮气→点燃酒精灯→停止通入氮气、通入CO。
(1)通入氮气的目的是____________________________。
(2)写出A中硬质玻璃管内发生反应的化学方程式________________________________。
(3)有同学认为该装置有不足之处,请你帮他完善__________________。
4.某小组采用图a所示实验装置探究CO还原Fe2O3时,出现了争论。甲同学观察到固体由红色变成黑色,推断黑色固体是Fe;乙同学提出质疑,认为黑色固体可能是Fe3O4,并查阅了资料:Fe3O4可被磁铁吸引,几乎不溶于稀的酸溶液。
(1)制备CO的原理是:HCOOH CO↑+H2O(HCOOH在常温下为液态),图b所示三种气体发生装置中,可用于制备CO的是________(填标号)。
(2)若甲同学推断正确,反应的化学方程式为_______________________。
(3)对乙同学提出的质疑进行分析和验证。
①定量分析物质组成可知,该反应生成Fe3O4是合理的,理由是_____________。
②该小组通过对黑色固体进行检验,证明同时含有Fe3O4和Fe。检验的操作和现象是:取样于试管中,____________。
(4)该小组为了探索CO还原Fe2O3与温度的关系,走访了某钢铁厂。工程师用SDTQ热分析仪对该反应进行研究,根据不同温度下所得固体的质量,推导对应的固体成分,结果如图。
①用CO炼铁时,还原Fe2O3的温度应不低于______℃。(填“400”“600”或“800”)
②图中:x=________。
③该小组查阅资料得知酒精灯加热温度为600 ℃左右,他们发现上述对黑色固体成分的检验结果与图像有矛盾,推测黑色固体在冷却过程中发生了以下反应:
________ === Fe3O4+________
命题点3 金属的锈蚀与防护
[知识逐点过]
条件 铁与空气中的①______和②_____同时接触(铁锈蚀条件的探究详见教材实验到重难考法)
防止铁生锈 原理 ③隔绝____________或④________
措施 a.保持铁制品表面干燥,如菜刀用完后洗净擦干; b.在铁制品表面形成保护层,如⑤_____、⑥_____、电镀等; c.改变铁的单一结构,制成⑦_____,如不锈钢等
除锈方法 铁锈的主要成分为⑧__________
a.物理方法:用砂纸打磨; b.化学方法:常用⑨__________、⑩________除铁锈,化学方程式分别为 _________、 ______________
保护措施 a.防止金属锈蚀;b.回收利用废旧金属;c.有计划合理地开采矿物;d.寻找金属的代用品
[教材实验到重难考法]
实验5 铁锈蚀条件的探究
例 为了探究铁钉锈蚀的条件,某同学设计了如图1实验,请回答下列问题:
(人教下P18图8-23)
图1
[教材基础要点巩固]
【实验现象及分析】
(1)一周后,甲试管中铁钉生锈,且________(填“a”“b”或“c”)处锈蚀最严重;乙、丙试管中铁钉不生锈。
(2)对比试管______(填序号)中的现象,说明铁生锈需要与氧气接触;对比试管甲、丙中的现象,说明铁生锈需要与____接触。
【实验结论】
(3)通过上述实验可知,铁锈蚀的条件是与__________、__________同时接触。
【实验反思】
(4)实验前,将铁钉打磨光亮的目的是______________________。
(5)实验中所用的蒸馏水须经过煮沸并迅速冷却,目的是__________________。
(6)乙试管中植物油的作用是__________;丙试管中棉花和氯化钙的作用是____________。
[中考重难考法提升]
考法1 异常现象分析
(7)将乙试管再放置3天后,发现铁钉表面出现了少量锈迹,产生这种现象的原因是______________。
考法2 铁锈蚀速率的影响因素
(8)[数字化实验]同学们通过数字化传感器进一步研究铁锈蚀的影响因素,实验记录如下。下列分析不正确的是________(填字母)。
实验装置 序号 其他试剂 一段时间后O2的含量
① 干燥剂 21%
② 10滴水 15%
③ 10滴水和1.0 g食盐 8%
A.②③中O2含量减少表明铁已锈蚀
B.①②证明水对铁锈蚀有影响
C.②③证明食盐能加快铁锈蚀
D.①②③证明炭粉对铁锈蚀有影响
考法3 创新装置
(9)同学们完成上述实验后,又设计了图2实验探究铁锈蚀条件。一段时间后观察到干燥的钢丝棉不生锈,潮湿的钢丝棉生锈,证明钢铁锈蚀条件之一是与________接触;图2实验装置较图1的优点是__________。
图2
考法4 实验探究方法
(10)[思维模型]通过对铁锈蚀条件的探究,可构建出有关控制变量法的思维模型如下:
对比图1实验中甲、乙试管,可知变量为______________。
[拓展训练]
1.判断下列说法的正误:
(1)铁器在干燥的空气中不易生锈(2018.11C)( )
(2)铁制品表面刷漆可防止生锈(2020.10D)( )
2.探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气 C.甲和丙:空气 D.甲和丁:水
3.对铁生锈与燃烧条件的实验探究如图所示。下列说法正确的是( )
A.对比①②可探究:接触氧气是否为铁生锈的条件之一
B.对比②③可探究:接触水是否为铁生锈的条件之一
C.对比①④可探究:温度达到着火点是否为铁燃烧的条件之一
D.对比③④可探究:接触氧气是否为铁燃烧的条件之一
4.2017年冬天,某小伙子为了取暖在卫生间里贴满了“暖宝宝”(该产品的部分说明书为:“暖身更暖心,升温快。发热成分:高纯度铁粉、水、盐……;发热时间:10小时;平均温度:52 ℃”),他把门窗关闭以防暖气泄漏。几分钟后,他失去意识而倒地,幸而被门外的朋友及时救起。请回答:
(1)铁氧化发热,主要生成物的化学式为________;盐是催化剂,其质量和____________不变。
(2)该小伙子失去意识并不是温度过高和身体本身的原因,而是________________________。
5.下列防锈方法中,与其他三种方法原理不同的是( )
A.表面涂油
B.表面刷漆
C.覆盖塑料
D.制成合金
6.下列做法不能有效保护金属资源的是( )
A.防止金属腐蚀
B.寻找金属的代用品
C.回收利用废旧金属
D.肆意开采金属矿物
7.常德滨湖公园的“金刚塔”,俗称“铁树”,始建于北宋建隆年间。由于常德天气潮湿多雨,加上“金刚塔”主要成分为铁,导致表面局部锈蚀严重,需作保护处理。
(1)铁生锈的条件为____________,铁锈主要成分为________(填化学式)。
(2)常德“金刚塔”表面局部锈蚀严重,以下合理的除锈措施是________(填序号)。
A.直接喷洒稀盐酸 B.小心打磨生锈处 C.用水清洗
(3)请你写出一种防止铁制品锈蚀的措施______________________________________。
8.某兴趣小组进行铁腐蚀的实验探究。
【实验探究】该小组利用如下装置对铁钉锈蚀的条件进行探究,一段时间后,在A和B中没有观察到明显现象,C和D中铁钉有锈蚀。
(1)B中将蒸馏水煮沸的目的是____________________。
(2)ABD对比,说明铁钉锈蚀需要的物质是__________;C中的铁钉比D中的锈蚀更严重,原因是_________。
【拓展探究】(3)为进一步探究铁钉锈蚀过程中气态物质的变化,该小组按示意图E所示装置完成以下实验。恒温下,向锥形瓶中加入少量稀盐酸,同时测量锥形瓶内气体压强随时间的变化,直至反应完全。
①测量过程中要保持恒温,理由是__________________________________________。
②请在图F中绘制整个反应过程中锥形瓶内气体压强的变化趋势。
命题点4 金属的化学性质
1.下列有关金属的说法正确的是( )
A.“真金不怕火炼”说明金的熔点高
B.不可用铁质容器配制波尔多液
C.(易错易混)铁可与稀盐酸反应生成FeCl3
D.将铜片插入稀硫酸中,铜片表面有气泡冒出
2.A是目前世界年产量最高的金属,回答下列问题:
(1)反应①的现象是____________________________________。
(2)反应②的基本反应类型是______________________。
(3)写出D的一种用途________,反应③可证明A的金属活动性比D____(填“强”或“弱”)。
(4)反应④的化学方程式为______________________________。
[知识逐点过]
1.金属与氧气反应
(1)通式:金属+氧气―→金属氧化物(化合反应)
(2)举例
金属 现象 化学方程式
铝 常温下在空气中表面变暗 ①____________________________
镁 发出耀眼的②________,放出大量的热,生成白色固体 ③____________________________
铁 ④_______________________________________________ ⑤____________________________
铜 生成黑色固体 ⑥____________________________
2.金属与酸反应
(1)条件:参加反应的金属的活动性必须排在________之前。
(2)通式:金属+稀盐酸/稀硫酸―→盐+氢气(置换反应)。
(3)举例(以与稀盐酸的反应为例)
金属 现象 化学方程式
镁 剧烈反应,有大量气泡产生 ____________________________
锌 反应较剧烈,有较多气泡产生 ____________________________
铁 有少量气泡产生,溶液由无色逐渐变为____________ ____________________________
3.金属与金属盐溶液反应
(1)条件:①金属活动性比盐溶液中的金属强,K、Ca、Na除外;②反应中盐必须可溶。
(2)通式:金属+盐―→新金属+新盐(置换反应)。
(3)举例
反应物 现象 化学方程式
铁丝与硫酸铜溶液 铁丝表面附着①____色固体,溶液由蓝色逐渐变为浅绿色 ②_____________
铜丝与硝酸银溶液 铜丝表面有银白色固体生成,溶液由无色逐渐变为③______色 ④_____________
[构建物质网络]
一、与铁相关的反应与转化
1.请写出下列物质的化学式
甲____________ 乙______________
2.请写出图中对应标号的化学方程式
①________________________________________________________________________;
②________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________。
二、与铜相关的转化
1.请写出下列物质的化学式:甲________
2.请写出图中对应标号的化学方程式
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
[拓展训练]
1.取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是( )
2.写出铝与稀盐酸反应的化学方程式______________,其反应类型是____________。
3.硫酸锌(ZnSO4)可用于治疗锌缺乏引起的食欲不振、生长发育迟缓等病症。下列选项中的两种物质,不能直接反应制得硫酸锌的是( )
A.Zn和H2SO4 B.ZnO和H2SO4
C.ZnCO3和H2SO4 D.Zn和Na2SO4
4.“——”表示物质可以发生反应,“―→”表示物质可以转换,下列琴琴同学说法不正确的是( )
A.①的现象是有气泡产生
B.②可用于碳的不完全燃烧
C.③可用于工业炼铁
D.隔绝氧气或者水可以防止④的发生
5.钴(Co)的金属活动性与铁相似,钴的化合物相关性质如下。下列预测合理的是( )
物质 CoO Co(OH)2 CoCl2 CoCO3
在水中的溶解性 难溶,灰绿色固体 难溶,粉红色固体 易溶,溶液呈粉红色 难溶,粉红色固体
A.Co能从MgCl2溶液中置换出Mg B.CoO能与盐酸反应得到粉红色溶液
C.CoCO3能与盐酸反应生成H2 D.Co(OH)2可由Co与NaOH溶液反应制得
6.在初中化学“金属的性质”中有如下实验,将无锈铁钉浸入CuSO4溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是____________________。
【进行实验】如图将一端缠绕的铝丝浸入CuSO4溶液中,观察现象。
(2)铝丝表面未出现红色物质,原因是____________________。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
序号 实验现象 结论与解释
① 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 CuSO4溶液呈弱酸性,与Al反应产生的气体是________;蓝绿色物质成分待探究
② 24 h后,铝丝仍光亮;48 h后,铝丝表面出现少量红色物质 红色物质是________,说明Al能和CuSO4溶液反应,但反应较慢
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;
②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体,向其中加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为____________________________________________。
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是________(填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是________(填序号)。
A.食醋 B.食用油 C.面粉 D.咸菜
命题点5 金属活动性顺序的判断、验证和探究
[知识逐点过]
1.金属活动性顺序的判断
常见金属的活动性顺序
金属活动性的规律 a.金属的位置越靠前,它的活动性就越⑦________ b.位于氢前的金属能置换出稀盐酸、稀硫酸中的氢 c.位于⑧________的金属能把位于⑨________的金属从它们化合物的溶液里置换出来(K、Ca、Na除外)
金属活动性的判断 a.在自然界中的存在形式:以__________形式存在比以 ________形式存在的金属活动性强 b.人类开发利用的时间:金属活动性越 ____的金属开发利用的越晚 c.金属活动性顺序:金属的位置越靠前,它的活动性越 ________ d.与酸的反应:能与酸反应的金属比不能与酸反应的金属的活动性 _____ e.与金属盐溶液的反应:若置换反应能发生,则该金属单质的活动性强于盐溶液中的金属;若置换反应不能发生,则该金属单质的活动性弱于盐溶液中的金属
2.金属活动性顺序的验证和探究(详见教材实验到重难考法)
[教材实验到重难考法]
实验6 金属活动性顺序的验证及探究
例 如图是某兴趣小组为验证铁、铜、银的金属活动性顺序,设计了两组实验,请回答下列问题。
[教材基础要点巩固]
【实验原理】
(1)实验A、B中发生反应的化学方程式分别为____________________、______________________________。
【实验现象】
(2)实验A、B中所观察到的现象分别是____________________________、__________________________。
【实验结论】
(3)上述三种金属的活动性顺序由强到弱为_________________________________。,
【实验反思】
(4)实验前打磨金属丝表面的目的是______________。
[方法指导]
[中考重难考法提升]
考法1 实验方案设计
(5)下列实验方案也能达到上述实验目的的是______(填字母)。
A.将铁丝、铜丝分别放入硝酸银溶液中
B.将铁丝、铜丝和银丝分别放入稀盐酸中
C.将铜丝分别放入硝酸亚铁、硝酸银溶液中
D.先向硝酸银溶液中加入足量铜粉,充分反应后再加入铁粉,观察现象
[方法指导]
考法2 陌生金属活动性顺序的探究
(6)水龙头的制作中常用到金属铬,同学们对铬、铜、镁三种金属的活动性顺序进行了探究。
【查阅资料】已知Cr2+的盐溶液呈蓝色
【作出猜想】上述三种金属的活动性顺序是:
猜想一:Cr>Mg>Cu 猜想二:Mg>Cr>Cu 猜想三:______________。
【进行实验】取两片大小、形状完全相同且已打磨好的铬片和铜片,进行下列实验:
实验编号 实验1 实验2
实验操作
实验现象 A中铬片表面有气泡出现;B中_________________ 无明显现象
实验结论 猜想________正确
[方法指导] 金属活动性顺序的探究(以Mg、Cu、Cr为例) 第一步:排列已知金属的活动性顺序,Mg>Cu 第二步:猜想陌生金属可能在的位置(前、中、后) Cr(前)>Mg>Cu Mg>Cr(中)>Cu Mg>Cu>Cr(后) 第三步:设计实验验证。 【归纳总结】比较金属活动性强弱的常见方法有:①金属与氧气反应的难易和剧烈程度;②金属与酸溶液是否反应;③金属与金属盐溶液是否反应。
[拓展训练]
1.利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A.铁+稀盐酸 B.铜+稀盐酸 C.银+稀盐酸 D.铜+硝酸银溶液
2.室温下,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的________(填“强”或“弱”)。
3.铁和铜在自然环境中都能被腐蚀。下列不能说明铁比铜活泼的事实是( )
A.历史上铜比铁使用更早
B.铁的文物比铜的稀有
C.氧化铁能与盐酸反应而铜单质不能
D.铁能与硫酸铜溶液反应
4.现有 X、Y、Z三种金属,如果把Y和Z分别放入硝酸银溶液中,过一会儿,在 Y表面有银析出,而Z没有变化;如果把 X和 Y分别放入稀硫酸中,X溶解并产生气泡,Y不反应。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )
A.Z、Y、X B.X、Z、Y C.X、Y、Z D.Y、X、Z
5.为验证铜、银、铁的金属活动性顺序,同学们设计了如图所示的6个实验。图中,“―→”表示将金属加入到盐溶液。
(1)⑤中,反应的化学方程式为____________________________。
(2)设计②的目的是________________________。
(3)仅由④和⑥不能得出铜、银、铁的金属活动性顺序,理由是______________________。
6.M是生产生活中常见的金属。张老师带领化学兴趣小组的同学欲探究M 与铜、铝的活动性顺序。
【查阅资料】MSO4溶液是无色液体。
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小玉的猜想是Al>Cu>M;小静的猜想是Al>M>Cu;你的猜想是__________。
【设计与实验一】小影取长短、粗细相同的 M丝、铜丝、铝丝和编号为①②③的3支试管,进行如表的实验(试管中均盛有相同体积、相同浓度的稀盐酸):
实验操作 M丝插入试管①中 铜丝插入试管②中 铝丝插入试管③中 实验结论
刚开始的现象 有少量气泡产生 无气泡 无气泡 M>Cu;M>Al
几分钟后的现象 有少量气泡产生 无气泡 有大量气泡产生 ________
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因是________________________________,因而无气泡产生。
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取长短、粗细相同、打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是______________________________________。
(2)试管丙中反应的化学方程式为________________________________。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管__________(填试管编号)中的实验,也可以得出正确的结论。
【拓展与延伸】如果只用两种金属和一种溶液来探究三种金属的活动性强弱,则该溶液是________(填化学式)溶液。
第5讲
命题点1
1.C 2.D
知识逐点过
1.纯金属 合金
2.导电 导热 延展 紫红
3.金属 更大 更强 更低 含碳量不同
[拓展训练]
1.(1)√ (2)√ (3)√
2.D 3.B 4.A
5.(1)含碳量不同 (2)b (3)2Al+Fe2O3 2Fe+Al2O3
命题点2
知识逐点过
2.Fe2O3 Fe3O4
3.(1)3CO+Fe2O3 2Fe+3CO2
【特别提醒】a.C+O2CO2 CO2+C 2CO
教材实验到重难考法
例 (1)3CO+Fe2O3 2Fe+3CO2 (2)通入CO 排尽装置中的空气,防止加热时发生爆炸 (3)红棕色粉末逐渐变为黑色 澄清石灰水变浑浊 二氧化碳(或CO2) (4)防止生成的铁再次被氧化 防止石灰水倒吸使硬质玻璃管炸裂 (5)尾气处理
(6) ①收集尾气 ②一氧化碳难溶于水也不与水反应,可用排水法收集(合理即可) ③NaOH溶液 (7)还原 CO2+Ca(OH)2 === CaCO3↓+H2O 在装置末端放置一只点燃的酒精灯(或在装置尾部系一只气球等,合理即可)
[拓展训练]
1.C
2.(1)赤铁矿 3CO+Fe2O3 2Fe+3CO2 (2)先通气再加热
3.(1)排尽装置内空气,防止加热CO与空气的混合气体时发生爆炸 (2)CO+CuO Cu+CO2
(3)增加尾气处理装置
4.(1)C (2)Fe2O3+3CO 2Fe+3CO2 (3)①Fe3O4中氧元素质量分数比Fe2O3中的低,Fe2O3发生还原反应也可能生成Fe3O4(合理即可) ②加入足量稀盐酸,观察到有气泡产生,溶液由无色变为浅绿色,试管底部有黑色固体剩余(合理即可) (4)①800
②33.6 ③4FeO Fe
命题点3
知识逐点过
①氧气(或O2) ②水蒸气(或H2O) ③空气(或氧气或O2) ④水(或H2O) ⑤刷漆(合理即可)
⑥涂油(合理即可) ⑦合金
⑧Fe2O3(或氧化铁) ⑨稀盐酸 ⑩稀硫酸
Fe2O3+6HCl=== 2FeCl3+3H2O
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
教材实验到重难考法
例 (1)b (2)甲、乙 水 (3)氧气(或空气) 水
(4)除去铁钉表面的氧化物和污物 (5)除去水中溶解的氧气 (6)隔绝空气(或氧气) 作干燥剂
(7)空气中的氧气进入水中(或植物油不能完全隔绝空气或氧气,合理即可)
(8)D (9)水 节约药品(或更有对比性等,合理即可) (10)是否与氧气(或空气)接触
[拓展训练]
1.(1)√ (2)√
2.D 3.C
4.(1)Fe2O3 化学性质 (2)铁氧化消耗O2,导致缺氧
5.D 6.D
7.(1)铁与氧气(或空气)和水接触 Fe2O3 (2)B (3)刷漆(或涂油、保持铁制品表面干燥等,合理即可)
8.(1)除去水中溶解的氧气 (2)水和氧气(或H2O和O2) C中O2更充足(合理即可) (3)①排除温度变化对压强的影响(合理即可)
②(合理即可)
命题点4
1.B
2.(1)剧烈燃烧,火星四射,放出大量的热,生成黑色固体 (2)置换反应 (3)作导线(合理即可) 强
(4)3CO+Fe2O3 2Fe+3CO2
知识逐点过
1.(2)①4Al+3O2=== 2Al2O3 ②白光 ③2Mg+O2 2MgO
④剧烈燃烧,火星四射,放出大量的热,生成黑色固体 ⑤3Fe+2O2 Fe3O4 ⑥2Cu+O2 2CuO
2.(1)氢(或H) (3)Mg+2HCl=== MgCl2+H2↑ Zn+2HCl=== ZnCl2+H2↑ 浅绿色
Fe+2HCl=== FeCl2+H2↑
3.(3)①红 ②Fe+CuSO4=== FeSO4+Cu ③蓝
④Cu+2AgNO3=== Cu(NO3)2+2Ag
构建物质网络
一、1.Cu(NO3)2(合理即可) Fe2O3
2.①3Fe+2O2 Fe3O4
②Fe+H2SO4=== FeSO4+H2↑
④Fe+Cu(NO3)2=== Fe(NO3)2+Cu(与甲物质对应)
⑤3CO+Fe2O3 2Fe+3CO2
⑥Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
二、1.CuO 2.①2Cu+O2 2CuO ②H2+CuO Cu+H2O(合理即可)
③Cu(NO3)2+2NaOH=== Cu(OH)2↓+2NaNO3(合理即可)
[拓展训练]
1.B
2.2Al+6HCl===2AlCl3+3H2↑ 置换反应
3.D 4.A 5.B
6.(1)铝的金属活动性比铜强 (2)铝丝表面有一层致密的氧化铝薄膜(合理即可) (3)①H2(或氢气) ②Cu(或铜)
(4)Cu2(OH)2SO4+H2SO4===2CuSO4+2H2O
(5)NaCl(或其他含Cl-的可溶性盐等,合理即可) (6)AD
命题点5
知识逐点过
1.①Mg ②Fe ③Cu ④Ag ⑤强 ⑥弱 ⑦强
⑧前面 ⑨后面 ⑩化合物 单质 强 强
强
教材实验到重难考法
例 (1)Fe+CuSO4=== FeSO4+Cu Cu+2AgNO3=== Cu(NO3)2+2Ag (2)铁丝表面析出红色固体,溶液由蓝色逐渐变为浅绿色 铜丝表面析出固体,溶液由无色逐渐变为蓝色 (3)Fe>Cu>Ag(或铁>铜>银)
(4)除去金属丝表面的氧化物及污物 (5)CD
(6)【作出猜想】Mg>Cu>Cr 【进行实验】无明显现象
二
[拓展训练]
1.C 2.弱 3.C 4.C
5.(1)Fe+CuSO4 === FeSO4+Cu
(2)验证铜和银的金属活动性顺序
(3)无法验证铁和铜的金属活动性顺序
6.【猜想与假设】M>Al>Cu
【设计与实验一】Al>M>Cu
【交流与表达】金属铝丝未打磨,氧化铝先和稀盐酸反应生成氯化铝和水
【设计与实验二】(1)M丝表面析出红色固体,溶液由蓝色逐渐变为无色
(2)2Al+3CuSO4=== Al2(SO4)3+3Cu
【交流与表达】丙
【拓展与延伸】MSO4(合理即可)
同课章节目录
