7.3.1乙醇 课件 (共27张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 7.3.1乙醇 课件 (共27张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 08:50:14 | ||
图片预览







文档简介
(共27张PPT)
第七章 有机化合物
第三节 乙醇与乙酸
第一课时 乙醇
学业要求 核心素养
1.掌握乙醇的分子结构和化学性质。 2.理解烃的衍生物、官能团的概念。 3.认识乙醇在日常生活中的应用。 1.从有机物的“官能团”角度对有机物从微观角度进行分类认识。
2.结合实验探究乙醇的性质与结构之间的关系。
3.从生活实践中学习乙醇的性质,进一步利用乙醇的性质,回归到生活中的应用。
对接课标,明确目标
生活中的乙醇产品
活动一:归纳乙醇的物理性质
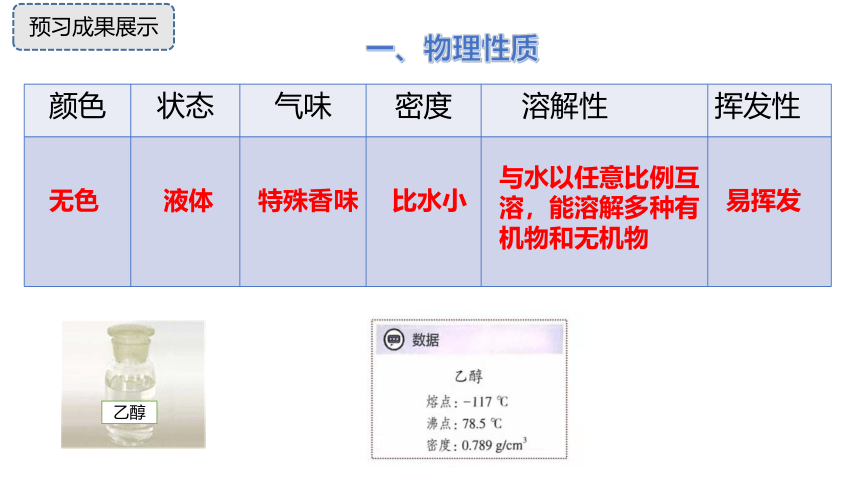
观察桌上乙醇试剂的颜色、状态、气味,结合生活常识和自主预习,总结乙醇有哪些物理性质呢?
颜色 状态 气味 密度 溶解性 挥发性
一、物理性质
与水以任意比例互溶,能溶解多种有机物和无机物
比水小
特殊香味
液体
无色
易挥发
预习成果展示
乙醇
乙醇
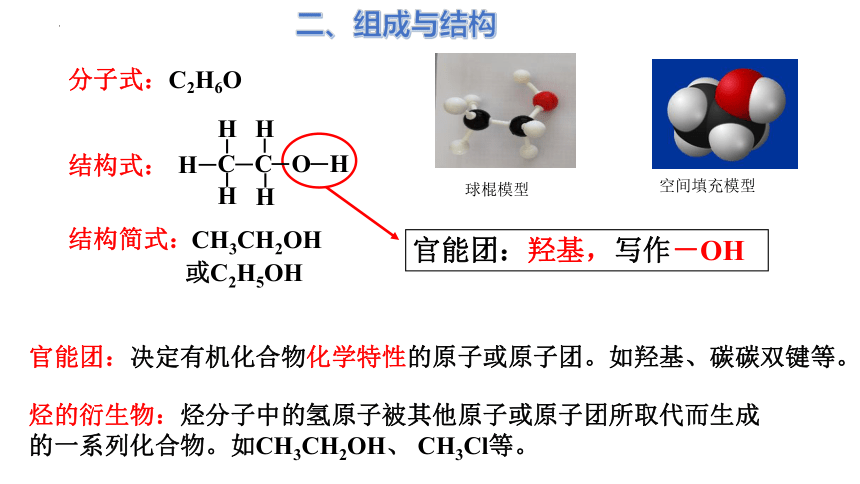
分子式 C2H6O
结构式
?
提示:黑球代表C
白球代表H
红球代表O
乙烷 C2H6
活动二:构建模型推测乙醇的结构
【小组合作】请在乙烷球棍模型的基础上,结合C、H、O原子的成键数目,组装分子式(C2H6O)所有可能的球棍模型。
活动成果展示
【小组讨论】结合信息提示,设计验证乙醇结构的方案并说明理由。
【问题1】A和B结构最大的区别是什么呢?
【问题2】乙醇的结构究竟是哪一种呢?我们如何来验证呢?
信息提示:
1.水的结构式为
2.钠与水反应产生氢气。
3.钠保存在煤油中,煤油的主要成分是碳氢化合物,只有C-C和C-H键。
①钠表面产生大量气泡且沉于乙醇底部,产生可燃性气体
②烧杯内壁有水雾产生
③向烧杯中加入澄清石灰水,石灰水不变浑浊
H2
实验现象:
实验结论:
乙醇与钠反应生成的气体是 。
验证猜想:乙醇的结构式是A式。
官能团:决定有机化合物化学特性的原子或原子团。如羟基、碳碳双键等。
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。如CH3CH2OH、 CH3Cl等。
C C O H
H
H
H
H
H
结构式:
官能团:羟基,写作-OH
结构简式:
CH3CH2OH
或C2H5OH
二、组成与结构
分子式:C2H6O
空间填充模型
球棍模型
乙醇是酒的主要成分。酒,是诗仙李白身上一个最鲜明的符号,他以酒为题,写下了很多不朽的诗歌。以下关于乙醇的化学用语不正确的是( )
A.乙醇的空间填充模型为
B.乙醇的分子式为C2H6O
C.乙醇的结构简式为CH3CH2OH
D.乙醇中羟基的电子式为
学以致用
A
三、乙醇的化学性质
1.乙醇与活泼金属钠的反应
CH3CH2OH + Na →
2 2 2
断键机理:
【思考】乙醇为什么能与钠反应呢?又是如何反应的呢?
【结论】羟基对乙醇的性质起着重要的作用。
对比钠分别与水、乙醇反应的剧烈程度,水分子中的氢原子活泼性 羟基上的氢原子。
CH3CH2ONa + H2↑
大于
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
(1) 燃烧
【思考】根据此性质,乙醇可以有什么用途呢?
2.乙醇的氧化反应
改变条件,
产物还一样吗?
【应用】乙醇可以作清洁燃料,比如乙醇汽油。
断键机理:所有键都断开
① 在试管中加入约2mL乙醇,
②取一根光洁的铜丝,下端绕成螺旋状,点燃酒精灯,在酒精灯外焰上灼烧,把灼热的铜丝迅速插入乙醇。
③重复上述操作步骤3--4次。
记录现象:
① 灼烧后铜丝颜色
②插入酒精后铜丝颜色
③试管中反应液的气味
小组合作实验——乙醇的催化氧化实验
活动四:探究乙醇的催化氧化反应
①:红色→黑色
②:黑色→红色
总反应方程式:
乙醛
(刺激性气味液体)
铜丝在反应中作催化剂
2Cu+O2 = 2CuO
△
2C2H5OH+2CuO 2CH3CHO+2H2O+2Cu
△
现象分析
2C2H5OH+O2 2CH3CHO+2H2O
△
催化剂
加热
插入乙醇
(2)乙醇的催化氧化
醛基 —CHO
乙醛的结构式为:
C—C—H
H
H
H
H
O—H
①
③
②
④
⑤
活动五:微观动画理解乙醇的催化氧化反应
【问题1】乙醇发生催化氧化时分子中化学键时如何变化的呢?
醇催化氧化的条件:与羟基直接相连的碳上至少有一个氢原子。
断开①③键
【问题2】所有的醇都能发生催化氧化反应吗?
(双选)下列各醇能被催化氧化为醛的是( )
A.CH3CH2— OH
C. CH3 — CH2—CH2
∣
OH
CH3
∣
B. CH3—C—OH
∣
CH3
CH3CHOH
∣
CH3
D.
学以致用
AC
铜、银用品放置时间久了会发黑,失去光泽,可以先把铜、银在火上烧热,马上蘸一下酒精,铜、银会光亮如初!
【应用】银光闪闪的铜银饰品
测酒驾的原理是什么呢?
K2Cr2O7 Cr2(SO4)3
(橙色) (绿色)
(3)被强氧化剂酸性KMnO4 、K2Cr2O7 溶液氧化
CH3CH2OH CH3COOH
(乙酸)
酸性KMnO4溶液
酸性K2Cr2O7 溶液
【应用】用来检验司机是否酒驾
学以致用
C
下列方法中可以证明乙醇分子中有一个氢原子与其他氢原子不同的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以和水任意比互溶
C.1 mol乙醇跟足量的Na作用得0.5 mol H2
D.乙醇可被酸性KMnO4氧化为乙酸(CH3COOH)
女儿红是浙江省绍兴市的地方传统名酒,属于发酵酒中的黄酒,用糯米、红糖等发酵而成,除乙醇外,还含有大量人体所需的氨基酸,江南的冬天空气潮湿寒冷,人们常饮用此酒来增强抵抗力。下列有关酒和酒精的说法中正确的是( )
A.酒精在水溶液中能电离出少量的H+,所以酒精是电解质
B.酒精结构中有—OH所以显碱性
C.酒精分子中的所有氢原子均可被钠置换出来
D.酒精是一种很好的溶剂,能溶解许多无机化合物和有机化合物,人们用白酒浸泡中药制成药酒就是利用了这一性质
D
制乙醛、乙酸等化工原料
溶剂
医用
饮料
燃料
四、乙醇的用途
收获与总结
收获与总结
2.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
A.和金属钠反应时①键断裂
B.在银催化共热下与O2反应时断裂①键和⑤键
C.在银催化共热下与O2反应时断裂①键和③键
D.在空气中完全燃烧时断裂①②③④⑤键
B
巩固练习
1. 某有机物的结构简式为
下列关于该有机物的叙述中,不正确的是( )
A. 能与金属钠发生反应并放出氢气
B. 能在催化剂作用下与H2发生加成反应
C. 不能使酸性KMnO4溶液褪色
D.能使溴水褪色
C
3.已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇、乙二醇
分别与足量的金属钠反应,产生等量的氢气。则这三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
A
课后作业
1.根据乙醇的化学性质,预测丙醇的化学性质,并写出相应的化学方程式。
2.《三维设计》上本课时基础练习题。
3.查阅资料:
①杜康酿酒的原理
②为什么做鱼时加点酒、醋,会使鱼的味道更加鲜美?
感谢您的观看!
第七章 有机化合物
第三节 乙醇与乙酸
第一课时 乙醇
学业要求 核心素养
1.掌握乙醇的分子结构和化学性质。 2.理解烃的衍生物、官能团的概念。 3.认识乙醇在日常生活中的应用。 1.从有机物的“官能团”角度对有机物从微观角度进行分类认识。
2.结合实验探究乙醇的性质与结构之间的关系。
3.从生活实践中学习乙醇的性质,进一步利用乙醇的性质,回归到生活中的应用。
对接课标,明确目标
生活中的乙醇产品
活动一:归纳乙醇的物理性质
观察桌上乙醇试剂的颜色、状态、气味,结合生活常识和自主预习,总结乙醇有哪些物理性质呢?
颜色 状态 气味 密度 溶解性 挥发性
一、物理性质
与水以任意比例互溶,能溶解多种有机物和无机物
比水小
特殊香味
液体
无色
易挥发
预习成果展示
乙醇
乙醇
分子式 C2H6O
结构式
?
提示:黑球代表C
白球代表H
红球代表O
乙烷 C2H6
活动二:构建模型推测乙醇的结构
【小组合作】请在乙烷球棍模型的基础上,结合C、H、O原子的成键数目,组装分子式(C2H6O)所有可能的球棍模型。
活动成果展示
【小组讨论】结合信息提示,设计验证乙醇结构的方案并说明理由。
【问题1】A和B结构最大的区别是什么呢?
【问题2】乙醇的结构究竟是哪一种呢?我们如何来验证呢?
信息提示:
1.水的结构式为
2.钠与水反应产生氢气。
3.钠保存在煤油中,煤油的主要成分是碳氢化合物,只有C-C和C-H键。
①钠表面产生大量气泡且沉于乙醇底部,产生可燃性气体
②烧杯内壁有水雾产生
③向烧杯中加入澄清石灰水,石灰水不变浑浊
H2
实验现象:
实验结论:
乙醇与钠反应生成的气体是 。
验证猜想:乙醇的结构式是A式。
官能团:决定有机化合物化学特性的原子或原子团。如羟基、碳碳双键等。
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。如CH3CH2OH、 CH3Cl等。
C C O H
H
H
H
H
H
结构式:
官能团:羟基,写作-OH
结构简式:
CH3CH2OH
或C2H5OH
二、组成与结构
分子式:C2H6O
空间填充模型
球棍模型
乙醇是酒的主要成分。酒,是诗仙李白身上一个最鲜明的符号,他以酒为题,写下了很多不朽的诗歌。以下关于乙醇的化学用语不正确的是( )
A.乙醇的空间填充模型为
B.乙醇的分子式为C2H6O
C.乙醇的结构简式为CH3CH2OH
D.乙醇中羟基的电子式为
学以致用
A
三、乙醇的化学性质
1.乙醇与活泼金属钠的反应
CH3CH2OH + Na →
2 2 2
断键机理:
【思考】乙醇为什么能与钠反应呢?又是如何反应的呢?
【结论】羟基对乙醇的性质起着重要的作用。
对比钠分别与水、乙醇反应的剧烈程度,水分子中的氢原子活泼性 羟基上的氢原子。
CH3CH2ONa + H2↑
大于
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
(1) 燃烧
【思考】根据此性质,乙醇可以有什么用途呢?
2.乙醇的氧化反应
改变条件,
产物还一样吗?
【应用】乙醇可以作清洁燃料,比如乙醇汽油。
断键机理:所有键都断开
① 在试管中加入约2mL乙醇,
②取一根光洁的铜丝,下端绕成螺旋状,点燃酒精灯,在酒精灯外焰上灼烧,把灼热的铜丝迅速插入乙醇。
③重复上述操作步骤3--4次。
记录现象:
① 灼烧后铜丝颜色
②插入酒精后铜丝颜色
③试管中反应液的气味
小组合作实验——乙醇的催化氧化实验
活动四:探究乙醇的催化氧化反应
①:红色→黑色
②:黑色→红色
总反应方程式:
乙醛
(刺激性气味液体)
铜丝在反应中作催化剂
2Cu+O2 = 2CuO
△
2C2H5OH+2CuO 2CH3CHO+2H2O+2Cu
△
现象分析
2C2H5OH+O2 2CH3CHO+2H2O
△
催化剂
加热
插入乙醇
(2)乙醇的催化氧化
醛基 —CHO
乙醛的结构式为:
C—C—H
H
H
H
H
O—H
①
③
②
④
⑤
活动五:微观动画理解乙醇的催化氧化反应
【问题1】乙醇发生催化氧化时分子中化学键时如何变化的呢?
醇催化氧化的条件:与羟基直接相连的碳上至少有一个氢原子。
断开①③键
【问题2】所有的醇都能发生催化氧化反应吗?
(双选)下列各醇能被催化氧化为醛的是( )
A.CH3CH2— OH
C. CH3 — CH2—CH2
∣
OH
CH3
∣
B. CH3—C—OH
∣
CH3
CH3CHOH
∣
CH3
D.
学以致用
AC
铜、银用品放置时间久了会发黑,失去光泽,可以先把铜、银在火上烧热,马上蘸一下酒精,铜、银会光亮如初!
【应用】银光闪闪的铜银饰品
测酒驾的原理是什么呢?
K2Cr2O7 Cr2(SO4)3
(橙色) (绿色)
(3)被强氧化剂酸性KMnO4 、K2Cr2O7 溶液氧化
CH3CH2OH CH3COOH
(乙酸)
酸性KMnO4溶液
酸性K2Cr2O7 溶液
【应用】用来检验司机是否酒驾
学以致用
C
下列方法中可以证明乙醇分子中有一个氢原子与其他氢原子不同的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以和水任意比互溶
C.1 mol乙醇跟足量的Na作用得0.5 mol H2
D.乙醇可被酸性KMnO4氧化为乙酸(CH3COOH)
女儿红是浙江省绍兴市的地方传统名酒,属于发酵酒中的黄酒,用糯米、红糖等发酵而成,除乙醇外,还含有大量人体所需的氨基酸,江南的冬天空气潮湿寒冷,人们常饮用此酒来增强抵抗力。下列有关酒和酒精的说法中正确的是( )
A.酒精在水溶液中能电离出少量的H+,所以酒精是电解质
B.酒精结构中有—OH所以显碱性
C.酒精分子中的所有氢原子均可被钠置换出来
D.酒精是一种很好的溶剂,能溶解许多无机化合物和有机化合物,人们用白酒浸泡中药制成药酒就是利用了这一性质
D
制乙醛、乙酸等化工原料
溶剂
医用
饮料
燃料
四、乙醇的用途
收获与总结
收获与总结
2.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
A.和金属钠反应时①键断裂
B.在银催化共热下与O2反应时断裂①键和⑤键
C.在银催化共热下与O2反应时断裂①键和③键
D.在空气中完全燃烧时断裂①②③④⑤键
B
巩固练习
1. 某有机物的结构简式为
下列关于该有机物的叙述中,不正确的是( )
A. 能与金属钠发生反应并放出氢气
B. 能在催化剂作用下与H2发生加成反应
C. 不能使酸性KMnO4溶液褪色
D.能使溴水褪色
C
3.已知分子中含有羟基的物质都能与钠反应产生氢气。
乙醇、乙二醇
分别与足量的金属钠反应,产生等量的氢气。则这三种醇的物质的量之比为( )
A.6∶3∶2 B.1∶2∶3
C.3∶2∶1 D.4∶3∶2
A
课后作业
1.根据乙醇的化学性质,预测丙醇的化学性质,并写出相应的化学方程式。
2.《三维设计》上本课时基础练习题。
3.查阅资料:
①杜康酿酒的原理
②为什么做鱼时加点酒、醋,会使鱼的味道更加鲜美?
感谢您的观看!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
