4.2 电解池 课件(共18张PPT含视频) 高中化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2 电解池 课件(共18张PPT含视频) 高中化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 34.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 09:33:00 | ||
图片预览






文档简介
(共18张PPT)
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
活泼金属
不活泼金属
极不活泼金属
较活泼金属
热分解法
物理提取法
电解法
热还原法
电解法:
2NaCl (熔融) === 2Na + Cl2 ↑
电解
MgCl2 (熔融) === Mg + Cl2 ↑
电解
2Al2O3 (熔融) === 4Al + 3O2 ↑
电解
冰晶石
①CuCl2
②HCl
③Na2SO4
阳极:
阴极:
阳极:
阴极:
⑤NaOH
阳极:
阴极:
④H2SO4
阳极:
阴极:
⑦NaCl
阳极:
阴极:
⑥CuSO4
阳极:
阴极:
阳极:
阴极:
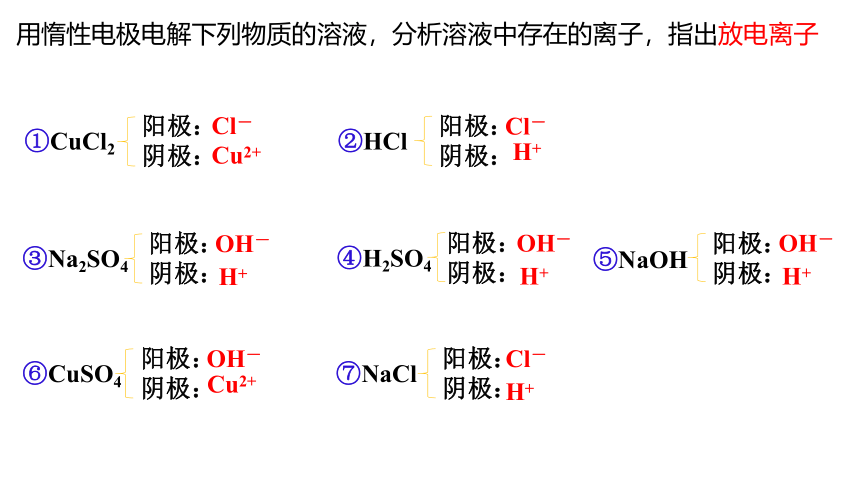
用惰性电极电解下列物质的溶液,分析溶液中存在的离子,指出放电离子
①CuCl2
②HCl
③Na2SO4
阳极:
阴极:
阳极:
阴极:
⑤NaOH
阳极:
阴极:
④H2SO4
阳极:
阴极:
⑦NaCl
阳极:
阴极:
⑥CuSO4
阳极:
阴极:
阳极:
阴极:
Cl-
Cu2+
Cl-
H+
OH-
H+
OH-
H+
OH-
H+
Cl-
H+
OH-
Cu2+
用惰性电极电解下列物质的溶液,分析溶液中存在的离子,指出放电离子
第四章 化学反应与电能
第二节 电解池
第2-3课时 电解原理的应用
阳极:
阴极:
2Cl- - 2e- = Cl2↑
Cu2+ + 2e- = Cu
总反应式:CuCl2 Cu + Cl2↑
电解
【思考】若要恢复到电解前的状态,应加入的物质是?
阳极:4OH-- 4e- = 2H2O + O2↑
阴极:4H2O + 4e- = 2H2↑+4OH-
总反应:2H2O 2H2↑+O2↑
电解
阳极:2H2O- 4e- = O2↑+ 4H+
阴极:4H+ + 4e- =2H2↑
总反应:2H2O 2H2↑+O2↑
电解
【思考】电解一段时间后,溶液的pH
阳极:2H2O - 4e- = O2↑+ 4H+
阴极:2Cu2+ + 4e- =2Cu
总反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4
电解
【思考】电解一段时间后,溶液的pH
【思考】若产生标况下22.4L氧气,要恢复到电解前的状态,需要加入
的物质及物质的量为多少?
阳极:2Cl-- 2e- = Cl2↑
阴极:2H2O + 2e- = H2↑+2OH-
总反应:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电解
【思考】电解一段时间后,溶液的pH
【思考】若产生标况下22.4L氢气,要恢复到电解前的状态,需要加入
的物质及物质的量为多少?
能否用该电解池制备Cl2、H2 和NaOH?若不能,该怎样改进装置?
阴极区域
原因一:Cl2 与 NaOH 反应
原因二:H2 与 Cl2 混合易爆炸
H2 + Cl2 2HCl
一定条件
Cl2 + 2OH- ClO- + Cl- + H2O
不能,原因如下:
阳极区域
阳离子交换膜
2NaCl+2H2O Cl2↑ + 2NaOH + H2↑
电解
2NaCl+2H2O Cl2↑ + 2NaOH + H2↑
电解
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)
>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
Fe
C
NaCl溶液
C
C
NaCl溶液
2NaCl+2H2O Cl2↑ + 2NaOH + H2↑
电解
C
Fe
NaCl溶液
NaOH溶液
Cu
Fe
CuSO4溶液
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)
>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
待镀铁制品
铜片
- +
CuSO4溶液
(1)定义: 利用电解原理在某些金属表面镀上一层其他金属或合金的过程
(2)目的:增强抗腐蚀能力,增加美观和表面硬度。
(3)电镀条件
阳极:镀层金属
阴极:镀件(待镀金属)
电镀液:含镀层金属阳离子的电解质溶液。
电镀
待镀铁制品
铜片
- +
CuSO4溶液
Cu
Cu
CuSO4溶液
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)
>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
阳极: 粗铜 Cu (含少量Fe﹑Ag﹑Au等)
阴极: 纯铜
CuSO4溶液
粗铜精炼
Cu - 2e- = Cu2+
Fe - 2e- = Fe2+
(Ag﹑Au沉积下来,形成阳极泥)
Cu2+ + 2e- = Cu
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
活泼金属
不活泼金属
极不活泼金属
较活泼金属
热分解法
物理提取法
电解法
热还原法
电解法:
2NaCl (熔融) === 2Na + Cl2 ↑
电解
MgCl2 (熔融) === Mg + Cl2 ↑
电解
2Al2O3 (熔融) === 4Al + 3O2 ↑
电解
冰晶石
①CuCl2
②HCl
③Na2SO4
阳极:
阴极:
阳极:
阴极:
⑤NaOH
阳极:
阴极:
④H2SO4
阳极:
阴极:
⑦NaCl
阳极:
阴极:
⑥CuSO4
阳极:
阴极:
阳极:
阴极:
用惰性电极电解下列物质的溶液,分析溶液中存在的离子,指出放电离子
①CuCl2
②HCl
③Na2SO4
阳极:
阴极:
阳极:
阴极:
⑤NaOH
阳极:
阴极:
④H2SO4
阳极:
阴极:
⑦NaCl
阳极:
阴极:
⑥CuSO4
阳极:
阴极:
阳极:
阴极:
Cl-
Cu2+
Cl-
H+
OH-
H+
OH-
H+
OH-
H+
Cl-
H+
OH-
Cu2+
用惰性电极电解下列物质的溶液,分析溶液中存在的离子,指出放电离子
第四章 化学反应与电能
第二节 电解池
第2-3课时 电解原理的应用
阳极:
阴极:
2Cl- - 2e- = Cl2↑
Cu2+ + 2e- = Cu
总反应式:CuCl2 Cu + Cl2↑
电解
【思考】若要恢复到电解前的状态,应加入的物质是?
阳极:4OH-- 4e- = 2H2O + O2↑
阴极:4H2O + 4e- = 2H2↑+4OH-
总反应:2H2O 2H2↑+O2↑
电解
阳极:2H2O- 4e- = O2↑+ 4H+
阴极:4H+ + 4e- =2H2↑
总反应:2H2O 2H2↑+O2↑
电解
【思考】电解一段时间后,溶液的pH
阳极:2H2O - 4e- = O2↑+ 4H+
阴极:2Cu2+ + 4e- =2Cu
总反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4
电解
【思考】电解一段时间后,溶液的pH
【思考】若产生标况下22.4L氧气,要恢复到电解前的状态,需要加入
的物质及物质的量为多少?
阳极:2Cl-- 2e- = Cl2↑
阴极:2H2O + 2e- = H2↑+2OH-
总反应:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电解
【思考】电解一段时间后,溶液的pH
【思考】若产生标况下22.4L氢气,要恢复到电解前的状态,需要加入
的物质及物质的量为多少?
能否用该电解池制备Cl2、H2 和NaOH?若不能,该怎样改进装置?
阴极区域
原因一:Cl2 与 NaOH 反应
原因二:H2 与 Cl2 混合易爆炸
H2 + Cl2 2HCl
一定条件
Cl2 + 2OH- ClO- + Cl- + H2O
不能,原因如下:
阳极区域
阳离子交换膜
2NaCl+2H2O Cl2↑ + 2NaOH + H2↑
电解
2NaCl+2H2O Cl2↑ + 2NaOH + H2↑
电解
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)
>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
Fe
C
NaCl溶液
C
C
NaCl溶液
2NaCl+2H2O Cl2↑ + 2NaOH + H2↑
电解
C
Fe
NaCl溶液
NaOH溶液
Cu
Fe
CuSO4溶液
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)
>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
待镀铁制品
铜片
- +
CuSO4溶液
(1)定义: 利用电解原理在某些金属表面镀上一层其他金属或合金的过程
(2)目的:增强抗腐蚀能力,增加美观和表面硬度。
(3)电镀条件
阳极:镀层金属
阴极:镀件(待镀金属)
电镀液:含镀层金属阳离子的电解质溶液。
电镀
待镀铁制品
铜片
- +
CuSO4溶液
Cu
Cu
CuSO4溶液
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)
>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
阳极: 粗铜 Cu (含少量Fe﹑Ag﹑Au等)
阴极: 纯铜
CuSO4溶液
粗铜精炼
Cu - 2e- = Cu2+
Fe - 2e- = Fe2+
(Ag﹑Au沉积下来,形成阳极泥)
Cu2+ + 2e- = Cu
【放电规律】
(1)阳极(失e-):活性电极 > S2->I->Br->Cl->OH->含氧酸根离子
(2)阴极 (得e-):Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
