4.3金属的腐蚀与防护 课件(共15张PPT含视频) 高中化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护 课件(共15张PPT含视频) 高中化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 41.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 00:00:00 | ||
图片预览





文档简介
(共15张PPT)
第四章 化学反应与电能
第三节 金属的腐蚀与防护
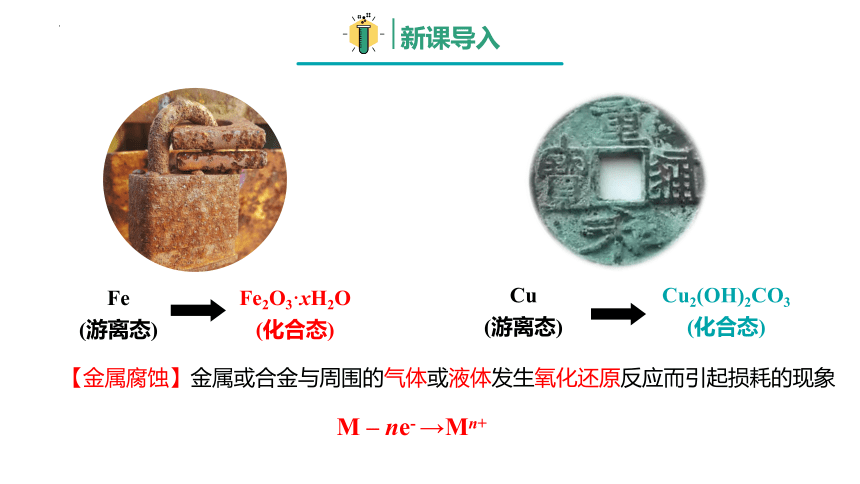
Fe2O3·xH2O
(化合态)
Fe
(游离态)
Cu2(OH)2CO3
(化合态)
Cu
(游离态)
M – ne- →Mn+
【金属腐蚀】金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象
使桥梁、建筑物的金属构架强度降低而造成坍塌
机器设备、仪器、仪表的精度和灵敏度降低,直至报废
使地下金属管道发生泄漏、轮船船体损坏等
交流讨论
金属腐蚀有哪些危害?
(1)化学腐蚀:金属跟其表面接触到的一些物质(如O2、Cl2、SO2等)
直接反应而引起的腐蚀
注意:无电流产生
1.金属的腐蚀
铁与氯气直接反应而腐蚀
输油、输气的钢管被原油、天然气中的含硫化合物腐蚀
高温条件被腐蚀的燃气灶
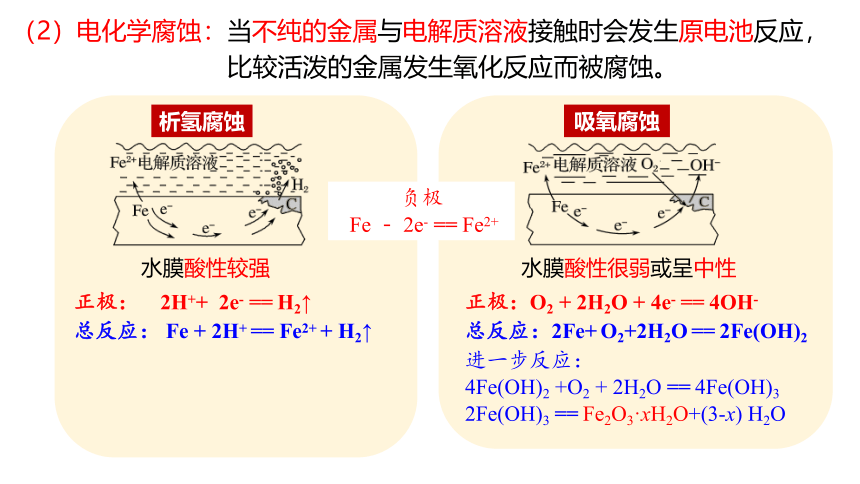
(2)电化学腐蚀:当不纯的金属与电解质溶液接触时会发生原电池反应,
比较活泼的金属发生氧化反应而被腐蚀。
与铜阀门连接的铁管
1.金属的腐蚀
水膜酸性较强
水膜酸性很弱或呈中性
正极: 2H++ 2e- == H2↑
负极
Fe - 2e- == Fe2+
总反应: Fe + 2H+ == Fe2+ + H2↑
进一步反应:
2Fe(OH)3 == Fe2O3·xH2O+(3-x) H2O
正极:O2 + 2H2O + 4e- == 4OH-
总反应:2Fe+ O2+2H2O == 2Fe(OH)2
4Fe(OH)2 +O2 + 2H2O == 4Fe(OH)3
析氢腐蚀
吸氧腐蚀
(2)电化学腐蚀:当不纯的金属与电解质溶液接触时会发生原电池反应,
比较活泼的金属发生氧化反应而被腐蚀。
1.金属的腐蚀
金属的腐蚀
(1)化学腐蚀
(2)电化学腐蚀
析氢腐蚀
吸氧腐蚀
①通常两种腐蚀同时存在,但绝大多数属于电化学腐蚀
②电化学腐蚀速率比化学腐蚀大得多
③电化学腐蚀中吸氧腐蚀更为普遍
特别提醒
水膜酸性较强
水膜酸性很弱或呈中性
1.改变金属材料的组成
如普通钢中加入镍、铬等制成不锈钢产品,钛合金不仅具有优异的抗腐蚀性,还具有良好的生物相容性。
钛合金髋关节
2.金属的防护
(2)在金属表面覆盖保护层
刷油漆
涂黄油
镀金属
涂搪瓷
烤蓝
2.金属的防护
生成一层致密的四氧化三铁薄膜
2.金属的防护
牺牲阳极法示意图
外加电流法示意图
(3)电化学保护法
牺牲阳极法示意图
e-
e-
船体上镶嵌的锌块
①牺牲阳极法
通常是在被保护的钢铁设备上(如锅炉的内壁、船舶的外壳等)安装若干镁合金或锌块。镁、锌比铁活泼,它们就成为原电池的负极(阳极),不断遭受腐蚀(需要定期检查、更换),而作为正极(阴极)的钢铁设备就被保护起来。
验证实验
步骤一
Fe作保护电极,Zn作辅助电极,以经过酸化的3%NaCl溶液作电解质溶液,按图所示连接好装置。观察电流表指针的变化,以及烧杯中两个电极附近发生的现象。
步骤二
过一段时间,用胶头滴管从和Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6] (铁氰化钾)溶液,观察试管中溶液颜色变化?
注意:Fe2+与K3[Fe(CN)6]溶液(黄色)反应生成带有特征蓝色的铁氰化亚铁KFe[Fe(CN)6]沉淀。
验证实验
把被保护的钢铁设备(如钢闸门)作为阴极,用惰性电极作为辅助阳极,两者均放在电解质溶液(如海水)里,外接直流电源。通电后,调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零,钢铁设备被迫成为阴极而受到保护。
外加电流法示意图
钢闸门的防腐
②外加电流法
第四章 化学反应与电能
第三节 金属的腐蚀与防护
Fe2O3·xH2O
(化合态)
Fe
(游离态)
Cu2(OH)2CO3
(化合态)
Cu
(游离态)
M – ne- →Mn+
【金属腐蚀】金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象
使桥梁、建筑物的金属构架强度降低而造成坍塌
机器设备、仪器、仪表的精度和灵敏度降低,直至报废
使地下金属管道发生泄漏、轮船船体损坏等
交流讨论
金属腐蚀有哪些危害?
(1)化学腐蚀:金属跟其表面接触到的一些物质(如O2、Cl2、SO2等)
直接反应而引起的腐蚀
注意:无电流产生
1.金属的腐蚀
铁与氯气直接反应而腐蚀
输油、输气的钢管被原油、天然气中的含硫化合物腐蚀
高温条件被腐蚀的燃气灶
(2)电化学腐蚀:当不纯的金属与电解质溶液接触时会发生原电池反应,
比较活泼的金属发生氧化反应而被腐蚀。
与铜阀门连接的铁管
1.金属的腐蚀
水膜酸性较强
水膜酸性很弱或呈中性
正极: 2H++ 2e- == H2↑
负极
Fe - 2e- == Fe2+
总反应: Fe + 2H+ == Fe2+ + H2↑
进一步反应:
2Fe(OH)3 == Fe2O3·xH2O+(3-x) H2O
正极:O2 + 2H2O + 4e- == 4OH-
总反应:2Fe+ O2+2H2O == 2Fe(OH)2
4Fe(OH)2 +O2 + 2H2O == 4Fe(OH)3
析氢腐蚀
吸氧腐蚀
(2)电化学腐蚀:当不纯的金属与电解质溶液接触时会发生原电池反应,
比较活泼的金属发生氧化反应而被腐蚀。
1.金属的腐蚀
金属的腐蚀
(1)化学腐蚀
(2)电化学腐蚀
析氢腐蚀
吸氧腐蚀
①通常两种腐蚀同时存在,但绝大多数属于电化学腐蚀
②电化学腐蚀速率比化学腐蚀大得多
③电化学腐蚀中吸氧腐蚀更为普遍
特别提醒
水膜酸性较强
水膜酸性很弱或呈中性
1.改变金属材料的组成
如普通钢中加入镍、铬等制成不锈钢产品,钛合金不仅具有优异的抗腐蚀性,还具有良好的生物相容性。
钛合金髋关节
2.金属的防护
(2)在金属表面覆盖保护层
刷油漆
涂黄油
镀金属
涂搪瓷
烤蓝
2.金属的防护
生成一层致密的四氧化三铁薄膜
2.金属的防护
牺牲阳极法示意图
外加电流法示意图
(3)电化学保护法
牺牲阳极法示意图
e-
e-
船体上镶嵌的锌块
①牺牲阳极法
通常是在被保护的钢铁设备上(如锅炉的内壁、船舶的外壳等)安装若干镁合金或锌块。镁、锌比铁活泼,它们就成为原电池的负极(阳极),不断遭受腐蚀(需要定期检查、更换),而作为正极(阴极)的钢铁设备就被保护起来。
验证实验
步骤一
Fe作保护电极,Zn作辅助电极,以经过酸化的3%NaCl溶液作电解质溶液,按图所示连接好装置。观察电流表指针的变化,以及烧杯中两个电极附近发生的现象。
步骤二
过一段时间,用胶头滴管从和Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6] (铁氰化钾)溶液,观察试管中溶液颜色变化?
注意:Fe2+与K3[Fe(CN)6]溶液(黄色)反应生成带有特征蓝色的铁氰化亚铁KFe[Fe(CN)6]沉淀。
验证实验
把被保护的钢铁设备(如钢闸门)作为阴极,用惰性电极作为辅助阳极,两者均放在电解质溶液(如海水)里,外接直流电源。通电后,调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零,钢铁设备被迫成为阴极而受到保护。
外加电流法示意图
钢闸门的防腐
②外加电流法
