化学人教版(2019)选择性必修1 2.1化学反应速率(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.1化学反应速率(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 09:44:39 | ||
图片预览









文档简介
(共35张PPT)
第二章 化学反应速率与化学反应平衡
第一节 化学反应速率
第1课时 化学反应速率
工业
制氨
钢铁
生锈
食物
腐败
尾气处理
为什么要研究化学反应速率?
那么,如何定量的描述化学反应过程进行的快慢呢?
1.化学反应速率
通常用单位时间内反应物质浓度的减少或生成物浓度的增大来表示。
(1)表达式:
(2)单位:
v(B)= ——
△c(B)
△t
、mol/(L·min)
或mol·L-1·s-1
、mol·L-1·min-1
mol/(L·s)
(3)规律:
化学反应速率之比 = 化学计量数之比
1 mol/(L·s)= mol/(L·min)
1.化学反应速率
通常用单位时间内反应物质浓度的减少或生成物浓度的增大来表示。
(1)表达式:
(2)单位:
v(B)= ——
△c(B)
△t
、mol/(L·min)
或mol·L-1·s-1
、mol·L-1·min-1
mol/(L·s)
(3)规律:
化学反应速率之比 = 化学计量数之比
(4)注意:
①取正值,平均速率
②指明具体的物质
③固体或纯液体不适用
每种物质表示的化学反应速率数值不同
如何比较化学反应速率的大小呢?
交流讨论
比较化学反应速率大小:统一单位,同种物质
进行化学反应速率测定时
需要检测什么物理量?
该如何测量?
交流讨论
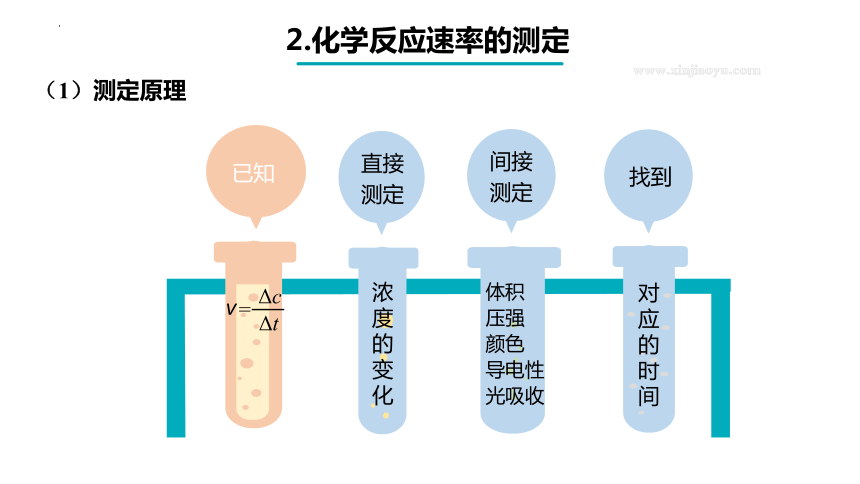
(1)测定原理
浓度的变化
直接测定
体积
压强
颜色
导电性
光吸收
间接测定
对应的时间
找到
已知
v
=
Δc
Δt
2.化学反应速率的测定
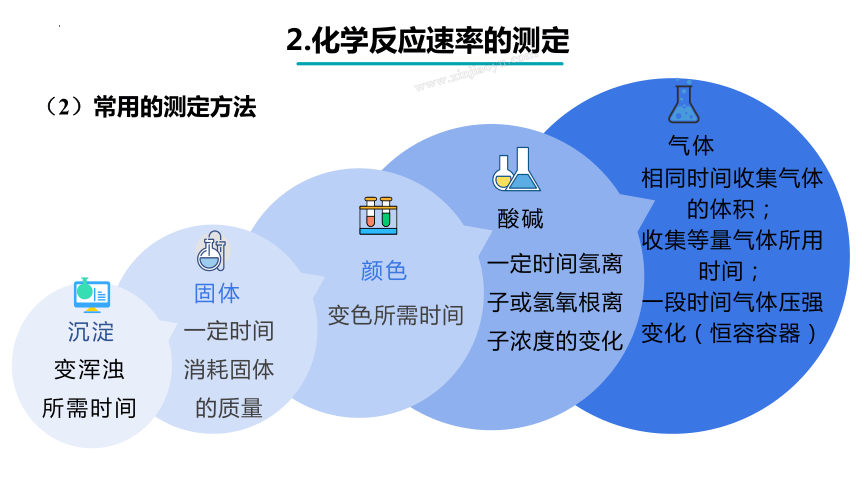
气体
相同时间收集气体的体积;
收集等量气体所用时间;
一段时间气体压强变化(恒容容器)
酸碱
一定时间氢离子或氢氧根离子浓度的变化
变色所需时间
颜色
固体
一定时间消耗固体的质量
沉淀
变浑浊
所需时间
(2)常用的测定方法
2.化学反应速率的测定
第二章 化学反应速率与化学反应平衡
第一节 化学反应速率
第2课时 影响化学反应速率的因素
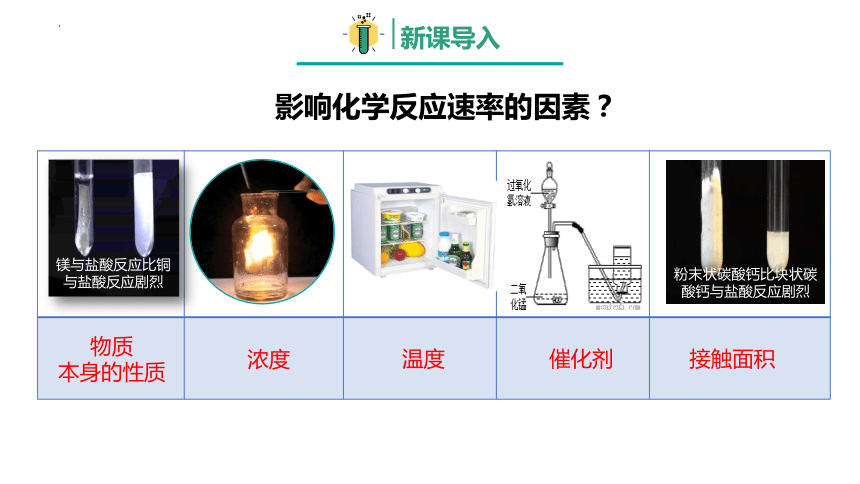
镁与盐酸反应比铜与盐酸反应剧烈
粉末状碳酸钙比块状碳酸钙与盐酸反应剧烈
物质
本身的性质
浓度
温度
催化剂
接触面积
影响化学反应速率的因素?
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
自变量?
↓
如何实现
自变量的变化?
↓
预期现象?
1.浓度
1.浓度
增大反应物的浓度,化学反应速率 ;
减小反应物的浓度,化学反应速率 。
加快
减慢
注意事项
①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。
②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
③常温下,铁铝遇到冷的浓硫酸、浓硝酸钝化。
增大反应物的量或浓度,化学反应速率一定增大?
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
2.温度
2.温度
升高温度,化学反应速率 ;
降低温度,化学反应速率 。
加快
减慢
注意事项
温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
升高反应温度,化学反应速率一定增大?
3.催化剂
加入催化剂,化学反应速率一定增大吗?
产物的量会变化吗?
反应的焓变会变化吗?
增大压强,引起气体反应物浓度 ,化学反应速率 ;
减小压强,引起气体反应物浓度 ,化学反应速率 。
增大
减小
加快
减慢
注意事项
压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
4.压强
增大压强,反应速率一定增大吗?
第二章 化学反应速率与化学反应平衡
第一节 化学反应速率
第3课时 活化能
如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢?
从微观上看,反应物分子一般总是经过若干个简单的反应步骤才最终转化为产物分子的。每一个简单的反应都称为一个基元反应。
反应历程是化学中用来描述某一化学变化所经由的全部基元反应,反应历程又称反应机理。
基元反应
例如:反应2HI H2+I2
反应历程 / 反应机理
第一步:2HI H2+2I·
第二步:2I· I2
任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为 1 mol/L 时,在每立方厘米、每秒内反应物分子间的碰撞可达到 1028 次。如果反应物分子间的任何一次碰撞都能发生反应的话,任何气体的反应均可以瞬间完成。但实际并非如此。
气体分子的碰撞频率
(快反应)
(慢反应)
为什么分子的碰撞时有的能发生化学反应,有的不能?
简单碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数分子碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞,反应物分子间有效碰撞的频率越高,化学反应速率越大。
吉尔伯特·牛顿·路易斯
示例:HI 分解反应中分子碰撞示意图
能量不足,碰撞无法发生反应
HI
HI
HI
HI
取向不对,碰撞无法发生反应
HI
HI
HI
HI
有效碰撞,发生反应
H2
I2
HI
HI
有效碰撞
投篮那些事
力道不足
——进不去球
取向不对
——进不去球
力道、取向恰好
——进球
能量
反应物
生成物
反应过程
活化能
E1
具有足够的能量,
能发生有效碰撞的分子
活化分子
ΔH
E2
活化分子变成生成物分子放出的能量
其它条件不变时
升高温度
活化分子
有效碰撞理论解释温度对化学反应速率的影响
升高温度 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
有效碰撞理论解释催化剂对化学反应速率的影响
正催化剂 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
其它条件不变时
增大反应物浓度
活化分子
有效碰撞理论解释浓度对化学反应速率的影响
增大浓度 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
容器的容积不变
压缩体积或充入气态反应物
活化分子
有效碰撞理论解释压强对化学反应速率的影响
增大压强 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
活化分子
容器的容积不变
充入非反应气体
有效碰撞理论解释压强对化学反应速率的影响
恒温、恒容充入非反应气体 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
活化分子
容器内压强不变
充入非反应气体
有效碰撞理论解释压强对化学反应速率的影响
恒温、恒压充入非反应气体 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
单位时间内、单位体积内有效碰撞次数增多
单位体积内分子总数不变,活化分子百分数增加,活化分子数增加。
单位体积内分子总数增加,活化分子百分数不变,活化分子数增加
增大反应物浓度
增大气体压强
增大化学反应速率
使用催化剂
升高温度
活化分子、有效碰撞与反应速率的关系
归纳总结
其他因素对化学反应速率的影响
光辐照
电弧
放射线辐照
强磁场
超声波
高速研磨
总之,向反应体系输人能量,都有可能改变化学反应速率
飞秒化学
飞秒化学是物理化学的一支,研究在极小的时间内化学反应的过程和机理。这一领域涉及的时间间隔短至约千万亿分之一秒,即1飞秒(fs, 1 fs=10-15 s) 。在这个极小的时间段里,产生的飞秒激光可以用于检测分子、原子、离子的结构、组成、运动等形成飞秒检测范畴。
始态、过渡态、终态
飞秒激光器
冲刺时间分辨技术
单位体积内 分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
升高温度
正催化剂
增大浓度
增大压强
→化学反应速率的表示和计算
→探究影响化学反应速率的因素
→活化能和有效碰撞理论解释影响反应速率的因素
第二章 化学反应速率与化学反应平衡
第一节 化学反应速率
第1课时 化学反应速率
工业
制氨
钢铁
生锈
食物
腐败
尾气处理
为什么要研究化学反应速率?
那么,如何定量的描述化学反应过程进行的快慢呢?
1.化学反应速率
通常用单位时间内反应物质浓度的减少或生成物浓度的增大来表示。
(1)表达式:
(2)单位:
v(B)= ——
△c(B)
△t
、mol/(L·min)
或mol·L-1·s-1
、mol·L-1·min-1
mol/(L·s)
(3)规律:
化学反应速率之比 = 化学计量数之比
1 mol/(L·s)= mol/(L·min)
1.化学反应速率
通常用单位时间内反应物质浓度的减少或生成物浓度的增大来表示。
(1)表达式:
(2)单位:
v(B)= ——
△c(B)
△t
、mol/(L·min)
或mol·L-1·s-1
、mol·L-1·min-1
mol/(L·s)
(3)规律:
化学反应速率之比 = 化学计量数之比
(4)注意:
①取正值,平均速率
②指明具体的物质
③固体或纯液体不适用
每种物质表示的化学反应速率数值不同
如何比较化学反应速率的大小呢?
交流讨论
比较化学反应速率大小:统一单位,同种物质
进行化学反应速率测定时
需要检测什么物理量?
该如何测量?
交流讨论
(1)测定原理
浓度的变化
直接测定
体积
压强
颜色
导电性
光吸收
间接测定
对应的时间
找到
已知
v
=
Δc
Δt
2.化学反应速率的测定
气体
相同时间收集气体的体积;
收集等量气体所用时间;
一段时间气体压强变化(恒容容器)
酸碱
一定时间氢离子或氢氧根离子浓度的变化
变色所需时间
颜色
固体
一定时间消耗固体的质量
沉淀
变浑浊
所需时间
(2)常用的测定方法
2.化学反应速率的测定
第二章 化学反应速率与化学反应平衡
第一节 化学反应速率
第2课时 影响化学反应速率的因素
镁与盐酸反应比铜与盐酸反应剧烈
粉末状碳酸钙比块状碳酸钙与盐酸反应剧烈
物质
本身的性质
浓度
温度
催化剂
接触面积
影响化学反应速率的因素?
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
自变量?
↓
如何实现
自变量的变化?
↓
预期现象?
1.浓度
1.浓度
增大反应物的浓度,化学反应速率 ;
减小反应物的浓度,化学反应速率 。
加快
减慢
注意事项
①浓度对速率的影响适用于气体或溶液参与的反应,固体和纯液体的浓度视为常数。
②对于离子反应,实际参加反应的离子浓度发生变化,才会引起化学反应速率的改变。
③常温下,铁铝遇到冷的浓硫酸、浓硝酸钝化。
增大反应物的量或浓度,化学反应速率一定增大?
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
2.温度
2.温度
升高温度,化学反应速率 ;
降低温度,化学反应速率 。
加快
减慢
注意事项
温度对反应速率的影响适用于除电化学反应外的绝大多数化学反应,如升高温度,不论吸热反应还是放热反应,不论正反应速率还是逆反应速率,均加快。
升高反应温度,化学反应速率一定增大?
3.催化剂
加入催化剂,化学反应速率一定增大吗?
产物的量会变化吗?
反应的焓变会变化吗?
增大压强,引起气体反应物浓度 ,化学反应速率 ;
减小压强,引起气体反应物浓度 ,化学反应速率 。
增大
减小
加快
减慢
注意事项
压强对速率的影响适用于有气体参与的反应,且通过浓度对反应速率的影响实现。
4.压强
增大压强,反应速率一定增大吗?
第二章 化学反应速率与化学反应平衡
第一节 化学反应速率
第3课时 活化能
如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢?
从微观上看,反应物分子一般总是经过若干个简单的反应步骤才最终转化为产物分子的。每一个简单的反应都称为一个基元反应。
反应历程是化学中用来描述某一化学变化所经由的全部基元反应,反应历程又称反应机理。
基元反应
例如:反应2HI H2+I2
反应历程 / 反应机理
第一步:2HI H2+2I·
第二步:2I· I2
任何气体中分子间的碰撞次数都是非常巨大的。通常情况下,当气体的浓度为 1 mol/L 时,在每立方厘米、每秒内反应物分子间的碰撞可达到 1028 次。如果反应物分子间的任何一次碰撞都能发生反应的话,任何气体的反应均可以瞬间完成。但实际并非如此。
气体分子的碰撞频率
(快反应)
(慢反应)
为什么分子的碰撞时有的能发生化学反应,有的不能?
简单碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数分子碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞,反应物分子间有效碰撞的频率越高,化学反应速率越大。
吉尔伯特·牛顿·路易斯
示例:HI 分解反应中分子碰撞示意图
能量不足,碰撞无法发生反应
HI
HI
HI
HI
取向不对,碰撞无法发生反应
HI
HI
HI
HI
有效碰撞,发生反应
H2
I2
HI
HI
有效碰撞
投篮那些事
力道不足
——进不去球
取向不对
——进不去球
力道、取向恰好
——进球
能量
反应物
生成物
反应过程
活化能
E1
具有足够的能量,
能发生有效碰撞的分子
活化分子
ΔH
E2
活化分子变成生成物分子放出的能量
其它条件不变时
升高温度
活化分子
有效碰撞理论解释温度对化学反应速率的影响
升高温度 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
有效碰撞理论解释催化剂对化学反应速率的影响
正催化剂 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
其它条件不变时
增大反应物浓度
活化分子
有效碰撞理论解释浓度对化学反应速率的影响
增大浓度 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
容器的容积不变
压缩体积或充入气态反应物
活化分子
有效碰撞理论解释压强对化学反应速率的影响
增大压强 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
活化分子
容器的容积不变
充入非反应气体
有效碰撞理论解释压强对化学反应速率的影响
恒温、恒容充入非反应气体 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
活化分子
容器内压强不变
充入非反应气体
有效碰撞理论解释压强对化学反应速率的影响
恒温、恒压充入非反应气体 单位体积内分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
单位时间内、单位体积内有效碰撞次数增多
单位体积内分子总数不变,活化分子百分数增加,活化分子数增加。
单位体积内分子总数增加,活化分子百分数不变,活化分子数增加
增大反应物浓度
增大气体压强
增大化学反应速率
使用催化剂
升高温度
活化分子、有效碰撞与反应速率的关系
归纳总结
其他因素对化学反应速率的影响
光辐照
电弧
放射线辐照
强磁场
超声波
高速研磨
总之,向反应体系输人能量,都有可能改变化学反应速率
飞秒化学
飞秒化学是物理化学的一支,研究在极小的时间内化学反应的过程和机理。这一领域涉及的时间间隔短至约千万亿分之一秒,即1飞秒(fs, 1 fs=10-15 s) 。在这个极小的时间段里,产生的飞秒激光可以用于检测分子、原子、离子的结构、组成、运动等形成飞秒检测范畴。
始态、过渡态、终态
飞秒激光器
冲刺时间分辨技术
单位体积内 分子总数 活化分子 百分数 单位体积内 活化分子数 反应速率
升高温度
正催化剂
增大浓度
增大压强
→化学反应速率的表示和计算
→探究影响化学反应速率的因素
→活化能和有效碰撞理论解释影响反应速率的因素
