化学人教版(2019)必修第二册7.3.2乙酸(共40张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.2乙酸(共40张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 27.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 13:52:17 | ||
图片预览










文档简介
(共40张PPT)
第三节 乙醇与乙酸
第2课时:乙酸
第七章 有机化合物
乙酸的结构与性质
01
酯化反应与酯
02
学习目标
1.通过模型观察,讨论交流、知道乙酸的分子结构特点及物理性质和化学性质,知道乙酸具有酸的通性且酸性比碳酸强,会写乙酸与Na、NaOH、Na2CO3、NaHCO3等物质反应的化学方程式。
2.通过设计实验探究、动画模拟演示,提高基本化学实验技能,了解酯化反应的概念,知道乙酸的酯化反应原理和断键部位,能正确书写酯化反应方程式。
3.结合生活经验和化学实验,初步体会有机物制备方法和特点,进一步认识乙酸对于人类日常生活、身体健康的重要性。
传说古代山西省有个酿酒高手叫杜康,他儿子黑塔跟父亲也学会了酿酒技术后,黑塔觉得酿酒后把酒糟扔掉可惜,于是他把酒糟浸泡在水缸里,到了第二十一日的酉时,一开缸,却发现一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”,这“调味酱”就是今天的醋。
酉
一
日
廿
乙酸的结构与性质
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
学生活动1:联系生活中的食醋,观察乙酸样品,闻其气味,阅读教材
P79页内容,思考乙酸具有哪些物理性质?填写表格内容。
①食醋是生活中常用的调味剂,有刺激性气味,味道酸。醋中含有3%~5%的乙酸,所以乙酸又被称为醋酸。
②乙酸的物理性质:
俗名 颜色 状态 气味 溶解性 熔点 沸点 挥发性
醋酸
无色
液体
有强烈的刺激气味
易溶于水和乙醇
16.6℃
117.9℃
易挥发
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
③无水乙酸温度较低时(低于16.6℃),会凝结成像冰一样的晶体,所以无水乙酸又称冰醋酸。若在实验室中遇到这种情况时,可将试剂瓶用手或热毛巾捂热,也可放在温水浴中温热,待冰醋酸熔化后,倒出即可。
【温馨提示】用途:是一种重要的有机化工原料。可用于生产醋酸纤维、合成纤维、喷漆溶剂、香料、染料、医药以及农药等。同时,乙酸是食醋的重要成分,也可用于杀菌消毒。
黄豆泡醋可以降血压
醋漱口可防感冒
可以生产农药
可以生产涂料
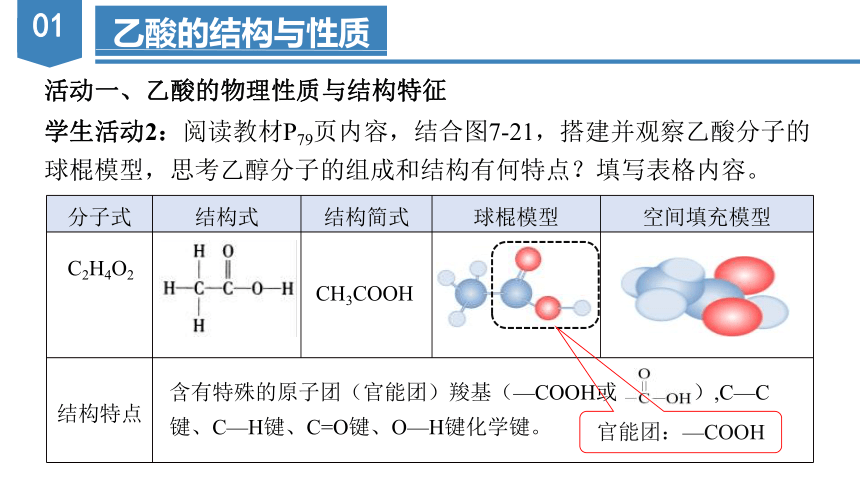
分子式 结构式 结构简式 球棍模型 空间填充模型
结构特点
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
学生活动2:阅读教材P79页内容,结合图7-21,搭建并观察乙酸分子的
球棍模型,思考乙醇分子的组成和结构有何特点?填写表格内容。
含有特殊的原子团(官能团)羧基(—COOH或 ),C—C键、C—H键、C=O键、O—H键化学键。
CH3COOH
C2H4O2
官能团:—COOH
【结论】乙酸分子可看成是甲基(-CH3)与羧基(-COOH)的组合,羧基决定着乙酸的主要化学性质。
发生化学反应时,主要断裂①②的化学键:
【温馨提示】乙酸属于有机化合物中的羧酸。羧酸是由烃基与羧基相连构成的有机化合物。羧酸可以分为脂肪酸(如CH3COOH)和芳香酸(如 ),一元羧酸(如C17H33COOH)、二元羧酸(如HOOC-COOH,乙二酸)和多元羧酸等。羧酸的官能团是羧基(—COOH)。
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
甲基(-CH3)
羧基(-COOH)
①
②
①键O-H 酸性
②键O-H 酯化
对应训练
【典例1】下列关于乙酸的说法中不正确的是( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有强烈刺激性气味的液体
D.乙酸分子中有四个氢原子,所以不是一元酸
D
【解析】乙酸是具有刺激性气味的液体;尽管乙酸分子中含有4个氢原子,但在水中只有羧基上的氢原子能发生部分电离: CH3COOH CH3COO-+H+,因此乙酸是一元酸。
对应训练
【典例2】下列说法正确的是( )
A.羧酸的官能团是羟基
B.羟基和氢氧根中含有的电子数不同
C.在氧气中燃烧只生成二氧化碳和水的有机物一定是烃
D.乙醇与钠反应生成氢气,此现象说明乙醇具有酸性
B
【解析】羧酸的官能团是羧基,A项错误;羟基含9个电子,氢氧根离子含10个电子,B项正确;烃的含氧衍生物在氧气中燃烧也生成二氧化碳和水,C项错误;乙醇溶于水不能电离出氢离子,所以乙醇不具有酸性,D项错误。
乙酸的结构与性质
活动二、探究乙酸的化学性质
学生活动1:结合教材P80页”思考与讨论”,根据下列药品,设计实
验证明乙酸的酸性,填写表格内容。
药品:镁条、NaOH溶液、Na2CO3粉末、乙酸溶液、酚酞、石蕊 、氧
化铜粉末
实验 实验内容 实验现象 实验结论、反应方程式
实验一 向一支盛有少量乙酸的试管里加入镁条
实验二 乙酸滴加到滴有酚酞的NaOH溶液中
产生气泡,手触摸发热
红色变成无色
乙酸具有酸:2CH3COOH+Mg==Mg(CH3COO-)2+H2↑
酸碱中和反应:CH3COOH+OH-==CH3COO-+H2O
乙酸的结构与性质
活动二、探究乙酸的化学性质
实验 实验内容 实验现象 实验结论、反应方程式
实验三 向一盛有少量碳酸钠粉末的试管里,加入约3mL乙酸溶液
实验四 将石蕊试液滴加到乙酸中
实验五 将以酸加入到氧化铜粉末中
结论 【温馨提示】乙酸属于饱和一元羧酸,同乙醇一样属于烃的含氧衍生物。饱和一元羧酸通式为:CnH2nO2。
产生气泡
溶液变红色
黑色固体溶解,生成蓝色溶液
乙酸酸性比碳酸强:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
乙酸具有酸的通性:CH3COOH CH3COO-+H+
与碱性氧化物反应成盐和水:CuO+2CH3COOH=Cu2++2CH3COO-
乙酸为一元弱酸,具有酸的通性,且酸性:CH3COOH>H2CO3
乙酸的结构与性质
活动二、探究乙酸的化学性质
乙酸的结构与性质
活动二、探究乙酸的化学性质
【思考】为什么俗话说:“姜是老的辣,酒是陈的香。”?蒸鱼时会加醋和酒,这
样鱼会更香醇鲜美,你知道为什么吗?
乙酸的结构与性质
活动二、探究乙酸的化学性质
学生活动2:根据教材P80页【实验7-6】,完成实验,观察实验现象,填
写表格内容。
实验 装置
实验 步骤
乙醇+浓硫酸+乙酸
饱和Na2CO3溶液
在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上,观察现象。
乙酸的结构与性质
活动二、探究乙酸的化学性质
实验现象
实验结论
化学 方程式
学生活动2:根据教材P80页【实验7-6】,完成实验,观察实验现象,填
写表格内容。
饱和Na2CO3溶液的液面上有 透明的油状液体 生成,并可能闻到 香味
在浓硫酸、加热的条件下,乙醇和乙酸发生反应,生成 无色、透明、不溶于水、有香味的油状的液体
CH3COOH+C2H5OH CH3COOC2H5+H2O
乙酸乙酯
乙酸
乙醇
对应训练
【典例1】下列说法不正确的是( )
A.乙酸的沸点比乙醇的高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
C
【解析】A.乙酸的沸点为117.9℃,乙醇的沸点为78℃,A正确;B.乙酸能和碳酸钠反应生成二氧化碳气体,依据强酸制弱酸的原理,乙酸的酸性强于碳酸,B正确;C.乙酸和乙醇生成乙酸乙酯的反应属于酯化反应,C不正确;D.乙酸分子中虽然有4个氢原子,但乙酸只含有1个-COOH,是一元酸,D正确;故选C。
对应训练
【典例2】某同学利用图所示装置制备乙酸乙酯。实验如下:
①向浓乙醇混合液中滴入乙酸后,加热试管
②一段时间后,试管中红色溶液上方出现油状液体
③停止加热,振荡试管,油状液体层变薄,下层红色溶液褪色
④取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是( )
A. 中加热利于加快酯化反应速率,故温度越高越好
B. 中油状液体层变薄主要是乙酸乙酯溶于溶液所致
C. 中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D. 取中上层油状液体测其核磁共振氢谱,共有组峰
D
对应训练
【解析】A.中加热利于加快酯化反应速率,但温度越高,制取乙酸乙酯的原料乙酸乙醇挥发更快,不利于提高转化率,乙酸乙酯沸点,温度越高,不利于乙酸乙酯收集到中,故A错误;B.饱和碳酸钠溶液能中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,中油状液体层变薄,不是乙酸乙酯溶于溶液所致,故B错误;C.碳酸钠溶液呈碱性,能使酚酞变红,停止加热,振荡试管,饱和碳酸钠溶液能中和挥发出来的乙酸,红色褪去,不是酚酞溶于乙酸乙酯中,故C错误;D.取中上层油状液体为乙酸乙酯,结构简式为:,该分子的核磁共振氢谱中有三组峰,其峰面积之比是3:2:3,故D正确。故选D。
酯化反应与酯
酯化反应与酯
活动一、探究酯化反应的原理
学生活动1:阅读教材P80页内容,结合【实验7-6】,思考酯化反应的概
念及特点是什么?如何证明酯化反应的断键方式?
①概念:酸与醇反应生成酯和水的反应叫酯化反应。
②特点:酯化反应是可逆反应,生成的酯会与水发生水解反应生成相应的醇与酸,同时,也属于取代反应,且酯化反应比较缓慢。
③原理:酯化反应可能有两种断键方式,一种酸中碳氧键断裂,一种酸中氢氧键断裂。即:
酯化反应与酯
活动一、探究酯化反应的原理
测定方法:用同位素原子示踪法验证酯化反应的实质(断键方式)主要是按a式进行的。用含18O的醇跟羧酸起酯化反应,形成含有18O的酯,证明这种酯化反应的实质是羧酸脱去羧基上的羟基,醇脱去羟基上的氢原子:
H
H
O
H
C
H
O
C
H
H
O
H
C
H
H
C
H
+H2O
浓硫酸
H
H
C
H
O
C
H
O
H
C
H
H
C
H
乙酸乙酯
同位素示踪法验证断键位置
【温馨提示】酯化反应原理:“酸脱羟基,醇脱氢”
酯化反应与酯
活动一、探究酯化反应的原理
学生活动2:问题探究1—从试剂加入顺序、长导管和浓硫酸的作用、酯
的分离等方面分析,酯化反应实验过程中要注意哪些问题?
①加入顺序:先加入乙醇,再沿器壁慢慢加入浓H2SO4,冷却后再加入CH3COOH。
②长导管作用:导气和冷凝回流,导管末端未插入饱和Na2CO3溶液中(防倒吸)。
③浓H2SO4的作用:催化剂—加快反应速率;吸水剂—提高乙醇、乙酸的转化率。
④酯的分离:采用分液法分离试管中的液体混合物,所得上层液体即为乙酸乙酯。
⑤实验时要用酒精灯缓慢加热的原因一是加快反应速率;二是减少乙醇、乙酸的挥发;三是将生成的乙酸乙酯及时蒸出,提高乙醇、乙酸的转化率。
酯化反应与酯
活动一、探究酯化反应的原理
学生活动2:问题探究1—制备乙酸乙酯的实验中,大试管中加入碎瓷片
的目的是什么?该实验中饱和碳酸钠溶液的作用是什么?
①大试管中放入几块碎瓷片,目的是防止加热过程中液体暴沸。
②该实验中饱和碳酸钠溶液有三个作用:一是与挥发出来的乙酸反应;二是溶解挥发出来的乙醇;三是减小乙酸乙酯在水中的溶解度,便于分层,得到乙酸乙酯。
③实验中,加热时温度可能不是很稳定,挥发出来的CH3COOH、CH3CH2OH溶于水,易造成溶液倒吸。故导管末端不能插入饱和碳酸钠溶液中。也可以在导管末断连接一个干燥管、倒置漏斗或加装空瓶等方法防止倒吸。
乙酸乙酯
对应训练
【典例1】乙酸分子的结构式为 ,下列反应及断键部位
正确的是( )
a.乙酸的电离,是①键断裂 b.乙酸与乙醇发生酯化反应,是②键断
裂 c.在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2
CH2Br—COOH+HBr,是③键断裂 d.乙酸变成乙酸酐的反应:
2CH3COOH ,是①②键断裂 。
A.abc B.abcd C.bcd D.acd
B
【解析】乙酸电离出H+时,断裂①键;在酯化反应时酸脱羟基,断裂②键;与Br2的反应,取代了甲基上的氢,断裂③键;生成乙酸酐的反应,一个乙酸分子断①键,另一个分子断②键,所以B正确。
对应训练
【典例2】乙酸与乙醇在浓硫酸催化作用下发生酯化反应,下列叙述
不正确的是( )
A.产物用饱和碳酸钠溶液吸收,下层得到有香味的油状液体
B.反应中乙酸分子中的羟基被—O—CH2CH3取代
C.反应中乙醇分子的氢原子被取代
D.酯化反应中,浓硫酸作用为催化剂和吸水剂
A
【解析】题述反应生成的乙酸乙酯产物中含有乙酸和乙醇,可用饱和碳酸钠溶液吸收乙酸和乙醇,同时可降低乙酸乙酯的溶解度,由于乙酸乙酯密度小于水,上层得到有香味的油状液体,A错误;酯化反应中羧酸提供羟基,醇提供氢原子,因此反应中乙酸分子中羟基被—OC2H5取代,B、C正确;酯化反应中浓硫酸的作用为催化剂和吸水剂,D正确。
酯化反应与酯
活动二、认识酯
学生活动1:阅读教材P80页最后自然段,结合【实验7-6】乙酸乙酯的制
备,思考什么是酯?酯的结构有何特点?
①定义:醇跟酸反应生成的一类化合物叫作酯,属于烃的一种含氧衍生物。
②结构特点:一般通式可写为 R' ,简写为R'COOR,官能团酯基(可表示为 或—COOR)。R和R′可以相同,也可以不同。
R是烃基,也可以是H,但R只能是烃基。
③命名:依据酸和醇的名称命名为“某酸某酯”。如乙酸乙酯:CH3COOCH2CH3
酯化反应与酯
活动二、认识酯
学生活动2:结合【实验7-6】乙酸乙酯的性质,思考酯类有哪些重要的
物理和化学性质?
①物理性质:低级酯(如乙酸乙酯)密度比水小,难溶于水,易溶于乙醇和乙醚等有机溶剂,具有芳香气味。
②化学性质:在酸或碱性条件下可以发生水解反应(酯化反应的逆过程),也属于取代反应,且在碱性条件下水解可进行完全。如乙酸乙酯水解的反应方程式:
稀硫酸催化时水解反应可逆:CH3COOC2H5+H2O CH3COOH+C2H5OH
NaOH催化时水解反应不可逆:CH3COOC2H5+NaOH CH3COONa+C2H5OH
酯化反应与酯
活动二、认识酯
学生活动2:结合【实验7-6】乙酸乙酯的性质,思考酯类有哪些重要的
物理和化学性质?
③用途:酯是有芳香气味的液体,存在于各种水果和花草中。如梨里含有乙酸异戊酯,苹果和香蕉里含有异戊酸异戊酯等。酯可用作溶剂(高档化妆品),也可用作制备饮料和糖果的香料。
酯化反应与酯
活动二、认识酯
【温馨提示】在一般酒中,除乙醇外,还含有有机酸、杂醇等,有机酸带酸味,杂醇气味难闻,饮用时涩口刺喉,但长期贮藏过程中有机酸能与杂醇相互酯化,形成多种酯类化合物,每种酯具有一种香气,多种酯就具有多种香气,所以老酒的香气浓郁而优美,口感味道也变得纯正了。
【酒为什么是陈年的香?】
对应训练
【典例1】下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
在上述实验过程中,所涉及的三次分离操作分别是( )
A.①蒸馏、②过滤、③分液
B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液
D.①分液、②蒸馏、③结晶、过滤
【解析】乙酸乙酯在饱和碳酸钠溶液中溶解度很小,所以第一步用分液的方法分离出乙酸乙酯;然后得到的A中含有乙酸钠和乙醇,由于乙酸钠的沸点高,故第二步用蒸馏的方法分离出乙醇;第三步,加硫酸将乙酸钠转变为乙酸,再蒸馏得到乙酸。
B
对应训练
【典例2】酯类物质广泛存在于香蕉、梨等水果中。某实验小组从梨中
分离出一种酯,该酯在稀硫酸作用下加热得到乙酸和另一种分子式为
C6H14O的物质。下列说法错误的是( )
A.乙酸分子中含有羧基
B.C6H14O可与金属钠发生反应
C.实验小组分离出的酯可表示为C6H13COOCH3
D.稀硫酸是该反应的催化剂
C
【解析】乙酸分子中含有羧基官能团,A正确;由题意知,C6H14O一定是醇,因此C6H14O可与金属钠发生反应,B正确;根据酯能在酸性条件下水解生成相应的酸和醇,可知用乙酸与C6H14O反应脱去一分子的水即可得到酯CH3COOC6H13,C错误;酯水解时需要酸或碱作催化剂,稀硫酸是该反应的催化剂,D正确。
1.酒精和醋酸是日常生活中的常用品,下列方法不能将二者鉴别开
的是( )
A.闻气味
B.分别用来浸泡水壶中的水垢,观察水垢是否溶解
C.分别滴加NaOH溶液
D.分别滴加石蕊溶液
C
【解析】A项,酒精和醋酸气味不同,可用闻气味的方法鉴别;B项,水垢的主要成分是CaCO3和Mg(OH)2,可溶于醋酸但不溶于酒精,可鉴别;C项,酒精和NaOH溶液不反应,醋酸和NaOH溶液反应,但无明显现象,不能鉴别;D项,醋酸使紫色石蕊溶液变红,但酒精不能,可鉴别。
2.下列关于乙酸性质的叙述中,错误的是 ( )
A. 乙酸的酸性比碳酸的强,所以它可以与碳酸盐反应,产生气体
B. 乙酸具有酸性,所以能与钠反应放出
C. 乙酸分子中含有碳氧双键,所以它能使溴水褪色
D. 乙酸在温度低于时,就凝结成冰状晶体
C
【解析】乙酸的酸性比碳酸的强,根据强酸制弱酸的原理可知,它可以与碳酸盐反应,产生气体,A正确;乙酸属于一元弱酸,具有酸性,所以能与钠发生反应放出,B正确;乙酸的结构式为 ,分子中的碳氧双键和不能发生反应,C错误;乙酸俗称冰醋酸,当温度低于时,就凝结成类似冰一样的晶体,D正确。
3.食醋中含有乙酸,下列关于乙酸的说法中正确的是( )
A.乙酸是有刺激性气味的液体
B.乙酸分子中含有4个氢原子,是四元弱酸
C.乙酸中的乙醇可用直接加热蒸馏的方法除去
D.乙酸酸性较弱,不能使紫色石蕊溶液变红
A
【解析】乙酸中只有羧基中的氢原子才能电离,是一元弱酸,B项错误;直接加热时乙酸与乙醇能发生反应生成乙酸乙酯,且乙酸也易挥发,应先与碱混合反应后再蒸馏出乙醇,最后加入硫酸蒸馏出乙酸,C项错误;乙酸是弱酸,但能使紫色石蕊溶液变红,D项错误。
4.实验室用下图装置制取乙酸乙酯(乙醇的结构简式为 ),
下列有关说法正确的是( )
A.甲试管中加入药品的顺序:3mL 、2mL浓硫酸和
2mLCH3COOH
B.乙试管中的饱和碳酸钠溶液可以换成氢氧化钠溶液
C.从乙试管中分离得到纯净干燥的乙酸乙酯的操作是:振荡、静置、
分液
D.生成的乙酸乙酯的结构
简式为
A
【解析】A.加入药品的顺序:先加密度小的液体,再加密度大的液体,有利于混合和热量散失,A正确;B.乙酸乙酯会与氢氧化钠溶液发生水解反应,B错误;C.分液后得到的乙酸乙酯中还含有少量的水分,需要加入干燥剂,蒸馏,C错误;D.酯化反应断键的规律是“酸脱羟基醇脱氢”,所以生成的乙酸乙酯的结构简式为 ,D错误;故选A。
延时符
俗称醋酸,无色、有刺激性气味的液体
定义
特点
酯
乙酸
物理性质
化学性质
用 途
酯化反应
弱酸性:CH3COOH CH3COO- + H+
酸与醇反应生成酯和水的反应
实验
可逆反应、酸脱羟基醇脱氢
加入顺序、浓硫酸作用、长导管作用、饱和碳酸钠作用
化工原料、调味剂、杀菌消毒
定义、结构特点、物理性质、化学性质(水解或取代)、用途
结构特征
结构简式:CH3COOH,官能团:羧基(—COOH)
第2课时 乙酸
第三节 乙醇与乙酸
第2课时:乙酸
第七章 有机化合物
乙酸的结构与性质
01
酯化反应与酯
02
学习目标
1.通过模型观察,讨论交流、知道乙酸的分子结构特点及物理性质和化学性质,知道乙酸具有酸的通性且酸性比碳酸强,会写乙酸与Na、NaOH、Na2CO3、NaHCO3等物质反应的化学方程式。
2.通过设计实验探究、动画模拟演示,提高基本化学实验技能,了解酯化反应的概念,知道乙酸的酯化反应原理和断键部位,能正确书写酯化反应方程式。
3.结合生活经验和化学实验,初步体会有机物制备方法和特点,进一步认识乙酸对于人类日常生活、身体健康的重要性。
传说古代山西省有个酿酒高手叫杜康,他儿子黑塔跟父亲也学会了酿酒技术后,黑塔觉得酿酒后把酒糟扔掉可惜,于是他把酒糟浸泡在水缸里,到了第二十一日的酉时,一开缸,却发现一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”,这“调味酱”就是今天的醋。
酉
一
日
廿
乙酸的结构与性质
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
学生活动1:联系生活中的食醋,观察乙酸样品,闻其气味,阅读教材
P79页内容,思考乙酸具有哪些物理性质?填写表格内容。
①食醋是生活中常用的调味剂,有刺激性气味,味道酸。醋中含有3%~5%的乙酸,所以乙酸又被称为醋酸。
②乙酸的物理性质:
俗名 颜色 状态 气味 溶解性 熔点 沸点 挥发性
醋酸
无色
液体
有强烈的刺激气味
易溶于水和乙醇
16.6℃
117.9℃
易挥发
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
③无水乙酸温度较低时(低于16.6℃),会凝结成像冰一样的晶体,所以无水乙酸又称冰醋酸。若在实验室中遇到这种情况时,可将试剂瓶用手或热毛巾捂热,也可放在温水浴中温热,待冰醋酸熔化后,倒出即可。
【温馨提示】用途:是一种重要的有机化工原料。可用于生产醋酸纤维、合成纤维、喷漆溶剂、香料、染料、医药以及农药等。同时,乙酸是食醋的重要成分,也可用于杀菌消毒。
黄豆泡醋可以降血压
醋漱口可防感冒
可以生产农药
可以生产涂料
分子式 结构式 结构简式 球棍模型 空间填充模型
结构特点
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
学生活动2:阅读教材P79页内容,结合图7-21,搭建并观察乙酸分子的
球棍模型,思考乙醇分子的组成和结构有何特点?填写表格内容。
含有特殊的原子团(官能团)羧基(—COOH或 ),C—C键、C—H键、C=O键、O—H键化学键。
CH3COOH
C2H4O2
官能团:—COOH
【结论】乙酸分子可看成是甲基(-CH3)与羧基(-COOH)的组合,羧基决定着乙酸的主要化学性质。
发生化学反应时,主要断裂①②的化学键:
【温馨提示】乙酸属于有机化合物中的羧酸。羧酸是由烃基与羧基相连构成的有机化合物。羧酸可以分为脂肪酸(如CH3COOH)和芳香酸(如 ),一元羧酸(如C17H33COOH)、二元羧酸(如HOOC-COOH,乙二酸)和多元羧酸等。羧酸的官能团是羧基(—COOH)。
乙酸的结构与性质
活动一、乙酸的物理性质与结构特征
甲基(-CH3)
羧基(-COOH)
①
②
①键O-H 酸性
②键O-H 酯化
对应训练
【典例1】下列关于乙酸的说法中不正确的是( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有强烈刺激性气味的液体
D.乙酸分子中有四个氢原子,所以不是一元酸
D
【解析】乙酸是具有刺激性气味的液体;尽管乙酸分子中含有4个氢原子,但在水中只有羧基上的氢原子能发生部分电离: CH3COOH CH3COO-+H+,因此乙酸是一元酸。
对应训练
【典例2】下列说法正确的是( )
A.羧酸的官能团是羟基
B.羟基和氢氧根中含有的电子数不同
C.在氧气中燃烧只生成二氧化碳和水的有机物一定是烃
D.乙醇与钠反应生成氢气,此现象说明乙醇具有酸性
B
【解析】羧酸的官能团是羧基,A项错误;羟基含9个电子,氢氧根离子含10个电子,B项正确;烃的含氧衍生物在氧气中燃烧也生成二氧化碳和水,C项错误;乙醇溶于水不能电离出氢离子,所以乙醇不具有酸性,D项错误。
乙酸的结构与性质
活动二、探究乙酸的化学性质
学生活动1:结合教材P80页”思考与讨论”,根据下列药品,设计实
验证明乙酸的酸性,填写表格内容。
药品:镁条、NaOH溶液、Na2CO3粉末、乙酸溶液、酚酞、石蕊 、氧
化铜粉末
实验 实验内容 实验现象 实验结论、反应方程式
实验一 向一支盛有少量乙酸的试管里加入镁条
实验二 乙酸滴加到滴有酚酞的NaOH溶液中
产生气泡,手触摸发热
红色变成无色
乙酸具有酸:2CH3COOH+Mg==Mg(CH3COO-)2+H2↑
酸碱中和反应:CH3COOH+OH-==CH3COO-+H2O
乙酸的结构与性质
活动二、探究乙酸的化学性质
实验 实验内容 实验现象 实验结论、反应方程式
实验三 向一盛有少量碳酸钠粉末的试管里,加入约3mL乙酸溶液
实验四 将石蕊试液滴加到乙酸中
实验五 将以酸加入到氧化铜粉末中
结论 【温馨提示】乙酸属于饱和一元羧酸,同乙醇一样属于烃的含氧衍生物。饱和一元羧酸通式为:CnH2nO2。
产生气泡
溶液变红色
黑色固体溶解,生成蓝色溶液
乙酸酸性比碳酸强:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
乙酸具有酸的通性:CH3COOH CH3COO-+H+
与碱性氧化物反应成盐和水:CuO+2CH3COOH=Cu2++2CH3COO-
乙酸为一元弱酸,具有酸的通性,且酸性:CH3COOH>H2CO3
乙酸的结构与性质
活动二、探究乙酸的化学性质
乙酸的结构与性质
活动二、探究乙酸的化学性质
【思考】为什么俗话说:“姜是老的辣,酒是陈的香。”?蒸鱼时会加醋和酒,这
样鱼会更香醇鲜美,你知道为什么吗?
乙酸的结构与性质
活动二、探究乙酸的化学性质
学生活动2:根据教材P80页【实验7-6】,完成实验,观察实验现象,填
写表格内容。
实验 装置
实验 步骤
乙醇+浓硫酸+乙酸
饱和Na2CO3溶液
在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上,观察现象。
乙酸的结构与性质
活动二、探究乙酸的化学性质
实验现象
实验结论
化学 方程式
学生活动2:根据教材P80页【实验7-6】,完成实验,观察实验现象,填
写表格内容。
饱和Na2CO3溶液的液面上有 透明的油状液体 生成,并可能闻到 香味
在浓硫酸、加热的条件下,乙醇和乙酸发生反应,生成 无色、透明、不溶于水、有香味的油状的液体
CH3COOH+C2H5OH CH3COOC2H5+H2O
乙酸乙酯
乙酸
乙醇
对应训练
【典例1】下列说法不正确的是( )
A.乙酸的沸点比乙醇的高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
C
【解析】A.乙酸的沸点为117.9℃,乙醇的沸点为78℃,A正确;B.乙酸能和碳酸钠反应生成二氧化碳气体,依据强酸制弱酸的原理,乙酸的酸性强于碳酸,B正确;C.乙酸和乙醇生成乙酸乙酯的反应属于酯化反应,C不正确;D.乙酸分子中虽然有4个氢原子,但乙酸只含有1个-COOH,是一元酸,D正确;故选C。
对应训练
【典例2】某同学利用图所示装置制备乙酸乙酯。实验如下:
①向浓乙醇混合液中滴入乙酸后,加热试管
②一段时间后,试管中红色溶液上方出现油状液体
③停止加热,振荡试管,油状液体层变薄,下层红色溶液褪色
④取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是( )
A. 中加热利于加快酯化反应速率,故温度越高越好
B. 中油状液体层变薄主要是乙酸乙酯溶于溶液所致
C. 中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D. 取中上层油状液体测其核磁共振氢谱,共有组峰
D
对应训练
【解析】A.中加热利于加快酯化反应速率,但温度越高,制取乙酸乙酯的原料乙酸乙醇挥发更快,不利于提高转化率,乙酸乙酯沸点,温度越高,不利于乙酸乙酯收集到中,故A错误;B.饱和碳酸钠溶液能中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,中油状液体层变薄,不是乙酸乙酯溶于溶液所致,故B错误;C.碳酸钠溶液呈碱性,能使酚酞变红,停止加热,振荡试管,饱和碳酸钠溶液能中和挥发出来的乙酸,红色褪去,不是酚酞溶于乙酸乙酯中,故C错误;D.取中上层油状液体为乙酸乙酯,结构简式为:,该分子的核磁共振氢谱中有三组峰,其峰面积之比是3:2:3,故D正确。故选D。
酯化反应与酯
酯化反应与酯
活动一、探究酯化反应的原理
学生活动1:阅读教材P80页内容,结合【实验7-6】,思考酯化反应的概
念及特点是什么?如何证明酯化反应的断键方式?
①概念:酸与醇反应生成酯和水的反应叫酯化反应。
②特点:酯化反应是可逆反应,生成的酯会与水发生水解反应生成相应的醇与酸,同时,也属于取代反应,且酯化反应比较缓慢。
③原理:酯化反应可能有两种断键方式,一种酸中碳氧键断裂,一种酸中氢氧键断裂。即:
酯化反应与酯
活动一、探究酯化反应的原理
测定方法:用同位素原子示踪法验证酯化反应的实质(断键方式)主要是按a式进行的。用含18O的醇跟羧酸起酯化反应,形成含有18O的酯,证明这种酯化反应的实质是羧酸脱去羧基上的羟基,醇脱去羟基上的氢原子:
H
H
O
H
C
H
O
C
H
H
O
H
C
H
H
C
H
+H2O
浓硫酸
H
H
C
H
O
C
H
O
H
C
H
H
C
H
乙酸乙酯
同位素示踪法验证断键位置
【温馨提示】酯化反应原理:“酸脱羟基,醇脱氢”
酯化反应与酯
活动一、探究酯化反应的原理
学生活动2:问题探究1—从试剂加入顺序、长导管和浓硫酸的作用、酯
的分离等方面分析,酯化反应实验过程中要注意哪些问题?
①加入顺序:先加入乙醇,再沿器壁慢慢加入浓H2SO4,冷却后再加入CH3COOH。
②长导管作用:导气和冷凝回流,导管末端未插入饱和Na2CO3溶液中(防倒吸)。
③浓H2SO4的作用:催化剂—加快反应速率;吸水剂—提高乙醇、乙酸的转化率。
④酯的分离:采用分液法分离试管中的液体混合物,所得上层液体即为乙酸乙酯。
⑤实验时要用酒精灯缓慢加热的原因一是加快反应速率;二是减少乙醇、乙酸的挥发;三是将生成的乙酸乙酯及时蒸出,提高乙醇、乙酸的转化率。
酯化反应与酯
活动一、探究酯化反应的原理
学生活动2:问题探究1—制备乙酸乙酯的实验中,大试管中加入碎瓷片
的目的是什么?该实验中饱和碳酸钠溶液的作用是什么?
①大试管中放入几块碎瓷片,目的是防止加热过程中液体暴沸。
②该实验中饱和碳酸钠溶液有三个作用:一是与挥发出来的乙酸反应;二是溶解挥发出来的乙醇;三是减小乙酸乙酯在水中的溶解度,便于分层,得到乙酸乙酯。
③实验中,加热时温度可能不是很稳定,挥发出来的CH3COOH、CH3CH2OH溶于水,易造成溶液倒吸。故导管末端不能插入饱和碳酸钠溶液中。也可以在导管末断连接一个干燥管、倒置漏斗或加装空瓶等方法防止倒吸。
乙酸乙酯
对应训练
【典例1】乙酸分子的结构式为 ,下列反应及断键部位
正确的是( )
a.乙酸的电离,是①键断裂 b.乙酸与乙醇发生酯化反应,是②键断
裂 c.在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2
CH2Br—COOH+HBr,是③键断裂 d.乙酸变成乙酸酐的反应:
2CH3COOH ,是①②键断裂 。
A.abc B.abcd C.bcd D.acd
B
【解析】乙酸电离出H+时,断裂①键;在酯化反应时酸脱羟基,断裂②键;与Br2的反应,取代了甲基上的氢,断裂③键;生成乙酸酐的反应,一个乙酸分子断①键,另一个分子断②键,所以B正确。
对应训练
【典例2】乙酸与乙醇在浓硫酸催化作用下发生酯化反应,下列叙述
不正确的是( )
A.产物用饱和碳酸钠溶液吸收,下层得到有香味的油状液体
B.反应中乙酸分子中的羟基被—O—CH2CH3取代
C.反应中乙醇分子的氢原子被取代
D.酯化反应中,浓硫酸作用为催化剂和吸水剂
A
【解析】题述反应生成的乙酸乙酯产物中含有乙酸和乙醇,可用饱和碳酸钠溶液吸收乙酸和乙醇,同时可降低乙酸乙酯的溶解度,由于乙酸乙酯密度小于水,上层得到有香味的油状液体,A错误;酯化反应中羧酸提供羟基,醇提供氢原子,因此反应中乙酸分子中羟基被—OC2H5取代,B、C正确;酯化反应中浓硫酸的作用为催化剂和吸水剂,D正确。
酯化反应与酯
活动二、认识酯
学生活动1:阅读教材P80页最后自然段,结合【实验7-6】乙酸乙酯的制
备,思考什么是酯?酯的结构有何特点?
①定义:醇跟酸反应生成的一类化合物叫作酯,属于烃的一种含氧衍生物。
②结构特点:一般通式可写为 R' ,简写为R'COOR,官能团酯基(可表示为 或—COOR)。R和R′可以相同,也可以不同。
R是烃基,也可以是H,但R只能是烃基。
③命名:依据酸和醇的名称命名为“某酸某酯”。如乙酸乙酯:CH3COOCH2CH3
酯化反应与酯
活动二、认识酯
学生活动2:结合【实验7-6】乙酸乙酯的性质,思考酯类有哪些重要的
物理和化学性质?
①物理性质:低级酯(如乙酸乙酯)密度比水小,难溶于水,易溶于乙醇和乙醚等有机溶剂,具有芳香气味。
②化学性质:在酸或碱性条件下可以发生水解反应(酯化反应的逆过程),也属于取代反应,且在碱性条件下水解可进行完全。如乙酸乙酯水解的反应方程式:
稀硫酸催化时水解反应可逆:CH3COOC2H5+H2O CH3COOH+C2H5OH
NaOH催化时水解反应不可逆:CH3COOC2H5+NaOH CH3COONa+C2H5OH
酯化反应与酯
活动二、认识酯
学生活动2:结合【实验7-6】乙酸乙酯的性质,思考酯类有哪些重要的
物理和化学性质?
③用途:酯是有芳香气味的液体,存在于各种水果和花草中。如梨里含有乙酸异戊酯,苹果和香蕉里含有异戊酸异戊酯等。酯可用作溶剂(高档化妆品),也可用作制备饮料和糖果的香料。
酯化反应与酯
活动二、认识酯
【温馨提示】在一般酒中,除乙醇外,还含有有机酸、杂醇等,有机酸带酸味,杂醇气味难闻,饮用时涩口刺喉,但长期贮藏过程中有机酸能与杂醇相互酯化,形成多种酯类化合物,每种酯具有一种香气,多种酯就具有多种香气,所以老酒的香气浓郁而优美,口感味道也变得纯正了。
【酒为什么是陈年的香?】
对应训练
【典例1】下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
在上述实验过程中,所涉及的三次分离操作分别是( )
A.①蒸馏、②过滤、③分液
B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液
D.①分液、②蒸馏、③结晶、过滤
【解析】乙酸乙酯在饱和碳酸钠溶液中溶解度很小,所以第一步用分液的方法分离出乙酸乙酯;然后得到的A中含有乙酸钠和乙醇,由于乙酸钠的沸点高,故第二步用蒸馏的方法分离出乙醇;第三步,加硫酸将乙酸钠转变为乙酸,再蒸馏得到乙酸。
B
对应训练
【典例2】酯类物质广泛存在于香蕉、梨等水果中。某实验小组从梨中
分离出一种酯,该酯在稀硫酸作用下加热得到乙酸和另一种分子式为
C6H14O的物质。下列说法错误的是( )
A.乙酸分子中含有羧基
B.C6H14O可与金属钠发生反应
C.实验小组分离出的酯可表示为C6H13COOCH3
D.稀硫酸是该反应的催化剂
C
【解析】乙酸分子中含有羧基官能团,A正确;由题意知,C6H14O一定是醇,因此C6H14O可与金属钠发生反应,B正确;根据酯能在酸性条件下水解生成相应的酸和醇,可知用乙酸与C6H14O反应脱去一分子的水即可得到酯CH3COOC6H13,C错误;酯水解时需要酸或碱作催化剂,稀硫酸是该反应的催化剂,D正确。
1.酒精和醋酸是日常生活中的常用品,下列方法不能将二者鉴别开
的是( )
A.闻气味
B.分别用来浸泡水壶中的水垢,观察水垢是否溶解
C.分别滴加NaOH溶液
D.分别滴加石蕊溶液
C
【解析】A项,酒精和醋酸气味不同,可用闻气味的方法鉴别;B项,水垢的主要成分是CaCO3和Mg(OH)2,可溶于醋酸但不溶于酒精,可鉴别;C项,酒精和NaOH溶液不反应,醋酸和NaOH溶液反应,但无明显现象,不能鉴别;D项,醋酸使紫色石蕊溶液变红,但酒精不能,可鉴别。
2.下列关于乙酸性质的叙述中,错误的是 ( )
A. 乙酸的酸性比碳酸的强,所以它可以与碳酸盐反应,产生气体
B. 乙酸具有酸性,所以能与钠反应放出
C. 乙酸分子中含有碳氧双键,所以它能使溴水褪色
D. 乙酸在温度低于时,就凝结成冰状晶体
C
【解析】乙酸的酸性比碳酸的强,根据强酸制弱酸的原理可知,它可以与碳酸盐反应,产生气体,A正确;乙酸属于一元弱酸,具有酸性,所以能与钠发生反应放出,B正确;乙酸的结构式为 ,分子中的碳氧双键和不能发生反应,C错误;乙酸俗称冰醋酸,当温度低于时,就凝结成类似冰一样的晶体,D正确。
3.食醋中含有乙酸,下列关于乙酸的说法中正确的是( )
A.乙酸是有刺激性气味的液体
B.乙酸分子中含有4个氢原子,是四元弱酸
C.乙酸中的乙醇可用直接加热蒸馏的方法除去
D.乙酸酸性较弱,不能使紫色石蕊溶液变红
A
【解析】乙酸中只有羧基中的氢原子才能电离,是一元弱酸,B项错误;直接加热时乙酸与乙醇能发生反应生成乙酸乙酯,且乙酸也易挥发,应先与碱混合反应后再蒸馏出乙醇,最后加入硫酸蒸馏出乙酸,C项错误;乙酸是弱酸,但能使紫色石蕊溶液变红,D项错误。
4.实验室用下图装置制取乙酸乙酯(乙醇的结构简式为 ),
下列有关说法正确的是( )
A.甲试管中加入药品的顺序:3mL 、2mL浓硫酸和
2mLCH3COOH
B.乙试管中的饱和碳酸钠溶液可以换成氢氧化钠溶液
C.从乙试管中分离得到纯净干燥的乙酸乙酯的操作是:振荡、静置、
分液
D.生成的乙酸乙酯的结构
简式为
A
【解析】A.加入药品的顺序:先加密度小的液体,再加密度大的液体,有利于混合和热量散失,A正确;B.乙酸乙酯会与氢氧化钠溶液发生水解反应,B错误;C.分液后得到的乙酸乙酯中还含有少量的水分,需要加入干燥剂,蒸馏,C错误;D.酯化反应断键的规律是“酸脱羟基醇脱氢”,所以生成的乙酸乙酯的结构简式为 ,D错误;故选A。
延时符
俗称醋酸,无色、有刺激性气味的液体
定义
特点
酯
乙酸
物理性质
化学性质
用 途
酯化反应
弱酸性:CH3COOH CH3COO- + H+
酸与醇反应生成酯和水的反应
实验
可逆反应、酸脱羟基醇脱氢
加入顺序、浓硫酸作用、长导管作用、饱和碳酸钠作用
化工原料、调味剂、杀菌消毒
定义、结构特点、物理性质、化学性质(水解或取代)、用途
结构特征
结构简式:CH3COOH,官能团:羧基(—COOH)
第2课时 乙酸
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
