专题1 揭示物质结构的奥秘 同步练习(含解析) 2023-2024学年高二下学期苏教版(2019)化学选择性必修2
文档属性
| 名称 | 专题1 揭示物质结构的奥秘 同步练习(含解析) 2023-2024学年高二下学期苏教版(2019)化学选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 286.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 14:46:02 | ||
图片预览



文档简介
专题1揭示物质结构的奥秘
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.Cl2和Cl2是氯元素的两种核素
B.石墨与金刚石互为同素异形体,两者不能发生相互转化
C.C5H12的一氯代物有8种
D.CH3COOCH2CH3与CH3CH2OOCCH3互为同分异构体
2.NA是阿伏加德罗常数的值,下列说法正确的是
A.22.4L(标准状况)氮气中含有7NA个中子
B.1mol重水比1mol水多NA个质子
C.若NA的数值变为原来的两倍,则O2的摩尔质量变为64g/mol
D.12C在自然界中的丰度为98.892%,因此碳元素的质量数为12
3.核磁共振、可用于测定蛋白质、核酸等生物大分子的空间结构。下列有关C、的叙述正确的是
A.C、具有相同的中子数 B.与互为同位素
C.的核外电子数与中子数相同 D.与的核外电子排布相同
4.改革开放40多年来,我国材料化学的发展为科技进步做出了突出贡献。下列有关材料的说法不正确的是
A.二水氯化钙(CaCl2 2H2O)属于纯净物
B.“纳米”铜比表面积大,可与盐酸剧烈反应生成H2
C.碳纳米管与石墨互为同素异形体
D.将"纳米材料"粒子分散到液体分散剂中所得混合物有丁达尔效应
5.科学家将含有石墨烯和碳纳米管两种纳米材料的水溶液在低温环境下冻干得到“全碳气凝胶”,该固态材料的密度仅是0.16mg·cm-3 ,是迄今为止世界上最轻的材料。下列有关说法正确的是
A.“全碳气凝胶”可用作处理海上原油泄漏的吸油材料
B.“全碳气凝胶”与石墨互为同位素
C.“全碳气凝胶”中含有碳碳双键,属于烯烃
D.“全碳气凝胶”的性质稳定,能在热的浓硫酸中稳定存在
6.下列化学用语使用正确的是
A.用电子式表示形成过程:
B.钾离子的结构示意图:
C.氨分子的电子式:
D.的一种同位素为
7.设为阿伏加德罗常数的值,下列说法正确的是
A.盐酸中含有个分子
B.已知核反应:,则1mol中含有中子数55
C.与一定量浓硫酸反应后完全溶解,生成气体的分子数等于
D.溶液中与离子数之和小于
8.下列说法正确的是
A.24g镁与27g铝中,含有相同的质子数 B.相同质量的氧气和臭氧中,电子数相同
C.22.4L的氯气的分子数目为NA D.1mol D2O与1mol H2O中,中子数比为2:1
9.下列化学用语只能用来表示一种微粒的是
A.S B.C2H6O C.12C D.
10.2021年我国在科技上不断取得重大成果。下列有关叙述错误的是
A."天问一号"太阳能电池复合材料的主要成分为石墨纤维和二氧化硅
B.无细胞化学酶系统催化CO2合成淀粉是促进碳中和的一种方法
C."神舟"十二号载人飞船中所使用的高强度碳纤维属于新型复合材料
D."嫦娥五号"登月采集的月壤样本中含有的3He,与地球上的2He互为同位素
二、判断题
11.1.7gH2O2中含有电子数为0.9NA。(_______)
12.所有原子都是由质子、中子和电子构成的。( )
13.所有原子核内一定都有中子。( )
14.3g3He含有的中子数为1NA。(_______)
15.与互为同位素。(_______)
三、解答题
16.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
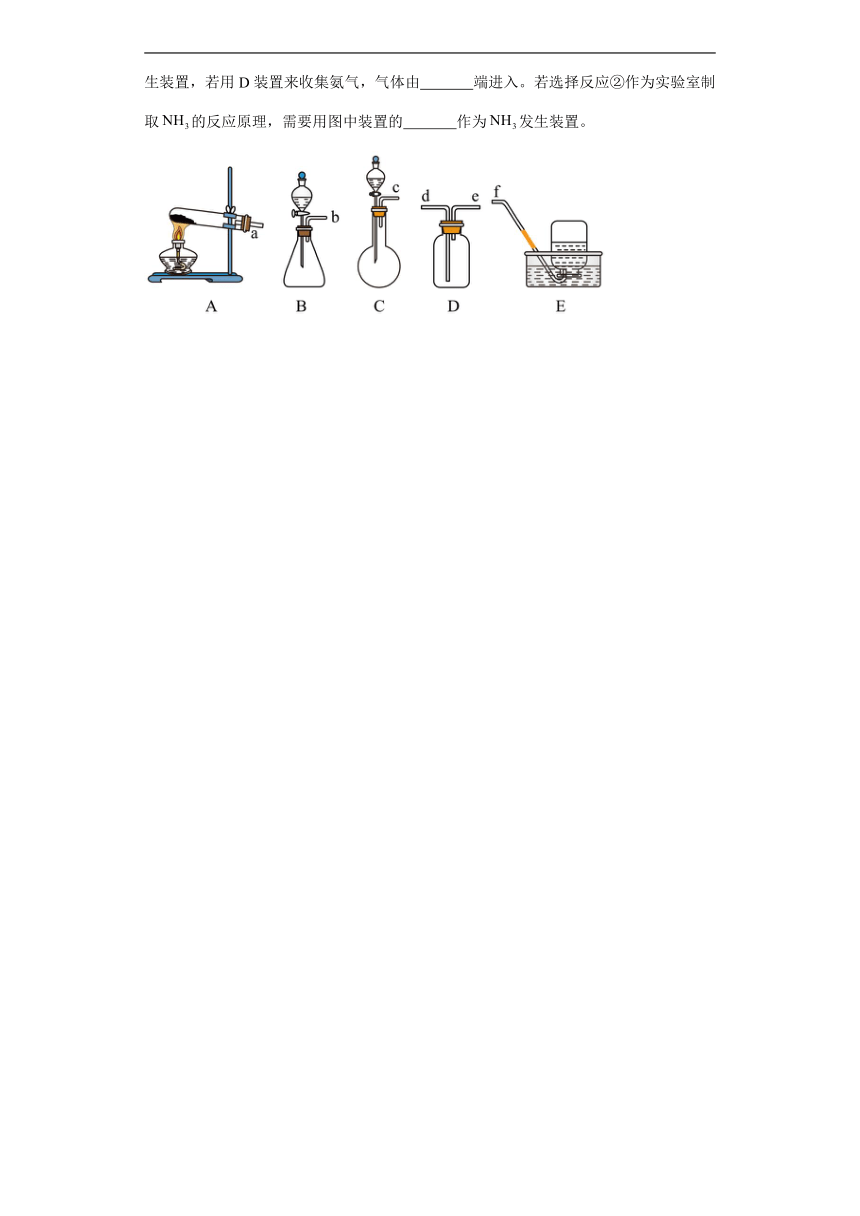
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素: (填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
① ;
② ;
③ 。
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的 作为发生装置,若用D装置来收集氨气,气体由 端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的 作为发生装置。
参考答案:
1.C
【详解】A.核素是一种原子,Cl2表示的是分子,Cl2和Cl2是氯元素的两种核素组成两种分子,故A的说法错误;
B.石墨与金刚石互为同素异形体,两者能发生相互转化,故B的说法错误;
C.C5H12的同分异构有3种,正戊烷的一氯代物有3种,异戊烷有4种,新戊烷有1种,总计8种,故C说法正确;
D.CH3COOCH2CH3与CH3CH2OOCCH3都是指乙酸乙酯,属于同一种物质,故D说法错误;
本题答案C。
2.C
【详解】A.氮气分子中含有的中子数为14,标准状况下22.4L氮气的物质的量为1mol,则1mol氮气中含有14NA个中子,故A错误;
B.重水和水的质子数相同,都为10,则1mol重水比1mol水的质子数相同,故B错误;
C.NA个O2的物质的量为1mol,质量为32g,摩尔质量为32 g/mol,若NA的数值变为原来的两倍,则NA个O2的物质的量为1mol,质量为64g,摩尔质量为64g/mol,故C正确;
D.自然界碳元素有12C、13C两种同位素,若12C在自然界中的丰度为98.892%,则碳元素的近似相对原子质量为12×98.892%+13×(1—98.892%)=12,故D错误;
故选C。
3.D
【详解】A.C、的中子数分别为13-6=7、15-7=8,不相同,A错误;
B.是由分子构成的物质,与不互为同位素,B错误;
C.的核外电子数为7,中子数为157=8,两者不相同,C错误;
D.与互为同位素,核电荷数与电子数相同,两者的核外电子排布相同,D正确;
答案选D。
4.B
【详解】A.结晶水合物属于纯净物,故二水氯化钙(CaCl2 2H2O)属于纯净物,故A正确;
B.铜属于不活泼金属,位于金属活动顺序表中氢的后边,不能和稀盐酸反应生成氢气,故B错误;
C.碳纳米管与石墨均为由碳元素组成的单质,两者互为同素异形体,故C正确;
D.由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间形成胶体分散系,具有丁达尔效应,故D正确。
答案选B。
5.A
【详解】A.“全碳气凝胶”具有极大的比表面积,吸附性强,可用作处理海上原油泄漏的吸油材料,A说法正确;
B.“全碳气凝胶”与石墨都是碳的单质,互为同素异形体,B说法错误;
C.“全碳气凝胶”为碳的单质,无氢原子,不属于烃类,C说法错误;
D.“全碳气凝胶”的性质稳定,但能在热的浓硫酸发生反应生成二氧化碳、二氧化硫等物质,D说法错误;
答案为A。
6.B
【详解】A.用电子式表示形成过程,要写出离子符号,A错误;
B.钾离子的结构示意图:,B正确;
C.氨分子的电子式:,C错误;
D.同位素是指质子数相同而中子数不同的两种原子,和不是同位素,D错误;
故选B。
7.C
【详解】A.氯化氢在水中完全电离,不存在分子,A错误;
B.核反应方程式必须遵循核电荷数和质量数守恒,即可推算出A=36,Z=89,,1molZM中含中子(89-36)NA=53NA,B错误;
C.由得失电子数目守恒可知,1mol锌与稀硫酸反应生成1mol氢气,与浓硫酸反应生成1mol二氧化硫,则0.25mol Zn与一定量浓硫酸反应后完全溶解时,无论是生成氢气,还是二氧化硫,或是二氧化硫或氢气的混合气体,气体的分子数恒定为0.25mol×NA mol—1=0.25NA,C正确;
D.1L 1mol/L CH3COONa溶液中n(Na+)=1mol,根据电荷守恒:n(CH3COO-)+n(OH-)=n(Na+)+n(H+),所以CH3COO-与OH-离子数之和大于NA,D错误;
故选C。
8.B
【详解】A.24g镁与27g铝,其物质的量都是1mol,含有的质子数的物质的量分别为:12mol和13mol,质子数不相同,故A错误;
B.氧气与臭氧都是由氧原子构成的单质,质量相同的氧气和臭氧,含有氧原子个数相同,故B正确;
C.22.4L的氯气的物质的量不一定是1mol,其分子数目不一定为NA,故C错误;
D.H无中子,D含有1个中子,O含有8个中子,所以1 mol D2O与 1 mol H2O中,中子数比为10:8=5:4,故D错误;
故答案选B。
9.C
【详解】A. S可以表示硫原子,也可以表示硫单质,故A不选;
B. C2H6O可以表示乙醇和二甲醚,故B不选;
C. 12C表示6个质子、6个中子的碳原子,故C选;
D. 可以表示甲烷也可以表示硅烷,故D不选;
故选C。
10.A
【详解】A.太阳能电池复合材料的主要成分为石墨纤维和单晶硅,二氧化硅为非金属氧化物,不能导电,选项A错误;
B.由CO2合成淀粉可降低大气中的CO2的含量,对促进碳中和具有积极的意义,选项B正确;
C.碳纤维是一种含碳量达90%以上的高强度纤维,是一种新型复合材料,选项C正确;
D.质子数相同、中子数不同的同种元素互称同位素,3He与2He质子数相同、中子数不同,互为同位素,选项D正确;
答案选A。
11.正确
【详解】1个H2O2分子中含有18个电子,1.7 g H2O2是0.05mol,则含有电子数为0.9 NA,故正确。
12.错误
【详解】氢的同位素中的中有质子和核外电子,但无中子,故该题错误。
13.错误
【详解】氢的同位素中质子数和质量数都是1的氢原子中没有中子,故错误。
14.正确
【详解】3He的中子数为3-2=1,则3g3He的中子数为=1NA,故正确。
15.错误
【详解】质子数相同,中子数不同的同种元素的不同核素,互为同位素,I2属于单质,不是核素,故错误;
16.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【详解】(1)实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.Cl2和Cl2是氯元素的两种核素
B.石墨与金刚石互为同素异形体,两者不能发生相互转化
C.C5H12的一氯代物有8种
D.CH3COOCH2CH3与CH3CH2OOCCH3互为同分异构体
2.NA是阿伏加德罗常数的值,下列说法正确的是
A.22.4L(标准状况)氮气中含有7NA个中子
B.1mol重水比1mol水多NA个质子
C.若NA的数值变为原来的两倍,则O2的摩尔质量变为64g/mol
D.12C在自然界中的丰度为98.892%,因此碳元素的质量数为12
3.核磁共振、可用于测定蛋白质、核酸等生物大分子的空间结构。下列有关C、的叙述正确的是
A.C、具有相同的中子数 B.与互为同位素
C.的核外电子数与中子数相同 D.与的核外电子排布相同
4.改革开放40多年来,我国材料化学的发展为科技进步做出了突出贡献。下列有关材料的说法不正确的是
A.二水氯化钙(CaCl2 2H2O)属于纯净物
B.“纳米”铜比表面积大,可与盐酸剧烈反应生成H2
C.碳纳米管与石墨互为同素异形体
D.将"纳米材料"粒子分散到液体分散剂中所得混合物有丁达尔效应
5.科学家将含有石墨烯和碳纳米管两种纳米材料的水溶液在低温环境下冻干得到“全碳气凝胶”,该固态材料的密度仅是0.16mg·cm-3 ,是迄今为止世界上最轻的材料。下列有关说法正确的是
A.“全碳气凝胶”可用作处理海上原油泄漏的吸油材料
B.“全碳气凝胶”与石墨互为同位素
C.“全碳气凝胶”中含有碳碳双键,属于烯烃
D.“全碳气凝胶”的性质稳定,能在热的浓硫酸中稳定存在
6.下列化学用语使用正确的是
A.用电子式表示形成过程:
B.钾离子的结构示意图:
C.氨分子的电子式:
D.的一种同位素为
7.设为阿伏加德罗常数的值,下列说法正确的是
A.盐酸中含有个分子
B.已知核反应:,则1mol中含有中子数55
C.与一定量浓硫酸反应后完全溶解,生成气体的分子数等于
D.溶液中与离子数之和小于
8.下列说法正确的是
A.24g镁与27g铝中,含有相同的质子数 B.相同质量的氧气和臭氧中,电子数相同
C.22.4L的氯气的分子数目为NA D.1mol D2O与1mol H2O中,中子数比为2:1
9.下列化学用语只能用来表示一种微粒的是
A.S B.C2H6O C.12C D.
10.2021年我国在科技上不断取得重大成果。下列有关叙述错误的是
A."天问一号"太阳能电池复合材料的主要成分为石墨纤维和二氧化硅
B.无细胞化学酶系统催化CO2合成淀粉是促进碳中和的一种方法
C."神舟"十二号载人飞船中所使用的高强度碳纤维属于新型复合材料
D."嫦娥五号"登月采集的月壤样本中含有的3He,与地球上的2He互为同位素
二、判断题
11.1.7gH2O2中含有电子数为0.9NA。(_______)
12.所有原子都是由质子、中子和电子构成的。( )
13.所有原子核内一定都有中子。( )
14.3g3He含有的中子数为1NA。(_______)
15.与互为同位素。(_______)
三、解答题
16.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素: (填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
① ;
② ;
③ 。
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的 作为发生装置,若用D装置来收集氨气,气体由 端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的 作为发生装置。
参考答案:
1.C
【详解】A.核素是一种原子,Cl2表示的是分子,Cl2和Cl2是氯元素的两种核素组成两种分子,故A的说法错误;
B.石墨与金刚石互为同素异形体,两者能发生相互转化,故B的说法错误;
C.C5H12的同分异构有3种,正戊烷的一氯代物有3种,异戊烷有4种,新戊烷有1种,总计8种,故C说法正确;
D.CH3COOCH2CH3与CH3CH2OOCCH3都是指乙酸乙酯,属于同一种物质,故D说法错误;
本题答案C。
2.C
【详解】A.氮气分子中含有的中子数为14,标准状况下22.4L氮气的物质的量为1mol,则1mol氮气中含有14NA个中子,故A错误;
B.重水和水的质子数相同,都为10,则1mol重水比1mol水的质子数相同,故B错误;
C.NA个O2的物质的量为1mol,质量为32g,摩尔质量为32 g/mol,若NA的数值变为原来的两倍,则NA个O2的物质的量为1mol,质量为64g,摩尔质量为64g/mol,故C正确;
D.自然界碳元素有12C、13C两种同位素,若12C在自然界中的丰度为98.892%,则碳元素的近似相对原子质量为12×98.892%+13×(1—98.892%)=12,故D错误;
故选C。
3.D
【详解】A.C、的中子数分别为13-6=7、15-7=8,不相同,A错误;
B.是由分子构成的物质,与不互为同位素,B错误;
C.的核外电子数为7,中子数为157=8,两者不相同,C错误;
D.与互为同位素,核电荷数与电子数相同,两者的核外电子排布相同,D正确;
答案选D。
4.B
【详解】A.结晶水合物属于纯净物,故二水氯化钙(CaCl2 2H2O)属于纯净物,故A正确;
B.铜属于不活泼金属,位于金属活动顺序表中氢的后边,不能和稀盐酸反应生成氢气,故B错误;
C.碳纳米管与石墨均为由碳元素组成的单质,两者互为同素异形体,故C正确;
D.由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间形成胶体分散系,具有丁达尔效应,故D正确。
答案选B。
5.A
【详解】A.“全碳气凝胶”具有极大的比表面积,吸附性强,可用作处理海上原油泄漏的吸油材料,A说法正确;
B.“全碳气凝胶”与石墨都是碳的单质,互为同素异形体,B说法错误;
C.“全碳气凝胶”为碳的单质,无氢原子,不属于烃类,C说法错误;
D.“全碳气凝胶”的性质稳定,但能在热的浓硫酸发生反应生成二氧化碳、二氧化硫等物质,D说法错误;
答案为A。
6.B
【详解】A.用电子式表示形成过程,要写出离子符号,A错误;
B.钾离子的结构示意图:,B正确;
C.氨分子的电子式:,C错误;
D.同位素是指质子数相同而中子数不同的两种原子,和不是同位素,D错误;
故选B。
7.C
【详解】A.氯化氢在水中完全电离,不存在分子,A错误;
B.核反应方程式必须遵循核电荷数和质量数守恒,即可推算出A=36,Z=89,,1molZM中含中子(89-36)NA=53NA,B错误;
C.由得失电子数目守恒可知,1mol锌与稀硫酸反应生成1mol氢气,与浓硫酸反应生成1mol二氧化硫,则0.25mol Zn与一定量浓硫酸反应后完全溶解时,无论是生成氢气,还是二氧化硫,或是二氧化硫或氢气的混合气体,气体的分子数恒定为0.25mol×NA mol—1=0.25NA,C正确;
D.1L 1mol/L CH3COONa溶液中n(Na+)=1mol,根据电荷守恒:n(CH3COO-)+n(OH-)=n(Na+)+n(H+),所以CH3COO-与OH-离子数之和大于NA,D错误;
故选C。
8.B
【详解】A.24g镁与27g铝,其物质的量都是1mol,含有的质子数的物质的量分别为:12mol和13mol,质子数不相同,故A错误;
B.氧气与臭氧都是由氧原子构成的单质,质量相同的氧气和臭氧,含有氧原子个数相同,故B正确;
C.22.4L的氯气的物质的量不一定是1mol,其分子数目不一定为NA,故C错误;
D.H无中子,D含有1个中子,O含有8个中子,所以1 mol D2O与 1 mol H2O中,中子数比为10:8=5:4,故D错误;
故答案选B。
9.C
【详解】A. S可以表示硫原子,也可以表示硫单质,故A不选;
B. C2H6O可以表示乙醇和二甲醚,故B不选;
C. 12C表示6个质子、6个中子的碳原子,故C选;
D. 可以表示甲烷也可以表示硅烷,故D不选;
故选C。
10.A
【详解】A.太阳能电池复合材料的主要成分为石墨纤维和单晶硅,二氧化硅为非金属氧化物,不能导电,选项A错误;
B.由CO2合成淀粉可降低大气中的CO2的含量,对促进碳中和具有积极的意义,选项B正确;
C.碳纤维是一种含碳量达90%以上的高强度纤维,是一种新型复合材料,选项C正确;
D.质子数相同、中子数不同的同种元素互称同位素,3He与2He质子数相同、中子数不同,互为同位素,选项D正确;
答案选A。
11.正确
【详解】1个H2O2分子中含有18个电子,1.7 g H2O2是0.05mol,则含有电子数为0.9 NA,故正确。
12.错误
【详解】氢的同位素中的中有质子和核外电子,但无中子,故该题错误。
13.错误
【详解】氢的同位素中质子数和质量数都是1的氢原子中没有中子,故错误。
14.正确
【详解】3He的中子数为3-2=1,则3g3He的中子数为=1NA,故正确。
15.错误
【详解】质子数相同,中子数不同的同种元素的不同核素,互为同位素,I2属于单质,不是核素,故错误;
16.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【详解】(1)实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C。
