8.3 人工合成有机化合物 同步练习(含解析) 2023-2024学年高一下学期苏教版(2019)化学必修第二册
文档属性
| 名称 | 8.3 人工合成有机化合物 同步练习(含解析) 2023-2024学年高一下学期苏教版(2019)化学必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 578.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 14:50:38 | ||
图片预览



文档简介
8.3人工合成有机化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列对科技成果的解读错误的是
科技成果 化学解读
A 发现聚苯乙烯塑料对土壤变形虫有影响 苯乙烯是合成聚苯乙烯的单体
B 实现高质量半导体材料的合成 所含元素均位于短周期
C 利用固态电解质提升锂硫电池的性能 锂硫电池能将化学能部分转化为电能
D 首例钇树脂微球治疗手术成功 的中子数与质子数之差为12
A.A B.B C.C D.D
2.下列说法不正确的是
A.①丙烷②正戊烷③异丁烷④新戊烷,沸点由高到低的顺序是②>④>③>①
B.高分子化合物 : 的单体是乙烯和CH2=CH-CH=CH2
C.丙烯与HCl加成可以得到互为同分异构体的两种有机物
D.由甲烷结构可知CCl4也是正四面体结构,而丙烯所有原子不可能共面
3.下列说法正确的是
A.聚氯乙烯可以制食物保鲜膜
B.医疗上的血液透析,是利用了胶体的丁达尔效应
C.Fe与水蒸气高温下反应生成Fe3O4和H2
D.泡沫灭火器中装有Na2CO3浓溶液和Al2(SO4)3浓溶液,两者混合会发生剧烈反应
4.元素及其化合物的转化具有重要应用,下列说法正确的是
A.工业上制硫酸,第一步为煅烧黄铁矿(FeS2)制备SO3
B.Si粉与N2反应生成的Si3N4是一种传统无机非金属材料
C.由四氟乙烯制备耐化学腐蚀耐高温的聚四氟乙烯坩埚的反应属于缩聚反应
D.AgNO3受热分解产物为Ag、NO2和O2,分解得到1molAg转移的电子的物质的量是2mol
5.化学与社会、环境密切相关。下列说法正确的是
A.防控新冠病毒所用的酒精浓度越大,消毒效果越好
B.高炉炼铁、工业合成氨等反应,可以通过改变反应条件实现反应物完全转化
C.水立方的外立面膜结构——ETFE膜(乙烯-四氟乙烯共聚物)能与溴水发生加成反应
D.冷链运输抗病毒疫苗可避免蛋白质变性
6.下列说法正确的是
A.咳嗽形成的飞沫气溶胶属于胶体分散系
B.“城市空气质量日报”报道的内容包括CO2、NO、SO2、可吸入颗粒物等
C.口罩熔喷布的原料聚丙烯属于天然有机高分子
D.蚕丝、羊毛和棉花的主要成分都是蛋白质
7.下列说法正确的是
A.氯乙烯、聚乙烯都是不饱和烃
B.聚苯乙烯的结构简式为
C.氯乙烯制取聚氯乙烯的反应为nCH2=CHCl
D.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
8.北京2022年冬奥会体现了绿色奥运、科技奥运。下列说法错误的是
A.飞扬火炬使用纯氢作燃料,实现碳排放为零
B.火炬燃料出口处有钠盐涂层,火焰呈明亮黄色
C.可降解餐具用聚乳酸制造,聚乳酸是天然高分子材料
D.速滑馆使用CO2制冰,比用氟利昂制冰更环保
9.新冠肺炎疫情出现以来,一系列举措体现了中国力量。在各种防护防控措施中,化学知识起了重要作用,下列有关说法错误的是
A.使用84消毒液杀菌消毒是利用ClO-的强氧化性
B.预防新冠病毒用95%的酒精比用75%的酒精效果好
C.N95型口罩的核心材料是聚丙烯,它属于有机高分子材料
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
10.下列物质属于高分子化合物的是
A.聚四氟乙烯 B.葡萄糖 C.乙酸乙酯 D.水玻璃
二、判断题
11.丙烯和聚丙烯都能使溴水褪色。(_______)
12.天然纤维耐高温。(_______)
13.通常所说的三大合成材料是塑料、合成纤维和合成橡胶。(___)
14.环氧乙烷开环聚合,可以使碳链减短。(___________)
15.聚乙烯是由乙烯经加聚反应合成的,但是聚乙烯的基本结构和乙烯的结构不同。( )
三、解答题
16.乙烯是石油化工的重要基本原料。根据下述装置回答问题:
(1)乙烯的电子式为 ,其分子的空间结构为 (填“平面”或“正四面体”)结构。
(2)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。预测试管A中可能出现的实验现象是 ,发生反应的化学方程式为 ,反应类型为 。
(3)试管B中可观察到的实验现象为 。
(4)试管C中观察到酸性高锰酸钾溶液褪色,原因是 。
(5)丙烯()与乙烯互为同系物,化学性质相似,写出丙烯在一定条件下生成聚丙烯的化学方程式 ,聚丙烯的链节为 。
(6)下列属于有机高分子化合物的是___________(填字母)。
①聚乙烯()②光导纤维③聚四氟乙烯()④聚丙烯()⑤聚氯乙烯()⑥丙烷
A.①②③④ B.②③④⑥ C.③④⑤⑥ D.①③④⑤
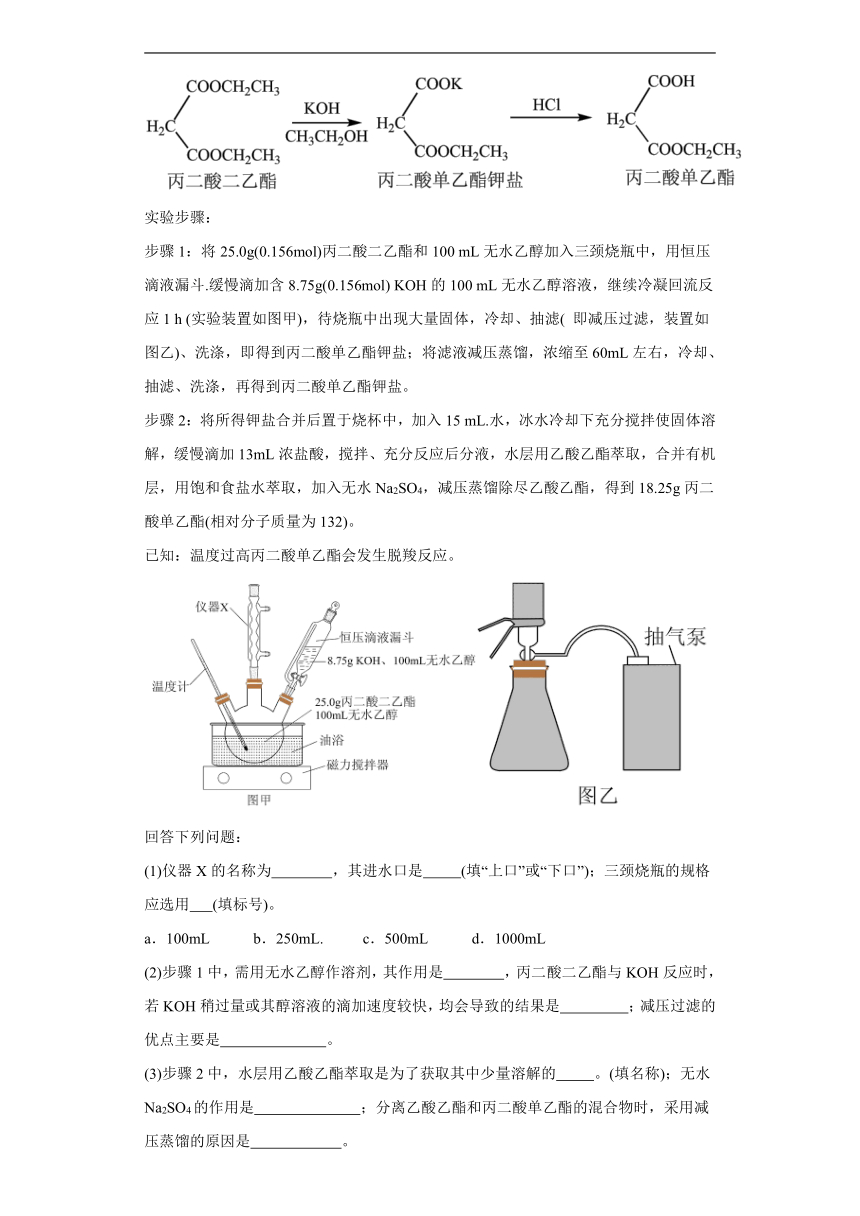
17.丙二酸单乙酯是重要的中间体,被广泛应用于天然产物及医药的化学合成中。以下是一种以丙二酸二乙酯为原料来制备丙二酸单乙酯的实验方法,反应原理如下:
实验步骤:
步骤1:将25.0g(0.156mol)丙二酸二乙酯和100 mL无水乙醇加入三颈烧瓶中,用恒压滴液漏斗.缓慢滴加含8.75g(0.156mol) KOH的100 mL无水乙醇溶液,继续冷凝回流反应1 h (实验装置如图甲),待烧瓶中出现大量固体,冷却、抽滤( 即减压过滤,装置如图乙)、洗涤,即得到丙二酸单乙酯钾盐;将滤液减压蒸馏,浓缩至60mL左右,冷却、抽滤、洗涤,再得到丙二酸单乙酯钾盐。
步骤2:将所得钾盐合并后置于烧杯中,加入15 mL.水,冰水冷却下充分搅拌使固体溶解,缓慢滴加13mL浓盐酸,搅拌、充分反应后分液,水层用乙酸乙酯萃取,合并有机层,用饱和食盐水萃取,加入无水Na2SO4,减压蒸馏除尽乙酸乙酯,得到18.25g丙二酸单乙酯(相对分子质量为132)。
已知:温度过高丙二酸单乙酯会发生脱羧反应。
回答下列问题:
(1)仪器X的名称为 ,其进水口是 (填“上口”或“下口”);三颈烧瓶的规格应选用 (填标号)。
a.100mL b.250mL. c.500mL d.1000mL
(2)步骤1中,需用无水乙醇作溶剂,其作用是 ,丙二酸二乙酯与KOH反应时,若KOH稍过量或其醇溶液的滴加速度较快,均会导致的结果是 ;减压过滤的优点主要是 。
(3)步骤2中,水层用乙酸乙酯萃取是为了获取其中少量溶解的 。(填名称);无水Na2SO4的作用是 ;分离乙酸乙酯和丙二酸单乙酯的混合物时,采用减压蒸馏的原因是 。
(4)本次实验的产率是 (列出计算式并计算)。
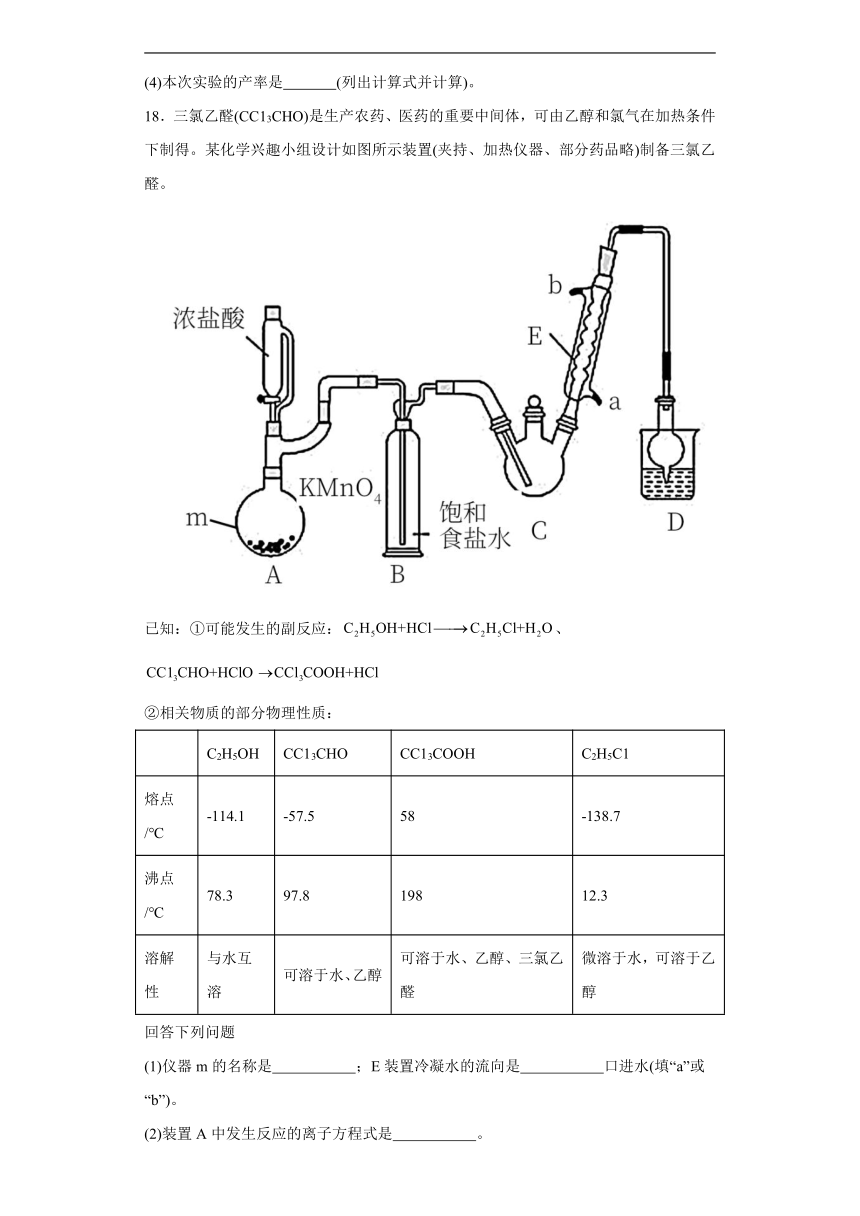
18.三氯乙醛(CC13CHO)是生产农药、医药的重要中间体,可由乙醇和氯气在加热条件下制得。某化学兴趣小组设计如图所示装置(夹持、加热仪器、部分药品略)制备三氯乙醛。
已知:①可能发生的副反应:、
②相关物质的部分物理性质:
C2H5OH CC13CHO CC13COOH C2H5C1
熔点/℃ -114.1 -57.5 58 -138.7
沸点/℃ 78.3 97.8 198 12.3
溶解性 与水互溶 可溶于水、乙醇 可溶于水、乙醇、三氯乙醛 微溶于水,可溶于乙醇
回答下列问题
(1)仪器m的名称是 ;E装置冷凝水的流向是 口进水(填“a”或“b”)。
(2)装置A中发生反应的离子方程式是 。
(3)装置C应控制反应温度在70℃左右,写出装置C中制取三氯乙醛(CC13CHO)的化学方程式 。
(4)装置D中干燥管的作用为 ,烧杯中的试剂是 。
(5)反应结束后,从C中的混合物中分离出CC13COOH的操作为 。
(6)有同学认为应在B、C之间加一干燥装置,你认为是否必要 (选填“是”或“否”),理由是 。
参考答案:
1.B
【详解】A.苯乙烯是合成聚苯乙烯的单体,A正确;
B.所含元素Zn、Se均位于第四周期,属于长周期,B错误;
C.原电池放电时将化学能转化为电能,C正确;
D.中子数为90-39=51,质子数为39,二者之差为51-39=12,D正确;
故选B。
2.B
【详解】A.由烷烃中碳原子数目越多,沸点越高,则沸点丙烷<异丁烷<戊烷,同分异构体中支链越多,沸点越低,则正戊烷>新戊烷,则沸点由高到低的顺序为:②>④>③>①,选项A正确;
B.结构片段为…―CH2―CH=CH―CH2―CH(CH3)-CH2-…,说明该高分子为加聚产物,则该高分子化合物的单体是CH2=CHCH=CH2和丙烯,选项B不正确;
C.丙烯一定条件下与HCl加成,可以生成1-氯丙烷,也可以生成2-氯丙烷,选项C正确;
D.由甲烷结构可知CCl4也是正四面体结构,丙烯中含有甲基,所有原子不可能共面,选项D正确;
答案选B。
3.C
【详解】A.聚氯乙烯有毒,能释放出有毒物质,不能用于包装食品,食物保鲜膜可使用聚乙烯塑料,A错误;
B.血液是胶体,不能透过半透膜,代谢产生的离子或小分子能透过半透膜,医疗上的血液透析是利用了胶体的渗析,而不是丁达尔效应,B错误;
C.Fe与水蒸气在高温下可反应生成Fe3O4和H2,对应方程式为:3Fe+4H2O(g)Fe3O4+4H2,C正确;
D.泡沫灭火器中装有小苏打NaHCO3溶液和Al2(SO4)3溶液,利用两者彻底双水解的原理产生大量的CO2和Al(OH)3泡沫,从而达到灭火的目的,D错误;
故答案选C。
4.D
【详解】A.工业上制硫酸,第一步煅烧黄铁矿生成SO2,反应的化学方程式为4FeS2+11O22Fe2O3+8SO2,不能生成SO3,A项错误;
B.Si与N2高温反应生成Si3N4,Si3N4是一种新型无机非金属材料,B项错误;
C.四氟乙烯中含碳碳双键,由四氟乙烯制备聚四氟乙烯的反应属于加聚反应,C项错误;
D.AgNO3分解的化学方程式为2AgNO32Ag+2NO2↑+O2↑,该反应中Ag元素的化合价由+1价降至0价、N元素的化合价由+5价降至+4价,部分O元素的化合价由-2价升至0价,生成2molAg转移4mol电子,则分解得到1molAg转移的电子的物质的量是2mol,D项正确;
答案选D。
5.D
【详解】A.酒精浓度过大,在病毒表面会使得病毒表面包膜迅速凝固,使得酒精不能渗透进去,消毒效率降低,所以通常用75%的酒精消毒,故A错误;
B.高炉炼铁中的CO和铁的氧化物的反应、C和CO2的反应、工业合成氨的反应都是可逆反应,改变反应条件也不可能实现反应物完全转化,故B错误;
C.乙烯和四氟乙烯分子中都有碳碳双键,但两者共聚后双键都变为单键,所以不能与溴水发生加成反应,故C错误;
D.蛋白质在高于一定温度下容易变性,所以采用冷链运输,故D正确;
故选D。
6.A
【详解】A.咳嗽形成的飞沫气溶胶属于胶体分散系,分散剂是空气,分散质是小液滴,A正确;
B.CO2是空气的成分,不属于“城市空气质量日报”报道的内容,B错误;
C.口罩熔喷布的原料聚丙烯属于人工合成的有机高分子化合物,C错误;
D.蚕丝、羊毛的主要成分都是蛋白质,而棉花主要成分是纤维素,属于糖类,D错误;
故合理选项是A。
7.C
【详解】A、氯乙烯含有氯元素,不属于烃;聚乙烯不含碳碳双键,不是不饱和烃,故A错误;
B. 聚苯乙烯的结构简式为,故B错误;
C. 氯乙烯发生加聚反应制取聚氯乙烯,反应方程式为nCH2=CHCl,故C正确;
D. 乙烯含有碳碳双键,能使溴的四氯化碳溶液褪色;聚乙烯不含碳碳双键,不能使溴的四氯化碳溶液褪色,故D错误;答案选C。
8.C
【详解】A.使用纯氢作燃料产物为水,没有碳排放,A正确;
B.火炬燃料出口处有钠盐涂层,火焰呈明亮黄色,因为钠离子的焰色反应为黄色,B正确;
C.可降解餐具用聚乳酸制造,聚乳酸不是天然高分子材料,是人工合成的高分子材料,C错误;
D.速滑馆使用CO2制冰,比用氟利昂制冰更环保,降低了对臭氧层的损害,D正确;
答案选C。
9.B
【详解】A.84消毒液的有效成分是NaClO,其中ClO-中的氯为+1价,具有强氧化性,可以杀菌消毒,故A正确;
B.95%的酒精会使细菌的菌体表面迅速凝固,形成一层包膜,阻止了酒精继续向菌体内部渗透,细菌内部的细胞没能彻底杀死,待到适当时机,包膜内的细胞可能将包膜冲破重新复活。而75%的酒精既能使组成细菌的蛋白质凝固,又不能形成包膜,能使酒精继续向内部渗透而彻底消毒,所以用95%的酒精不如用75%的酒精消毒效果好,故B选;
C.聚丙烯是丙烯通过加聚反应生成的高分子化合物,故C正确;
D.聚四氟乙烯的单体为四氟乙烯,它可以看做是乙烯分子中的4个氢原子被氟原子代替而衍生出来的有机物,属于卤代烃,故D正确;
故选B。
【点睛】
10.A
【详解】A.四氟乙烯通过加聚反应合成聚四氟乙烯,聚四氟乙烯的相对分子质量>10000,属于高分子化合物,A正确;
B.葡萄糖是小分子,B错误;
C.乙酸乙酯是小分子,C错误;
D.水玻璃是硅酸钠的水溶液,不是高分子,D错误;
故选A。
11.错误
【解析】略
12.正确
【详解】天然纤维性能为耐高温、抗腐蚀、抗紫外线、轻柔舒适、光泽好等,则天然纤维耐高温,故答案为正确;
13.正确
【解析】略
14.错误
【详解】环氧乙烷开环聚合,形成高分子,不能使碳链减短,而是使碳链加长;
答案为:错误。
15.正确
【详解】聚乙烯是由乙烯经加聚反应合成的,但是聚乙烯的基本结构和乙烯的结构不同,乙烯具有碳碳双键,而聚乙烯没有,故正确。
16.(1) 平面
(2) 溶液褪色且溶液不分层 加成反应
(3)溶液褪色,液体分层
(4)乙烯和酸性高锰酸钾发生氧化还原反应导致酸性高锰酸钾溶液褪色
(5)
(6)D
【分析】乙烯分子中含有碳碳双键,能与Br2发生加成反应生成1,2-二溴乙烷,也能与酸性高锰酸钾发生氧化还原反应使其褪色,据此解答。
【详解】(1)乙烯的结构简式为CH2=CH2,其电子式为:,乙烯分子中所有原子都位于同一平面,其分子的空间结构为平面结构;
(2)乙烯与Br2发生加成反应生成1,2-二溴乙烷,四氯化碳中的Br2被消耗导致溶液褪色,且1,2-二溴乙烷易溶于四氯化碳,溶液不分层,所以试管A中可能出现的实验现象是溶液褪色且溶液不分层,发生反应的化学方程式为:,反应类型为加成反应;
(3)乙烯与Br2发生加成反应生成1,2-二溴乙烷,水中的Br2被消耗导致溶液褪色,且1,2-二溴乙烷难溶于水,将出现分层,则试管B中可观察到的实验现象为溶液褪色,液体分层;
(4)试管C中观察到酸性高锰酸钾溶液褪色,原因是乙烯和酸性高锰酸钾发生氧化还原反应导致酸性高锰酸钾溶液褪色;
(5)丙烯在一定条件下发生加聚反应生成聚丙烯,其化学方程式为:nCH2=CH—CH3,聚丙烯的链节为:;
(6)通过加聚反应生成的加聚物属于有机高分子化合物,①聚乙烯(PE)、③聚四氟乙烯(PTFE)、④聚丙烯(PP)、⑤聚氯乙烯(PVC)都是加聚物,则①③④⑤均属于有机高分子化合物;②光导纤维所用材料为SiO2,属于无机非金属化合物;⑥丙烷属于有机小分子化合物,故选D。
17. 球形冷凝管 下口 c 使反应物充分接触 生成少量丙二酸二钾盐 加快过滤速度、得到较干燥的沉淀 丙二酸单乙酯 干燥 降低沸点,避免温度过高丙二酸单乙酯发生脱羧反应 ×100%=88.6%
【分析】三颈烧瓶中,丙二酸二乙酯在氢氧化钾和乙醇的条件下发生反应得到丙二酸单乙酯钾盐,再将丙二酸单乙酯钾盐与浓盐酸反应制得丙二酸单乙酯和氯化钾溶液,水层用乙酸乙酯萃取,合并有机层,用饱和食盐水萃取,加入无水Na2SO4干燥,减压蒸馏除尽乙酸乙酯,可制得丙二酸单乙酯,由此分析。
【详解】(1)根据仪器的形状可知,仪器X的名称为球形冷凝管,为了冷凝效果更好,冷凝管应该下进上出,其进水口是下口;由于丙二酸二乙酯和100mL无水乙醇加入三颈烧瓶中,用恒压滴液漏斗,缓慢滴加含KOH的100mL无水乙醇溶液,三颈烧瓶中液体的体积大于三分之一不超过三分之二,三颈烧瓶的规格应选用500mL;
(2)步骤1中,需用无水乙醇作溶剂,其作用是使反应物充分接触,丙二酸二乙酯与KOH反应时,若KOH稍过量或其醇溶液的滴加速度较快,会使丙二酸二乙酯完全水解,生成少量丙二酸二钾盐;减压过滤也就是抽滤,是利用抽气泵使抽滤瓶中的压强降低,优点主要是加快过滤速度、得到较干燥的沉淀;
(3)步骤2中,水层用乙酸乙酯萃取是为了获取其中少量溶解的丙二酸单乙酯;无水Na2SO4具有吸水性,作用是干燥;由于温度过高丙二酸单乙酯会发生脱羧反应,分离乙酸乙酯和丙二酸单乙酯的混合物时,应采用减压蒸馏;
(4)由于~KOH~,本次实验的产率==。
18. 圆底烧瓶 a 导气、防止液体倒吸 氢氧化钠溶液 蒸馏(或分馏) 是 氯气能与水反应生成HCl与HClO,导致装置C中副产物CC13COOH、C2H5Cl增多
【分析】A装置中高锰酸钾和浓盐酸反应生成氯气;B装置用饱和食盐水除去Cl2中的HCl;装置C中,乙醇和氯气在加热条件下生成CC13CHO;仪器E进行冷凝、回流,自下而上通水冷凝效果好;D装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,而球形干燥管又可以防止倒吸。
【详解】(1)仪器m是圆底烧瓶;仪器E进行冷凝、回流,自下而上通水冷凝效果好,则E装置冷凝水的流向是a口进水;
(2)装置A中,高锰酸钾和浓盐酸反应生成氯气,离子方程式为;
(3)装置C中,乙醇和氯气在加热条件下生成CC13CHO,化学方程式为;
(4)装置D中干燥管可以导气、防止液体倒吸;D装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气;
(5)由表中数据可知,CC13COOH的沸点为198℃,沸点较大,可用蒸馏(或分馏)将CC13COOH从混合物中分离出;
(6)氯气能与水反应生成HCl与HClO,导致装置C中副产物CC13COOH、C2H5Cl增多,故应在装置B、C之间加一干燥装置。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列对科技成果的解读错误的是
科技成果 化学解读
A 发现聚苯乙烯塑料对土壤变形虫有影响 苯乙烯是合成聚苯乙烯的单体
B 实现高质量半导体材料的合成 所含元素均位于短周期
C 利用固态电解质提升锂硫电池的性能 锂硫电池能将化学能部分转化为电能
D 首例钇树脂微球治疗手术成功 的中子数与质子数之差为12
A.A B.B C.C D.D
2.下列说法不正确的是
A.①丙烷②正戊烷③异丁烷④新戊烷,沸点由高到低的顺序是②>④>③>①
B.高分子化合物 : 的单体是乙烯和CH2=CH-CH=CH2
C.丙烯与HCl加成可以得到互为同分异构体的两种有机物
D.由甲烷结构可知CCl4也是正四面体结构,而丙烯所有原子不可能共面
3.下列说法正确的是
A.聚氯乙烯可以制食物保鲜膜
B.医疗上的血液透析,是利用了胶体的丁达尔效应
C.Fe与水蒸气高温下反应生成Fe3O4和H2
D.泡沫灭火器中装有Na2CO3浓溶液和Al2(SO4)3浓溶液,两者混合会发生剧烈反应
4.元素及其化合物的转化具有重要应用,下列说法正确的是
A.工业上制硫酸,第一步为煅烧黄铁矿(FeS2)制备SO3
B.Si粉与N2反应生成的Si3N4是一种传统无机非金属材料
C.由四氟乙烯制备耐化学腐蚀耐高温的聚四氟乙烯坩埚的反应属于缩聚反应
D.AgNO3受热分解产物为Ag、NO2和O2,分解得到1molAg转移的电子的物质的量是2mol
5.化学与社会、环境密切相关。下列说法正确的是
A.防控新冠病毒所用的酒精浓度越大,消毒效果越好
B.高炉炼铁、工业合成氨等反应,可以通过改变反应条件实现反应物完全转化
C.水立方的外立面膜结构——ETFE膜(乙烯-四氟乙烯共聚物)能与溴水发生加成反应
D.冷链运输抗病毒疫苗可避免蛋白质变性
6.下列说法正确的是
A.咳嗽形成的飞沫气溶胶属于胶体分散系
B.“城市空气质量日报”报道的内容包括CO2、NO、SO2、可吸入颗粒物等
C.口罩熔喷布的原料聚丙烯属于天然有机高分子
D.蚕丝、羊毛和棉花的主要成分都是蛋白质
7.下列说法正确的是
A.氯乙烯、聚乙烯都是不饱和烃
B.聚苯乙烯的结构简式为
C.氯乙烯制取聚氯乙烯的反应为nCH2=CHCl
D.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
8.北京2022年冬奥会体现了绿色奥运、科技奥运。下列说法错误的是
A.飞扬火炬使用纯氢作燃料,实现碳排放为零
B.火炬燃料出口处有钠盐涂层,火焰呈明亮黄色
C.可降解餐具用聚乳酸制造,聚乳酸是天然高分子材料
D.速滑馆使用CO2制冰,比用氟利昂制冰更环保
9.新冠肺炎疫情出现以来,一系列举措体现了中国力量。在各种防护防控措施中,化学知识起了重要作用,下列有关说法错误的是
A.使用84消毒液杀菌消毒是利用ClO-的强氧化性
B.预防新冠病毒用95%的酒精比用75%的酒精效果好
C.N95型口罩的核心材料是聚丙烯,它属于有机高分子材料
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
10.下列物质属于高分子化合物的是
A.聚四氟乙烯 B.葡萄糖 C.乙酸乙酯 D.水玻璃
二、判断题
11.丙烯和聚丙烯都能使溴水褪色。(_______)
12.天然纤维耐高温。(_______)
13.通常所说的三大合成材料是塑料、合成纤维和合成橡胶。(___)
14.环氧乙烷开环聚合,可以使碳链减短。(___________)
15.聚乙烯是由乙烯经加聚反应合成的,但是聚乙烯的基本结构和乙烯的结构不同。( )
三、解答题
16.乙烯是石油化工的重要基本原料。根据下述装置回答问题:
(1)乙烯的电子式为 ,其分子的空间结构为 (填“平面”或“正四面体”)结构。
(2)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。预测试管A中可能出现的实验现象是 ,发生反应的化学方程式为 ,反应类型为 。
(3)试管B中可观察到的实验现象为 。
(4)试管C中观察到酸性高锰酸钾溶液褪色,原因是 。
(5)丙烯()与乙烯互为同系物,化学性质相似,写出丙烯在一定条件下生成聚丙烯的化学方程式 ,聚丙烯的链节为 。
(6)下列属于有机高分子化合物的是___________(填字母)。
①聚乙烯()②光导纤维③聚四氟乙烯()④聚丙烯()⑤聚氯乙烯()⑥丙烷
A.①②③④ B.②③④⑥ C.③④⑤⑥ D.①③④⑤
17.丙二酸单乙酯是重要的中间体,被广泛应用于天然产物及医药的化学合成中。以下是一种以丙二酸二乙酯为原料来制备丙二酸单乙酯的实验方法,反应原理如下:
实验步骤:
步骤1:将25.0g(0.156mol)丙二酸二乙酯和100 mL无水乙醇加入三颈烧瓶中,用恒压滴液漏斗.缓慢滴加含8.75g(0.156mol) KOH的100 mL无水乙醇溶液,继续冷凝回流反应1 h (实验装置如图甲),待烧瓶中出现大量固体,冷却、抽滤( 即减压过滤,装置如图乙)、洗涤,即得到丙二酸单乙酯钾盐;将滤液减压蒸馏,浓缩至60mL左右,冷却、抽滤、洗涤,再得到丙二酸单乙酯钾盐。
步骤2:将所得钾盐合并后置于烧杯中,加入15 mL.水,冰水冷却下充分搅拌使固体溶解,缓慢滴加13mL浓盐酸,搅拌、充分反应后分液,水层用乙酸乙酯萃取,合并有机层,用饱和食盐水萃取,加入无水Na2SO4,减压蒸馏除尽乙酸乙酯,得到18.25g丙二酸单乙酯(相对分子质量为132)。
已知:温度过高丙二酸单乙酯会发生脱羧反应。
回答下列问题:
(1)仪器X的名称为 ,其进水口是 (填“上口”或“下口”);三颈烧瓶的规格应选用 (填标号)。
a.100mL b.250mL. c.500mL d.1000mL
(2)步骤1中,需用无水乙醇作溶剂,其作用是 ,丙二酸二乙酯与KOH反应时,若KOH稍过量或其醇溶液的滴加速度较快,均会导致的结果是 ;减压过滤的优点主要是 。
(3)步骤2中,水层用乙酸乙酯萃取是为了获取其中少量溶解的 。(填名称);无水Na2SO4的作用是 ;分离乙酸乙酯和丙二酸单乙酯的混合物时,采用减压蒸馏的原因是 。
(4)本次实验的产率是 (列出计算式并计算)。
18.三氯乙醛(CC13CHO)是生产农药、医药的重要中间体,可由乙醇和氯气在加热条件下制得。某化学兴趣小组设计如图所示装置(夹持、加热仪器、部分药品略)制备三氯乙醛。
已知:①可能发生的副反应:、
②相关物质的部分物理性质:
C2H5OH CC13CHO CC13COOH C2H5C1
熔点/℃ -114.1 -57.5 58 -138.7
沸点/℃ 78.3 97.8 198 12.3
溶解性 与水互溶 可溶于水、乙醇 可溶于水、乙醇、三氯乙醛 微溶于水,可溶于乙醇
回答下列问题
(1)仪器m的名称是 ;E装置冷凝水的流向是 口进水(填“a”或“b”)。
(2)装置A中发生反应的离子方程式是 。
(3)装置C应控制反应温度在70℃左右,写出装置C中制取三氯乙醛(CC13CHO)的化学方程式 。
(4)装置D中干燥管的作用为 ,烧杯中的试剂是 。
(5)反应结束后,从C中的混合物中分离出CC13COOH的操作为 。
(6)有同学认为应在B、C之间加一干燥装置,你认为是否必要 (选填“是”或“否”),理由是 。
参考答案:
1.B
【详解】A.苯乙烯是合成聚苯乙烯的单体,A正确;
B.所含元素Zn、Se均位于第四周期,属于长周期,B错误;
C.原电池放电时将化学能转化为电能,C正确;
D.中子数为90-39=51,质子数为39,二者之差为51-39=12,D正确;
故选B。
2.B
【详解】A.由烷烃中碳原子数目越多,沸点越高,则沸点丙烷<异丁烷<戊烷,同分异构体中支链越多,沸点越低,则正戊烷>新戊烷,则沸点由高到低的顺序为:②>④>③>①,选项A正确;
B.结构片段为…―CH2―CH=CH―CH2―CH(CH3)-CH2-…,说明该高分子为加聚产物,则该高分子化合物的单体是CH2=CHCH=CH2和丙烯,选项B不正确;
C.丙烯一定条件下与HCl加成,可以生成1-氯丙烷,也可以生成2-氯丙烷,选项C正确;
D.由甲烷结构可知CCl4也是正四面体结构,丙烯中含有甲基,所有原子不可能共面,选项D正确;
答案选B。
3.C
【详解】A.聚氯乙烯有毒,能释放出有毒物质,不能用于包装食品,食物保鲜膜可使用聚乙烯塑料,A错误;
B.血液是胶体,不能透过半透膜,代谢产生的离子或小分子能透过半透膜,医疗上的血液透析是利用了胶体的渗析,而不是丁达尔效应,B错误;
C.Fe与水蒸气在高温下可反应生成Fe3O4和H2,对应方程式为:3Fe+4H2O(g)Fe3O4+4H2,C正确;
D.泡沫灭火器中装有小苏打NaHCO3溶液和Al2(SO4)3溶液,利用两者彻底双水解的原理产生大量的CO2和Al(OH)3泡沫,从而达到灭火的目的,D错误;
故答案选C。
4.D
【详解】A.工业上制硫酸,第一步煅烧黄铁矿生成SO2,反应的化学方程式为4FeS2+11O22Fe2O3+8SO2,不能生成SO3,A项错误;
B.Si与N2高温反应生成Si3N4,Si3N4是一种新型无机非金属材料,B项错误;
C.四氟乙烯中含碳碳双键,由四氟乙烯制备聚四氟乙烯的反应属于加聚反应,C项错误;
D.AgNO3分解的化学方程式为2AgNO32Ag+2NO2↑+O2↑,该反应中Ag元素的化合价由+1价降至0价、N元素的化合价由+5价降至+4价,部分O元素的化合价由-2价升至0价,生成2molAg转移4mol电子,则分解得到1molAg转移的电子的物质的量是2mol,D项正确;
答案选D。
5.D
【详解】A.酒精浓度过大,在病毒表面会使得病毒表面包膜迅速凝固,使得酒精不能渗透进去,消毒效率降低,所以通常用75%的酒精消毒,故A错误;
B.高炉炼铁中的CO和铁的氧化物的反应、C和CO2的反应、工业合成氨的反应都是可逆反应,改变反应条件也不可能实现反应物完全转化,故B错误;
C.乙烯和四氟乙烯分子中都有碳碳双键,但两者共聚后双键都变为单键,所以不能与溴水发生加成反应,故C错误;
D.蛋白质在高于一定温度下容易变性,所以采用冷链运输,故D正确;
故选D。
6.A
【详解】A.咳嗽形成的飞沫气溶胶属于胶体分散系,分散剂是空气,分散质是小液滴,A正确;
B.CO2是空气的成分,不属于“城市空气质量日报”报道的内容,B错误;
C.口罩熔喷布的原料聚丙烯属于人工合成的有机高分子化合物,C错误;
D.蚕丝、羊毛的主要成分都是蛋白质,而棉花主要成分是纤维素,属于糖类,D错误;
故合理选项是A。
7.C
【详解】A、氯乙烯含有氯元素,不属于烃;聚乙烯不含碳碳双键,不是不饱和烃,故A错误;
B. 聚苯乙烯的结构简式为,故B错误;
C. 氯乙烯发生加聚反应制取聚氯乙烯,反应方程式为nCH2=CHCl,故C正确;
D. 乙烯含有碳碳双键,能使溴的四氯化碳溶液褪色;聚乙烯不含碳碳双键,不能使溴的四氯化碳溶液褪色,故D错误;答案选C。
8.C
【详解】A.使用纯氢作燃料产物为水,没有碳排放,A正确;
B.火炬燃料出口处有钠盐涂层,火焰呈明亮黄色,因为钠离子的焰色反应为黄色,B正确;
C.可降解餐具用聚乳酸制造,聚乳酸不是天然高分子材料,是人工合成的高分子材料,C错误;
D.速滑馆使用CO2制冰,比用氟利昂制冰更环保,降低了对臭氧层的损害,D正确;
答案选C。
9.B
【详解】A.84消毒液的有效成分是NaClO,其中ClO-中的氯为+1价,具有强氧化性,可以杀菌消毒,故A正确;
B.95%的酒精会使细菌的菌体表面迅速凝固,形成一层包膜,阻止了酒精继续向菌体内部渗透,细菌内部的细胞没能彻底杀死,待到适当时机,包膜内的细胞可能将包膜冲破重新复活。而75%的酒精既能使组成细菌的蛋白质凝固,又不能形成包膜,能使酒精继续向内部渗透而彻底消毒,所以用95%的酒精不如用75%的酒精消毒效果好,故B选;
C.聚丙烯是丙烯通过加聚反应生成的高分子化合物,故C正确;
D.聚四氟乙烯的单体为四氟乙烯,它可以看做是乙烯分子中的4个氢原子被氟原子代替而衍生出来的有机物,属于卤代烃,故D正确;
故选B。
【点睛】
10.A
【详解】A.四氟乙烯通过加聚反应合成聚四氟乙烯,聚四氟乙烯的相对分子质量>10000,属于高分子化合物,A正确;
B.葡萄糖是小分子,B错误;
C.乙酸乙酯是小分子,C错误;
D.水玻璃是硅酸钠的水溶液,不是高分子,D错误;
故选A。
11.错误
【解析】略
12.正确
【详解】天然纤维性能为耐高温、抗腐蚀、抗紫外线、轻柔舒适、光泽好等,则天然纤维耐高温,故答案为正确;
13.正确
【解析】略
14.错误
【详解】环氧乙烷开环聚合,形成高分子,不能使碳链减短,而是使碳链加长;
答案为:错误。
15.正确
【详解】聚乙烯是由乙烯经加聚反应合成的,但是聚乙烯的基本结构和乙烯的结构不同,乙烯具有碳碳双键,而聚乙烯没有,故正确。
16.(1) 平面
(2) 溶液褪色且溶液不分层 加成反应
(3)溶液褪色,液体分层
(4)乙烯和酸性高锰酸钾发生氧化还原反应导致酸性高锰酸钾溶液褪色
(5)
(6)D
【分析】乙烯分子中含有碳碳双键,能与Br2发生加成反应生成1,2-二溴乙烷,也能与酸性高锰酸钾发生氧化还原反应使其褪色,据此解答。
【详解】(1)乙烯的结构简式为CH2=CH2,其电子式为:,乙烯分子中所有原子都位于同一平面,其分子的空间结构为平面结构;
(2)乙烯与Br2发生加成反应生成1,2-二溴乙烷,四氯化碳中的Br2被消耗导致溶液褪色,且1,2-二溴乙烷易溶于四氯化碳,溶液不分层,所以试管A中可能出现的实验现象是溶液褪色且溶液不分层,发生反应的化学方程式为:,反应类型为加成反应;
(3)乙烯与Br2发生加成反应生成1,2-二溴乙烷,水中的Br2被消耗导致溶液褪色,且1,2-二溴乙烷难溶于水,将出现分层,则试管B中可观察到的实验现象为溶液褪色,液体分层;
(4)试管C中观察到酸性高锰酸钾溶液褪色,原因是乙烯和酸性高锰酸钾发生氧化还原反应导致酸性高锰酸钾溶液褪色;
(5)丙烯在一定条件下发生加聚反应生成聚丙烯,其化学方程式为:nCH2=CH—CH3,聚丙烯的链节为:;
(6)通过加聚反应生成的加聚物属于有机高分子化合物,①聚乙烯(PE)、③聚四氟乙烯(PTFE)、④聚丙烯(PP)、⑤聚氯乙烯(PVC)都是加聚物,则①③④⑤均属于有机高分子化合物;②光导纤维所用材料为SiO2,属于无机非金属化合物;⑥丙烷属于有机小分子化合物,故选D。
17. 球形冷凝管 下口 c 使反应物充分接触 生成少量丙二酸二钾盐 加快过滤速度、得到较干燥的沉淀 丙二酸单乙酯 干燥 降低沸点,避免温度过高丙二酸单乙酯发生脱羧反应 ×100%=88.6%
【分析】三颈烧瓶中,丙二酸二乙酯在氢氧化钾和乙醇的条件下发生反应得到丙二酸单乙酯钾盐,再将丙二酸单乙酯钾盐与浓盐酸反应制得丙二酸单乙酯和氯化钾溶液,水层用乙酸乙酯萃取,合并有机层,用饱和食盐水萃取,加入无水Na2SO4干燥,减压蒸馏除尽乙酸乙酯,可制得丙二酸单乙酯,由此分析。
【详解】(1)根据仪器的形状可知,仪器X的名称为球形冷凝管,为了冷凝效果更好,冷凝管应该下进上出,其进水口是下口;由于丙二酸二乙酯和100mL无水乙醇加入三颈烧瓶中,用恒压滴液漏斗,缓慢滴加含KOH的100mL无水乙醇溶液,三颈烧瓶中液体的体积大于三分之一不超过三分之二,三颈烧瓶的规格应选用500mL;
(2)步骤1中,需用无水乙醇作溶剂,其作用是使反应物充分接触,丙二酸二乙酯与KOH反应时,若KOH稍过量或其醇溶液的滴加速度较快,会使丙二酸二乙酯完全水解,生成少量丙二酸二钾盐;减压过滤也就是抽滤,是利用抽气泵使抽滤瓶中的压强降低,优点主要是加快过滤速度、得到较干燥的沉淀;
(3)步骤2中,水层用乙酸乙酯萃取是为了获取其中少量溶解的丙二酸单乙酯;无水Na2SO4具有吸水性,作用是干燥;由于温度过高丙二酸单乙酯会发生脱羧反应,分离乙酸乙酯和丙二酸单乙酯的混合物时,应采用减压蒸馏;
(4)由于~KOH~,本次实验的产率==。
18. 圆底烧瓶 a 导气、防止液体倒吸 氢氧化钠溶液 蒸馏(或分馏) 是 氯气能与水反应生成HCl与HClO,导致装置C中副产物CC13COOH、C2H5Cl增多
【分析】A装置中高锰酸钾和浓盐酸反应生成氯气;B装置用饱和食盐水除去Cl2中的HCl;装置C中,乙醇和氯气在加热条件下生成CC13CHO;仪器E进行冷凝、回流,自下而上通水冷凝效果好;D装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,而球形干燥管又可以防止倒吸。
【详解】(1)仪器m是圆底烧瓶;仪器E进行冷凝、回流,自下而上通水冷凝效果好,则E装置冷凝水的流向是a口进水;
(2)装置A中,高锰酸钾和浓盐酸反应生成氯气,离子方程式为;
(3)装置C中,乙醇和氯气在加热条件下生成CC13CHO,化学方程式为;
(4)装置D中干燥管可以导气、防止液体倒吸;D装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气;
(5)由表中数据可知,CC13COOH的沸点为198℃,沸点较大,可用蒸馏(或分馏)将CC13COOH从混合物中分离出;
(6)氯气能与水反应生成HCl与HClO,导致装置C中副产物CC13COOH、C2H5Cl增多,故应在装置B、C之间加一干燥装置。
