8.1 化石燃料与有机化合物 同步练习(含解析) 2023-2024学年高一下学期苏教版(2019)化学必修第二册
文档属性
| 名称 | 8.1 化石燃料与有机化合物 同步练习(含解析) 2023-2024学年高一下学期苏教版(2019)化学必修第二册 |
|
|
| 格式 | docx | ||
| 文件大小 | 496.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 00:00:00 | ||
图片预览


文档简介
8.1化石燃料与有机化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.利用下列反应不能制得括号中纯净物质的是
A.乙烯与氯气加成(1,2 二氯乙烷)
B.氯气与苯用氯化铁作催化剂反应(氯苯)
C.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)
D.乙烯与水加成(乙醇)
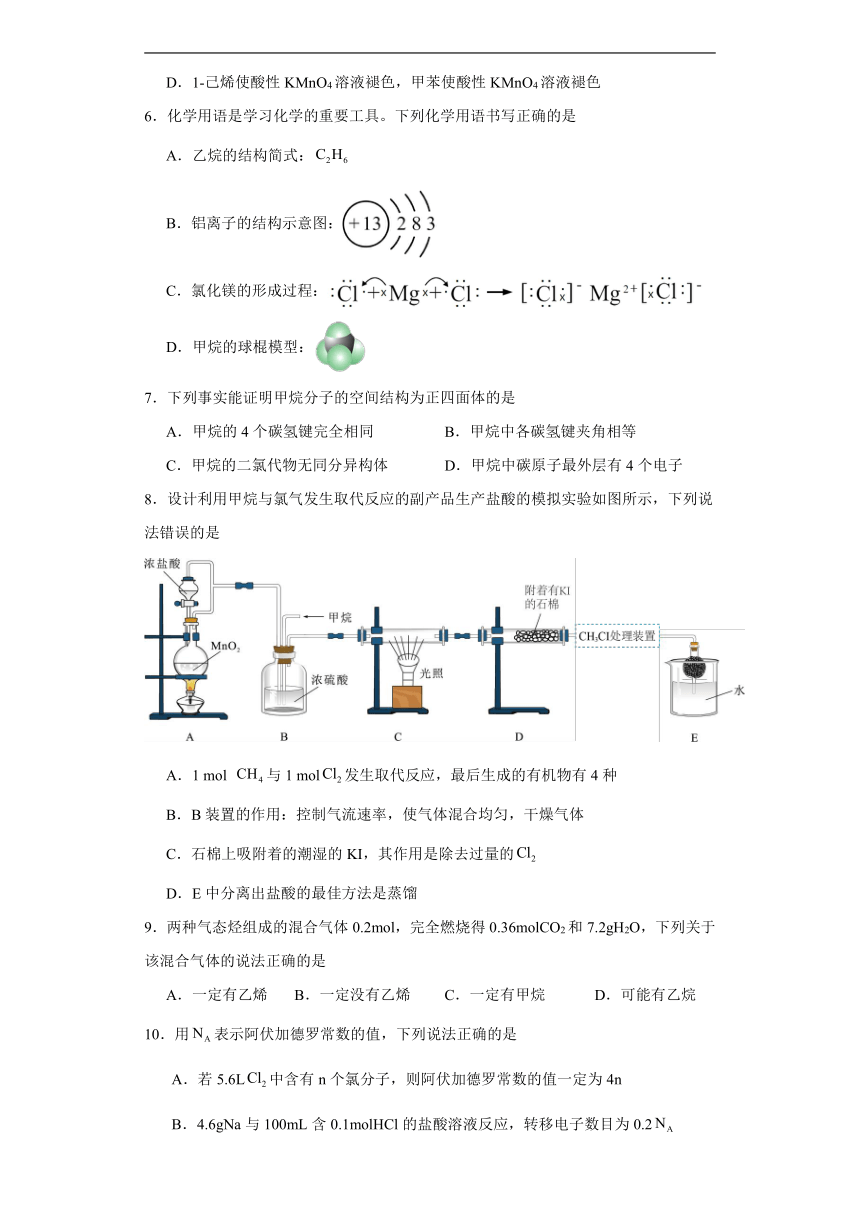
2.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,结构简式如图所示。下列关于MMF的说法中,正确的是
A.MMF能使酸性高锰酸钾溶液褪色
B.MMF的分子式为C23H33O7N
C.MMF中含酯基、羟基、酮基、碳碳双键等官能团
D.MMF分子中所有原子可能共平面
3.下列反应中属于加成反应的是
A.乙烯使酸性高锰酸钾溶液褪色
B.将四氯化碳滴入溴水中,振荡后水层接近无色
C.乙炔使溴水褪色
D.甲烷与氯气混合,黄绿色消失
4.下列物质对应的组成不正确的是
A.苏打:Na2CO3 B.氯仿:CH3Cl
C.绿矾:FeSO4·7H2O D.肥田粉:(NH4)2SO4
5.下列同一组反应的反应类型,不相同的是
A.1-丁烯使溴水褪色,乙炔制取氯乙烯
B.苯乙烯制取聚苯乙烯,四氟乙烯制取聚四氟乙烯
C.由一氯己烷制1-己烯;由丙烯制1,2-二溴丙烷
D.1-己烯使酸性KMnO4溶液褪色,甲苯使酸性KMnO4溶液褪色
6.化学用语是学习化学的重要工具。下列化学用语书写正确的是
A.乙烷的结构简式:
B.铝离子的结构示意图:
C.氯化镁的形成过程:
D.甲烷的球棍模型:
7.下列事实能证明甲烷分子的空间结构为正四面体的是
A.甲烷的4个碳氢键完全相同 B.甲烷中各碳氢键夹角相等
C.甲烷的二氯代物无同分异构体 D.甲烷中碳原子最外层有4个电子
8.设计利用甲烷与氯气发生取代反应的副产品生产盐酸的模拟实验如图所示,下列说法错误的是
A.1 mol 与1 mol发生取代反应,最后生成的有机物有4种
B.B装置的作用:控制气流速率,使气体混合均匀,干燥气体
C.石棉上吸附着的潮湿的KI,其作用是除去过量的
D.E中分离出盐酸的最佳方法是蒸馏
9.两种气态烃组成的混合气体0.2mol,完全燃烧得0.36molCO2和7.2gH2O,下列关于该混合气体的说法正确的是
A.一定有乙烯 B.一定没有乙烯 C.一定有甲烷 D.可能有乙烷
10.用表示阿伏加德罗常数的值,下列说法正确的是
A.若5.6L中含有n个氯分子,则阿伏加德罗常数的值一定为4n
B.4.6gNa与100mL含0.1molHCl的盐酸溶液反应,转移电子数目为0.2
C.14g由乙烯和环丙烷组成的混合气体中所含分子总数为0.5
D.标准状况下,22.4L含有的分子总数为
二、判断题
11.乙烯、苯、聚乙烯均含有碳碳双键。( )
12.乙烯和乙烷都为碳氢化合物,因此性质相同。(___________)
13.标准状况下,2.24L三氯甲烷含有的分子数目为0.1NA。(______)
14.同系物之间相对分子质量相差14或14的整数倍。(_______)
15.苯与溴水混合后加入FeBr3,发生放热反应,制备密度大于水的溴苯。( )
三、解答题
16.实验室制备硝基苯的实验装置如图所示,主要步骤如下:
Ⅰ.配制一定比例的浓硫酸与浓硝酸的混合酸,加入试管中;
Ⅱ.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
Ⅲ.在50~60℃下发生反应,直至反应结束;
Ⅳ.将粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤并用无水CaCl2进行干燥;
Ⅴ.对用无水CaCl2干燥后的粗硝基苯进行“某种操作”,得到纯净的硝基苯。
回答下列问题:
(1)步骤I中配制混合酸时的加入次序是 中,并不断搅拌。
A.“浓硫酸加入浓硝酸” B.“浓硝酸加入到浓硫酸”
(2)试管中发生反应的化学方程式为 ,该反应中浓硫酸的作用是 。
(3)经步骤Ⅴ后得到纯净的硝基苯:
①但在实验过程中得到的硝基苯却为黄色液体,可能的原因是 。
②硝基苯有毒,与人体皮肤接触或蒸气被人体吸收,都能引起中毒。洗去人体皮肤上的硝基苯的常用安全试剂是 (填化学名称)。
③“某种操作”指的是 。
(4)若起始时加入的苯的质量为9.75g,混合酸足量,经过上述步骤后,最后得到纯净的硝基苯的质量为12.3 g,则产率为 。
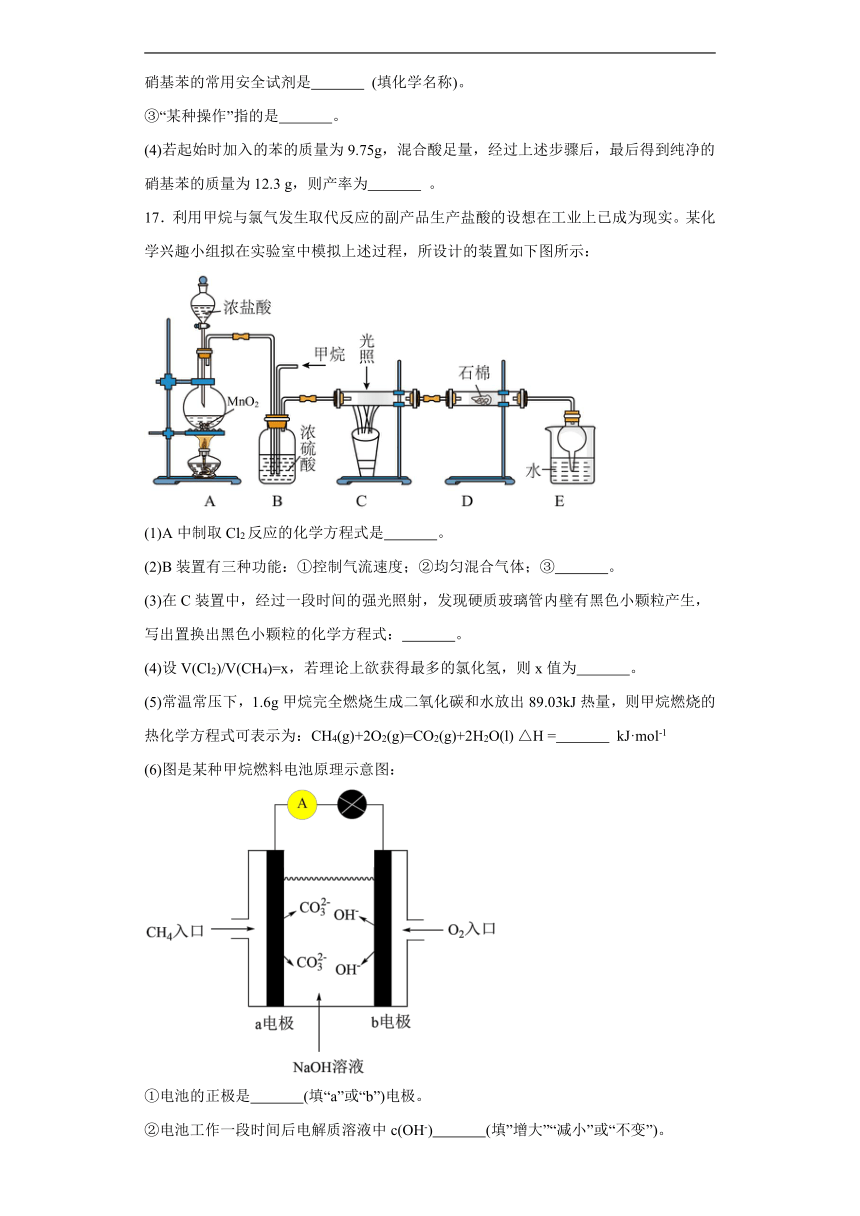
17.利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
(1)A中制取Cl2反应的化学方程式是 。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式: 。
(4)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值为 。
(5)常温常压下,1.6g甲烷完全燃烧生成二氧化碳和水放出89.03kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H = kJ·mol-1
(6)图是某种甲烷燃料电池原理示意图:
①电池的正极是 (填“a”或“b”)电极。
②电池工作一段时间后电解质溶液中c(OH-) (填”增大”“减小”或“不变”)。
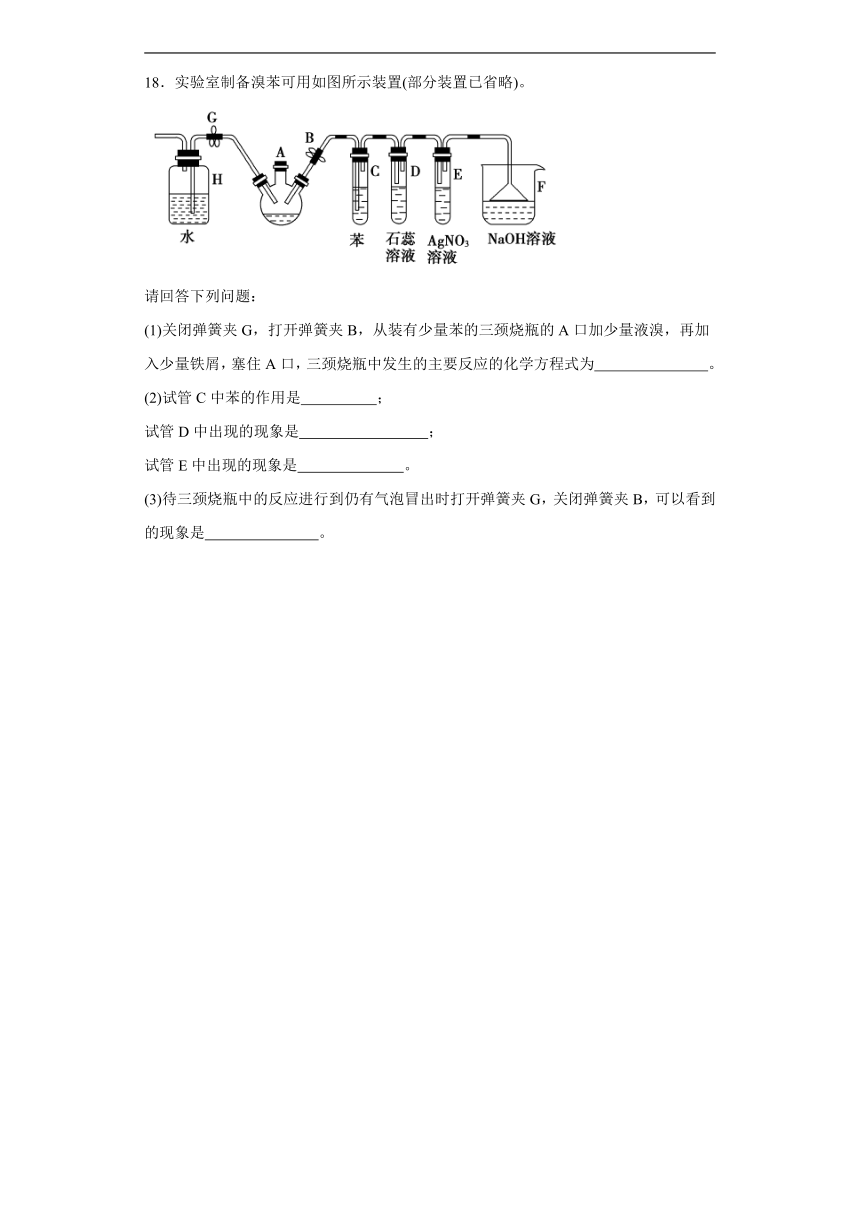
18.实验室制备溴苯可用如图所示装置(部分装置已省略)。
请回答下列问题:
(1)关闭弹簧夹G,打开弹簧夹B,从装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为 。
(2)试管C中苯的作用是 ;
试管D中出现的现象是 ;
试管E中出现的现象是 。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开弹簧夹G,关闭弹簧夹B,可以看到的现象是 。
参考答案:
1.C
【详解】A. 乙烯与Cl2加成只生成1,2-二氯乙烷一种产物,可以得到纯净物,A错误;
B. 乙烯与水在一定条件下发生反应生成乙醇,该反应产物只有一种,可以得到纯净物,B错误;
C. 液溴与苯用溴化铁作催化剂反应,生成产物只有溴苯一种产物,可以得到纯净物,C错误;
D. 甲烷与氯气的反应,即使氯气的物质的量不足,反应产物中甲烷的四种氯代产物同时存在,得到的是混合物,D正确。
故选C。
2.A
【详解】A.MMF中含有碳碳双键,所以能使酸性高锰酸钾溶液褪色,故A正确;
B.根据MMF的结构简式得到分子式为C23H31O7N,故B错误;
C.MMF中含酯基、羟基、碳碳双键等官能团,不含酮基,故C错误;
D.MMF分子中含有饱和的碳原子,因此所有原子不可能共平面,故D错误。
综上所述,答案为A。
3.C
【详解】A.乙烯使酸性高锰酸钾溶液褪色发生的是氧化反应,A错误;
B.将四氯化碳滴入溴水中,振荡后水层接近无色,发生的是萃取,B错误;
C.乙炔中含有碳碳三键,可以与溴发生加成反应,使溴水褪色,C正确;
D.甲烷与氯气混合,黄绿色消失发生的是取代反应,D错误;
综上所述答案为C。
4.B
【详解】A.Na2CO3俗名苏打、纯碱,A正确;
B.氯仿指三氯甲烷,即CHCl3,B错误;
C.FeSO4·7H2O由于含有Fe2+呈现浅绿色,俗称绿矾,C正确;
D.(NH4)2SO4可以为植物生长提供氮肥,俗称肥田粉,D正确;
故答案选B。
5.C
【详解】A.1-丁烯和溴发生加成反应生成1,2-二溴丁烷,乙炔和HCl发生加成反应生成氯乙烯,都是加成反应,反应类型相同,故A不选;
B.苯乙烯发生加聚反应生成聚苯乙烯,四氟乙烯发生加聚反应生成聚四氟乙烯,都是加聚反应,反应类型相同,故B不选;
C.一氯己烷发生消去反应生成1-己烯,丙烯和溴发生加成反应生成1,2-二溴丙烷,前者是消去反应、后者是加成反应,反应类型不同,故C选;
D.1-己烯、甲苯都和酸性高锰酸钾溶液发生氧化还原反应而使酸性高锰酸钾溶液褪色,二者都发生氧化反应,反应类型相同,故D不选;
答案选C。
6.C
【详解】A.C2H6是乙烷的分子式,其结构简式为CH3CH3,故A错误;
B.Al3+是Al失去最外层3个电子,其离子结构示意图为 ,故B错误;
C.MgCl2为离子化合物,Mg原子失去2个电子,分别给了两个Cl原子,氯化镁的形成过程为 ,故C正确;
D. 为甲烷的空间填充模型,其球棍模型为 ,故D错误;
答案为C。
7.C
【详解】A.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,CH4中的四个键完全相同,选项A错误;
B.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,CH4中各碳氢键夹角都相等,选项B错误;
C.甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合,选项C正确;
D.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,甲烷中碳原子最外层都是4个电子,选项D错误;
答案选C。
8.D
【分析】实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,最后生成的HCl溶于水生成盐酸与有机物可用分液的方法分离。
【详解】A.CH4和Cl2有系列副反应,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4共4种,A正确;
B.生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体的作用之外,因浓硫酸具有吸水性,还具有干燥作用,装置B有均匀混合气体、控制气流速度、干燥混合气体等作用,B正确;
C.KI有还原性,Cl2有氧化性,可用KI除去过量的Cl2,C正确;
D.盐酸和有机物不互溶,出现分层,从E中分离出盐酸的方法是分液,D错误;
故选:D。
9.C
【详解】n(H2O)=7.2g÷18g/mol=0.4mol,设烃为CxHy,则根据原子守恒可知x=0.36÷0.2=1.8,y=0.8÷0.2=4,则该混合烃的平均分子式为C1.8H4,根据C原子可知,该烃一定含有CH4,另一种烃含有4个H原子,可能为乙烯、丙炔等,一定不含乙烷。
故选C。
10.B
【详解】A.没指出状态是“标准状况”,不能做出具体计算,A错误;
B.Na与HCl反应,再与反应,即4.6gNa完全反应,相当于0.2molNa变成,即转移0.2电子,B正确;
C.乙烯和环丙烷的摩尔质量不同,故分子总数无法确定,C错误;
D.标准状况下,是液体,不适用气体摩尔体积公式,D错误;
故选B。
11.错误
【详解】苯分子中不存在碳碳双键,其碳碳键为介于碳碳单键和碳碳双键之间特殊的键,乙烯加聚时碳碳双键转化为单键,故聚乙烯中不含碳碳双键,题干说法错误。
12.错误
【解析】略
13.错误
【详解】标况下三氯甲烷为液态,不能用22.4L/mol的气体摩尔体积相关公式计算,故错误。
14.正确
【解析】略
15.错误
【详解】苯与溴水不反应,苯与液溴在铁或溴化铁作催化剂下发生取代反应,该反应为放热反应,溴苯的密度大于水,题中所给说法是错误;故答案为错误。
16.(1)浓硫酸加入浓硝酸
(2) +HNO3(浓)+H2O 作吸水剂和催化剂
(3) 溶解了NO2 乙醇(或其他合理答案) 蒸馏
(4)80%
【分析】苯和浓硝酸和浓硫酸在加热条下生成硝基苯,混合酸的混合过程中后加入浓硫酸。生成的硝基苯因含有二氧化氮而显黄色,经过用氢氧化钠洗涤后用蒸馏的方法得到硝基苯。据此解答。
【详解】(1)因为浓硫酸的密度大,混酸时一般浓硫酸后加入。
(2)苯和浓硝酸在浓硫酸和加热条件下反应生成硝基苯和水,方程式为:+HNO3(浓) +H2O。浓硫酸的作用为吸水剂和催化剂。
(3)浓硝酸能分解生成二氧化氮,二氧化氮溶解在硝基苯中使之显黄色。硝基苯为有机物,易溶于有机溶剂,故可以用乙醇洗涤硝基苯。干燥后的粗硝基苯含有苯,利用蒸馏的方式进行分离。
(4)硝基苯的产率为
17.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)干燥混合气体
(3)CH4+2Cl2 C+4HCl
(4)大于或等于4
(5)-890.3
(6) b 减小
【分析】本题利用A装置MnO2能将HCl(浓) 氧化Cl2,将CH4和Cl2通入B中混合并干燥后通入C中,在光照条件下发生取代反应,尾气用水吸收,为了发生倒吸,使用防止倒吸装置。
【详解】(1)MnO2能将HCl(浓) 氧化为MnCl2和Cl2,化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)生成的氯气中还含有水分,浓硫酸具有吸水性,所以B装置除了控制气流速度、均匀混合气体外,还有干燥作用;
(3)甲烷和氯气生成的黑色小颗粒为碳单质根据原子守恒可知还生成HCl,据此写出方程式为:CH4+2Cl2 C+4HCl;
(4)甲烷可以和氯气发生取代反应,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳,反应的计量系数关系如下: ,由此可以看出理论上欲获得最多的氯化氢,要尽可能的生成CCl4,因此则x值为大于或等于4;
(5)1.6g甲烷即0.1molCH4完全燃烧生成二氧化碳和水放出89.03kJ热量,则1mol CH4完全燃烧生成二氧化碳和水放出890.3kJ热量,据此写出燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890.3 kJ·mol-1;
(6)甲烷碱性燃料电池中,燃料甲烷发生氧化反应,所在电极a为负极,则b电极为正极,结合多种守恒、电荷守恒写出总反应方程式:,因此电池工作一段时间后电解质溶液中c(OH-)减小。
18.(1)+Br2+HBr↑
(2) 吸收挥发出来的溴蒸气 产生白雾,溶液变红 产生淡黄色沉淀
(3)广口瓶中的水沿导管进入三颈烧瓶中,瓶中液体出现分层
【分析】苯和液溴发生反应生成溴苯和溴化氢,溴易挥发,苯可以吸收溴化氢中的溴,溴化氢溶于水显酸性,能使石蕊溶液变红,溴化氢溶于水发生电离,电离出来的Br-和硝酸银溶液中的Ag+生成AgBr淡黄色沉淀,HBr极易溶于水,用NaOH溶液吸收时需要防止倒吸。
【详解】(1)三颈烧瓶中发生的主要反应是苯和液溴的取代反应,反应的化学方程式为:+Br2+HBr↑。
(2)溴易挥发,生成的溴化氢中混有溴蒸气,所以试管C中苯的作用是吸收挥发出来的溴蒸气。溴化氢易挥发,溶于水显酸性,所以试管D中出现的现象是产生白雾,溶液变红。溴化银是淡黄色沉淀,所以试管E中出现的现象是产生淡黄色沉淀。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开弹簧夹G,关闭弹簧夹B,由于HBr极易溶于水,水会倒吸进三颈烧瓶中,又因为溴苯不溶于水,所以可以看到的现象是广口瓶中的水沿导管进入三颈烧瓶中,瓶中液体出现分层。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.利用下列反应不能制得括号中纯净物质的是
A.乙烯与氯气加成(1,2 二氯乙烷)
B.氯气与苯用氯化铁作催化剂反应(氯苯)
C.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)
D.乙烯与水加成(乙醇)
2.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,结构简式如图所示。下列关于MMF的说法中,正确的是
A.MMF能使酸性高锰酸钾溶液褪色
B.MMF的分子式为C23H33O7N
C.MMF中含酯基、羟基、酮基、碳碳双键等官能团
D.MMF分子中所有原子可能共平面
3.下列反应中属于加成反应的是
A.乙烯使酸性高锰酸钾溶液褪色
B.将四氯化碳滴入溴水中,振荡后水层接近无色
C.乙炔使溴水褪色
D.甲烷与氯气混合,黄绿色消失
4.下列物质对应的组成不正确的是
A.苏打:Na2CO3 B.氯仿:CH3Cl
C.绿矾:FeSO4·7H2O D.肥田粉:(NH4)2SO4
5.下列同一组反应的反应类型,不相同的是
A.1-丁烯使溴水褪色,乙炔制取氯乙烯
B.苯乙烯制取聚苯乙烯,四氟乙烯制取聚四氟乙烯
C.由一氯己烷制1-己烯;由丙烯制1,2-二溴丙烷
D.1-己烯使酸性KMnO4溶液褪色,甲苯使酸性KMnO4溶液褪色
6.化学用语是学习化学的重要工具。下列化学用语书写正确的是
A.乙烷的结构简式:
B.铝离子的结构示意图:
C.氯化镁的形成过程:
D.甲烷的球棍模型:
7.下列事实能证明甲烷分子的空间结构为正四面体的是
A.甲烷的4个碳氢键完全相同 B.甲烷中各碳氢键夹角相等
C.甲烷的二氯代物无同分异构体 D.甲烷中碳原子最外层有4个电子
8.设计利用甲烷与氯气发生取代反应的副产品生产盐酸的模拟实验如图所示,下列说法错误的是
A.1 mol 与1 mol发生取代反应,最后生成的有机物有4种
B.B装置的作用:控制气流速率,使气体混合均匀,干燥气体
C.石棉上吸附着的潮湿的KI,其作用是除去过量的
D.E中分离出盐酸的最佳方法是蒸馏
9.两种气态烃组成的混合气体0.2mol,完全燃烧得0.36molCO2和7.2gH2O,下列关于该混合气体的说法正确的是
A.一定有乙烯 B.一定没有乙烯 C.一定有甲烷 D.可能有乙烷
10.用表示阿伏加德罗常数的值,下列说法正确的是
A.若5.6L中含有n个氯分子,则阿伏加德罗常数的值一定为4n
B.4.6gNa与100mL含0.1molHCl的盐酸溶液反应,转移电子数目为0.2
C.14g由乙烯和环丙烷组成的混合气体中所含分子总数为0.5
D.标准状况下,22.4L含有的分子总数为
二、判断题
11.乙烯、苯、聚乙烯均含有碳碳双键。( )
12.乙烯和乙烷都为碳氢化合物,因此性质相同。(___________)
13.标准状况下,2.24L三氯甲烷含有的分子数目为0.1NA。(______)
14.同系物之间相对分子质量相差14或14的整数倍。(_______)
15.苯与溴水混合后加入FeBr3,发生放热反应,制备密度大于水的溴苯。( )
三、解答题
16.实验室制备硝基苯的实验装置如图所示,主要步骤如下:
Ⅰ.配制一定比例的浓硫酸与浓硝酸的混合酸,加入试管中;
Ⅱ.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
Ⅲ.在50~60℃下发生反应,直至反应结束;
Ⅳ.将粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤并用无水CaCl2进行干燥;
Ⅴ.对用无水CaCl2干燥后的粗硝基苯进行“某种操作”,得到纯净的硝基苯。
回答下列问题:
(1)步骤I中配制混合酸时的加入次序是 中,并不断搅拌。
A.“浓硫酸加入浓硝酸” B.“浓硝酸加入到浓硫酸”
(2)试管中发生反应的化学方程式为 ,该反应中浓硫酸的作用是 。
(3)经步骤Ⅴ后得到纯净的硝基苯:
①但在实验过程中得到的硝基苯却为黄色液体,可能的原因是 。
②硝基苯有毒,与人体皮肤接触或蒸气被人体吸收,都能引起中毒。洗去人体皮肤上的硝基苯的常用安全试剂是 (填化学名称)。
③“某种操作”指的是 。
(4)若起始时加入的苯的质量为9.75g,混合酸足量,经过上述步骤后,最后得到纯净的硝基苯的质量为12.3 g,则产率为 。
17.利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
(1)A中制取Cl2反应的化学方程式是 。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式: 。
(4)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值为 。
(5)常温常压下,1.6g甲烷完全燃烧生成二氧化碳和水放出89.03kJ热量,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H = kJ·mol-1
(6)图是某种甲烷燃料电池原理示意图:
①电池的正极是 (填“a”或“b”)电极。
②电池工作一段时间后电解质溶液中c(OH-) (填”增大”“减小”或“不变”)。
18.实验室制备溴苯可用如图所示装置(部分装置已省略)。
请回答下列问题:
(1)关闭弹簧夹G,打开弹簧夹B,从装有少量苯的三颈烧瓶的A口加少量液溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为 。
(2)试管C中苯的作用是 ;
试管D中出现的现象是 ;
试管E中出现的现象是 。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开弹簧夹G,关闭弹簧夹B,可以看到的现象是 。
参考答案:
1.C
【详解】A. 乙烯与Cl2加成只生成1,2-二氯乙烷一种产物,可以得到纯净物,A错误;
B. 乙烯与水在一定条件下发生反应生成乙醇,该反应产物只有一种,可以得到纯净物,B错误;
C. 液溴与苯用溴化铁作催化剂反应,生成产物只有溴苯一种产物,可以得到纯净物,C错误;
D. 甲烷与氯气的反应,即使氯气的物质的量不足,反应产物中甲烷的四种氯代产物同时存在,得到的是混合物,D正确。
故选C。
2.A
【详解】A.MMF中含有碳碳双键,所以能使酸性高锰酸钾溶液褪色,故A正确;
B.根据MMF的结构简式得到分子式为C23H31O7N,故B错误;
C.MMF中含酯基、羟基、碳碳双键等官能团,不含酮基,故C错误;
D.MMF分子中含有饱和的碳原子,因此所有原子不可能共平面,故D错误。
综上所述,答案为A。
3.C
【详解】A.乙烯使酸性高锰酸钾溶液褪色发生的是氧化反应,A错误;
B.将四氯化碳滴入溴水中,振荡后水层接近无色,发生的是萃取,B错误;
C.乙炔中含有碳碳三键,可以与溴发生加成反应,使溴水褪色,C正确;
D.甲烷与氯气混合,黄绿色消失发生的是取代反应,D错误;
综上所述答案为C。
4.B
【详解】A.Na2CO3俗名苏打、纯碱,A正确;
B.氯仿指三氯甲烷,即CHCl3,B错误;
C.FeSO4·7H2O由于含有Fe2+呈现浅绿色,俗称绿矾,C正确;
D.(NH4)2SO4可以为植物生长提供氮肥,俗称肥田粉,D正确;
故答案选B。
5.C
【详解】A.1-丁烯和溴发生加成反应生成1,2-二溴丁烷,乙炔和HCl发生加成反应生成氯乙烯,都是加成反应,反应类型相同,故A不选;
B.苯乙烯发生加聚反应生成聚苯乙烯,四氟乙烯发生加聚反应生成聚四氟乙烯,都是加聚反应,反应类型相同,故B不选;
C.一氯己烷发生消去反应生成1-己烯,丙烯和溴发生加成反应生成1,2-二溴丙烷,前者是消去反应、后者是加成反应,反应类型不同,故C选;
D.1-己烯、甲苯都和酸性高锰酸钾溶液发生氧化还原反应而使酸性高锰酸钾溶液褪色,二者都发生氧化反应,反应类型相同,故D不选;
答案选C。
6.C
【详解】A.C2H6是乙烷的分子式,其结构简式为CH3CH3,故A错误;
B.Al3+是Al失去最外层3个电子,其离子结构示意图为 ,故B错误;
C.MgCl2为离子化合物,Mg原子失去2个电子,分别给了两个Cl原子,氯化镁的形成过程为 ,故C正确;
D. 为甲烷的空间填充模型,其球棍模型为 ,故D错误;
答案为C。
7.C
【详解】A.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,CH4中的四个键完全相同,选项A错误;
B.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,CH4中各碳氢键夹角都相等,选项B错误;
C.甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合,选项C正确;
D.无论甲烷分子是以碳原子为中心的正四面体结构,还是平面正方形结构,甲烷中碳原子最外层都是4个电子,选项D错误;
答案选C。
8.D
【分析】实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,最后生成的HCl溶于水生成盐酸与有机物可用分液的方法分离。
【详解】A.CH4和Cl2有系列副反应,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4共4种,A正确;
B.生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体的作用之外,因浓硫酸具有吸水性,还具有干燥作用,装置B有均匀混合气体、控制气流速度、干燥混合气体等作用,B正确;
C.KI有还原性,Cl2有氧化性,可用KI除去过量的Cl2,C正确;
D.盐酸和有机物不互溶,出现分层,从E中分离出盐酸的方法是分液,D错误;
故选:D。
9.C
【详解】n(H2O)=7.2g÷18g/mol=0.4mol,设烃为CxHy,则根据原子守恒可知x=0.36÷0.2=1.8,y=0.8÷0.2=4,则该混合烃的平均分子式为C1.8H4,根据C原子可知,该烃一定含有CH4,另一种烃含有4个H原子,可能为乙烯、丙炔等,一定不含乙烷。
故选C。
10.B
【详解】A.没指出状态是“标准状况”,不能做出具体计算,A错误;
B.Na与HCl反应,再与反应,即4.6gNa完全反应,相当于0.2molNa变成,即转移0.2电子,B正确;
C.乙烯和环丙烷的摩尔质量不同,故分子总数无法确定,C错误;
D.标准状况下,是液体,不适用气体摩尔体积公式,D错误;
故选B。
11.错误
【详解】苯分子中不存在碳碳双键,其碳碳键为介于碳碳单键和碳碳双键之间特殊的键,乙烯加聚时碳碳双键转化为单键,故聚乙烯中不含碳碳双键,题干说法错误。
12.错误
【解析】略
13.错误
【详解】标况下三氯甲烷为液态,不能用22.4L/mol的气体摩尔体积相关公式计算,故错误。
14.正确
【解析】略
15.错误
【详解】苯与溴水不反应,苯与液溴在铁或溴化铁作催化剂下发生取代反应,该反应为放热反应,溴苯的密度大于水,题中所给说法是错误;故答案为错误。
16.(1)浓硫酸加入浓硝酸
(2) +HNO3(浓)+H2O 作吸水剂和催化剂
(3) 溶解了NO2 乙醇(或其他合理答案) 蒸馏
(4)80%
【分析】苯和浓硝酸和浓硫酸在加热条下生成硝基苯,混合酸的混合过程中后加入浓硫酸。生成的硝基苯因含有二氧化氮而显黄色,经过用氢氧化钠洗涤后用蒸馏的方法得到硝基苯。据此解答。
【详解】(1)因为浓硫酸的密度大,混酸时一般浓硫酸后加入。
(2)苯和浓硝酸在浓硫酸和加热条件下反应生成硝基苯和水,方程式为:+HNO3(浓) +H2O。浓硫酸的作用为吸水剂和催化剂。
(3)浓硝酸能分解生成二氧化氮,二氧化氮溶解在硝基苯中使之显黄色。硝基苯为有机物,易溶于有机溶剂,故可以用乙醇洗涤硝基苯。干燥后的粗硝基苯含有苯,利用蒸馏的方式进行分离。
(4)硝基苯的产率为
17.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)干燥混合气体
(3)CH4+2Cl2 C+4HCl
(4)大于或等于4
(5)-890.3
(6) b 减小
【分析】本题利用A装置MnO2能将HCl(浓) 氧化Cl2,将CH4和Cl2通入B中混合并干燥后通入C中,在光照条件下发生取代反应,尾气用水吸收,为了发生倒吸,使用防止倒吸装置。
【详解】(1)MnO2能将HCl(浓) 氧化为MnCl2和Cl2,化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)生成的氯气中还含有水分,浓硫酸具有吸水性,所以B装置除了控制气流速度、均匀混合气体外,还有干燥作用;
(3)甲烷和氯气生成的黑色小颗粒为碳单质根据原子守恒可知还生成HCl,据此写出方程式为:CH4+2Cl2 C+4HCl;
(4)甲烷可以和氯气发生取代反应,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳,反应的计量系数关系如下: ,由此可以看出理论上欲获得最多的氯化氢,要尽可能的生成CCl4,因此则x值为大于或等于4;
(5)1.6g甲烷即0.1molCH4完全燃烧生成二氧化碳和水放出89.03kJ热量,则1mol CH4完全燃烧生成二氧化碳和水放出890.3kJ热量,据此写出燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890.3 kJ·mol-1;
(6)甲烷碱性燃料电池中,燃料甲烷发生氧化反应,所在电极a为负极,则b电极为正极,结合多种守恒、电荷守恒写出总反应方程式:,因此电池工作一段时间后电解质溶液中c(OH-)减小。
18.(1)+Br2+HBr↑
(2) 吸收挥发出来的溴蒸气 产生白雾,溶液变红 产生淡黄色沉淀
(3)广口瓶中的水沿导管进入三颈烧瓶中,瓶中液体出现分层
【分析】苯和液溴发生反应生成溴苯和溴化氢,溴易挥发,苯可以吸收溴化氢中的溴,溴化氢溶于水显酸性,能使石蕊溶液变红,溴化氢溶于水发生电离,电离出来的Br-和硝酸银溶液中的Ag+生成AgBr淡黄色沉淀,HBr极易溶于水,用NaOH溶液吸收时需要防止倒吸。
【详解】(1)三颈烧瓶中发生的主要反应是苯和液溴的取代反应,反应的化学方程式为:+Br2+HBr↑。
(2)溴易挥发,生成的溴化氢中混有溴蒸气,所以试管C中苯的作用是吸收挥发出来的溴蒸气。溴化氢易挥发,溶于水显酸性,所以试管D中出现的现象是产生白雾,溶液变红。溴化银是淡黄色沉淀,所以试管E中出现的现象是产生淡黄色沉淀。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开弹簧夹G,关闭弹簧夹B,由于HBr极易溶于水,水会倒吸进三颈烧瓶中,又因为溴苯不溶于水,所以可以看到的现象是广口瓶中的水沿导管进入三颈烧瓶中,瓶中液体出现分层。
