9.3金属材料的性能及应用同步练习(含解析) 2023-2024学年高一下学期苏教版(2019)化学必修第二册
文档属性
| 名称 | 9.3金属材料的性能及应用同步练习(含解析) 2023-2024学年高一下学期苏教版(2019)化学必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 20:44:40 | ||
图片预览



文档简介
9.3金属材料的性能及应用
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.2022年北京冬奥会火炬“飞扬”用氢气为燃料,耐高温碳纤维材料为外壳,铝合金为点火段材料,辅以可调节火焰颜色的“配方”。下列说法错误的是
A.氢气作燃料对环境友好无污染 B.碳纤维不属于有机材料
C.铝合金密度小、易燃 D.含钠元素的“配方”可使火焰呈黄色
2.很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列文物不属于合金材料的是
A B C D
曾侯乙编钟 青花花鸟纹鱼尾瓶 圆明园兽首 马踏飞燕(东汉铜奔马)
A.A B.B C.C D.D
3.2023年中国计划发射“神舟十六号”、“神舟十七号”载人飞船和“天舟六号”货运飞船。下列有关说法不正确的是
A.用于制造载人飞船上太阳能电池板的半导体材料主要成分为
B.镁铝合金广泛应用于航天领域,因为镁铝合金密度小、强度高
C.飞船船体覆盖的耐高温陶瓷材料属于传统无机非金属材料
D.火箭使用碳纳米管可以减轻火箭质量,这种材料属于新型无机非金属材料
4.下列关于金属材料的说法,正确的是( )
A.导电性最好的金属是铜
B.钢的性能比生铁的好,所以钢是很纯的铁
C.合金的抗腐蚀性能不如成分金属好
D.焊锡(锡铅合金)的熔点比锡、铅的熔点都低
5.已有百年历史的陈家祠是岭南建筑艺术明珠,在建筑结构上巧妙地运用了多种装饰工艺。下列装饰工艺主要使用金属材料的是
A. 栩栩如生的石雕 B. 精妙生动的木雕 C. 精致的砖雕 D. 镶嵌的铜铁铸
A.A B.B C.C D.D
6.下列有关对金属和金属材料的认识不正确的是
A.铁有良好的导热性,常用来制作炊具
B.铝表面易形成致密的氧化膜,可阻止铝进一步被氧化
C.废旧电池的回收,可减少对环境的污染
D.合金的硬度一般小于成分金属的硬度
7.化学与工业、生活密切相关,下列说法错误的是
A.氯气、臭氧、二氧化氯都可用于饮用水的消毒
B.工业上用氯气与石灰水反应制取漂白粉
C.霓虹灯光、激光、焰火都与电子跃迁释放能量有关
D.镁合金密度较小、强度较大,可用于制造飞机部件
8.合金从古代到现代,从生活领域到工业领域都有着广泛应用。下列说法错误的是
A.铝合金大量用于高铁建设
B.“玉兔二号”钛合金筛网轮的主要成分是非金属材料
C.制饭勺、饭盒、高压锅等的不锈钢是合金
D.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
9.北齐冶金家綦毋怀文发明的“灌钢法”是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再经高温锻打成钢。下列有关“灌钢法”的说法正确的是
A.生铁的熔点高于熟铁 B.锻打成钢时仅发生物理变化
C.钢是以铁为主的含碳合金 D.钢在三者中含碳量最低
10.广东拥有多项非物质文化遗产,以下代表作的主要材料不属于天然有机高分子的是
A.东莞莞香所用的常绿乔木 B.佛山醒狮所用的铜锣 C.潮汕剪纸所用的牛皮 D.粤绣用的孔雀毛
A.A B.B C.C D.D
二、判断题
11.氧化铜可作为制造玻璃、搪瓷的红色颜料。(______)
12.合金的性质与其成分金属的性质不完全相同。(______)
13.压电陶瓷能实现机械能与电能的相互转化。(_____)
14.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为“蓝色固体”。(______)
15.能与酸反应的氧化物,一定是碱性氧化物 。(______)
三、解答题
16.水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是 。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是 (填编号)。
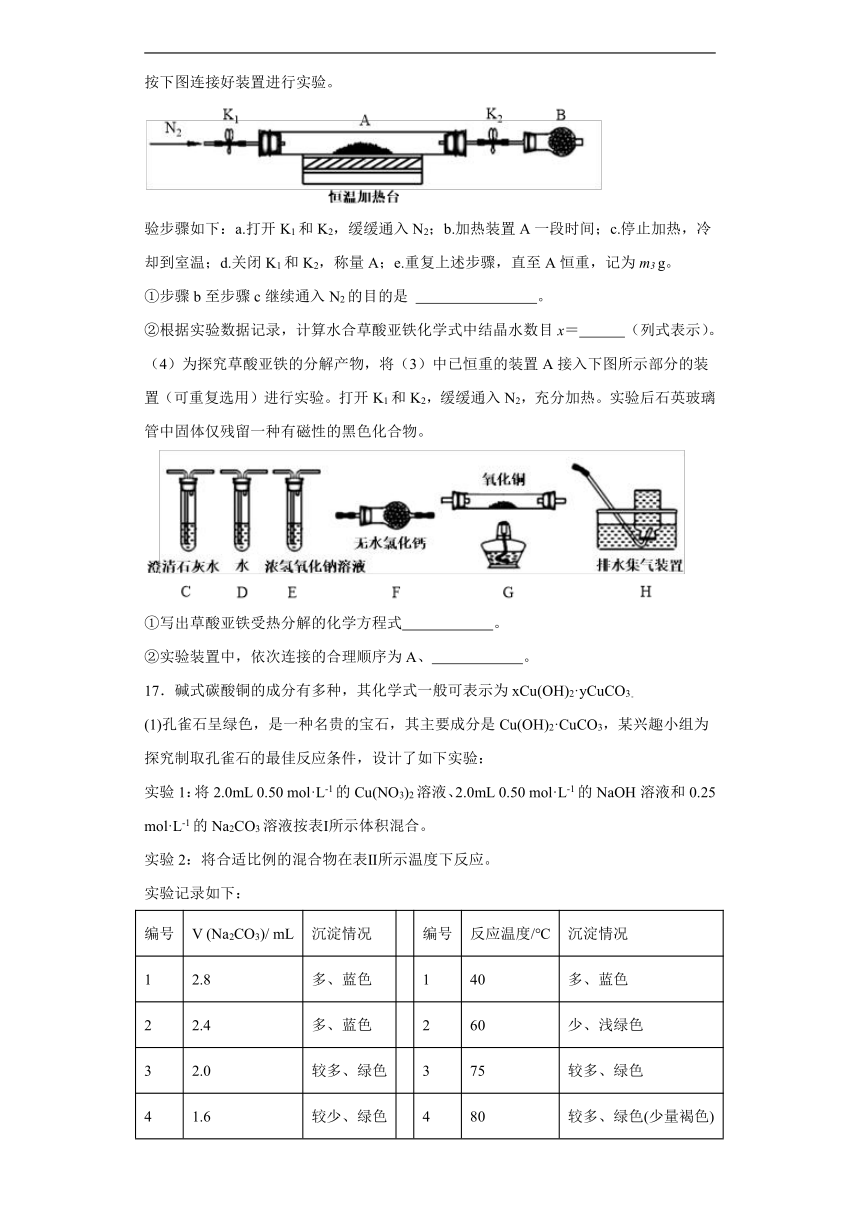
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x= (列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
①写出草酸亚铁受热分解的化学方程式 。
②实验装置中,依次连接的合理顺序为A、 。
17.碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3,某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L-1的Cu(NO3)2溶液、2.0mL 0.50 mol·L-1的NaOH溶液和0.25 mol·L-1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
编号 V (Na2CO3)/ mL 沉淀情况 编号 反应温度/℃ 沉淀情况
1 2.8 多、蓝色 1 40 多、蓝色
2 2.4 多、蓝色 2 60 少、浅绿色
3 2.0 较多、绿色 3 75 较多、绿色
4 1.6 较少、绿色 4 80 较多、绿色(少量褐色)
表Ⅰ 表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的原因是 。
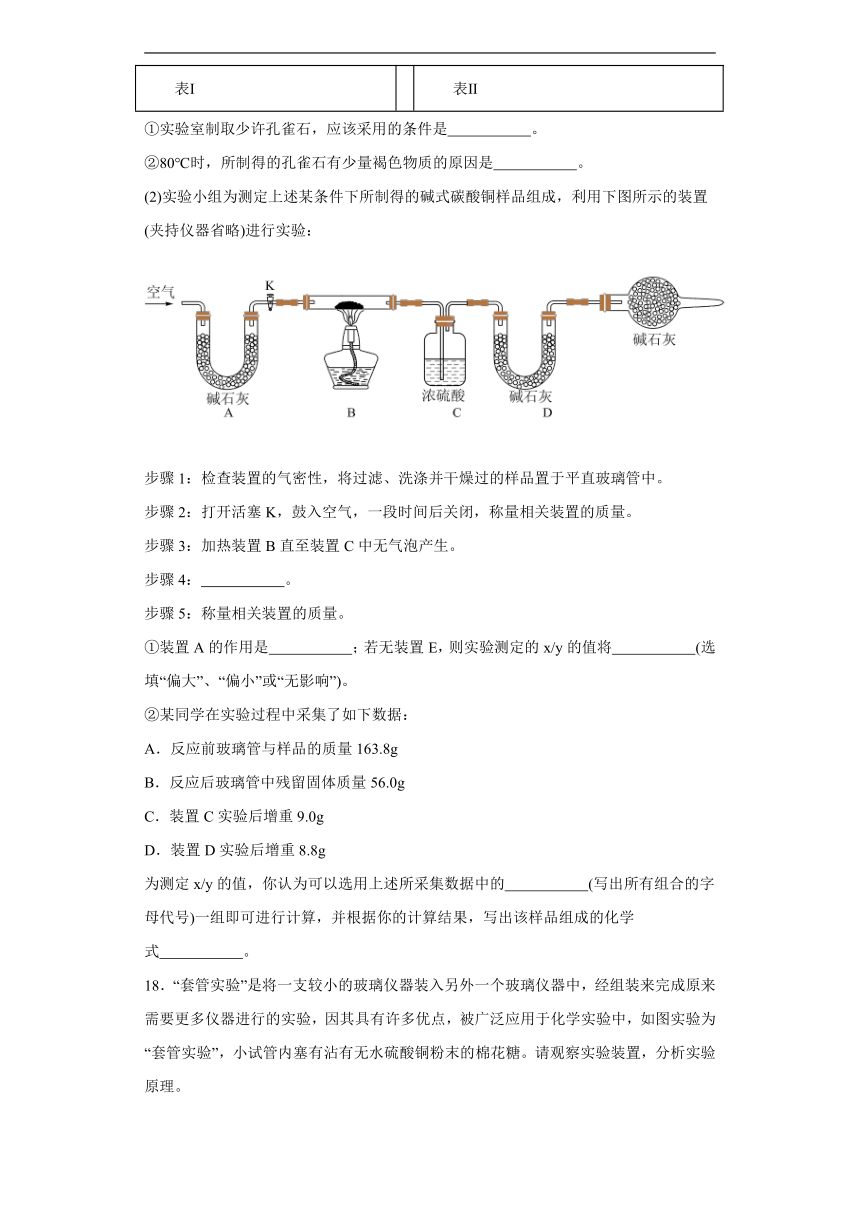
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: 。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 (选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
18.“套管实验”是将一支较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要更多仪器进行的实验,因其具有许多优点,被广泛应用于化学实验中,如图实验为“套管实验”,小试管内塞有沾有无水硫酸铜粉末的棉花糖。请观察实验装置,分析实验原理。
回答下列问题:
(1)该实验的目的是 。
(2)该实验的现象是 ,
B中发生反应的离子方程式是 。
(3)一段时间后结束实验,待装置冷却,取出小试管中固体溶于水,然后滴加1mol/L盐酸,产生CO2的量与盐酸的量的关系如图所示,其中合理的是 。
(4)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g,则原混合物中碳酸钠的质量分数为 。
参考答案:
1.C
【详解】A.氢气燃烧生成水,不会造成环境污染,则氢气作燃料对环境友好无污染,故A正确;
B.碳纤维是无机非金属材料,不属于天然高分子材料,故B正确;
C.由题意可知,铝合金为点火段材料说明合金性质稳定,不易燃烧,故C错误;
D.钠元素焰色反应的焰色为黄色,则火炬飞扬的火焰呈黄色说明配方中含有钠元素,故D正确;
故选C。
2.B
【详解】A.曾侯乙编钟为青铜器,属于合金,故A不符合题意;
B.瓷器的主要成分为硅酸盐,属于无机非金属材料,不是合金,故B符合题意;
C.圆明园兽首为铜合金,故C不符合题意;
D.马踏飞燕(东汉铜奔马)为铜制品,属于合金,故D不符合题意;
故选B。
3.C
【详解】A.Si是一种良好的半导体材料,故用于制造载人飞船上太阳能电池板的半导体材料主要成分为Si,A正确;
B.合金的密度一般比成分金属小,机械强度比成分金属大,故镁铝合金广泛应用于航天领域,因为镁铝合金密度小、强度高,B正确;
C.相对于传统的无机非金属材料玻璃、陶瓷和水泥相比,耐高温陶瓷材料属于新型无机非金属材料,C错误;
D.相对于传统的无机非金属材料玻璃、陶瓷和水泥相比,火箭使用碳纳米管可以减轻火箭质量,这种材料属于新型无机非金属材料,D正确;
故答案为:C。
4.D
【详解】A.银的导电性能比铜还要好,故A错误;
B.钢是铁的合金,含碳量0.03%~2%,钢不是纯铁是铁合金,是混合物,故B错误;
C.合金的性能比它们的组分金属性能好,多数合金的抗腐蚀性比组成它们的纯金属更好,故C错误;
D.焊锡是一种合金,其熔点比组成它的锡、铅的熔点都要低,这也是合金的优点,故D正确;
故答案为D。
5.D
【详解】A.栩栩如生的石雕不是金属材料,故A不选;
B.精妙生动的木雕的主要成分是纤维素,不是金属材料,故B不选;
C.精致的砖雕主要成分是硅酸盐,不是金属材料,故C不选;
D.镶嵌的铜铁铸属于合金,故D选;
答案为D。
6.D
【详解】A.铁具有良好的导热性,而且铁元素也是人体必需的元素,常用铁制作炊具,故A正确;
B.铝具有抗腐蚀性,铝表面易形成致密的氧化膜,可阻止里面的金属进一步被氧化,故B正确;
C.废旧电池中汞等重金属元素会污染环境,不能随意丢弃,需要回收,故C正确;
D.合金的硬度一般大于成分金属的硬度,故D错误;
故选D。
7.B
【详解】A.氯气与水生成的次氯酸、臭氧、二氧化氯等均具有强氧化性,能使蛋白质变性,则氯气、臭氧、二氧化氯都可用于饮用水的杀菌消毒, A正确;
B.工业上用氯气与石灰乳反应制取漂白粉,B错误;
C.电子在基态和激发态之间的跃迁会引起能量的变化,并以光的形式体现,所以霓虹灯光、激光、焰火都与原子核外电子跃迁释放能量有关,C正确;
D.镁合金具有密度较小、强度较大,耐腐蚀的优点,可用于制造火箭、导弹、 飞机部件,D正确;
故选B。
8.B
【详解】A.铝合金具有质地轻、强度高、抗腐蚀能力强等特点,可用于制造高铁车厢等,A正确;
B.钛合金是金属材料,B错误;
C.不锈钢是铁与镍、铬等形成的合金,C正确;
D.后(司)母戊鼎为商代后期的青铜器,属于铜合金制品,D正确;
故选B。
9.C
【详解】A.生铁是铁碳合金,熔点比熟铁低,故A错误;
B.锻打成钢时既发生物理变化又发生化学变化,故B错误;
C.钢是以铁为主的含碳合金,故C正确;
D.熟铁在三者中含碳量最低,故D错误;
故选C。
10.B
【详解】A.东莞莞香所用的常绿乔木含有纤维素,是天然有机高分子,A正确;
B.佛山醒狮所用的铜锣是金属材料,不是高分子,B错误;
C.潮汕剪纸所用的牛皮含有蛋白质,是天然有机高分子,C正确;
D.粤绣用的孔雀毛含有蛋白质,是天然有机高分子,D正确;
故合理选项为B。
11.错误
【详解】氧化铜是黑色物质,不能作为红色颜料,错误;
12.正确
【详解】合金的熔点比它的各成分金属的熔点都低,故上述说法正确;
13.正确
【详解】对压电陶瓷挤压或拉伸时,它的两端就会形成一定的电压,并且压电陶瓷还能把电能转换成超声振动,所以压电陶瓷能够实现机械能和电能的互相转化,故正确。
14.错误
【详解】向CuSO4溶液中滴入过量NaOH溶液充分反应后生成氢氧化铜,氢氧化铜受热易分解,则将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为黑色氧化铜,故答案为:错误。
15.错误
【详解】既可与酸反应,又可与碱反应,为两性氧化物,所以能与酸反应的氧化物,不一定是碱性氧化物;
故答案为错误。
16. FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4 ② 将装置A中的水蒸气带走;同时防止FeC2O4冷却时被氧化 3FeC2O4 Fe3O4 + 4CO↑+ 2CO2↑ C E (C) F G C H
【详解】(1)硫酸亚铁溶液和草酸反应的化学方程式是FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4;
(2)①向试管中加入几滴KSCN溶液,溶液不变红,不能说明肯定存在Fe2+;向试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀,说明肯定存在Fe2+;草酸根离子、Fe2+均能与紫红色酸性KMnO4溶液反应,不能说明肯定存在Fe2+;故答案选②。
(3)①在无氧环境中进行反应,防止FeC2O4冷却时被氧化,同时将装置A中的水蒸气转移出A装置;②m(H2O)=(m3-m1)g,m(FeC2O4)= (m2-m3)g,根据FeC2O4·xH2O= FeC2O4 + xH2O反应可知:144:18x=(m2-m3)g:(m3-m1)g,x=;
(4)①由于分解后有磁性的黑色化合物生成,该化合物为Fe3O4,铁元素化合价有变化,说明分解过程中发生了氧化还原反应,化学方程式为:3FeC2O4 Fe3O4 + 4CO↑+ 2CO2↑;
②生成的气体先通过澄清石灰水来证明二氧化碳的存在,再通过浓的氢氧化钠吸收二氧化碳,再通过澄清石灰水来证明二氧化碳已吸收完全,气体经干燥灼热的氧化铜,将产生后气体澄清石灰水来证明又生成了二氧化碳,最后进行尾气处理;依次连接的合理顺序为A、C E (C) F G C H。
17.(1) n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1 75℃有少量孔雀石受热分解为CuO
(2) 打开活塞K,继续通一段时间空气 除去空气中的CO2和H2O 偏小 BC、BD、CD 5Cu(OH)2·2CuCO3
【详解】(1)①根据表2可知,温度为75℃时,生成的孔雀石,因此温度应该控制在75℃。根据表1控制,当碳酸钠溶液的体积是2.0ml时,生成的孔雀石多,此时n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1;
②80℃时,所制得的孔雀石有少量褐色物质,孔雀石受热易分解,所以温度过高时,Cu(OH)2受热分解为CuO;
答案:n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1;75℃有少量孔雀石受热分解为CuO;
(2)微粒把反应中产生的CO2和水蒸气全部被吸收,再冷却时,应该继续通一段时间空气至装置冷却 。
①由于空气中含有水蒸气和CO2,所以利用碱石灰来除去空气中的CO2和H2O。若无装置E,则D装置质量会偏大,导致CO2的质量偏多,所以x/y的值将偏小;
②要计算x/y的值,则需要知道生成物水和CO2的质量。由于反应后玻璃管中残留固体质量是氧化铜,所以正确的组合是BC、BD、CD 。装置C实验后增重9.0g,则水是0.5mol。装置D实验后增重8.8g,则CO2是0.2mol,所以x/y的值2.5,因此化学式5Cu(OH)2·2CuCO3;
答案:打开活塞K,继续通一段时间空气;除去空气中的CO2和H2O;偏小;BC、BD、CD;5Cu(OH)2·2CuCO3。
18. 探究(或证明)碳酸氢钠不稳定,受热易分解产生CO2和H2O,而碳酸钠稳定。 棉花糖上的粉末变蓝;B中澄清石灰水变浑浊 Ca2+ + 2OH- + CO2 = CaCO3 ↓ + H2O BC 32.8%
【详解】(1)由实验装置图可知:两个试管内分别装有Na2CO3、NaHCO3,给它们加热,然后用澄清的石灰水来检验CO2的产生,所以该实验的目的是探究(或证明)碳酸氢钠不稳定,受热易分解产生CO2和H2O,而碳酸钠稳定;来探究二者的热稳定性的相对大小。故答案:探究(或证明)碳酸氢钠不稳定,受热易分解产生CO2和H2O,而碳酸钠稳定。
(2)小试管内塞有沾有无水硫酸铜粉末的棉花糖,硫酸铜遇水反应生成CuSO4 5H2O,CuSO4 5H2O呈蓝色,根据化学反应2NaHCO3Na2CO3 +2H2O+CO2↑,所以该实验的现象是棉花糖上的粉末变蓝;B中澄清石灰水变浑浊。CO2与Ca(OH)2反应生成碳酸钙白色沉淀和水,所以B中发生反应的离子方程式是Ca2++2OH-+CO2=CaCO3↓+H2O。故答案:棉花糖上的粉末变蓝;B中澄清石灰水变浑浊;Ca2+ + 2OH- + CO2 = CaCO3 ↓ + H2O。
(3)NaHCO3不稳定,受热分解。向固体中加入HCl时首先发生反应:Na2CO3+HCl=NaCl+NaHCO3;无气体产生,当该反应完全后,再发生反应 NaHCO3+HCl=NaCl+H2O+ CO2↑,放出气体。因此,若NaHCO3完全分解,则两步消耗的HCl的物质的量相等,体积也相等。若它部分分解,则发生第一步消耗的HCl就比第二步少些。B为部分分解的图象;C为完全分解的图象。答案选BC。
(4)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g,沉淀的物质的量为0.04mol,即反应生成CO2 0.04mol,根据化学反应2NaHCO3Na2CO3 +2H2O+CO2↑,混合物中碳酸氢钠的物质的量为0.08mol,质量为0.08mol×84g/mol=6.72g,碳酸钠的质量为10-6.72=3.28g,则原混合物中碳酸钠的质量分数=×100%=32.8%。故答案:32.8%。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.2022年北京冬奥会火炬“飞扬”用氢气为燃料,耐高温碳纤维材料为外壳,铝合金为点火段材料,辅以可调节火焰颜色的“配方”。下列说法错误的是
A.氢气作燃料对环境友好无污染 B.碳纤维不属于有机材料
C.铝合金密度小、易燃 D.含钠元素的“配方”可使火焰呈黄色
2.很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列文物不属于合金材料的是
A B C D
曾侯乙编钟 青花花鸟纹鱼尾瓶 圆明园兽首 马踏飞燕(东汉铜奔马)
A.A B.B C.C D.D
3.2023年中国计划发射“神舟十六号”、“神舟十七号”载人飞船和“天舟六号”货运飞船。下列有关说法不正确的是
A.用于制造载人飞船上太阳能电池板的半导体材料主要成分为
B.镁铝合金广泛应用于航天领域,因为镁铝合金密度小、强度高
C.飞船船体覆盖的耐高温陶瓷材料属于传统无机非金属材料
D.火箭使用碳纳米管可以减轻火箭质量,这种材料属于新型无机非金属材料
4.下列关于金属材料的说法,正确的是( )
A.导电性最好的金属是铜
B.钢的性能比生铁的好,所以钢是很纯的铁
C.合金的抗腐蚀性能不如成分金属好
D.焊锡(锡铅合金)的熔点比锡、铅的熔点都低
5.已有百年历史的陈家祠是岭南建筑艺术明珠,在建筑结构上巧妙地运用了多种装饰工艺。下列装饰工艺主要使用金属材料的是
A. 栩栩如生的石雕 B. 精妙生动的木雕 C. 精致的砖雕 D. 镶嵌的铜铁铸
A.A B.B C.C D.D
6.下列有关对金属和金属材料的认识不正确的是
A.铁有良好的导热性,常用来制作炊具
B.铝表面易形成致密的氧化膜,可阻止铝进一步被氧化
C.废旧电池的回收,可减少对环境的污染
D.合金的硬度一般小于成分金属的硬度
7.化学与工业、生活密切相关,下列说法错误的是
A.氯气、臭氧、二氧化氯都可用于饮用水的消毒
B.工业上用氯气与石灰水反应制取漂白粉
C.霓虹灯光、激光、焰火都与电子跃迁释放能量有关
D.镁合金密度较小、强度较大,可用于制造飞机部件
8.合金从古代到现代,从生活领域到工业领域都有着广泛应用。下列说法错误的是
A.铝合金大量用于高铁建设
B.“玉兔二号”钛合金筛网轮的主要成分是非金属材料
C.制饭勺、饭盒、高压锅等的不锈钢是合金
D.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
9.北齐冶金家綦毋怀文发明的“灌钢法”是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再经高温锻打成钢。下列有关“灌钢法”的说法正确的是
A.生铁的熔点高于熟铁 B.锻打成钢时仅发生物理变化
C.钢是以铁为主的含碳合金 D.钢在三者中含碳量最低
10.广东拥有多项非物质文化遗产,以下代表作的主要材料不属于天然有机高分子的是
A.东莞莞香所用的常绿乔木 B.佛山醒狮所用的铜锣 C.潮汕剪纸所用的牛皮 D.粤绣用的孔雀毛
A.A B.B C.C D.D
二、判断题
11.氧化铜可作为制造玻璃、搪瓷的红色颜料。(______)
12.合金的性质与其成分金属的性质不完全相同。(______)
13.压电陶瓷能实现机械能与电能的相互转化。(_____)
14.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为“蓝色固体”。(______)
15.能与酸反应的氧化物,一定是碱性氧化物 。(______)
三、解答题
16.水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是 。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是 (填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x= (列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
①写出草酸亚铁受热分解的化学方程式 。
②实验装置中,依次连接的合理顺序为A、 。
17.碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3,某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L-1的Cu(NO3)2溶液、2.0mL 0.50 mol·L-1的NaOH溶液和0.25 mol·L-1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
编号 V (Na2CO3)/ mL 沉淀情况 编号 反应温度/℃ 沉淀情况
1 2.8 多、蓝色 1 40 多、蓝色
2 2.4 多、蓝色 2 60 少、浅绿色
3 2.0 较多、绿色 3 75 较多、绿色
4 1.6 较少、绿色 4 80 较多、绿色(少量褐色)
表Ⅰ 表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的原因是 。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: 。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 (选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
18.“套管实验”是将一支较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要更多仪器进行的实验,因其具有许多优点,被广泛应用于化学实验中,如图实验为“套管实验”,小试管内塞有沾有无水硫酸铜粉末的棉花糖。请观察实验装置,分析实验原理。
回答下列问题:
(1)该实验的目的是 。
(2)该实验的现象是 ,
B中发生反应的离子方程式是 。
(3)一段时间后结束实验,待装置冷却,取出小试管中固体溶于水,然后滴加1mol/L盐酸,产生CO2的量与盐酸的量的关系如图所示,其中合理的是 。
(4)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g,则原混合物中碳酸钠的质量分数为 。
参考答案:
1.C
【详解】A.氢气燃烧生成水,不会造成环境污染,则氢气作燃料对环境友好无污染,故A正确;
B.碳纤维是无机非金属材料,不属于天然高分子材料,故B正确;
C.由题意可知,铝合金为点火段材料说明合金性质稳定,不易燃烧,故C错误;
D.钠元素焰色反应的焰色为黄色,则火炬飞扬的火焰呈黄色说明配方中含有钠元素,故D正确;
故选C。
2.B
【详解】A.曾侯乙编钟为青铜器,属于合金,故A不符合题意;
B.瓷器的主要成分为硅酸盐,属于无机非金属材料,不是合金,故B符合题意;
C.圆明园兽首为铜合金,故C不符合题意;
D.马踏飞燕(东汉铜奔马)为铜制品,属于合金,故D不符合题意;
故选B。
3.C
【详解】A.Si是一种良好的半导体材料,故用于制造载人飞船上太阳能电池板的半导体材料主要成分为Si,A正确;
B.合金的密度一般比成分金属小,机械强度比成分金属大,故镁铝合金广泛应用于航天领域,因为镁铝合金密度小、强度高,B正确;
C.相对于传统的无机非金属材料玻璃、陶瓷和水泥相比,耐高温陶瓷材料属于新型无机非金属材料,C错误;
D.相对于传统的无机非金属材料玻璃、陶瓷和水泥相比,火箭使用碳纳米管可以减轻火箭质量,这种材料属于新型无机非金属材料,D正确;
故答案为:C。
4.D
【详解】A.银的导电性能比铜还要好,故A错误;
B.钢是铁的合金,含碳量0.03%~2%,钢不是纯铁是铁合金,是混合物,故B错误;
C.合金的性能比它们的组分金属性能好,多数合金的抗腐蚀性比组成它们的纯金属更好,故C错误;
D.焊锡是一种合金,其熔点比组成它的锡、铅的熔点都要低,这也是合金的优点,故D正确;
故答案为D。
5.D
【详解】A.栩栩如生的石雕不是金属材料,故A不选;
B.精妙生动的木雕的主要成分是纤维素,不是金属材料,故B不选;
C.精致的砖雕主要成分是硅酸盐,不是金属材料,故C不选;
D.镶嵌的铜铁铸属于合金,故D选;
答案为D。
6.D
【详解】A.铁具有良好的导热性,而且铁元素也是人体必需的元素,常用铁制作炊具,故A正确;
B.铝具有抗腐蚀性,铝表面易形成致密的氧化膜,可阻止里面的金属进一步被氧化,故B正确;
C.废旧电池中汞等重金属元素会污染环境,不能随意丢弃,需要回收,故C正确;
D.合金的硬度一般大于成分金属的硬度,故D错误;
故选D。
7.B
【详解】A.氯气与水生成的次氯酸、臭氧、二氧化氯等均具有强氧化性,能使蛋白质变性,则氯气、臭氧、二氧化氯都可用于饮用水的杀菌消毒, A正确;
B.工业上用氯气与石灰乳反应制取漂白粉,B错误;
C.电子在基态和激发态之间的跃迁会引起能量的变化,并以光的形式体现,所以霓虹灯光、激光、焰火都与原子核外电子跃迁释放能量有关,C正确;
D.镁合金具有密度较小、强度较大,耐腐蚀的优点,可用于制造火箭、导弹、 飞机部件,D正确;
故选B。
8.B
【详解】A.铝合金具有质地轻、强度高、抗腐蚀能力强等特点,可用于制造高铁车厢等,A正确;
B.钛合金是金属材料,B错误;
C.不锈钢是铁与镍、铬等形成的合金,C正确;
D.后(司)母戊鼎为商代后期的青铜器,属于铜合金制品,D正确;
故选B。
9.C
【详解】A.生铁是铁碳合金,熔点比熟铁低,故A错误;
B.锻打成钢时既发生物理变化又发生化学变化,故B错误;
C.钢是以铁为主的含碳合金,故C正确;
D.熟铁在三者中含碳量最低,故D错误;
故选C。
10.B
【详解】A.东莞莞香所用的常绿乔木含有纤维素,是天然有机高分子,A正确;
B.佛山醒狮所用的铜锣是金属材料,不是高分子,B错误;
C.潮汕剪纸所用的牛皮含有蛋白质,是天然有机高分子,C正确;
D.粤绣用的孔雀毛含有蛋白质,是天然有机高分子,D正确;
故合理选项为B。
11.错误
【详解】氧化铜是黑色物质,不能作为红色颜料,错误;
12.正确
【详解】合金的熔点比它的各成分金属的熔点都低,故上述说法正确;
13.正确
【详解】对压电陶瓷挤压或拉伸时,它的两端就会形成一定的电压,并且压电陶瓷还能把电能转换成超声振动,所以压电陶瓷能够实现机械能和电能的互相转化,故正确。
14.错误
【详解】向CuSO4溶液中滴入过量NaOH溶液充分反应后生成氢氧化铜,氢氧化铜受热易分解,则将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物体为黑色氧化铜,故答案为:错误。
15.错误
【详解】既可与酸反应,又可与碱反应,为两性氧化物,所以能与酸反应的氧化物,不一定是碱性氧化物;
故答案为错误。
16. FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4 ② 将装置A中的水蒸气带走;同时防止FeC2O4冷却时被氧化 3FeC2O4 Fe3O4 + 4CO↑+ 2CO2↑ C E (C) F G C H
【详解】(1)硫酸亚铁溶液和草酸反应的化学方程式是FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4;
(2)①向试管中加入几滴KSCN溶液,溶液不变红,不能说明肯定存在Fe2+;向试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀,说明肯定存在Fe2+;草酸根离子、Fe2+均能与紫红色酸性KMnO4溶液反应,不能说明肯定存在Fe2+;故答案选②。
(3)①在无氧环境中进行反应,防止FeC2O4冷却时被氧化,同时将装置A中的水蒸气转移出A装置;②m(H2O)=(m3-m1)g,m(FeC2O4)= (m2-m3)g,根据FeC2O4·xH2O= FeC2O4 + xH2O反应可知:144:18x=(m2-m3)g:(m3-m1)g,x=;
(4)①由于分解后有磁性的黑色化合物生成,该化合物为Fe3O4,铁元素化合价有变化,说明分解过程中发生了氧化还原反应,化学方程式为:3FeC2O4 Fe3O4 + 4CO↑+ 2CO2↑;
②生成的气体先通过澄清石灰水来证明二氧化碳的存在,再通过浓的氢氧化钠吸收二氧化碳,再通过澄清石灰水来证明二氧化碳已吸收完全,气体经干燥灼热的氧化铜,将产生后气体澄清石灰水来证明又生成了二氧化碳,最后进行尾气处理;依次连接的合理顺序为A、C E (C) F G C H。
17.(1) n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1 75℃有少量孔雀石受热分解为CuO
(2) 打开活塞K,继续通一段时间空气 除去空气中的CO2和H2O 偏小 BC、BD、CD 5Cu(OH)2·2CuCO3
【详解】(1)①根据表2可知,温度为75℃时,生成的孔雀石,因此温度应该控制在75℃。根据表1控制,当碳酸钠溶液的体积是2.0ml时,生成的孔雀石多,此时n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1;
②80℃时,所制得的孔雀石有少量褐色物质,孔雀石受热易分解,所以温度过高时,Cu(OH)2受热分解为CuO;
答案:n[Cu(NO3)2]:n(NaOH) : n(Na2CO3)=2:2:1;75℃有少量孔雀石受热分解为CuO;
(2)微粒把反应中产生的CO2和水蒸气全部被吸收,再冷却时,应该继续通一段时间空气至装置冷却 。
①由于空气中含有水蒸气和CO2,所以利用碱石灰来除去空气中的CO2和H2O。若无装置E,则D装置质量会偏大,导致CO2的质量偏多,所以x/y的值将偏小;
②要计算x/y的值,则需要知道生成物水和CO2的质量。由于反应后玻璃管中残留固体质量是氧化铜,所以正确的组合是BC、BD、CD 。装置C实验后增重9.0g,则水是0.5mol。装置D实验后增重8.8g,则CO2是0.2mol,所以x/y的值2.5,因此化学式5Cu(OH)2·2CuCO3;
答案:打开活塞K,继续通一段时间空气;除去空气中的CO2和H2O;偏小;BC、BD、CD;5Cu(OH)2·2CuCO3。
18. 探究(或证明)碳酸氢钠不稳定,受热易分解产生CO2和H2O,而碳酸钠稳定。 棉花糖上的粉末变蓝;B中澄清石灰水变浑浊 Ca2+ + 2OH- + CO2 = CaCO3 ↓ + H2O BC 32.8%
【详解】(1)由实验装置图可知:两个试管内分别装有Na2CO3、NaHCO3,给它们加热,然后用澄清的石灰水来检验CO2的产生,所以该实验的目的是探究(或证明)碳酸氢钠不稳定,受热易分解产生CO2和H2O,而碳酸钠稳定;来探究二者的热稳定性的相对大小。故答案:探究(或证明)碳酸氢钠不稳定,受热易分解产生CO2和H2O,而碳酸钠稳定。
(2)小试管内塞有沾有无水硫酸铜粉末的棉花糖,硫酸铜遇水反应生成CuSO4 5H2O,CuSO4 5H2O呈蓝色,根据化学反应2NaHCO3Na2CO3 +2H2O+CO2↑,所以该实验的现象是棉花糖上的粉末变蓝;B中澄清石灰水变浑浊。CO2与Ca(OH)2反应生成碳酸钙白色沉淀和水,所以B中发生反应的离子方程式是Ca2++2OH-+CO2=CaCO3↓+H2O。故答案:棉花糖上的粉末变蓝;B中澄清石灰水变浑浊;Ca2+ + 2OH- + CO2 = CaCO3 ↓ + H2O。
(3)NaHCO3不稳定,受热分解。向固体中加入HCl时首先发生反应:Na2CO3+HCl=NaCl+NaHCO3;无气体产生,当该反应完全后,再发生反应 NaHCO3+HCl=NaCl+H2O+ CO2↑,放出气体。因此,若NaHCO3完全分解,则两步消耗的HCl的物质的量相等,体积也相等。若它部分分解,则发生第一步消耗的HCl就比第二步少些。B为部分分解的图象;C为完全分解的图象。答案选BC。
(4)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g,沉淀的物质的量为0.04mol,即反应生成CO2 0.04mol,根据化学反应2NaHCO3Na2CO3 +2H2O+CO2↑,混合物中碳酸氢钠的物质的量为0.08mol,质量为0.08mol×84g/mol=6.72g,碳酸钠的质量为10-6.72=3.28g,则原混合物中碳酸钠的质量分数=×100%=32.8%。故答案:32.8%。
