化学人教版(2019)必修第二册7.3.2乙酸(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.2乙酸(共20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-03 00:00:00 | ||
图片预览





文档简介
(共20张PPT)
必修第二册 第七章节 有机化合物
第三节 乙醇与乙酸
第二课时 乙酸(第一课时)
教学目的:
1.通过乙酸的结构及其主要性质与应用,认识有机化学中羧基与其性质的关系。
2. 通过重要实验酯化反应的演示,掌握实验原理及实验操作要点。
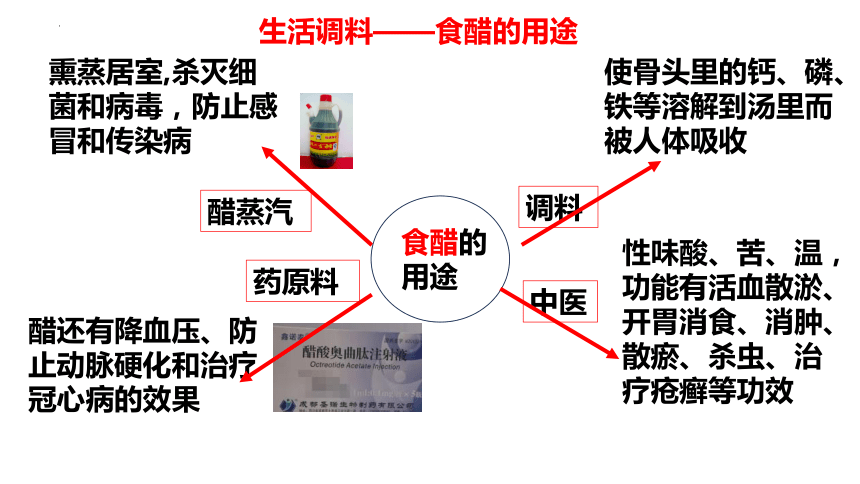
熏蒸居室,杀灭细菌和病毒,防止感冒和传染病
醋蒸汽
使骨头里的钙、磷、铁等溶解到汤里而被人体吸收
调料
醋还有降血压、防止动脉硬化和治疗冠心病的效果
药原料
食醋的用途
生活调料——食醋的用途
中医
性味酸、苦、温,功能有活血散淤、开胃消食、消肿、散瘀、杀虫、治疗疮癣等功效
1.食醋含乙酸3%~5%,纯乙酸是一种有强烈刺激性气味的无色液体。
3. 熔点16.6 ℃,温度低于熔点时,乙酸凝结成晶体,所以纯净的乙酸又称冰醋酸。
[动脑筋] 在冬天室温较低时,实验室的中无水乙酸就会凝结成像冰一样的晶体。你将如何从试剂瓶中取出无水乙酸
乙酸
熔点: 16.6 ℃
沸点: 118 ℃
密度: 1.05g/cm3
2. 乙酸易溶于水和乙醇。沸点低,易挥发,因此常用来醋酸蒸气用来环境消毒。
学习任务一 观察体验乙酸的物理性质
学习任务二、掌握乙酸的分子结构
乙酸
C2H4O2
分子式
结构式
C
C
O
H
H
H
H
O
球棍模型
氧
酸
羧基—COOH
官能团
CH3COOH
结构简式
Yang suan suo
比例模型
一、乙酸是一元弱酸,具有酸的通性
学习任务三、乙酸的化学性质
CH3COOH
CH3COO-+H+
电离方程式:
1.与指示剂反应: 使紫色石蕊试液变红
2.与活泼金属反应: 产生氢气
3.与金属氧化物反应
4.与碱作用
5.与盐作用
【思考讨论】
1.抽水马桶用久后会出现水垢(主要成分是CaCO3) ,家庭主妇常用食醋浸泡可以清除。请写出相应的化学方程式?
2CH3COOH + CaCO3 (CH3COO)2Ca +CO2↑+H2O
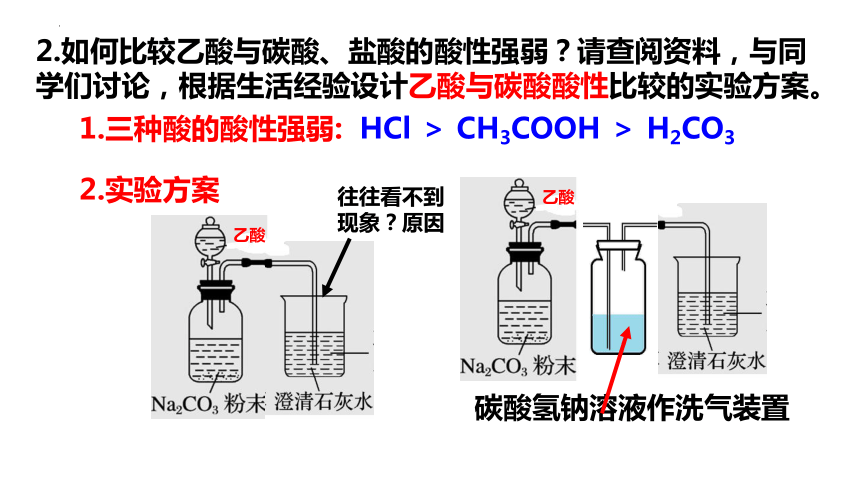
2.如何比较乙酸与碳酸、盐酸的酸性强弱?请查阅资料,与同学们讨论,根据生活经验设计乙酸与碳酸酸性比较的实验方案。
1.三种酸的酸性强弱: HCl > CH3COOH > H2CO3
碳酸氢钠溶液作洗气装置
乙酸
乙酸
2.实验方案
往往看不到现象?原因
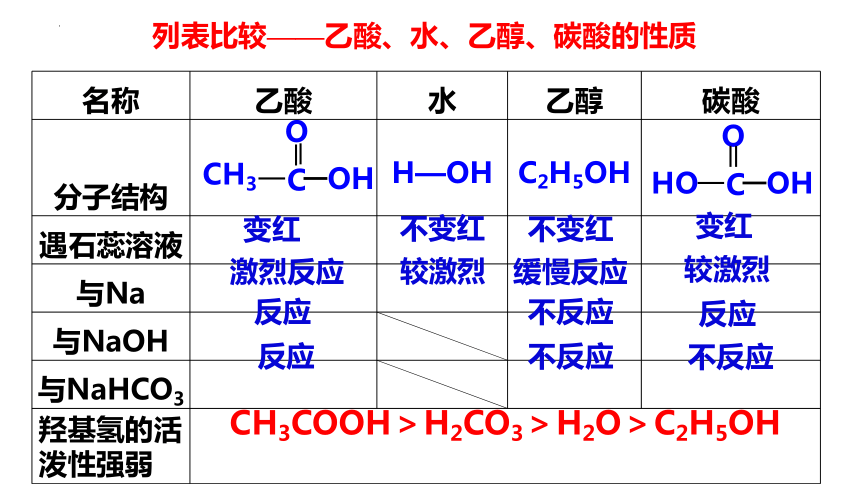
名称 乙酸 水 乙醇 碳酸
分子结构 H—OH C2H5OH
遇石蕊溶液
与Na
与NaOH
与NaHCO3
羟基氢的活泼性强弱 变红
不变红
不变红
变红
激烈反应
较激烈
缓慢反应
较激烈
反应
不反应
反应
CH3COOH>H2CO3>H2O>C2H5OH
C
O
HO
H
O
CH3
C
O
H
O
列表比较——乙酸、水、乙醇、碳酸的性质
反应
不反应
不反应
【课堂练习】
1.实验室有乙醇与乙酸二瓶无色液体,怎样用化学方法加以鉴别?
提示①利用乙酸的酸性:
a.紫色石蕊试液 b.碳酸钠粉末 c.锌粉 d.CuO固体
②利用乙醇的还原性
如红热的氧化铜固体
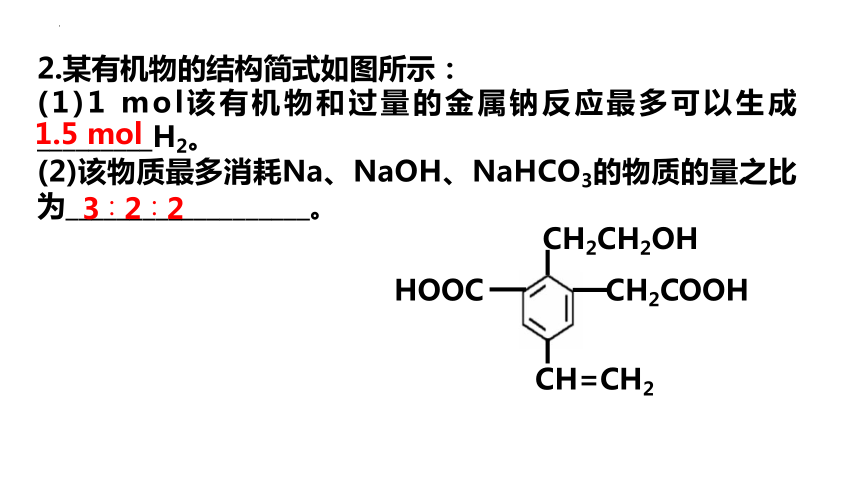
2.某有机物的结构简式如图所示:
(1)1 mol该有机物和过量的金属钠反应最多可以生成_________H2。
(2)该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为___________________。
1.5 mol
3∶2∶2
CH2COOH
CH2CH2OH
CH=CH2
HOOC
“酒是陈的香”
古代酿酒工艺中的踩窖、封窖、勾调、陈放四个环节,其中陈放的化学原理是什么?
陈放数十年
【思考讨论】
红烧带腥的河鱼时常加醋(CH3COOH),同时再加点料酒(CH3CH2OH),这样鱼的味道就变得无腥、香醇。为什么?
2.酯化反应
【实验7-6】在一支试管中加入3 mL 乙醇,然后边振荡试管边加慢慢加入2 mL浓硫酸和2mL乙酸 ,在加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸汽经导管通入饱和碳酸钠液面之上 ,观察现象 。
饱和碳酸钠液面上出现分层,上层是呈无色有酯香味油状液体 ;
实验现象记录:
学习任务三、乙酸的化学性质
2.酯化反应的原理:
CH3COOH + C2H5OH CH3COOC2H5+H2O
浓H2SO4
▲
乙酸 无水乙醇
这种酸和醇反应生成酯和水的反应,叫做酯化反应。
酯化反应是可逆反应,1mol乙酸和1mol乙醇充分反应不能生成得到1mol乙酸乙酯和1mol的水。
乙酸乙酯(有果香味的无色油状液体)
学习任务三、乙酸的化学性质
酯化反应也属于取代反应。
酯化反应实验仪器使用及注意点
1.液体的混合顺序:
先2ml乙醇,再加入3ml浓硫酸,振荡待冷却后,再加入3ml乙酸。
2. 浓硫酸的作用是什么?用酒精灯加热的目的?
a.催化剂(加快反应速率)
b.吸水剂(增大酯生成的程度)
a. 升高温度(加快反应速率)
b.将生成的乙酸乙酯及时蒸出(增大酯生成的程度)
3.长导气管末端位置为什么不能插入饱和碳酸钠液面以下?
为了防止倒吸
试剂 浓硫酸 乙醇 乙酸 乙酸乙酯
沸点(℃) 440℃ 78.5℃ 118℃ 77.1℃
液体的成份是混有乙酸与乙醇的乙酸乙酯,
不能用大火加热,防止乙酸、乙醇挥发降低产率。
4.实验过程中要求用酒精灯小火加热。根据下表分析,酯化反应时从长导气管出来的液体成份是什么?
5. 饱和Na2CO3溶液的作用是什么?最后用什么方法分离得到酯?
反应乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。
乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离得到。
酿酒工艺中陈放的化学原理是什么?
【思考与结论】
陈放数十年
2CH3CH2OH+O2 2CH3CHO+2H2O
生物菌
陶制酒缸虽然是密封,但还是有微量的氧气渗入,这些氧气会将乙醇氧化成乙酸,乙酸和乙醇再反应生成乙酸乙酯,这是白酒香味的主要来源,所以陈酿时间越久,香味也就越浓。
2CH3CHO+O2 2CH3COOH
生物菌
CH3COOH + C2H5OH CH3COOC2H5+H2O
乙酸 乙醇 乙酸乙酯
生物菌
任务四——探究酯化反应可能的反应方式
a
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
可能一
可能二
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
机理1:酸脱羟基醇脱氢
机理2:醇脱羟基酸脱氢
CH3 C OH + H 18O C2H5
浓H2SO4
=
O
CH3 C 18O C2H5 + H2O
=
O
同位素示踪
实质:
“酸脱羟基醇脱氢”
低级酯是具有芳香气味的液体,广泛存在于各种水果和花草中。
【生活常识】
C O
=
O
酯类物质的官能团是酯基:
或写成—COOR
CH3-C-O-C2H5 + H2O
O
O
CH3-C-OH + C2H5OH
一定条件下,酯能水解生成酸与醇:
稀硫酸
有机化工原料
乙酸的用途
香料、
染料、
农药、
喷漆溶剂等
乙酸制药,降血压、防止动脉硬化和治疗冠心病的效果
药原料
醋酸纤维、
合成纤维等
乙酸
乙酸的分子组成
结构简式
结构式
分子式
官能团
CH3COOH
乙酸的物理性质
C
C
O
H
H
H
H
O
羧基—COOH
C2H4O2
易溶于水
有刺激性气味的液体
熔点16.6 ℃,又称冰醋酸。
乙酸、乙醇的分离
化学性质
酸的通性
酯化反应
碳酸钠溶液
乙酸钠、乙醇,蒸馏
酸的五大通性
课堂小结
必修第二册 第七章节 有机化合物
第三节 乙醇与乙酸
第二课时 乙酸(第一课时)
教学目的:
1.通过乙酸的结构及其主要性质与应用,认识有机化学中羧基与其性质的关系。
2. 通过重要实验酯化反应的演示,掌握实验原理及实验操作要点。
熏蒸居室,杀灭细菌和病毒,防止感冒和传染病
醋蒸汽
使骨头里的钙、磷、铁等溶解到汤里而被人体吸收
调料
醋还有降血压、防止动脉硬化和治疗冠心病的效果
药原料
食醋的用途
生活调料——食醋的用途
中医
性味酸、苦、温,功能有活血散淤、开胃消食、消肿、散瘀、杀虫、治疗疮癣等功效
1.食醋含乙酸3%~5%,纯乙酸是一种有强烈刺激性气味的无色液体。
3. 熔点16.6 ℃,温度低于熔点时,乙酸凝结成晶体,所以纯净的乙酸又称冰醋酸。
[动脑筋] 在冬天室温较低时,实验室的中无水乙酸就会凝结成像冰一样的晶体。你将如何从试剂瓶中取出无水乙酸
乙酸
熔点: 16.6 ℃
沸点: 118 ℃
密度: 1.05g/cm3
2. 乙酸易溶于水和乙醇。沸点低,易挥发,因此常用来醋酸蒸气用来环境消毒。
学习任务一 观察体验乙酸的物理性质
学习任务二、掌握乙酸的分子结构
乙酸
C2H4O2
分子式
结构式
C
C
O
H
H
H
H
O
球棍模型
氧
酸
羧基—COOH
官能团
CH3COOH
结构简式
Yang suan suo
比例模型
一、乙酸是一元弱酸,具有酸的通性
学习任务三、乙酸的化学性质
CH3COOH
CH3COO-+H+
电离方程式:
1.与指示剂反应: 使紫色石蕊试液变红
2.与活泼金属反应: 产生氢气
3.与金属氧化物反应
4.与碱作用
5.与盐作用
【思考讨论】
1.抽水马桶用久后会出现水垢(主要成分是CaCO3) ,家庭主妇常用食醋浸泡可以清除。请写出相应的化学方程式?
2CH3COOH + CaCO3 (CH3COO)2Ca +CO2↑+H2O
2.如何比较乙酸与碳酸、盐酸的酸性强弱?请查阅资料,与同学们讨论,根据生活经验设计乙酸与碳酸酸性比较的实验方案。
1.三种酸的酸性强弱: HCl > CH3COOH > H2CO3
碳酸氢钠溶液作洗气装置
乙酸
乙酸
2.实验方案
往往看不到现象?原因
名称 乙酸 水 乙醇 碳酸
分子结构 H—OH C2H5OH
遇石蕊溶液
与Na
与NaOH
与NaHCO3
羟基氢的活泼性强弱 变红
不变红
不变红
变红
激烈反应
较激烈
缓慢反应
较激烈
反应
不反应
反应
CH3COOH>H2CO3>H2O>C2H5OH
C
O
HO
H
O
CH3
C
O
H
O
列表比较——乙酸、水、乙醇、碳酸的性质
反应
不反应
不反应
【课堂练习】
1.实验室有乙醇与乙酸二瓶无色液体,怎样用化学方法加以鉴别?
提示①利用乙酸的酸性:
a.紫色石蕊试液 b.碳酸钠粉末 c.锌粉 d.CuO固体
②利用乙醇的还原性
如红热的氧化铜固体
2.某有机物的结构简式如图所示:
(1)1 mol该有机物和过量的金属钠反应最多可以生成_________H2。
(2)该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为___________________。
1.5 mol
3∶2∶2
CH2COOH
CH2CH2OH
CH=CH2
HOOC
“酒是陈的香”
古代酿酒工艺中的踩窖、封窖、勾调、陈放四个环节,其中陈放的化学原理是什么?
陈放数十年
【思考讨论】
红烧带腥的河鱼时常加醋(CH3COOH),同时再加点料酒(CH3CH2OH),这样鱼的味道就变得无腥、香醇。为什么?
2.酯化反应
【实验7-6】在一支试管中加入3 mL 乙醇,然后边振荡试管边加慢慢加入2 mL浓硫酸和2mL乙酸 ,在加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸汽经导管通入饱和碳酸钠液面之上 ,观察现象 。
饱和碳酸钠液面上出现分层,上层是呈无色有酯香味油状液体 ;
实验现象记录:
学习任务三、乙酸的化学性质
2.酯化反应的原理:
CH3COOH + C2H5OH CH3COOC2H5+H2O
浓H2SO4
▲
乙酸 无水乙醇
这种酸和醇反应生成酯和水的反应,叫做酯化反应。
酯化反应是可逆反应,1mol乙酸和1mol乙醇充分反应不能生成得到1mol乙酸乙酯和1mol的水。
乙酸乙酯(有果香味的无色油状液体)
学习任务三、乙酸的化学性质
酯化反应也属于取代反应。
酯化反应实验仪器使用及注意点
1.液体的混合顺序:
先2ml乙醇,再加入3ml浓硫酸,振荡待冷却后,再加入3ml乙酸。
2. 浓硫酸的作用是什么?用酒精灯加热的目的?
a.催化剂(加快反应速率)
b.吸水剂(增大酯生成的程度)
a. 升高温度(加快反应速率)
b.将生成的乙酸乙酯及时蒸出(增大酯生成的程度)
3.长导气管末端位置为什么不能插入饱和碳酸钠液面以下?
为了防止倒吸
试剂 浓硫酸 乙醇 乙酸 乙酸乙酯
沸点(℃) 440℃ 78.5℃ 118℃ 77.1℃
液体的成份是混有乙酸与乙醇的乙酸乙酯,
不能用大火加热,防止乙酸、乙醇挥发降低产率。
4.实验过程中要求用酒精灯小火加热。根据下表分析,酯化反应时从长导气管出来的液体成份是什么?
5. 饱和Na2CO3溶液的作用是什么?最后用什么方法分离得到酯?
反应乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。
乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离得到。
酿酒工艺中陈放的化学原理是什么?
【思考与结论】
陈放数十年
2CH3CH2OH+O2 2CH3CHO+2H2O
生物菌
陶制酒缸虽然是密封,但还是有微量的氧气渗入,这些氧气会将乙醇氧化成乙酸,乙酸和乙醇再反应生成乙酸乙酯,这是白酒香味的主要来源,所以陈酿时间越久,香味也就越浓。
2CH3CHO+O2 2CH3COOH
生物菌
CH3COOH + C2H5OH CH3COOC2H5+H2O
乙酸 乙醇 乙酸乙酯
生物菌
任务四——探究酯化反应可能的反应方式
a
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
可能一
可能二
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
机理1:酸脱羟基醇脱氢
机理2:醇脱羟基酸脱氢
CH3 C OH + H 18O C2H5
浓H2SO4
=
O
CH3 C 18O C2H5 + H2O
=
O
同位素示踪
实质:
“酸脱羟基醇脱氢”
低级酯是具有芳香气味的液体,广泛存在于各种水果和花草中。
【生活常识】
C O
=
O
酯类物质的官能团是酯基:
或写成—COOR
CH3-C-O-C2H5 + H2O
O
O
CH3-C-OH + C2H5OH
一定条件下,酯能水解生成酸与醇:
稀硫酸
有机化工原料
乙酸的用途
香料、
染料、
农药、
喷漆溶剂等
乙酸制药,降血压、防止动脉硬化和治疗冠心病的效果
药原料
醋酸纤维、
合成纤维等
乙酸
乙酸的分子组成
结构简式
结构式
分子式
官能团
CH3COOH
乙酸的物理性质
C
C
O
H
H
H
H
O
羧基—COOH
C2H4O2
易溶于水
有刺激性气味的液体
熔点16.6 ℃,又称冰醋酸。
乙酸、乙醇的分离
化学性质
酸的通性
酯化反应
碳酸钠溶液
乙酸钠、乙醇,蒸馏
酸的五大通性
课堂小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
