化学人教版(2019)选择性必修2 3.3.2离子晶体(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.2离子晶体(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 34.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-04 14:31:58 | ||
图片预览







文档简介
(共21张PPT)
第三节 金属晶体与离子晶体
课时 2 离子晶体
1. 借助离子晶体等模型认识晶体的结构特点
2. 认识离子晶体的物理性质与晶体结构的关系
食盐(NaCl),厨房最常见的调味品,你能说出它的哪些物理性质?
烧烤、爆炒时加入食盐,食盐不会熔化,说明什么问题?
如何从微观角度解释?
一、离子键
1. 概念:
阴、阳离子之间通过静电作用形成的化学键
2. 实质:
静电作用(引力+斥力)
+11
2 8
+17
8 8 2
Na+
Cl-
静电引力
+11
2 8
+17
8 8 2
静电斥力
静电斥力
3. 特征:
没有方向性和饱和性
二、离子晶体
1. 概念:
由阳离子和阴离子相互作用(离子键)而形成的晶体
2. 成键粒子:
阳离子、阴离子
3. 粒子间作用力:
阴、阳离子间以离子键结合
(可能存在共价键、氢键等)
烧碱 NaOH
胆矾 CuSO4·5H2O
赤铜矿 Cu2O
胆矾 CuSO4·5H2O
萤石 CaF2
重晶石 BaSO4
二、离子晶体
4. 常见的离子晶体:
强碱、活泼金属的氧化物和过氧化物、大多数盐
烧碱 NaOH
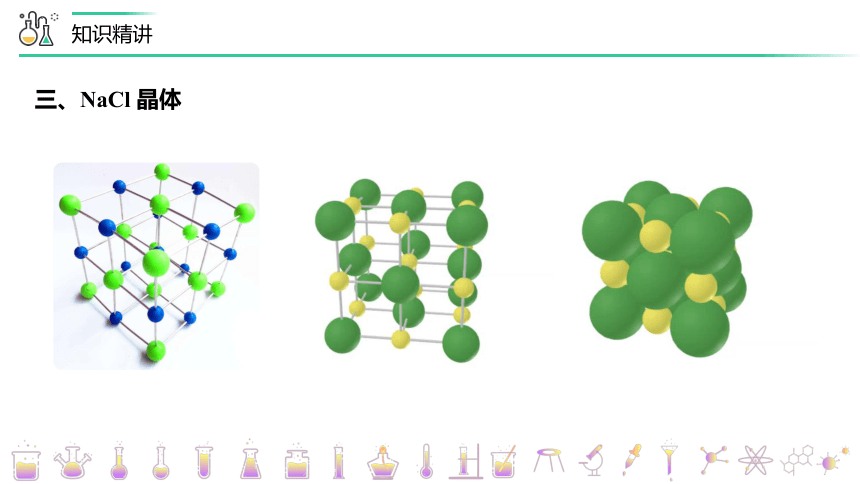
三、NaCl 晶体
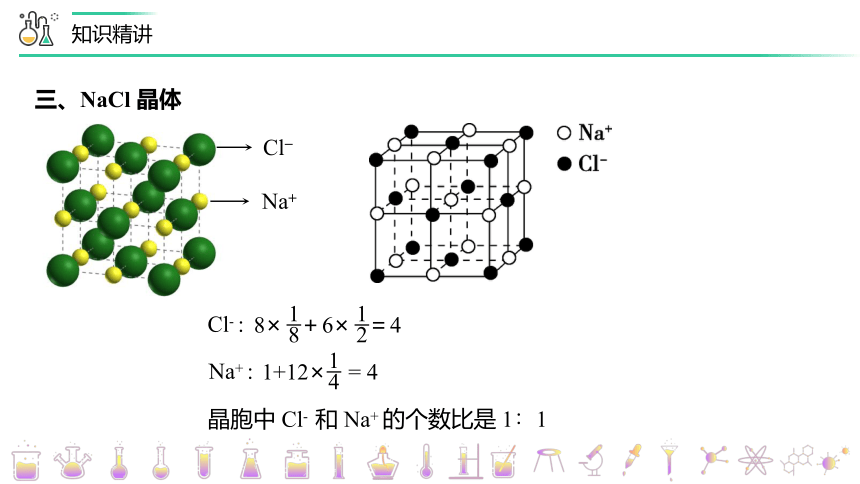
三、NaCl 晶体
Cl
Na+
Cl- :
8
1
2
1
8× +6× =4
Na+ :
4
1
1+12× = 4
晶胞中 Cl- 和 Na+ 的个数比是 1∶1
三、NaCl 晶体
Na+ 周围距离最近的Cl- 有几个?
1
2
3
4
5
6
6 个
四、CsCl 晶体
Cl
Cs+
Cl- :
8
1
8× =1
Cs+ :
晶胞中 Cl- 和 Cs+ 的个数比是 1∶1
1
Cs+ 周围距离最近的 Cl- 有几个?
8 个
五、离子晶体的物理性质
1. 熔、沸点:
一般来说,离子晶体具有较高的熔、沸点,难挥发
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量
离子晶体 熔点/℃ 沸点/℃
NaCl 801 1413
CsCl 645 1290
① 原因:
② 影响因素:
阴、阳离子的电荷数越多,离子半径越小,熔、沸点越高
Na+、Cs+所带电荷一样,但 Na+的半径小于 Cs+的半径,NaCl 中离子键强于 CsCl 中离子键,所以 NaCl 的熔点高于 CsCl 的熔点
五、离子晶体的物理性质
2. 硬度:
离子晶体的硬度较大,难于压缩。
五、离子晶体的物理性质
3. 导电性:
离子晶体不导电,溶于水或熔融态能导电。
五、离子晶体的物理性质
4. 溶解性:
大多数易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯、CCl4 等)
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
知识点都掌握了吗?来做几道题检测下~
【例1】下列物质的晶体属于离子晶体的是( )
A.苛性钾 B.碘化氢 C.硫酸 D.醋酸
【变1】下列晶体分类中正确的是( )
题型一:离子晶体的判断
A
C
选项 离子晶体 共价晶体 分子晶体 金属晶体
A NH4Cl Ar C6H12O6 生铁
B H2SO4 Si S Hg
C CH3COONa SiO2 I2 Fe
D Ba(OH)2 金刚石 普通玻璃 Cu
【例2】下列性质中,可以说明某晶体是离子晶体的是( )
A.具有较高的熔点 B.固体不导电,水溶液可导电
C.可溶于水 D.固体不导电,熔融状态可导电
【变2】具有下列性质的物质属于离子晶体的是( )
A.熔点 1 070 ℃,易溶于水,其水溶液和熔融状态均能导电
B.熔点 10.31 ℃,液态不导电,水溶液能导电
C.能溶于 CCl4,熔点 112.8 ℃,沸点 444.6 ℃
D.熔点 97.81 ℃,质软,导电,密度 0.97 g·cm-3
题型二:离子晶体的性质
D
A
【例3】在离子晶体中,阴、阳离子按一定的规律进
行排列,如图甲是 NaCl 的晶胞结构。在离子晶体中,
阴、阳离子近似具有球形对称结构,可看作是不等
径的刚性圆球,并彼此相切,如图乙。已知a为常数。
(1)NaCl 晶体中,每个Na+同时吸引___个Cl-;Na+与Cl-的数目之比为___。
(2)Na+半径与Cl-半径之比为______________(已知=1.414)。
(3)若a=5.6×10-8 cm,NaCl晶体的密度为_____________(已知5.63=175.6,M(NaCl)=58.5 g·mol-1)。
题型三:离子晶体的计算
6
1:1
0.414∶1
2.2 g·cm-3
知识导图
第三节 金属晶体与离子晶体
课时 2 离子晶体
1. 借助离子晶体等模型认识晶体的结构特点
2. 认识离子晶体的物理性质与晶体结构的关系
食盐(NaCl),厨房最常见的调味品,你能说出它的哪些物理性质?
烧烤、爆炒时加入食盐,食盐不会熔化,说明什么问题?
如何从微观角度解释?
一、离子键
1. 概念:
阴、阳离子之间通过静电作用形成的化学键
2. 实质:
静电作用(引力+斥力)
+11
2 8
+17
8 8 2
Na+
Cl-
静电引力
+11
2 8
+17
8 8 2
静电斥力
静电斥力
3. 特征:
没有方向性和饱和性
二、离子晶体
1. 概念:
由阳离子和阴离子相互作用(离子键)而形成的晶体
2. 成键粒子:
阳离子、阴离子
3. 粒子间作用力:
阴、阳离子间以离子键结合
(可能存在共价键、氢键等)
烧碱 NaOH
胆矾 CuSO4·5H2O
赤铜矿 Cu2O
胆矾 CuSO4·5H2O
萤石 CaF2
重晶石 BaSO4
二、离子晶体
4. 常见的离子晶体:
强碱、活泼金属的氧化物和过氧化物、大多数盐
烧碱 NaOH
三、NaCl 晶体
三、NaCl 晶体
Cl
Na+
Cl- :
8
1
2
1
8× +6× =4
Na+ :
4
1
1+12× = 4
晶胞中 Cl- 和 Na+ 的个数比是 1∶1
三、NaCl 晶体
Na+ 周围距离最近的Cl- 有几个?
1
2
3
4
5
6
6 个
四、CsCl 晶体
Cl
Cs+
Cl- :
8
1
8× =1
Cs+ :
晶胞中 Cl- 和 Cs+ 的个数比是 1∶1
1
Cs+ 周围距离最近的 Cl- 有几个?
8 个
五、离子晶体的物理性质
1. 熔、沸点:
一般来说,离子晶体具有较高的熔、沸点,难挥发
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量
离子晶体 熔点/℃ 沸点/℃
NaCl 801 1413
CsCl 645 1290
① 原因:
② 影响因素:
阴、阳离子的电荷数越多,离子半径越小,熔、沸点越高
Na+、Cs+所带电荷一样,但 Na+的半径小于 Cs+的半径,NaCl 中离子键强于 CsCl 中离子键,所以 NaCl 的熔点高于 CsCl 的熔点
五、离子晶体的物理性质
2. 硬度:
离子晶体的硬度较大,难于压缩。
五、离子晶体的物理性质
3. 导电性:
离子晶体不导电,溶于水或熔融态能导电。
五、离子晶体的物理性质
4. 溶解性:
大多数易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯、CCl4 等)
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
知识点都掌握了吗?来做几道题检测下~
【例1】下列物质的晶体属于离子晶体的是( )
A.苛性钾 B.碘化氢 C.硫酸 D.醋酸
【变1】下列晶体分类中正确的是( )
题型一:离子晶体的判断
A
C
选项 离子晶体 共价晶体 分子晶体 金属晶体
A NH4Cl Ar C6H12O6 生铁
B H2SO4 Si S Hg
C CH3COONa SiO2 I2 Fe
D Ba(OH)2 金刚石 普通玻璃 Cu
【例2】下列性质中,可以说明某晶体是离子晶体的是( )
A.具有较高的熔点 B.固体不导电,水溶液可导电
C.可溶于水 D.固体不导电,熔融状态可导电
【变2】具有下列性质的物质属于离子晶体的是( )
A.熔点 1 070 ℃,易溶于水,其水溶液和熔融状态均能导电
B.熔点 10.31 ℃,液态不导电,水溶液能导电
C.能溶于 CCl4,熔点 112.8 ℃,沸点 444.6 ℃
D.熔点 97.81 ℃,质软,导电,密度 0.97 g·cm-3
题型二:离子晶体的性质
D
A
【例3】在离子晶体中,阴、阳离子按一定的规律进
行排列,如图甲是 NaCl 的晶胞结构。在离子晶体中,
阴、阳离子近似具有球形对称结构,可看作是不等
径的刚性圆球,并彼此相切,如图乙。已知a为常数。
(1)NaCl 晶体中,每个Na+同时吸引___个Cl-;Na+与Cl-的数目之比为___。
(2)Na+半径与Cl-半径之比为______________(已知=1.414)。
(3)若a=5.6×10-8 cm,NaCl晶体的密度为_____________(已知5.63=175.6,M(NaCl)=58.5 g·mol-1)。
题型三:离子晶体的计算
6
1:1
0.414∶1
2.2 g·cm-3
知识导图
