5.2.1氮气及氮氧化物课件 (共25张PPT)人教版(2019)必修第二册
文档属性
| 名称 | 5.2.1氮气及氮氧化物课件 (共25张PPT)人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-04 16:40:38 | ||
图片预览





文档简介
(共25张PPT)
§5.2 氮及其化合物
N
在国民经济和日常生活中,氮气有广泛的用途。首先,利用它“性格孤独”的特点,我们将它充灌在电灯泡里,可防止钨丝的氧化延长灯泡的使用寿命。还可用它来代替惰性气体作焊接金属时的保护气。氮气为什么可以作保护气?
01
氮的存在及氮的固定
01
02
03
04
01
N
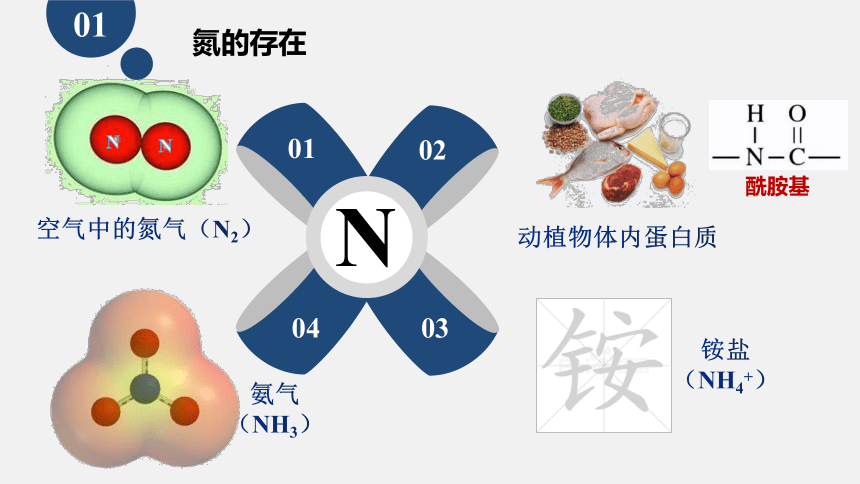
氮的存在
N
N
空气中的氮气(N2)
动植物体内蛋白质
酰胺基
氨气
(NH3)
铵盐
(NH4+)
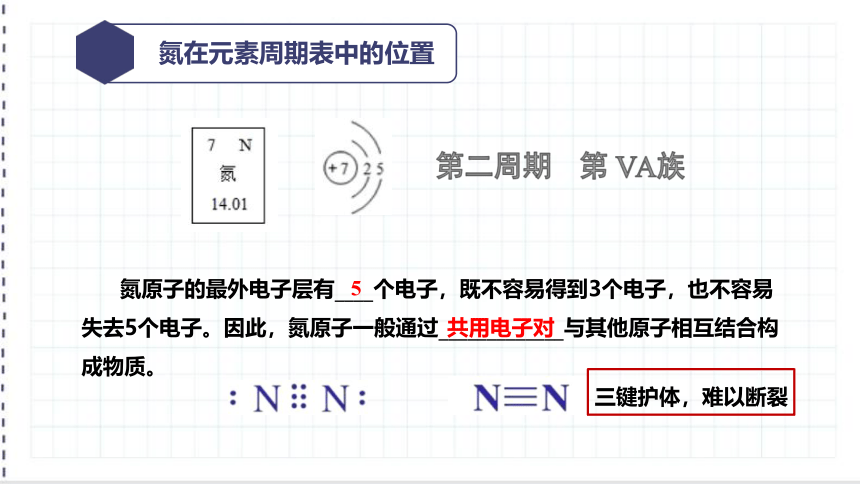
氮在元素周期表中的位置
第二周期 第 ⅤA族
氮原子的最外电子层有____个电子,既不容易得到3个电子,也不容易失去5个电子。因此,氮原子一般通过_____________与其他原子相互结合构成物质。
5
共用电子对
三键护体,难以断裂
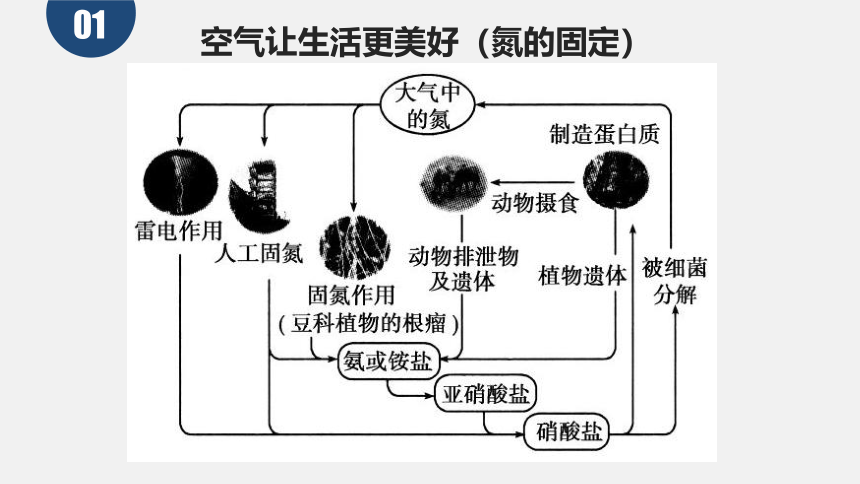
空气让生活更美好(氮的固定)
78% N2
21% O2
01
空气让生活更美好(氮的固定)
01
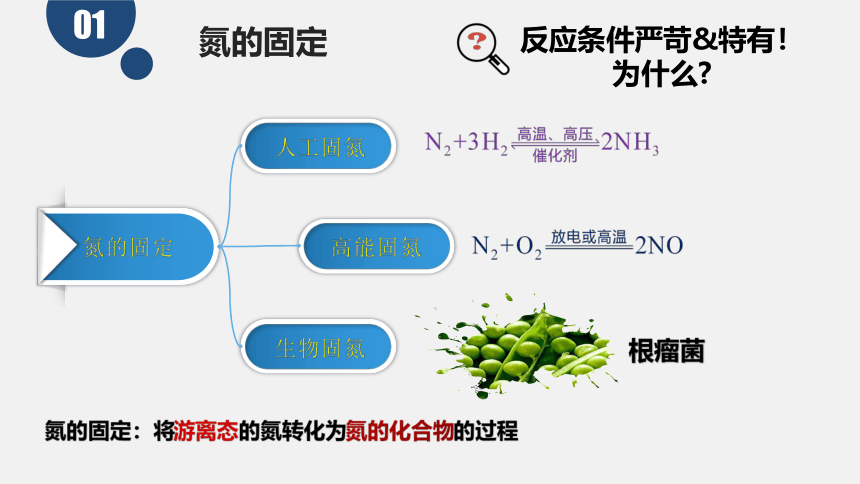
氮的固定
01
氮的固定
人工固氮
高能固氮
生物固氮
氮的固定:将游离态的氮转化为氮的化合物的过程
根瘤菌
反应条件严苛&特有!
为什么
氮的固定:一个反应,三个诺奖
01
弗里茨·哈珀
1918年
博施
1931年
埃特尔
2007年
发明了N2和H2
直接合成氨的方法
改进了反应条件,实现
氨的规模化工业生产
发现了合成氨
的反应机理
氮气的性质
物理性质:N2是一种无色、无味的气体,ρ(N2)<ρ(空气),难溶于水。
化学性质:
(1)稳定性:通常情况下,氮气难以与其他物质发生化学反应,
无法被大多数生物体直接吸收。
(2)氮气与金属或非金属单质的反应
①与金属镁反应:_______________________________。
②与氧气反应:_______________________________。
③与氢气反应:_______________________________。
N2+3H2 2NH3
02
氮氧化物
氮的氧化物
N2O
+1
NO
+2
N2O3
+3
NO2 N2O4
+4
02
N2O5
+5
从左往右,非金属性依次增强!
诺贝尔生理学或医学奖(1998年)
穆拉德
Ferid Murad
弗奇戈特
Robert F.Furchgott
伊格纳罗
Louis J. Ignarro
发现在心血管系统中起信号分子作用的一氧化氮。
一氧化氮在治疗疾病中的突出应用
一氧化氮和二氧化氮
物理性质
物质 颜色、状态 气味 毒性 水溶性
NO 无色气体 无味 有毒 ____溶于水
NO2 _____色气体 _________ ______ ____溶于水
红棕
有刺激性
气味
有毒
不
易
二氧化氮溶于水的实验
实验 操作 在如上图注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 振荡注射器
实验 现象
化学 方程式 二氧化氮溶于水的实验
实验 操作 在如上图注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 振荡注射器
实验 现象 无明显 现象 无色气体变为 红棕色 红棕色气体变浅至消失,有无色气体生成,注射器活塞向内滑动
化学 方程式 2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(工业制硝酸的原理)
如果要将注射器中的NO充分转化,可以采取什么措施?
继续通入过量的空气
工业生产硝酸时,由于NO2与H2O反应会生成HNO3和NO,NO又可与O2反应生成NO2,因此通入适量的氧气可使NO或NO2恰好完全溶于水。
(1)试根据反应:
①3NO2+H2O===2HNO3+NO
②2NO+O2===2NO2
推出NO2与O2的混合气体、NO与O2的混合气体被水完全吸收转化为HNO3的化学方程式:______________________________________,______________________________________________________。
①×2+②得:4NO2+O2+2H2O===4HNO3
①×2+②×3得:4NO+3O2+2H2O===4HNO3
(2)将一支充有12 mL NO2气体的试管倒置于水槽中,充分反应。
①下列图示正确的是___(填字母)。
②若水不能充满试管,需再向试管中缓缓充入O2,现象为
__________________________________,最终充入___mL氧气,
才能使水全部充满。
无色气体变为红棕色,液面逐渐上升
3
C
02
氮氧化物(NOX)性质的应用——工业制硝酸
N2
H2
NH3
O2
O2
NO
NO2
HNO3
H2O
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
4NH3+5O2 4NO+6H2O
催化剂
Δ
N2+3H2 2NH3
催化剂
高温高压
02
氮氧化物(NOX)性质的应用——雷雨发庄稼
N2+O2 = 2NO(无色)
放电
2NO+O2 = 2NO2(红棕色)
3NO2+H2O = 2HNO3+NO
硝酸型酸雨的形成
土壤
氮肥
1.汽车尾气主要含有CO2、CO、SO2、NOx(氮氧化物)等物质,这种尾气逐渐成为城市空气污染的主要来源之一,根据NOx的性质特点,已开发出多种化学治理氮氧化物污染的方法。(1)氮氧化物与环境问题密切相关,可导致___________________________________ 等问题(任填两条)。
(2)已知某硝酸厂排放的尾气中NO、NO2的体积比为1∶1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐,有关反应的化学方程式为 ______________________________________。在该含氮的钠盐中,氮元素的化合价为________。(碱液吸收法)
氮氧化物(NOX)的危害
02
(硝酸型)酸雨、臭氧层空洞、光化学烟雾
NO+NO2+2NaOH=NaNO2+H2O
+3
(3)某氮氧化物和CO在催化剂的作用下充分反应,生成N2和CO2,可消除CO与该氮氧化物的污染。若测得N2和CO2的物质的量之比为1:2,则该氮氧化物的化学式是___。
(4)用氨可将氮氧化物转化为无毒气体,例如:8NH3+6NO2=7N2+12H2O。该反应中的氧化剂是______,还原产物和氧化产物的质量之比为______。如果用氨在催化剂、加热的条件下来处理NO,有关反应的化学方程式为 _____________________。
NO
NO2
3:4
4NH3+5O2===4NO+6H2O
催化剂
△
02
氮氧化物(NOX)的危害
NOX
高效尾气处理装置
02
NO与NO2的制备
实验原理:Cu+4HNO3(浓)=== Cu(NO3)2+2NO2 +2H2O
铜与浓硝酸反应
实验现象:
剧烈反应产生红棕色气体,溶液变为绿色,铜片逐渐减少
铜与稀硝酸反应
实验现象:
缓慢反应生成无色气体,接触空气后变红棕色溶液变为蓝色,铜片逐渐减少。
实验原理:
§5.2 氮及其化合物
N
在国民经济和日常生活中,氮气有广泛的用途。首先,利用它“性格孤独”的特点,我们将它充灌在电灯泡里,可防止钨丝的氧化延长灯泡的使用寿命。还可用它来代替惰性气体作焊接金属时的保护气。氮气为什么可以作保护气?
01
氮的存在及氮的固定
01
02
03
04
01
N
氮的存在
N
N
空气中的氮气(N2)
动植物体内蛋白质
酰胺基
氨气
(NH3)
铵盐
(NH4+)
氮在元素周期表中的位置
第二周期 第 ⅤA族
氮原子的最外电子层有____个电子,既不容易得到3个电子,也不容易失去5个电子。因此,氮原子一般通过_____________与其他原子相互结合构成物质。
5
共用电子对
三键护体,难以断裂
空气让生活更美好(氮的固定)
78% N2
21% O2
01
空气让生活更美好(氮的固定)
01
氮的固定
01
氮的固定
人工固氮
高能固氮
生物固氮
氮的固定:将游离态的氮转化为氮的化合物的过程
根瘤菌
反应条件严苛&特有!
为什么
氮的固定:一个反应,三个诺奖
01
弗里茨·哈珀
1918年
博施
1931年
埃特尔
2007年
发明了N2和H2
直接合成氨的方法
改进了反应条件,实现
氨的规模化工业生产
发现了合成氨
的反应机理
氮气的性质
物理性质:N2是一种无色、无味的气体,ρ(N2)<ρ(空气),难溶于水。
化学性质:
(1)稳定性:通常情况下,氮气难以与其他物质发生化学反应,
无法被大多数生物体直接吸收。
(2)氮气与金属或非金属单质的反应
①与金属镁反应:_______________________________。
②与氧气反应:_______________________________。
③与氢气反应:_______________________________。
N2+3H2 2NH3
02
氮氧化物
氮的氧化物
N2O
+1
NO
+2
N2O3
+3
NO2 N2O4
+4
02
N2O5
+5
从左往右,非金属性依次增强!
诺贝尔生理学或医学奖(1998年)
穆拉德
Ferid Murad
弗奇戈特
Robert F.Furchgott
伊格纳罗
Louis J. Ignarro
发现在心血管系统中起信号分子作用的一氧化氮。
一氧化氮在治疗疾病中的突出应用
一氧化氮和二氧化氮
物理性质
物质 颜色、状态 气味 毒性 水溶性
NO 无色气体 无味 有毒 ____溶于水
NO2 _____色气体 _________ ______ ____溶于水
红棕
有刺激性
气味
有毒
不
易
二氧化氮溶于水的实验
实验 操作 在如上图注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 振荡注射器
实验 现象
化学 方程式 二氧化氮溶于水的实验
实验 操作 在如上图注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 振荡注射器
实验 现象 无明显 现象 无色气体变为 红棕色 红棕色气体变浅至消失,有无色气体生成,注射器活塞向内滑动
化学 方程式 2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(工业制硝酸的原理)
如果要将注射器中的NO充分转化,可以采取什么措施?
继续通入过量的空气
工业生产硝酸时,由于NO2与H2O反应会生成HNO3和NO,NO又可与O2反应生成NO2,因此通入适量的氧气可使NO或NO2恰好完全溶于水。
(1)试根据反应:
①3NO2+H2O===2HNO3+NO
②2NO+O2===2NO2
推出NO2与O2的混合气体、NO与O2的混合气体被水完全吸收转化为HNO3的化学方程式:______________________________________,______________________________________________________。
①×2+②得:4NO2+O2+2H2O===4HNO3
①×2+②×3得:4NO+3O2+2H2O===4HNO3
(2)将一支充有12 mL NO2气体的试管倒置于水槽中,充分反应。
①下列图示正确的是___(填字母)。
②若水不能充满试管,需再向试管中缓缓充入O2,现象为
__________________________________,最终充入___mL氧气,
才能使水全部充满。
无色气体变为红棕色,液面逐渐上升
3
C
02
氮氧化物(NOX)性质的应用——工业制硝酸
N2
H2
NH3
O2
O2
NO
NO2
HNO3
H2O
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
4NH3+5O2 4NO+6H2O
催化剂
Δ
N2+3H2 2NH3
催化剂
高温高压
02
氮氧化物(NOX)性质的应用——雷雨发庄稼
N2+O2 = 2NO(无色)
放电
2NO+O2 = 2NO2(红棕色)
3NO2+H2O = 2HNO3+NO
硝酸型酸雨的形成
土壤
氮肥
1.汽车尾气主要含有CO2、CO、SO2、NOx(氮氧化物)等物质,这种尾气逐渐成为城市空气污染的主要来源之一,根据NOx的性质特点,已开发出多种化学治理氮氧化物污染的方法。(1)氮氧化物与环境问题密切相关,可导致___________________________________ 等问题(任填两条)。
(2)已知某硝酸厂排放的尾气中NO、NO2的体积比为1∶1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐,有关反应的化学方程式为 ______________________________________。在该含氮的钠盐中,氮元素的化合价为________。(碱液吸收法)
氮氧化物(NOX)的危害
02
(硝酸型)酸雨、臭氧层空洞、光化学烟雾
NO+NO2+2NaOH=NaNO2+H2O
+3
(3)某氮氧化物和CO在催化剂的作用下充分反应,生成N2和CO2,可消除CO与该氮氧化物的污染。若测得N2和CO2的物质的量之比为1:2,则该氮氧化物的化学式是___。
(4)用氨可将氮氧化物转化为无毒气体,例如:8NH3+6NO2=7N2+12H2O。该反应中的氧化剂是______,还原产物和氧化产物的质量之比为______。如果用氨在催化剂、加热的条件下来处理NO,有关反应的化学方程式为 _____________________。
NO
NO2
3:4
4NH3+5O2===4NO+6H2O
催化剂
△
02
氮氧化物(NOX)的危害
NOX
高效尾气处理装置
02
NO与NO2的制备
实验原理:Cu+4HNO3(浓)=== Cu(NO3)2+2NO2 +2H2O
铜与浓硝酸反应
实验现象:
剧烈反应产生红棕色气体,溶液变为绿色,铜片逐渐减少
铜与稀硝酸反应
实验现象:
缓慢反应生成无色气体,接触空气后变红棕色溶液变为蓝色,铜片逐渐减少。
实验原理:
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
