化学人教版(2019)选择性必修1 3.3.2溶液中微粒浓度大小比较(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.2溶液中微粒浓度大小比较(共20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 620.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-04 21:58:09 | ||
图片预览








文档简介
(共20张PPT)
第三节 盐类水解
第三章 水溶液中的离子反应与平衡
第2课时 溶液中微粒浓度大小比较
教学目标
1.能用电离理论与水解理论解释离子浓度大小的原因。
2.能运用三个守恒判断溶液中离子浓度的关系。
第三节 盐类的水解
第2课时 溶液中微粒浓度大小比较
一. 两大理论
1.电离理论
1).弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离。
例如氨水溶液中:NH3·H2O、NH4+、OH-、H+浓度的大小关系是:
c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
2).多元弱酸的电离是分步进行的,且第一步电离程度远大于第二步,依次类推。
如H2S溶液中:H2S、HS-、S2-、H+、OH-浓度的大小关系是:
c (H2S) > c (H+) > c (HS–) > c (S2–) > c (OH–)
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
不考虑电离产物的水解
2.水解理论
① 水解是微弱的,水解生成微粒的浓度,一般小于水
解离子的浓度
如:NH4Cl 溶液中:NH3·H2O、NH4+、Cl- 、OH-、H+浓度的大小关系是:
c (Cl–) > c (NH4+) > c (H+) > c (NH3·H2O) > c (OH–)
NH4Cl = NH4+ + Cl-
NH4+ +H2O NH3H2O + H+
② 多元弱酸水解是分步,主要决定第一步
如:Na2CO3 溶液中:
c (Na+) > c (CO32–) > c (OH–) > c (HCO3–) > c (H2CO3)> c (H+)
不考虑水解产物的电离
Na2CO3 =2Na+ + CO3 2-
单水解程度很小,水解产生的离子或分子浓度
远远小于弱离子的浓度。
CO3 2- +H2O HCO3-+ OH-
HCO3- + H2O H2CO3 + OH-
二、三大守恒
1、电荷守恒
溶液中阴离子和阳离子所带的电荷总数相等。
NH4Cl = NH4+ + Cl-
正电荷总数 == 负电荷总数
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
n ( NH4+ ) + n( H+ ) == n( Cl– ) + n( OH– )
NH4+ +H2O NH3H2O + H+
如:Na2CO3 溶液中:
Na2CO3 =2Na+ + CO3 2-
CO3 2- +H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
∵ 正电荷总数 == 负电荷总数
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( CO32–) + c ( HCO3– )
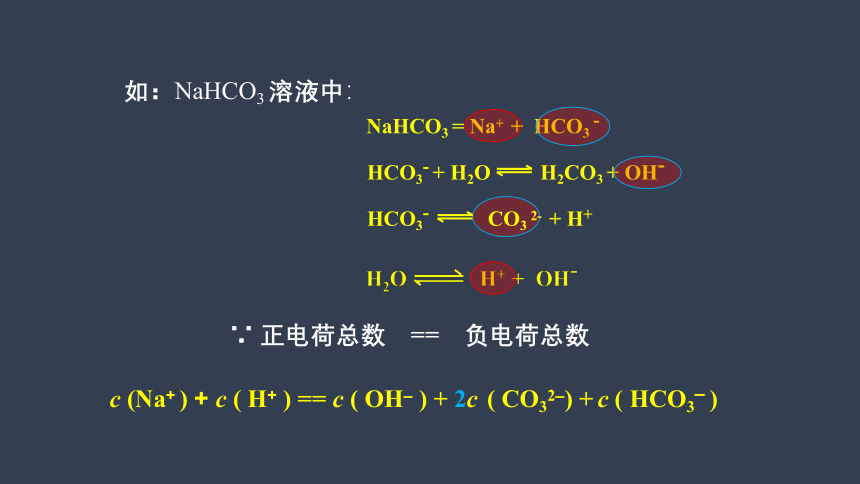
如:NaHCO3 溶液中:
NaHCO3 = Na+ + HCO3 -
HCO3- + H2O H2CO3 + OH-
∵ 正电荷总数 == 负电荷总数
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( CO32–) + c ( HCO3– )
HCO3- CO3 2- + H+
2、物料守恒(元素守恒)
在电解质溶液中,由于某些离子发生电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。
如:Na2CO3 溶液中:
Na2CO3 =2Na+ + CO3 2-
CO3 2- +H2O HCO3-+ OH-
c (Na+ ) = 2c ( CO32–)始
= 2[c ( CO32–)+c ( HCO3–)+c ( H2CO3)]
HCO3- + H2O H2CO3 + OH-
即 c (Na+) : c (C) =2 : 1
如:NaHCO3 溶液中:
NaHCO3 =Na+ + HCO3 -
= c ( HCO3– ) + c ( H2CO3 ) + c ( CO32–)
c (Na+ ) = c ( HCO3–)始
NH4Cl = NH4+ + Cl-
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
3、盐(水解)溶液中的质子守恒
电解质溶液中分子或离子得到或
失去质子(H+)的物质的量应相等。
c ( Cl-) == c ( NH4+ ) + c ( NH3 H2O )
c ( H+ ) == c ( OH– )+ c ( NH3 H2O )
电荷守恒
物料守恒
质子守恒
NH4+ +H2O NH3H2O + H+
理解水溶液中离子平衡的内涵是水溶液中溶质的加入对水的电离的影响这个前提。抓住任何条件下由水电离出的c(H+)水=c(OH-)水,再结合H+和OH-的去向即可得出单一溶质溶液的质子守恒。方便又快捷。
如NH4Cl溶液中存在:
NH4+
H2O
H+
OH-
NH3 H2O
OH-
OH-
c ( H+ )
c ( OH– )+ c ( NH3 H2O )
=
c(H+)水
c(OH-)水
=
如CH3COONa溶液中存在:
CH3COO-
H2O
H+
OH-
CH3COOH
H+
H+
c ( H+ )+c( CH3COOH )
c ( OH– )
=
c(H+)水
c(OH-)水
=
如NaHCO3溶液中存在:
HCO3-
H+
OH-
H+
H2CO3
H+
CO32-
OH-
OH-
c(H+)+c(H2CO3)
c(OH-)+c(CO32-)
=
c(H+)水
c(OH-)水
=
H2O
H+
OH-
CO32-
H2CO3
2H+
HCO3-
H+
H+
c(H+)水
c(OH-)水
=
2c(H2CO3)+c(H2CO3-) +c(H+)
c(OH-)
=
如Na2CO3溶液中存在:
H2O
①判断电解质溶液中各离子浓度的大小关系,要从电解质的电离、盐的水解等方面综合考虑,并注意守恒法的运用(电荷守恒和元素守恒),理清一条思路,掌握分析方法。
三.离子浓度比较
电解质溶液
单一溶液
混合溶液
酸或碱溶液--考虑电离
盐溶液--考虑水解
反应
不过量
过量
生成酸或碱--考虑电离
生成盐--考虑水解
根据过量程度考虑电离或水解
不反应
同时考虑电离和水解
②根据粒子浓度关系式,套用合适守恒式
粒子浓度关系 思考套用公式
一边全为阴离子,另一边全为阳离子 电荷守恒式
一边粒子全含有一种元素,另一边粒子全含另一种元素 物料守恒式
一边粒子能电离H+,另一边粒子能结合H+ 质子守恒式
两边没有明显特征 三守恒式结合
③分清主次关系,不要片面考虑某些混合溶液中可能同时存在水解平衡和电离平衡,需要根据题目提供的溶液酸碱性或一般规律判断究竟是哪一种因素起主导作用。
1、0.1mol/l下列溶液PH值由大到小的顺序是 __________________________
①H2SO4 ② NH3·H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
⑨>③>②>⑥>⑤>④>⑧>⑦>①
2、将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A. c (Cl-) + c (OH-) = c(NH4+) + c (H+)
B. c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C. c(NH4+) > c (Cl--)> c (OH-)> c (H+)
D. c (Cl-)> c (H+) > c (NH4+) > c (OH-)
AC
第三节 盐类水解
第三章 水溶液中的离子反应与平衡
第2课时 溶液中微粒浓度大小比较
教学目标
1.能用电离理论与水解理论解释离子浓度大小的原因。
2.能运用三个守恒判断溶液中离子浓度的关系。
第三节 盐类的水解
第2课时 溶液中微粒浓度大小比较
一. 两大理论
1.电离理论
1).弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离。
例如氨水溶液中:NH3·H2O、NH4+、OH-、H+浓度的大小关系是:
c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
2).多元弱酸的电离是分步进行的,且第一步电离程度远大于第二步,依次类推。
如H2S溶液中:H2S、HS-、S2-、H+、OH-浓度的大小关系是:
c (H2S) > c (H+) > c (HS–) > c (S2–) > c (OH–)
对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。
不考虑电离产物的水解
2.水解理论
① 水解是微弱的,水解生成微粒的浓度,一般小于水
解离子的浓度
如:NH4Cl 溶液中:NH3·H2O、NH4+、Cl- 、OH-、H+浓度的大小关系是:
c (Cl–) > c (NH4+) > c (H+) > c (NH3·H2O) > c (OH–)
NH4Cl = NH4+ + Cl-
NH4+ +H2O NH3H2O + H+
② 多元弱酸水解是分步,主要决定第一步
如:Na2CO3 溶液中:
c (Na+) > c (CO32–) > c (OH–) > c (HCO3–) > c (H2CO3)> c (H+)
不考虑水解产物的电离
Na2CO3 =2Na+ + CO3 2-
单水解程度很小,水解产生的离子或分子浓度
远远小于弱离子的浓度。
CO3 2- +H2O HCO3-+ OH-
HCO3- + H2O H2CO3 + OH-
二、三大守恒
1、电荷守恒
溶液中阴离子和阳离子所带的电荷总数相等。
NH4Cl = NH4+ + Cl-
正电荷总数 == 负电荷总数
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
n ( NH4+ ) + n( H+ ) == n( Cl– ) + n( OH– )
NH4+ +H2O NH3H2O + H+
如:Na2CO3 溶液中:
Na2CO3 =2Na+ + CO3 2-
CO3 2- +H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
∵ 正电荷总数 == 负电荷总数
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( CO32–) + c ( HCO3– )
如:NaHCO3 溶液中:
NaHCO3 = Na+ + HCO3 -
HCO3- + H2O H2CO3 + OH-
∵ 正电荷总数 == 负电荷总数
c (Na+ ) + c ( H+ ) == c ( OH– ) + 2c ( CO32–) + c ( HCO3– )
HCO3- CO3 2- + H+
2、物料守恒(元素守恒)
在电解质溶液中,由于某些离子发生电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。
如:Na2CO3 溶液中:
Na2CO3 =2Na+ + CO3 2-
CO3 2- +H2O HCO3-+ OH-
c (Na+ ) = 2c ( CO32–)始
= 2[c ( CO32–)+c ( HCO3–)+c ( H2CO3)]
HCO3- + H2O H2CO3 + OH-
即 c (Na+) : c (C) =2 : 1
如:NaHCO3 溶液中:
NaHCO3 =Na+ + HCO3 -
= c ( HCO3– ) + c ( H2CO3 ) + c ( CO32–)
c (Na+ ) = c ( HCO3–)始
NH4Cl = NH4+ + Cl-
c ( NH4+ ) + c ( H+ ) == c ( Cl– ) + c ( OH– )
3、盐(水解)溶液中的质子守恒
电解质溶液中分子或离子得到或
失去质子(H+)的物质的量应相等。
c ( Cl-) == c ( NH4+ ) + c ( NH3 H2O )
c ( H+ ) == c ( OH– )+ c ( NH3 H2O )
电荷守恒
物料守恒
质子守恒
NH4+ +H2O NH3H2O + H+
理解水溶液中离子平衡的内涵是水溶液中溶质的加入对水的电离的影响这个前提。抓住任何条件下由水电离出的c(H+)水=c(OH-)水,再结合H+和OH-的去向即可得出单一溶质溶液的质子守恒。方便又快捷。
如NH4Cl溶液中存在:
NH4+
H2O
H+
OH-
NH3 H2O
OH-
OH-
c ( H+ )
c ( OH– )+ c ( NH3 H2O )
=
c(H+)水
c(OH-)水
=
如CH3COONa溶液中存在:
CH3COO-
H2O
H+
OH-
CH3COOH
H+
H+
c ( H+ )+c( CH3COOH )
c ( OH– )
=
c(H+)水
c(OH-)水
=
如NaHCO3溶液中存在:
HCO3-
H+
OH-
H+
H2CO3
H+
CO32-
OH-
OH-
c(H+)+c(H2CO3)
c(OH-)+c(CO32-)
=
c(H+)水
c(OH-)水
=
H2O
H+
OH-
CO32-
H2CO3
2H+
HCO3-
H+
H+
c(H+)水
c(OH-)水
=
2c(H2CO3)+c(H2CO3-) +c(H+)
c(OH-)
=
如Na2CO3溶液中存在:
H2O
①判断电解质溶液中各离子浓度的大小关系,要从电解质的电离、盐的水解等方面综合考虑,并注意守恒法的运用(电荷守恒和元素守恒),理清一条思路,掌握分析方法。
三.离子浓度比较
电解质溶液
单一溶液
混合溶液
酸或碱溶液--考虑电离
盐溶液--考虑水解
反应
不过量
过量
生成酸或碱--考虑电离
生成盐--考虑水解
根据过量程度考虑电离或水解
不反应
同时考虑电离和水解
②根据粒子浓度关系式,套用合适守恒式
粒子浓度关系 思考套用公式
一边全为阴离子,另一边全为阳离子 电荷守恒式
一边粒子全含有一种元素,另一边粒子全含另一种元素 物料守恒式
一边粒子能电离H+,另一边粒子能结合H+ 质子守恒式
两边没有明显特征 三守恒式结合
③分清主次关系,不要片面考虑某些混合溶液中可能同时存在水解平衡和电离平衡,需要根据题目提供的溶液酸碱性或一般规律判断究竟是哪一种因素起主导作用。
1、0.1mol/l下列溶液PH值由大到小的顺序是 __________________________
①H2SO4 ② NH3·H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
⑨>③>②>⑥>⑤>④>⑧>⑦>①
2、将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A. c (Cl-) + c (OH-) = c(NH4+) + c (H+)
B. c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C. c(NH4+) > c (Cl--)> c (OH-)> c (H+)
D. c (Cl-)> c (H+) > c (NH4+) > c (OH-)
AC
