化学人教版(2019)选择性必修2 3.1.2晶胞(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.1.2晶胞(共24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-04 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第三章 晶体结构与性质
第一节 物质的聚集状态与晶体的常识
二、晶胞
人教版(2019版) 化学
选修2 物质结构与性质
1.理解晶胞的含义。
2.学会晶胞中微粒数的计算方法——均摊法。
3.能根据晶胞的结构确定晶体的化学式。
教学目标
晶胞的含义
知识点1
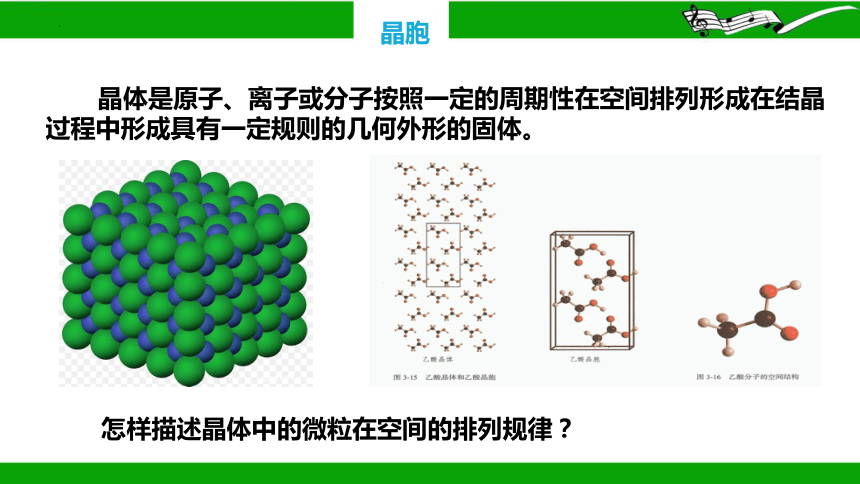
怎样描述晶体中的微粒在空间的排列规律?
晶体是原子、离子或分子按照一定的周期性在空间排列形成在结晶过程中形成具有一定规则的几何外形的固体。
晶胞
晶胞
为了描述晶体在微观空间里原子的排列,无须画出千千万万个原子,
只需在晶体微观空间里取出一个基本的单元即可。这种描述晶体结构的基本单元叫做晶胞。
晶胞
②整块晶体可看作数量巨大的晶胞“无隙并置”而成
①常规的晶胞一般是平行六面体
“无隙”:相邻晶胞之间没有任何间隙。
“并置”:所有晶胞都是平行排列的,取向相同。
正方体 或 长方体
晶胞的特征:
均摊法计算
知识点2
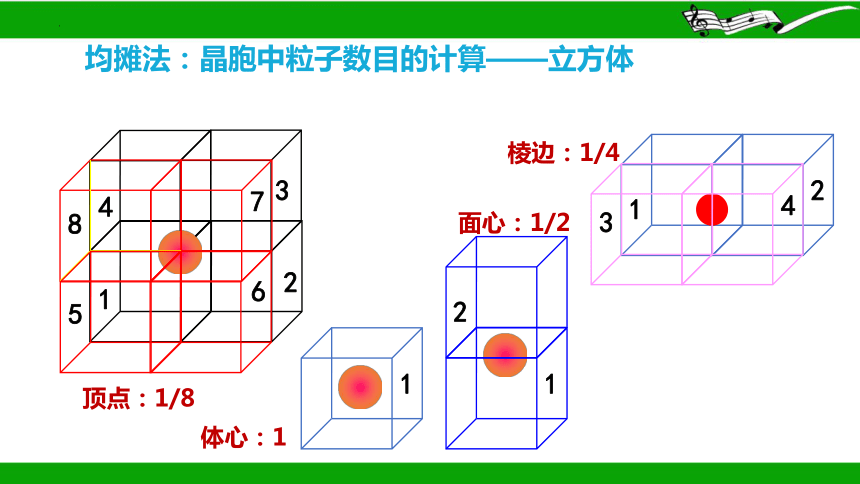
均摊法
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有 属于这个晶胞。
均摊法:晶胞中粒子数目的计算——立方体
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方体
1.长方体(正方体)晶胞中不同位置的粒子数的计算
三棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
均摊法:晶胞中粒子数目的计算——三棱柱
三棱柱
2.正三棱柱晶胞中不同位置的粒子数的计算
均摊法:晶胞中粒子数目的计算——六棱柱
六棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/3
顶点
1/6
六棱柱
3.正六棱柱晶胞中不同位置的粒子数的计算
小结
(1)立方体
(2)三棱柱
(3)六棱柱
体心
1
面心
1/2
棱边
1/4
顶点
1/8
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
体心
1
面心
1/2
棱边
水平1/4 竖1/3
顶点
1/6
常见的立方晶胞中原子数的计算
简单立方
体心立方
面心立方
8× =1
8
1
8× +1=2
8
1
8× +6× =4
2
1
8
1
课堂练习
1.某晶体的一部分如右图所示,这种晶体中A、B、C三种粒子数之比是( )
A.3∶9∶4 B.1∶4∶2
C.2∶9∶4 D.3∶8∶4
B
A
B
C
确定晶体的化学式
知识点3
晶体的化学式表示的是晶体(也可以说是晶胞)中各类原子或离子数目的最简整数比
团簇分子或纳米颗粒与晶胞不同,这两类物质是独立的分子,所有原子均为该分子所有。与晶体中多个晶胞共用原子不相同
晶体化学式的确定
化学式
Cl-
Na+
氯化钠晶胞
=1:1
1. 计算一个NaCl晶胞中含多少Na+和Cl-?
Na+:Cl-
8× +6× =4
2
1
8
1
12× + 1 =4
4
1
离子晶体化学式只表示每个晶胞或晶体中各类粒子的最简整数比
立方晶胞
①Cl-位于 和 ,共有 个
②Na+位于 和 ,共有 个
顶点
面心
4
棱边
体心
4
课堂练习
1.金属钠的一个晶胞的原子数=
2.金属锌的一个晶胞的原子数=
3.I2的一个晶胞的分子数=
4.金刚石的一个晶胞的原子数=
2.下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
8× +6× =4
2
1
8
1
面心立方
体心立方
→原子数为8
课堂练习
晶胞中,E点位于体心,
C、D、B点位于面心,A点位于顶点
课堂练习
1.金属钠的一个晶胞的原子数=
2.金属锌的一个晶胞的原子数=
3.I2的一个晶胞的分子数=
4.金刚石的一个晶胞的原子数=
2.下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
8× +6× =4
2
1
8
1
面心立方
体心立方
8个顶点
→原子数为8
个体心
个面心
?
4
6
8× +6× +4=8
2
1
8
1
一、晶胞的含义
二、均摊法计算
三、确定晶体的化学式
课堂总结
第三章 晶体结构与性质
第一节 物质的聚集状态与晶体的常识
二、晶胞
人教版(2019版) 化学
选修2 物质结构与性质
1.理解晶胞的含义。
2.学会晶胞中微粒数的计算方法——均摊法。
3.能根据晶胞的结构确定晶体的化学式。
教学目标
晶胞的含义
知识点1
怎样描述晶体中的微粒在空间的排列规律?
晶体是原子、离子或分子按照一定的周期性在空间排列形成在结晶过程中形成具有一定规则的几何外形的固体。
晶胞
晶胞
为了描述晶体在微观空间里原子的排列,无须画出千千万万个原子,
只需在晶体微观空间里取出一个基本的单元即可。这种描述晶体结构的基本单元叫做晶胞。
晶胞
②整块晶体可看作数量巨大的晶胞“无隙并置”而成
①常规的晶胞一般是平行六面体
“无隙”:相邻晶胞之间没有任何间隙。
“并置”:所有晶胞都是平行排列的,取向相同。
正方体 或 长方体
晶胞的特征:
均摊法计算
知识点2
均摊法
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有 属于这个晶胞。
均摊法:晶胞中粒子数目的计算——立方体
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方体
1.长方体(正方体)晶胞中不同位置的粒子数的计算
三棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
均摊法:晶胞中粒子数目的计算——三棱柱
三棱柱
2.正三棱柱晶胞中不同位置的粒子数的计算
均摊法:晶胞中粒子数目的计算——六棱柱
六棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/3
顶点
1/6
六棱柱
3.正六棱柱晶胞中不同位置的粒子数的计算
小结
(1)立方体
(2)三棱柱
(3)六棱柱
体心
1
面心
1/2
棱边
1/4
顶点
1/8
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
体心
1
面心
1/2
棱边
水平1/4 竖1/3
顶点
1/6
常见的立方晶胞中原子数的计算
简单立方
体心立方
面心立方
8× =1
8
1
8× +1=2
8
1
8× +6× =4
2
1
8
1
课堂练习
1.某晶体的一部分如右图所示,这种晶体中A、B、C三种粒子数之比是( )
A.3∶9∶4 B.1∶4∶2
C.2∶9∶4 D.3∶8∶4
B
A
B
C
确定晶体的化学式
知识点3
晶体的化学式表示的是晶体(也可以说是晶胞)中各类原子或离子数目的最简整数比
团簇分子或纳米颗粒与晶胞不同,这两类物质是独立的分子,所有原子均为该分子所有。与晶体中多个晶胞共用原子不相同
晶体化学式的确定
化学式
Cl-
Na+
氯化钠晶胞
=1:1
1. 计算一个NaCl晶胞中含多少Na+和Cl-?
Na+:Cl-
8× +6× =4
2
1
8
1
12× + 1 =4
4
1
离子晶体化学式只表示每个晶胞或晶体中各类粒子的最简整数比
立方晶胞
①Cl-位于 和 ,共有 个
②Na+位于 和 ,共有 个
顶点
面心
4
棱边
体心
4
课堂练习
1.金属钠的一个晶胞的原子数=
2.金属锌的一个晶胞的原子数=
3.I2的一个晶胞的分子数=
4.金刚石的一个晶胞的原子数=
2.下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
8× +6× =4
2
1
8
1
面心立方
体心立方
→原子数为8
课堂练习
晶胞中,E点位于体心,
C、D、B点位于面心,A点位于顶点
课堂练习
1.金属钠的一个晶胞的原子数=
2.金属锌的一个晶胞的原子数=
3.I2的一个晶胞的分子数=
4.金刚石的一个晶胞的原子数=
2.下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
8× +6× =4
2
1
8
1
面心立方
体心立方
8个顶点
→原子数为8
个体心
个面心
?
4
6
8× +6× +4=8
2
1
8
1
一、晶胞的含义
二、均摊法计算
三、确定晶体的化学式
课堂总结
