2024届高三化学二轮复习专题13:化学反应速率与化学平衡(共40张PPT)
文档属性
| 名称 | 2024届高三化学二轮复习专题13:化学反应速率与化学平衡(共40张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-05 10:28:33 | ||
图片预览








文档简介
(共40张PPT)
专题十三: 化学反应速率及化学平衡
2024届高三化学二轮复习专题
【新课程标准】
1.了解化学反应速率的概念和定量表示方法。能正确计算化学反应的转化率(α)。2.了解反应活化能的概念,了解催化剂的重要作用。3.了解化学反应的可逆性及化学平衡的建立。4.掌握化学平衡的特征。了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。6.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
2024届高三化学二轮专题复习
【命题热点及近五年考频考题】
2023年:湖南卷T13,山东卷T13,全国新课标卷T12,浙江6月卷T14,浙江1月卷T14,北京卷T3,辽宁卷T13
2022年:湖南卷T6,T12,T14;浙江卷T20;辽宁卷T12;河北卷T11;海南卷T8;江苏卷T10,T13;广东卷T13,T15;山东卷T10。
2021年:湖南T11;广东T4;辽宁T11;浙江T5;海南T8;江苏T14;北京T14;河北T13;浙江T18、T20。
2020年:全国II;江苏T15。
2019年:江苏T15;浙江T19、T22。
2024届高三化学二轮专题复习
【研磨典题】
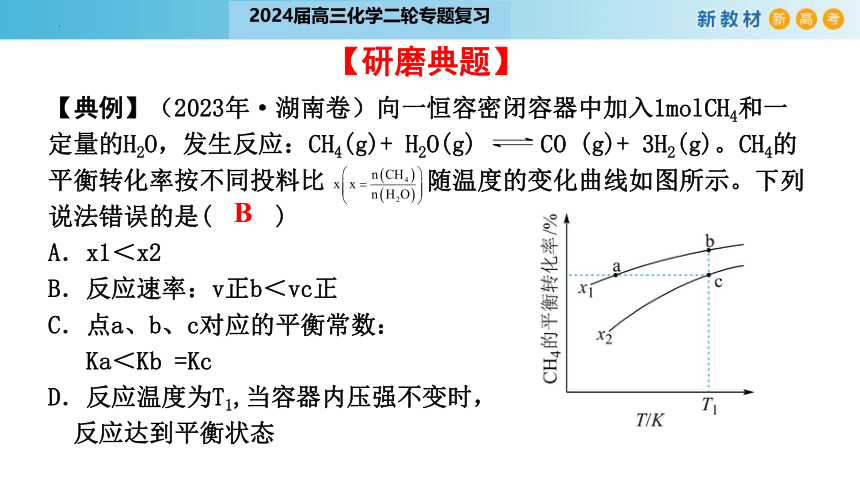
【典例】(2023年·湖南卷)向一恒容密闭容器中加入1molCH4和一定量的H2O,发生反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)。CH4的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法错误的是( )
A.x1<x2
B.反应速率:v正b<vc正
C.点a、b、c对应的平衡常数:
Ka<Kb =Kc
D.反应温度为T1,当容器内压强不变时,
反应达到平衡状态
B
2024届高三化学二轮专题复习
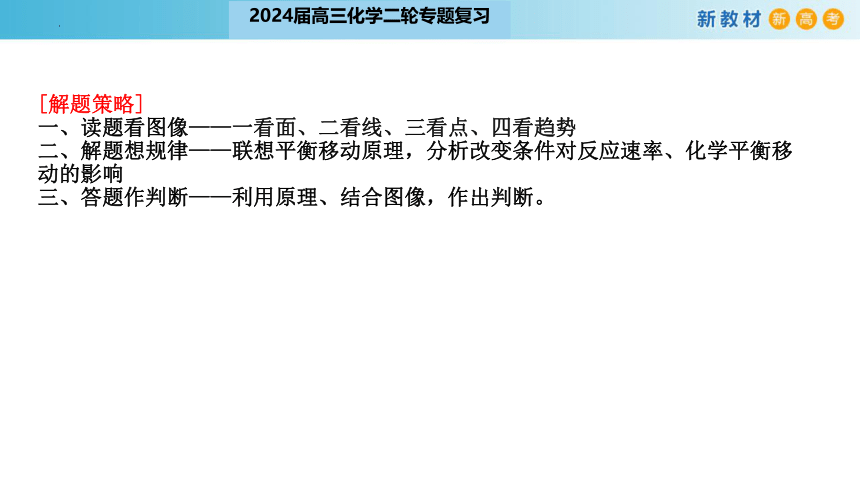
[解题策略]
一、读题看图像——一看面、二看线、三看点、四看趋势
二、解题想规律——联想平衡移动原理,分析改变条件对反应速率、化学平衡移动的影响
三、答题作判断——利用原理、结合图像,作出判断。
2024届高三化学二轮专题复习
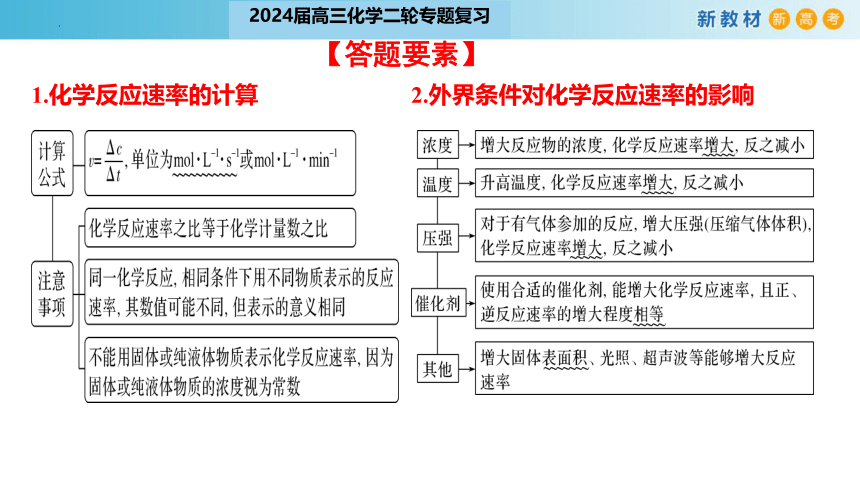
【答题要素】
1.化学反应速率的计算
2.外界条件对化学反应速率的影响
2024届高三化学二轮专题复习
3.化学平衡状态的判断(1)等——“正逆相等”①同一物质(两种表述):v(正)=v(逆)、断键数=成键数。
②不同物质:--- =——
(2)定——“变量不变”:如果一个量是随反应进行而改变的(即变量),当其“不变”时反应就达到平衡状态,即“变量”不变可说明达到平衡状态。
①平衡体系中各物质的质量、物质的量、浓度及百分含量等保持不变。
②一定条件下的气体密度、总压强、气体的平均相对分子质量不变等。
③有色体系的颜色保持不变。
V正 X
X的化学计量数
V逆 Y
Y的化学计量数
2024届高三化学二轮专题复习
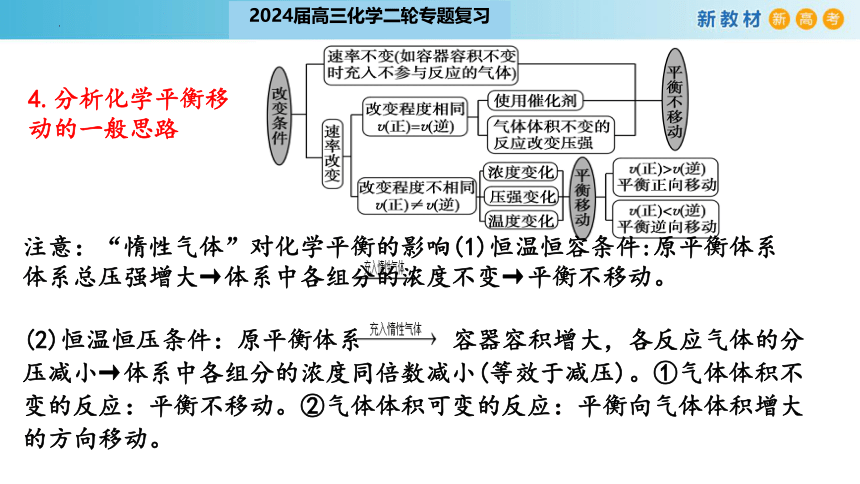
4.分析化学平衡移动的一般思路
注意:“惰性气体”对化学平衡的影响(1)恒温恒容条件:原平衡体系 体系总压强增大→体系中各组分的浓度不变→平衡不移动。
(2)恒温恒压条件:原平衡体系 容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压)。①气体体积不变的反应:平衡不移动。②气体体积可变的反应:平衡向气体体积增大的方向移动。
2024届高三化学二轮专题复习
5.化学平衡移动的判断方法
(1)依据勒夏特列原理判断
通过比较平衡被破坏的瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
①若外界条件改变,引起 ,则化学平衡向正反应方向移动;
②若外界条件改变,引起 ,则化学平衡向逆反应方向移动;
③若外界条件改变,虽能引起 和 变化,但变化后新的 和 仍保持相等,则化学平衡不发生移动。
(2)依据浓度商 判断
通过比较浓度商 与平衡常数 的大小来判断平衡移动的方向。
①若 ,平衡向逆反应方向移动。
②若 ,平衡不移动。
③若 ,平衡向正反应方向移动。
2024届高三化学二轮专题复习
6.化学平衡常数及其应用(1)对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即:K正=1/K(逆)。若方程式中的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会发生改变。
(2)与反应热的关系,一般情况下:
(3)与物质状态的关系
由于固体或纯液体浓度视为一常数,所以在平衡常数表达式中不再写出。
①稀溶液中进行的反应,如有水参加反应,由于水的浓度视为常数而不必出现在表达式中;
②非水溶液中进行的反应,若有水参加或生成,则应出现在表达式中。
2024届高三化学二轮专题复习
化学平衡常数应用:
(1)利用K可以推测可逆反应进行的程度。K大说明反应进行的程度大,反应物的平衡转化率大;K小说明反应进行的程度小,反应物的平衡转化率小。(2)利用K可判断反应的热效应。若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。(3)借助平衡常数,可以判断一个化学反应是否达到化学平衡状态以及反应的方向(Q为浓度商):①若Q>K,平衡逆向移动;②若Q=K,平衡不移动;③若Q<K,平衡正向移动。
2024届高三化学二轮专题复习
7.判断平衡转化率变化的规律(1)若反应物有多种:aA(g)+bB(g) cC(g)+dD(g),①在不改变其他条件时,只增加A的量,平衡向正反应方向移动,但是A的转化率减小,B的转化率增大。②若按原比例同倍数地增加A和B,平衡向正反应方向移动,但是反应物的转化率与气体物质的计量数有关:若a+b=c+d,A、B的转化率都不变;若a+b>c+d,A、B的转化率都增大;若a+bb+c,A的转化率增大;
③若a2024届高三化学二轮专题复习
8.两种典型的图像
(1)转化率(或百分含量)与温度变化图像
[析图关键] 表示两个外界条件同时变化时,反应物 的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。如:图1中,当压强相等(任意一条等压线)时,升高温度, 的转化率增大,说明升高温度平衡向正反应方向移动,即正反应为吸热反应。当温度相等时,在图1中作垂线,与三条等压线交于三点,这三点自下而上为增大压强, 的转化率增大,说明增大压强平衡向正反应方向移动,即正反应为气体体积减小的反应。
2024届高三化学二轮专题复习
(2)转化率(或百分含量)与压强变化图像
[析图关键] 图3中,当温度相等(任意一条等温线)时,增大压强, 的转化率增大,说明增大压强平衡正向移动,即正反应是气体体积减小的反应。当压强相等时,在图3中作垂线,与两条等温线交于两点,这两点自下而上为降低温度, 的转化率增大,说明降低温度平衡正向移动,即正反应为放热反应。
2024届高三化学二轮专题复习
【方法指导】解答化学平衡图像题四步骤
2024届高三化学二轮专题复习
【真题再练】
1、【2023年北京卷】下列事实能用平衡移动原理解释的是( )A.H2O2溶液中加入少量MnO2固体,促进H2O2分解.
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深.
C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体.
D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
B
【解析】A.MnO2会催化 H2O2分解,与平衡移动无关,A项错误; B.NO2转化为N2O4 的反应是放热反应,升温平衡逆向移动, NO2浓度增大,混合气体颜色加深,B项正确;C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C项错误;D.加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D项错误;故选B。
2024届高三化学二轮专题复习
2、(2023年·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol L-1,TFAA的浓度为0.08mol L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是( )
A.t1时刻,体系中有E存在B.t2时刻,体系中无F存在C.E和TFAA反应生成F的活化能很小D.反应达平衡后,TFAA的浓度为0.08mol L-1
AC
2024届高三化学二轮专题复习
3、(2023年·浙江6月卷)一定条件下,1-苯基丙炔(Ph—C≡C-CH3)可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是( )A.反应焓变:反应I>反应ⅡB.反应活化能:反应I<反应ⅡC.增加HCl浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物I
C
2024届高三化学二轮专题复习
4、(2023年·浙江1月卷)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是 ( )
A.E6-E3=E5-E2 B.可计算Cl-Cl键能为2(E2-E3)kJ mol-1 C.相同条件下,O3的平衡转化率:历程II>历程ID.历程I、历程II中速率最快的一步反应的热化学方程式为:ClO(g)+O(g)=O2(g)+Cl(g) H=(E5-E4)kJ mol-1
C
2024届高三化学二轮专题复习
5、【2023年辽宁卷】某小组进行实验,向10ml蒸馏水中加入0.4gI2,充分振荡,溶液呈浅棕色,再加入0.2g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知 为棕色,下列关于颜色变化的解释错误的是( )
选项 颜色变化 解释
A 溶液呈浅棕色 I2在水中溶解度较小
B 溶液颜色加深 发生了反应:
C 紫黑色晶体消失 I2(aq)的消耗使溶解平衡
右移
D 溶液褪色 Zn与有色物质发生了置换反应
D
2024届高三化学二轮专题复习
6、(2022年湖南卷).向体积均为1L的两恒容容器中分别充入2molX和1molY,发生反应:2X (g)+ Y(g) 2Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0
B.气体的总物质的量:na<ncC.a点平衡常数:K>12
D.反应速率:Va正<Vb正
B
2024届高三化学二轮专题复习
7.(2022年湖南卷)甲基丙烯酸甲酯是合成有机玻璃的单体。旧法合成的反应:(CH3)C=O+HCN→(CH3)C(OH)CN(CH3)C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4 新法合成的反应:CH3C≡CH+CH3OH CH2=C(CH3)COOCH3下列说法错误的是( ) (阿伏加德罗常数的值为NA)A.HCN的电子式为
B.新法没有副产物产生,原子利用率高C.1L0.05mol/L的NH4HSO4溶液中NH4+的微粒数小于0.05NAD.Pd的作用是降低反应的活化能,使活化分子数目增多,百分数不变
D
2024届高三化学二轮专题复习
8.(2022年湖南卷)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:
下列有关四种不同反应进程的说法正确的是( )A.进程Ⅰ是放热反应
B.平衡时P的产率:Ⅱ>ⅠC.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
AD
2024届高三化学二轮专题复习
9.(2022年山东卷)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )
A.含N分子参与的反应一定有电子转移B.由NO生成HONO的反应历程有2种C.增大NO的量,C3H8的平衡转化率不变D.当主要发生包含②的历程时,最终生成的水减少
D
2024届高三化学二轮专题复习
10.(2022年广东卷)恒容密闭容器中,BaSO4(s)+4H2(g) BaS(s)+4H2O(g)在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是( )
A.该反应的ΔH<0B.a为n(H2O)随温度的变化曲线C.向平衡体系中充入惰性气体,平衡不移动D.向平衡体系中加入BaSO4,H2的平衡转化率增大
C
2024届高三化学二轮专题复习
11.(2022年广东卷)在相同条件下研究催化剂I、Ⅱ对反应 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )
A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·L-1·min-1
D
2024届高三化学二轮专题复习
12.(2022年江苏卷)用尿素水解生成的NH3催化还原NO,是柴油机车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 4N2(g)+6H2O(g),下列说法正确的是 ( )
A.上述反应ΔS<0B.上述反应平衡常数K=
C.上述反应中消耗1 mol NH3,转移电子的数目为2×6.02×1023D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
B
2024届高三化学二轮专题复习
13.(2022年江苏卷)乙醇—水催化重整可获得H2。其主要反应为C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) ΔH=+173.3 kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。CO的选择性= ×100%
下列说法正确的是 ( )
A.图中曲线①表示平衡时H2产率随温度的变化B.升高温度,平衡时CO的选择性增大C.一定温度下,增大 可提高乙醇平衡转化率D.一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
D
2024届高三化学二轮专题复习
14.(2022年海南卷)某温度下,反应CH2=CH2(g)+H2O(g)
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是( )A.增大压强,v正> v逆,平衡常数增大B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动D.恒容下,充入一定量的CH2=CH2(g),CH2=CH2(g)的平衡转化率增大
15.(2022年辽宁卷)某温度下,在1L恒容密闭容器中2.0molX发生反应2X(s) Y(g)+2Z(g),有关数据如下:
时间段/ min 产物Z的平均生成速率/ mol·L-1·min-1
0~2 0.20
0~4 0.15
0~6 0.10
下列说法错误的是( )A.1 min时,Z的浓度大于0.20mol/L
B.2 min时,加入0.20molZ,此时
C.3 min时,Y的体积分数约为33.3%D.5 min时,X的物质的量为1.4mol
C
B
2024届高三化学二轮专题复习
16.(2022年河北卷)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为①X Y;②Y Z。反应①的速率 ,反应②的速率 ,式中 为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的 曲线。下列说法错误的是( )
A.随C(X)的减小,反应①、②的速率均降低B.体系中
C.欲提高Y的产率,需提高反应温度且控制反应时间D.温度低于T1时,总反应速率由反应②决定
AB
2024届高三化学二轮专题复习
17.(2022年浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
A.实验①,0~20min,v(N2)=1.00× 10-5mol/(L·min) B.实验②,60min时处于平衡状态,X≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大D.相同条件下,增加催化剂的表面积,反应速率增大
C
2024届高三化学二轮专题复习
18.(2021湖南.不定项)已知:A(g)+2B(g) 3C(g) △H<0 ,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
A.容器内压强不变,表明反应达到平衡
B.t2时改变的条件:向容器中加入C
C.平衡时A的体积分数φ:
D.平衡常数K:KⅡ
BC
2024届高三化学二轮专题复习
19.(2021广东)反应X===2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
20.(2021辽宁)某温度下,在恒容密闭容器中加入一定量X,发生反应2X(s) Y(s)+Z(g),一段时间后达到平衡。下列说法错误的是( )
A.升高温度,若c(Z)增大,则△H>0
B.加入一定量Z,达新平衡后m(Y)减小
C.加入等物质的量的Y和Z,达新平衡后c(Z)增大
D.加入一定量氩气,平衡不移动
D
C
2024届高三化学二轮专题复习
21.(2021浙江)取50 mL过氧化氢水溶液,在少量I-存在下分解:2H2O2===2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:下列说法不正确的是( )
A.反应20 min时,测得O2体积为224 mL(标准状况)
B.20~40 min,消耗H2O2的平均速率为0.010 mol/(L·min)
C.第30 min时的反应速率小于第50 min时的反应速率
D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解
22.(2021海南)制备水煤气的反应C(s)+H2O(g) H2(g)+CO(g) △H>0,下列说法正确的是( )
A. 该反应△S<0 B. 升高温度,反应速率增大
C. 恒温下,增大总压,H2O(g)的平衡转化率不变
D. 恒温恒压下,加入催化剂,平衡常数增大
t/min 0 20 40 60 80
c/(mol·L-1) 0.80 0.40 0.20 0.10 0.050
C
B
2024届高三化学二轮专题复习
1. 室温下,某溶液初始时仅溶有 和 且浓度相等,同时发生以下两个反应:① ;② 。反应①的速率可表示为 ,反应②的速率可表示为 ( 、 为速率常数)。反应体系中组分 、 的浓度随时间变化情况如图。下列说法错误的是( )
A. 时间段内, 的平均反应速率为
B. 反应开始后,体系中 和 的浓度之比保持不变
C. 如果反应能进行到底,反应结束时 的 转化为
D. 反应①的活化能比反应②的活化能大
A
【预测押题】
2024届高三化学二轮专题复习
2. 已知 ,反应历程分两步:
快反应:① , ,
慢反应:② ,
,
下列说法正确的是( )
A. 是该反应的催化剂
B. 温度升高 正、 均减小, 、 均增大
C. 反应②中 与 的碰撞仅部分有效
D. 反应①正反应的活化能大于逆反应的活化能
C
2024届高三化学二轮专题复习
3.一定温度下向容器中加入A发生反应如下:①A→B,②A→C,③B C。反应体系中A、B、C的浓度随时间t的变化曲线如图所示。下列说法错误的是( )
A.反应①的活化能大于反应②
B.该温度下,反应③的平衡常数大于1
C.t1时,B的消耗速率大于生成速率 D.t2时,c(C)=c0-c(B)
4.研究反应2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H<0对实现“碳中和”有重要意义。在密闭容器中充入1molCO2与3molH2,发生反应上述反应并达平衡,测得平衡体系中各种物质的体积分数随温度变化如图所示。下列说法中正确的是( )
A.表示CH3CH2OH组分的曲线是Ⅳ
B.图中曲线交点a对应的H2转化率为60%C.图中曲线交点ab对应反应平衡常数Ka>Kb
D. 若使用催化剂,则b点向上移动
A
A
2024届高三化学二轮专题复习
5.根据下列图示所得出的结论错误的是( )
A.图甲是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时,c(CO2)随反应时间变化曲线,t1时刻改变的条件可能是缩小容器的体积B.图乙是密闭容器中发生aA(g)+bB(g) cC(g)反应,C的平衡物质的量与温度的关系,则该反应焓变 H<0C.图丙是恒温密闭容器中发生N2(g)+3H2(g) 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>a>cD.图丁是HI(g)分解反应能量与反应进程关系曲线,a、b中I2的状态分别为气态、固态
C
2024届高三化学二轮专题复习
6. 电镀废液中 可通过下列反应转化成铬黄 :
,达到平衡。下列说法正确的是( )
A. 移走 , 的转化率升高
B. 加入少量 固体,自然沉降后,溶液颜色变深
C. 加入 固体,平衡逆向移动
D. 降低温度,该反应的平衡常数 增大
D
2024届高三化学二轮专题复习
7. 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入 和 ,平衡时 、 、 的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应Ⅰ的平衡常数可表示
B. 图中曲线 表示 的物质的量随温度的变化
C. 提高 转化为 的转化率,需要研发在低温区高效的催化剂
D. 的
C
2024届高三化学二轮专题复习
专题十三: 化学反应速率及化学平衡
2024届高三化学二轮复习专题
【新课程标准】
1.了解化学反应速率的概念和定量表示方法。能正确计算化学反应的转化率(α)。2.了解反应活化能的概念,了解催化剂的重要作用。3.了解化学反应的可逆性及化学平衡的建立。4.掌握化学平衡的特征。了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。6.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
2024届高三化学二轮专题复习
【命题热点及近五年考频考题】
2023年:湖南卷T13,山东卷T13,全国新课标卷T12,浙江6月卷T14,浙江1月卷T14,北京卷T3,辽宁卷T13
2022年:湖南卷T6,T12,T14;浙江卷T20;辽宁卷T12;河北卷T11;海南卷T8;江苏卷T10,T13;广东卷T13,T15;山东卷T10。
2021年:湖南T11;广东T4;辽宁T11;浙江T5;海南T8;江苏T14;北京T14;河北T13;浙江T18、T20。
2020年:全国II;江苏T15。
2019年:江苏T15;浙江T19、T22。
2024届高三化学二轮专题复习
【研磨典题】
【典例】(2023年·湖南卷)向一恒容密闭容器中加入1molCH4和一定量的H2O,发生反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)。CH4的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法错误的是( )
A.x1<x2
B.反应速率:v正b<vc正
C.点a、b、c对应的平衡常数:
Ka<Kb =Kc
D.反应温度为T1,当容器内压强不变时,
反应达到平衡状态
B
2024届高三化学二轮专题复习
[解题策略]
一、读题看图像——一看面、二看线、三看点、四看趋势
二、解题想规律——联想平衡移动原理,分析改变条件对反应速率、化学平衡移动的影响
三、答题作判断——利用原理、结合图像,作出判断。
2024届高三化学二轮专题复习
【答题要素】
1.化学反应速率的计算
2.外界条件对化学反应速率的影响
2024届高三化学二轮专题复习
3.化学平衡状态的判断(1)等——“正逆相等”①同一物质(两种表述):v(正)=v(逆)、断键数=成键数。
②不同物质:--- =——
(2)定——“变量不变”:如果一个量是随反应进行而改变的(即变量),当其“不变”时反应就达到平衡状态,即“变量”不变可说明达到平衡状态。
①平衡体系中各物质的质量、物质的量、浓度及百分含量等保持不变。
②一定条件下的气体密度、总压强、气体的平均相对分子质量不变等。
③有色体系的颜色保持不变。
V正 X
X的化学计量数
V逆 Y
Y的化学计量数
2024届高三化学二轮专题复习
4.分析化学平衡移动的一般思路
注意:“惰性气体”对化学平衡的影响(1)恒温恒容条件:原平衡体系 体系总压强增大→体系中各组分的浓度不变→平衡不移动。
(2)恒温恒压条件:原平衡体系 容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压)。①气体体积不变的反应:平衡不移动。②气体体积可变的反应:平衡向气体体积增大的方向移动。
2024届高三化学二轮专题复习
5.化学平衡移动的判断方法
(1)依据勒夏特列原理判断
通过比较平衡被破坏的瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
①若外界条件改变,引起 ,则化学平衡向正反应方向移动;
②若外界条件改变,引起 ,则化学平衡向逆反应方向移动;
③若外界条件改变,虽能引起 和 变化,但变化后新的 和 仍保持相等,则化学平衡不发生移动。
(2)依据浓度商 判断
通过比较浓度商 与平衡常数 的大小来判断平衡移动的方向。
①若 ,平衡向逆反应方向移动。
②若 ,平衡不移动。
③若 ,平衡向正反应方向移动。
2024届高三化学二轮专题复习
6.化学平衡常数及其应用(1)对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即:K正=1/K(逆)。若方程式中的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会发生改变。
(2)与反应热的关系,一般情况下:
(3)与物质状态的关系
由于固体或纯液体浓度视为一常数,所以在平衡常数表达式中不再写出。
①稀溶液中进行的反应,如有水参加反应,由于水的浓度视为常数而不必出现在表达式中;
②非水溶液中进行的反应,若有水参加或生成,则应出现在表达式中。
2024届高三化学二轮专题复习
化学平衡常数应用:
(1)利用K可以推测可逆反应进行的程度。K大说明反应进行的程度大,反应物的平衡转化率大;K小说明反应进行的程度小,反应物的平衡转化率小。(2)利用K可判断反应的热效应。若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。(3)借助平衡常数,可以判断一个化学反应是否达到化学平衡状态以及反应的方向(Q为浓度商):①若Q>K,平衡逆向移动;②若Q=K,平衡不移动;③若Q<K,平衡正向移动。
2024届高三化学二轮专题复习
7.判断平衡转化率变化的规律(1)若反应物有多种:aA(g)+bB(g) cC(g)+dD(g),①在不改变其他条件时,只增加A的量,平衡向正反应方向移动,但是A的转化率减小,B的转化率增大。②若按原比例同倍数地增加A和B,平衡向正反应方向移动,但是反应物的转化率与气体物质的计量数有关:若a+b=c+d,A、B的转化率都不变;若a+b>c+d,A、B的转化率都增大;若a+b
③若a
8.两种典型的图像
(1)转化率(或百分含量)与温度变化图像
[析图关键] 表示两个外界条件同时变化时,反应物 的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。如:图1中,当压强相等(任意一条等压线)时,升高温度, 的转化率增大,说明升高温度平衡向正反应方向移动,即正反应为吸热反应。当温度相等时,在图1中作垂线,与三条等压线交于三点,这三点自下而上为增大压强, 的转化率增大,说明增大压强平衡向正反应方向移动,即正反应为气体体积减小的反应。
2024届高三化学二轮专题复习
(2)转化率(或百分含量)与压强变化图像
[析图关键] 图3中,当温度相等(任意一条等温线)时,增大压强, 的转化率增大,说明增大压强平衡正向移动,即正反应是气体体积减小的反应。当压强相等时,在图3中作垂线,与两条等温线交于两点,这两点自下而上为降低温度, 的转化率增大,说明降低温度平衡正向移动,即正反应为放热反应。
2024届高三化学二轮专题复习
【方法指导】解答化学平衡图像题四步骤
2024届高三化学二轮专题复习
【真题再练】
1、【2023年北京卷】下列事实能用平衡移动原理解释的是( )A.H2O2溶液中加入少量MnO2固体,促进H2O2分解.
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深.
C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体.
D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
B
【解析】A.MnO2会催化 H2O2分解,与平衡移动无关,A项错误; B.NO2转化为N2O4 的反应是放热反应,升温平衡逆向移动, NO2浓度增大,混合气体颜色加深,B项正确;C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C项错误;D.加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D项错误;故选B。
2024届高三化学二轮专题复习
2、(2023年·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol L-1,TFAA的浓度为0.08mol L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是( )
A.t1时刻,体系中有E存在B.t2时刻,体系中无F存在C.E和TFAA反应生成F的活化能很小D.反应达平衡后,TFAA的浓度为0.08mol L-1
AC
2024届高三化学二轮专题复习
3、(2023年·浙江6月卷)一定条件下,1-苯基丙炔(Ph—C≡C-CH3)可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是( )A.反应焓变:反应I>反应ⅡB.反应活化能:反应I<反应ⅡC.增加HCl浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物I
C
2024届高三化学二轮专题复习
4、(2023年·浙江1月卷)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是 ( )
A.E6-E3=E5-E2 B.可计算Cl-Cl键能为2(E2-E3)kJ mol-1 C.相同条件下,O3的平衡转化率:历程II>历程ID.历程I、历程II中速率最快的一步反应的热化学方程式为:ClO(g)+O(g)=O2(g)+Cl(g) H=(E5-E4)kJ mol-1
C
2024届高三化学二轮专题复习
5、【2023年辽宁卷】某小组进行实验,向10ml蒸馏水中加入0.4gI2,充分振荡,溶液呈浅棕色,再加入0.2g锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知 为棕色,下列关于颜色变化的解释错误的是( )
选项 颜色变化 解释
A 溶液呈浅棕色 I2在水中溶解度较小
B 溶液颜色加深 发生了反应:
C 紫黑色晶体消失 I2(aq)的消耗使溶解平衡
右移
D 溶液褪色 Zn与有色物质发生了置换反应
D
2024届高三化学二轮专题复习
6、(2022年湖南卷).向体积均为1L的两恒容容器中分别充入2molX和1molY,发生反应:2X (g)+ Y(g) 2Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0
B.气体的总物质的量:na<ncC.a点平衡常数:K>12
D.反应速率:Va正<Vb正
B
2024届高三化学二轮专题复习
7.(2022年湖南卷)甲基丙烯酸甲酯是合成有机玻璃的单体。旧法合成的反应:(CH3)C=O+HCN→(CH3)C(OH)CN(CH3)C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4 新法合成的反应:CH3C≡CH+CH3OH CH2=C(CH3)COOCH3下列说法错误的是( ) (阿伏加德罗常数的值为NA)A.HCN的电子式为
B.新法没有副产物产生,原子利用率高C.1L0.05mol/L的NH4HSO4溶液中NH4+的微粒数小于0.05NAD.Pd的作用是降低反应的活化能,使活化分子数目增多,百分数不变
D
2024届高三化学二轮专题复习
8.(2022年湖南卷)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:
下列有关四种不同反应进程的说法正确的是( )A.进程Ⅰ是放热反应
B.平衡时P的产率:Ⅱ>ⅠC.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
AD
2024届高三化学二轮专题复习
9.(2022年山东卷)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )
A.含N分子参与的反应一定有电子转移B.由NO生成HONO的反应历程有2种C.增大NO的量,C3H8的平衡转化率不变D.当主要发生包含②的历程时,最终生成的水减少
D
2024届高三化学二轮专题复习
10.(2022年广东卷)恒容密闭容器中,BaSO4(s)+4H2(g) BaS(s)+4H2O(g)在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是( )
A.该反应的ΔH<0B.a为n(H2O)随温度的变化曲线C.向平衡体系中充入惰性气体,平衡不移动D.向平衡体系中加入BaSO4,H2的平衡转化率增大
C
2024届高三化学二轮专题复习
11.(2022年广东卷)在相同条件下研究催化剂I、Ⅱ对反应 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )
A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·L-1·min-1
D
2024届高三化学二轮专题复习
12.(2022年江苏卷)用尿素水解生成的NH3催化还原NO,是柴油机车辆尾气净化的主要方法。反应为4NH3(g)+O2(g)+4NO(g) 4N2(g)+6H2O(g),下列说法正确的是 ( )
A.上述反应ΔS<0B.上述反应平衡常数K=
C.上述反应中消耗1 mol NH3,转移电子的数目为2×6.02×1023D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
B
2024届高三化学二轮专题复习
13.(2022年江苏卷)乙醇—水催化重整可获得H2。其主要反应为C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) ΔH=+173.3 kJ·mol-1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。CO的选择性= ×100%
下列说法正确的是 ( )
A.图中曲线①表示平衡时H2产率随温度的变化B.升高温度,平衡时CO的选择性增大C.一定温度下,增大 可提高乙醇平衡转化率D.一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
D
2024届高三化学二轮专题复习
14.(2022年海南卷)某温度下,反应CH2=CH2(g)+H2O(g)
CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是( )A.增大压强,v正> v逆,平衡常数增大B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动D.恒容下,充入一定量的CH2=CH2(g),CH2=CH2(g)的平衡转化率增大
15.(2022年辽宁卷)某温度下,在1L恒容密闭容器中2.0molX发生反应2X(s) Y(g)+2Z(g),有关数据如下:
时间段/ min 产物Z的平均生成速率/ mol·L-1·min-1
0~2 0.20
0~4 0.15
0~6 0.10
下列说法错误的是( )A.1 min时,Z的浓度大于0.20mol/L
B.2 min时,加入0.20molZ,此时
C.3 min时,Y的体积分数约为33.3%D.5 min时,X的物质的量为1.4mol
C
B
2024届高三化学二轮专题复习
16.(2022年河北卷)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为①X Y;②Y Z。反应①的速率 ,反应②的速率 ,式中 为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的 曲线。下列说法错误的是( )
A.随C(X)的减小,反应①、②的速率均降低B.体系中
C.欲提高Y的产率,需提高反应温度且控制反应时间D.温度低于T1时,总反应速率由反应②决定
AB
2024届高三化学二轮专题复习
17.(2022年浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
A.实验①,0~20min,v(N2)=1.00× 10-5mol/(L·min) B.实验②,60min时处于平衡状态,X≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大D.相同条件下,增加催化剂的表面积,反应速率增大
C
2024届高三化学二轮专题复习
18.(2021湖南.不定项)已知:A(g)+2B(g) 3C(g) △H<0 ,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
A.容器内压强不变,表明反应达到平衡
B.t2时改变的条件:向容器中加入C
C.平衡时A的体积分数φ:
D.平衡常数K:K
BC
2024届高三化学二轮专题复习
19.(2021广东)反应X===2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
20.(2021辽宁)某温度下,在恒容密闭容器中加入一定量X,发生反应2X(s) Y(s)+Z(g),一段时间后达到平衡。下列说法错误的是( )
A.升高温度,若c(Z)增大,则△H>0
B.加入一定量Z,达新平衡后m(Y)减小
C.加入等物质的量的Y和Z,达新平衡后c(Z)增大
D.加入一定量氩气,平衡不移动
D
C
2024届高三化学二轮专题复习
21.(2021浙江)取50 mL过氧化氢水溶液,在少量I-存在下分解:2H2O2===2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:下列说法不正确的是( )
A.反应20 min时,测得O2体积为224 mL(标准状况)
B.20~40 min,消耗H2O2的平均速率为0.010 mol/(L·min)
C.第30 min时的反应速率小于第50 min时的反应速率
D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解
22.(2021海南)制备水煤气的反应C(s)+H2O(g) H2(g)+CO(g) △H>0,下列说法正确的是( )
A. 该反应△S<0 B. 升高温度,反应速率增大
C. 恒温下,增大总压,H2O(g)的平衡转化率不变
D. 恒温恒压下,加入催化剂,平衡常数增大
t/min 0 20 40 60 80
c/(mol·L-1) 0.80 0.40 0.20 0.10 0.050
C
B
2024届高三化学二轮专题复习
1. 室温下,某溶液初始时仅溶有 和 且浓度相等,同时发生以下两个反应:① ;② 。反应①的速率可表示为 ,反应②的速率可表示为 ( 、 为速率常数)。反应体系中组分 、 的浓度随时间变化情况如图。下列说法错误的是( )
A. 时间段内, 的平均反应速率为
B. 反应开始后,体系中 和 的浓度之比保持不变
C. 如果反应能进行到底,反应结束时 的 转化为
D. 反应①的活化能比反应②的活化能大
A
【预测押题】
2024届高三化学二轮专题复习
2. 已知 ,反应历程分两步:
快反应:① , ,
慢反应:② ,
,
下列说法正确的是( )
A. 是该反应的催化剂
B. 温度升高 正、 均减小, 、 均增大
C. 反应②中 与 的碰撞仅部分有效
D. 反应①正反应的活化能大于逆反应的活化能
C
2024届高三化学二轮专题复习
3.一定温度下向容器中加入A发生反应如下:①A→B,②A→C,③B C。反应体系中A、B、C的浓度随时间t的变化曲线如图所示。下列说法错误的是( )
A.反应①的活化能大于反应②
B.该温度下,反应③的平衡常数大于1
C.t1时,B的消耗速率大于生成速率 D.t2时,c(C)=c0-c(B)
4.研究反应2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H<0对实现“碳中和”有重要意义。在密闭容器中充入1molCO2与3molH2,发生反应上述反应并达平衡,测得平衡体系中各种物质的体积分数随温度变化如图所示。下列说法中正确的是( )
A.表示CH3CH2OH组分的曲线是Ⅳ
B.图中曲线交点a对应的H2转化率为60%C.图中曲线交点ab对应反应平衡常数Ka>Kb
D. 若使用催化剂,则b点向上移动
A
A
2024届高三化学二轮专题复习
5.根据下列图示所得出的结论错误的是( )
A.图甲是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时,c(CO2)随反应时间变化曲线,t1时刻改变的条件可能是缩小容器的体积B.图乙是密闭容器中发生aA(g)+bB(g) cC(g)反应,C的平衡物质的量与温度的关系,则该反应焓变 H<0C.图丙是恒温密闭容器中发生N2(g)+3H2(g) 2NH3(g)反应,达到平衡时NH3的体积分数随N2的起始物质的量的变化曲线,则H2的转化率:b>a>cD.图丁是HI(g)分解反应能量与反应进程关系曲线,a、b中I2的状态分别为气态、固态
C
2024届高三化学二轮专题复习
6. 电镀废液中 可通过下列反应转化成铬黄 :
,达到平衡。下列说法正确的是( )
A. 移走 , 的转化率升高
B. 加入少量 固体,自然沉降后,溶液颜色变深
C. 加入 固体,平衡逆向移动
D. 降低温度,该反应的平衡常数 增大
D
2024届高三化学二轮专题复习
7. 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入 和 ,平衡时 、 、 的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应Ⅰ的平衡常数可表示
B. 图中曲线 表示 的物质的量随温度的变化
C. 提高 转化为 的转化率,需要研发在低温区高效的催化剂
D. 的
C
2024届高三化学二轮专题复习
同课章节目录
