1.2 课时1 碳原子的成键方式 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 1.2 课时1 碳原子的成键方式 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 495.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-05 22:04:57 | ||
图片预览




文档简介
2.1第1课时 碳原子的成键方式
【学习目标】
1.了解原子的成键特点和成键方式的多样性,能以此认识到有机化合物种类繁多的原因。培养宏观辨识与微观探析的化学核心素养。
2.了解单键、双键、三键的特点,知道碳原子的饱和程度对有机化合物性质的重要影响。培养宏观辨识与微观探析的化学核心素养。
3.学会有机物分子结构的表示方法,熟知几种典型分子构型。培养证据推理与模型认知的化学核心素养。
【自主预习】
一、碳原子的成键特点
1.碳原子的成键特点
碳原子最外层有 个电子,通常以 的形式与其他原子成键,达到最外层 个电子的稳定结构。
2.结合方式的多样性
(1)碳原子之间可以形成 ,也可以形成 ,还可以形成 。
(2)多个碳原子可以相互结合形成 结构,也可以形成 结构。
(3)碳原子除了彼此间成键外,还可以与 等其他元素的原子成键。
3.单键、双键和三键与空间构型
碳碳单键 碳碳双键 碳碳三键
表示方式 —C≡C—
成键方式 1个碳原子与周围 个原子成键;碳碳之间共用 对电子 1个碳原子与周围 个原子成键;碳碳之间共用 对电子 1个碳原子与周围 个原子成键;碳碳之间共用 对电子
键角
空间构型 碳原子与其他4个原子形成 结构 双键碳原子及与之相连的原子处于 上 三键碳原子及与之相连的原子处于 上
二、极性键和非极性键
1.极性键: 元素的两个原子成键时,它们吸引共用电子的能力不同,共用电子将偏向吸引电子能力较强的一方,所形成的共价键是极性共价键,简称极性键。
2.非极性键: 元素的两个原子成键时,它们吸引共用电子的能力相同,所形成的共价键是非极性共价键,简称非极性键。
3.有机化合物分子中常见共价键的类型
键型 极性键 非极性键
单键 H3C—H H3C—OH H3C—Cl H3C—Br H3C—CH3
双键 H2CCH2
三键
4.键的极性与有机化合物分子反应活性的关系
共价键是否具有极性及极性的强弱程度对有机化合物的性质有着重要影响。键的极性越强,越容易 ,有机化合物分子的反应活性 。
【答案】
一、1.四 共用电子对 八 2.单键 双键 三键 链状 环状 H、O、N、Cl 3.4 1 3 2 2 3 109°28' 120° 180° 四面体形 同一平面 同一直线
二、1.不同 2.同种 4.断裂 越强
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)CH4与CH3Cl均为正四面体结构分子。 ( )
(2)有机物分子中均有极性键和非极性键。 ( )
(3)含有甲基的有机物中所有原子一定不可能共平面。 ( )
(4)含有碳碳三键的有机物均为直线结构。 ( )
(5)存在苯环结构的有机物至少有12个原子共平面。 ( )
【答案】(1)× (2)× (3)√ (4)× (5)√
2. 某有机化合物结构简式为
。分析其结构并回答下列问题:
(1)写出其分子式: ,其中含有 个不饱和碳原子,分子中的饱和碳原子有 个。
(2)分子中的极性键有 (写出两种即可),分子中有 种双键。
(3)该物质具有的性质是 (填字母)。
a.可以与溴水反应
b.可以使酸性高锰酸钾溶液褪色
c.可以与Na反应
d.可以发生加成反应
e.只能发生还原反应,不能发生氧化反应
【答案】(1)C16H16O5 12 4 (2)碳氧键、氧氢键、碳氢键(任意两种即可) 2 (3)abcd
【解析】(1)根据碳原子的成键特点,与4个原子形成共价键的碳原子称之为饱和碳原子,成键原子数目小于4的碳原子称之为不饱和碳原子,共有不饱和碳原子12个,具有四面体结构的碳原子为饱和碳原子,共有4个。(2)凡是不同元素的原子之间形成的共价键都称之为极性键,此分子中有碳氧单键、碳氧双键、碳氢键、氧氢键四种极性键。此分子中有碳碳双键和碳氧双键两种双键,此外还有碳碳三键和苯环。(3)该物质中有双键、三键,可以发生加成反应,同时也可发生还原反应,不饱和键的存在可以使酸性高锰酸钾溶液或溴水褪色;羟基(—OH)、羧基(—COOH)可以与钠反应;不饱和键、羟基等都可以发生氧化反应。
【合作探究】
任务1 单键、双键和三键
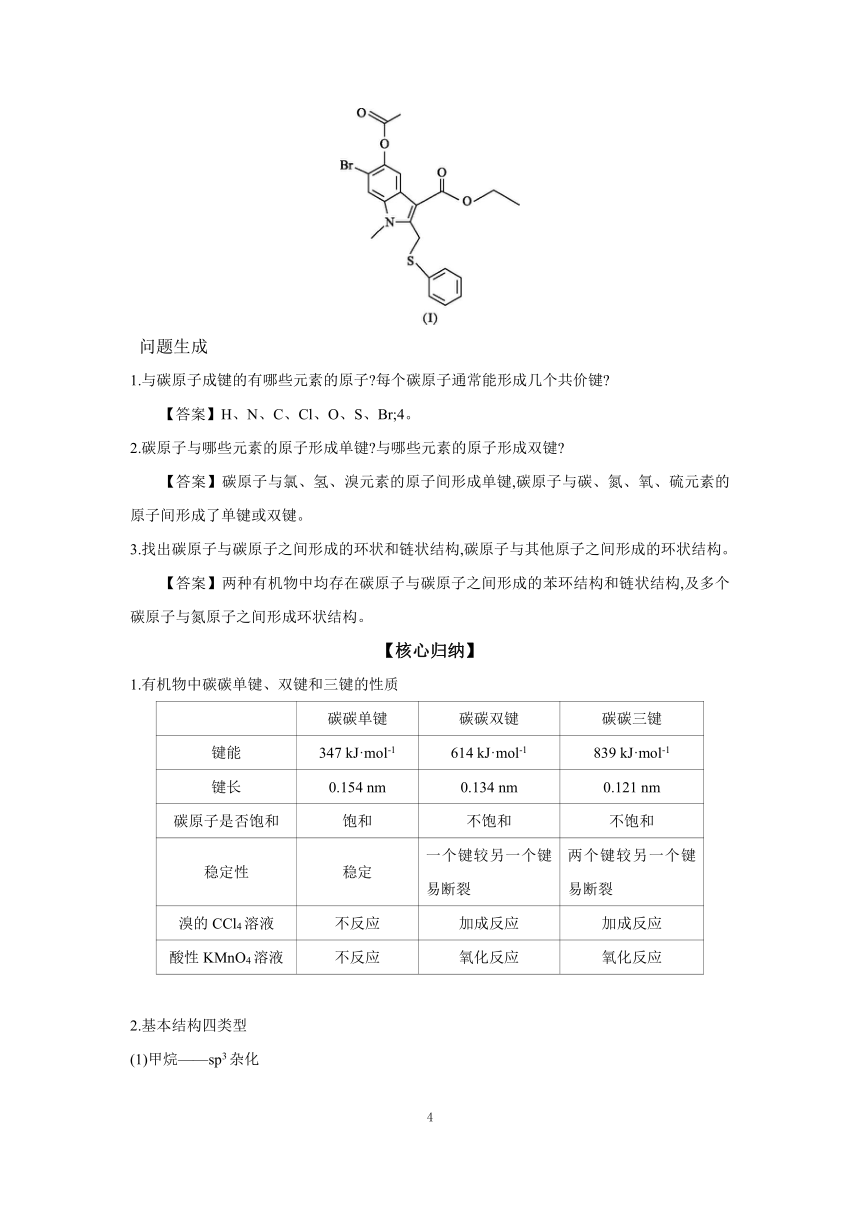
情境导入 “病毒肺炎诊疗方案”抗病毒治疗中增加了磷酸氯喹和阿比多尔两种药物。合成磷酸氯喹的原料之一氯喹(H)与合成阿比朵尔的中间体(I)的结构如图所示:
问题生成
1.与碳原子成键的有哪些元素的原子 每个碳原子通常能形成几个共价键
【答案】H、N、C、Cl、O、S、Br;4。
2.碳原子与哪些元素的原子形成单键 与哪些元素的原子形成双键
【答案】碳原子与氯、氢、溴元素的原子间形成单键,碳原子与碳、氮、氧、硫元素的原子间形成了单键或双键。
3.找出碳原子与碳原子之间形成的环状和链状结构,碳原子与其他原子之间形成的环状结构。
【答案】两种有机物中均存在碳原子与碳原子之间形成的苯环结构和链状结构,及多个碳原子与氮原子之间形成环状结构。
【核心归纳】
1.有机物中碳碳单键、双键和三键的性质
碳碳单键 碳碳双键 碳碳三键
键能 347 kJ·mol-1 614 kJ·mol-1 839 kJ·mol-1
键长 0.154 nm 0.134 nm 0.121 nm
碳原子是否饱和 饱和 不饱和 不饱和
稳定性 稳定 一个键较另一个键易断裂 两个键较另一个键易断裂
溴的CCl4溶液 不反应 加成反应 加成反应
酸性KMnO4溶液 不反应 氧化反应 氧化反应
2.基本结构四类型
(1)甲烷——sp3杂化
①甲烷分子为正四面体结构。
②甲基上的四个原子不共面。
(2)乙烯——sp2杂化
①乙烯分子为平面形结构。
②乙烯分子中双键碳原子和与之相连的4个氢原子在同一平面上。
③烯烃分子中双键碳原子和与双键碳原子直接相连的4个原子在同一平面上。
(3)苯——sp2杂化
①苯分子为平面形结构。
②苯分子中6个碳原子和与之相连的6个氢原子在同一平面上。
③芳香烃中苯环上的6个碳原子和与其直接相连的6个原子一定在同一平面上。
(4)乙炔——sp杂化
H—C≡C—H
①乙炔分子为直线形结构。
②乙炔分子中三键碳原子和与之相连的2个氢原子在同一直线上。
③炔烃中三键碳原子和与三键碳原子直接相连的2个原子在同一直线上。
(5)组合结构
组合结构就是将前面的四种类型的基团按一定方式连接成某种有机物。如,作如下分析(图示)
其中可能共平面的原子最多有20个(M+N),最少有14个(N),一定共直线的原子最多有6个(L)。
(6)有机物共线、共面问题的分析思路
①若要分析有机物中碳原子的共线、共面问题,则要进行单元分割,必要时要兼顾分子对称性。
②单键可以旋转,双键和三键则不能旋转。
③若在分子结构中有一个碳原子形成四个单键,则该分子中不是所有原子都在同一平面上。
【典型例题】
【例1】下列有机化合物中碳原子的连接方式不可能的是( )。
A. B.
C. D.
【答案】C
【解析】碳原子周围形成四个共价键,常见的可以形成碳碳单键、碳碳双键和碳碳三键,C项中2号碳形成了五个共价键,不符合价键原理,C项错误。
【例2】下列有机物分子中,所有原子不可能在同一平面上的是( )。
A.CH2CH—C≡N B.CH2CH—CHCH2
C. D.
【答案】D
【解析】据甲烷、乙烯、乙炔、苯的结构可知A、B、C三项中所有原子均可能在同一平面上,只有D项中含有—CH3,所有原子不可能共平面。
【例3】有机物的表示方法多种多样,下面是常用的有机物的表示方法:
① ② ③CH4
④ ⑤
⑥
⑦
⑧
⑨
⑩
(1)上述表示方法中属于结构简式的为 ;属于结构式的为 ;属于键线式的为 ;属于空间填充模型的为 ;属于球棍模型的为 。
(2)写出⑨的分子式: 。
(3)写出⑩中官能团的电子式: 、 。
(4)②的分子式为 ,最简式为 。
【答案】(1)①③④⑦ ⑩ ②⑥⑨ ⑤ ⑧
(2)C11H18O2 (3)···H ···H
(4)C6H12 CH2
【灵犀一点】
有机物分子结构的表示方法
种类 实例 含义
分子式 CH4 用元素符号表示物质分子组成的式子,可反映出一个分子中原子的种类和数目
最简式 (实验式) 乙烷C2H6 最简式为CH3 ①表示物质组成的各元素原子最简整数比的式子 ②由最简式可求最简式量
电子式 H 用小黑点等记号代替电子,表示原子最外层电子成键情况的式子
结构式 ①具有化学式所能表示的意义,能反映物质的结构 ②表示分子中原子的结合或排列顺序的式子,但不表示空间结构
结构简式 (示性式) CH2CHCH3 将结构式中碳碳单键、碳氢键等短线省略后得到的式子即为结构简式,它比结构式书写简单,比较常用。结构式的简便写法,着重突出结构特点(官能团)
键线式 (丁烷) (丙烯) (氯乙烷) 只要求写出碳碳键及与碳原子相连的官能团,并用近似的键角表示,每个拐点或终点均表示一个碳原子,即为键线式
球棍 模型 小球表示原子,短棍表示价键,用于表示分子的空间结构(立体形状)
空间 填充 模型 ①用不同体积的小球表示不同大小的原子 ②用于表示分子中各原子的相对大小和结合顺序
任务2 极性键和非极性键
情境导入 乙醇与钠反应时能够产生氢气,乙醇分子中含有六个氢原子,精确实验表明产生的氢气中的氢原子来自O—H键上的氢原子,而不是C—H键上的。
问题生成
1.为什么产生的氢气中的氢原子来自O—H键上的氢原子
【答案】因为氧的电负性大于碳的电负性,O—H键的极性比C—H键的极性强,O—H键易断裂,C—H键难断裂。
2.共价键为什么会表现出极性
【答案】不同原子对电子的吸引能力不同,造成共用电子对发生偏移。
3.共价键的极性对有机物的性质有何影响
【答案】乙醇能与钠反应放出氢气,而乙烷与钠不反应,原因是乙醇中O—H键的极性比乙烷中C—H键的强。
4.共价键的极性与成键原子的得电子能力有何关系 影响共价键极性的因素还有哪些
【答案】两个成键原子得电子能力(吸引共用电子对的能力)差别越大,形成的共价键的极性越强。如H—F键的极性比C—H键的极性强得多。共价键的极性及其强弱还会受分子中邻近基团或外界环境的影响。
【核心归纳】
共价键极性的判断和比较
(1)可以根据成键元素原子吸引电子能力或电负性的差异来判断,差异越大,键的极性越强。如:H—O键、H—C键、H—Cl键的极性大小关系是H—O键>H—Cl键>H—C键。
(2)共价键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响。
【典型例题】
【例4】下列关于苯乙炔()的说法错误的是( )。
A.该分子有8个σ键和5个π键
B.该分子中碳原子有sp和sp2杂化
C.该分子中含有极性键和非极性键
D.该分子中有8个碳原子在同一平面上
【答案】A
【解析】A项,苯乙炔分子中含有14个σ键,苯环中有1个大π键,碳碳三键(C≡C)中有2个π键,故共含有3个π键,错误;B项,苯环中碳原子都采取sp2杂化,碳碳三键碳原子采取sp杂化,故该分子中碳原子有sp和sp2杂化,正确;C项,同种原子间形成的共价键为非极性键,不同原子间形成的共价键为极性键,该分子中碳原子间形成非极性键,碳与氢原子间形成极性键,正确;D项,苯环是平面形结构,碳碳三键是直线形结构,因此该分子中有8个碳原子在同一平面上,正确。
【例5】某有机物的结构如图所示:
根据该有机物的结构回答下列问题:
(1)该物质的1个分子中含有 个不饱和碳原子。
(2)分子中的单键分别为 (写名称,下同);分子中的双键分别为 ;1个分子中三键的数目为 。
(3)写出两种极性键: ;写出两种非极性键: 。
【答案】(1)4
(2)碳氢单键、碳氯单键、碳硫单键、碳碳单键 碳氧双键、碳碳双键 1
(3)碳氢单键、碳氯单键、碳硫单键、碳氧双键、碳氮三键(写两种即可) 碳碳单键、碳碳双键
【随堂检测】
1.下列化学用语书写正确的是( )。
A.甲烷的电子式:H
B.丙烯的键线式:
C.乙醇的结构式:
D.乙炔的结构简式:CHCH
【答案】A
【解析】丙烯的键线式为;乙醇的结构式为;乙炔的结构简式为CH≡CH。
2.下列说法正确的是( )。
A.碳骨架为的烃的结构简式为(CH3)2CCH2
B.有机物分子里一定既有非极性键又有极性键
C.有的烃分子中,一个碳原子形成3个共价键
D.乙烷的键线式为
【答案】A
【解析】根据碳原子的成键特点,碳原子之间可形成非极性共价键,碳原子与其他原子之间则以极性共价键结合,但是甲烷分子中只有极性键,B项错误。有机物中碳原子通过4个共价键与其他原子相连,C项错误。应为丙烷的键线式,D项错误。
3.据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
下列对该物质的说法中正确的是( )。
A.①处的化学键表示碳碳双键
B.此星际分子属于烃类
C.③处的原子可能是氯原子或氟原子
D.②处的化学键表示碳碳单键,是非极性键
【答案】D
【解析】有机物分子中碳原子要满足4个价键,推测其结构简式为H—C≡C—C≡,所以①处是碳碳三键,③处是N原子(若为F或Cl,则C原子不能满足4个价键),②处是碳碳单键。
4.下列关于CH3—C≡C—CH2—CH3的说法正确的是( )。
A.分子中含有极性共价键和非极性共价键
B.分子中只有极性键
C.碳碳三键键能是碳碳单键键能的三倍
D.分子中只有非极性键
【答案】A
【解析】在题给分子中,碳碳单键和碳碳三键均属于非极性键,碳氢单键属于极性键,A项正确,B、D两项错误;碳碳三键键能要小于碳碳单键键能的三倍,C项错误。
5.已知下列物质:①CH4 ②CH≡CH ③CH2CH2
④ ⑤CCl4
其中,只含有极性键的是 ,既含有极性键又含有非极性键的是 ;既含单键又含双键的是 ,既含σ键、又含π键的是 。
【答案】①⑤ ②③④ ③ ②③④
【解析】CH4中只含有C—H,C—H为极性键;CH≡CH中含有C≡C(非极性键)与C—H(极性键);CH2CH2中含有非极性键CC和极性键C—H;苯中碳和碳之间是非极性键,C—H是极性键;CCl4中只含有极性键C—Cl。碳氢键为σ键,碳碳双键中有一个σ键和一个π键,碳碳三键中有一个σ键和两个π键,苯分子中碳碳之间存在大π键。①⑤中只有σ键,②③④既含σ键、又含π键。
2
【学习目标】
1.了解原子的成键特点和成键方式的多样性,能以此认识到有机化合物种类繁多的原因。培养宏观辨识与微观探析的化学核心素养。
2.了解单键、双键、三键的特点,知道碳原子的饱和程度对有机化合物性质的重要影响。培养宏观辨识与微观探析的化学核心素养。
3.学会有机物分子结构的表示方法,熟知几种典型分子构型。培养证据推理与模型认知的化学核心素养。
【自主预习】
一、碳原子的成键特点
1.碳原子的成键特点
碳原子最外层有 个电子,通常以 的形式与其他原子成键,达到最外层 个电子的稳定结构。
2.结合方式的多样性
(1)碳原子之间可以形成 ,也可以形成 ,还可以形成 。
(2)多个碳原子可以相互结合形成 结构,也可以形成 结构。
(3)碳原子除了彼此间成键外,还可以与 等其他元素的原子成键。
3.单键、双键和三键与空间构型
碳碳单键 碳碳双键 碳碳三键
表示方式 —C≡C—
成键方式 1个碳原子与周围 个原子成键;碳碳之间共用 对电子 1个碳原子与周围 个原子成键;碳碳之间共用 对电子 1个碳原子与周围 个原子成键;碳碳之间共用 对电子
键角
空间构型 碳原子与其他4个原子形成 结构 双键碳原子及与之相连的原子处于 上 三键碳原子及与之相连的原子处于 上
二、极性键和非极性键
1.极性键: 元素的两个原子成键时,它们吸引共用电子的能力不同,共用电子将偏向吸引电子能力较强的一方,所形成的共价键是极性共价键,简称极性键。
2.非极性键: 元素的两个原子成键时,它们吸引共用电子的能力相同,所形成的共价键是非极性共价键,简称非极性键。
3.有机化合物分子中常见共价键的类型
键型 极性键 非极性键
单键 H3C—H H3C—OH H3C—Cl H3C—Br H3C—CH3
双键 H2CCH2
三键
4.键的极性与有机化合物分子反应活性的关系
共价键是否具有极性及极性的强弱程度对有机化合物的性质有着重要影响。键的极性越强,越容易 ,有机化合物分子的反应活性 。
【答案】
一、1.四 共用电子对 八 2.单键 双键 三键 链状 环状 H、O、N、Cl 3.4 1 3 2 2 3 109°28' 120° 180° 四面体形 同一平面 同一直线
二、1.不同 2.同种 4.断裂 越强
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)CH4与CH3Cl均为正四面体结构分子。 ( )
(2)有机物分子中均有极性键和非极性键。 ( )
(3)含有甲基的有机物中所有原子一定不可能共平面。 ( )
(4)含有碳碳三键的有机物均为直线结构。 ( )
(5)存在苯环结构的有机物至少有12个原子共平面。 ( )
【答案】(1)× (2)× (3)√ (4)× (5)√
2. 某有机化合物结构简式为
。分析其结构并回答下列问题:
(1)写出其分子式: ,其中含有 个不饱和碳原子,分子中的饱和碳原子有 个。
(2)分子中的极性键有 (写出两种即可),分子中有 种双键。
(3)该物质具有的性质是 (填字母)。
a.可以与溴水反应
b.可以使酸性高锰酸钾溶液褪色
c.可以与Na反应
d.可以发生加成反应
e.只能发生还原反应,不能发生氧化反应
【答案】(1)C16H16O5 12 4 (2)碳氧键、氧氢键、碳氢键(任意两种即可) 2 (3)abcd
【解析】(1)根据碳原子的成键特点,与4个原子形成共价键的碳原子称之为饱和碳原子,成键原子数目小于4的碳原子称之为不饱和碳原子,共有不饱和碳原子12个,具有四面体结构的碳原子为饱和碳原子,共有4个。(2)凡是不同元素的原子之间形成的共价键都称之为极性键,此分子中有碳氧单键、碳氧双键、碳氢键、氧氢键四种极性键。此分子中有碳碳双键和碳氧双键两种双键,此外还有碳碳三键和苯环。(3)该物质中有双键、三键,可以发生加成反应,同时也可发生还原反应,不饱和键的存在可以使酸性高锰酸钾溶液或溴水褪色;羟基(—OH)、羧基(—COOH)可以与钠反应;不饱和键、羟基等都可以发生氧化反应。
【合作探究】
任务1 单键、双键和三键
情境导入 “病毒肺炎诊疗方案”抗病毒治疗中增加了磷酸氯喹和阿比多尔两种药物。合成磷酸氯喹的原料之一氯喹(H)与合成阿比朵尔的中间体(I)的结构如图所示:
问题生成
1.与碳原子成键的有哪些元素的原子 每个碳原子通常能形成几个共价键
【答案】H、N、C、Cl、O、S、Br;4。
2.碳原子与哪些元素的原子形成单键 与哪些元素的原子形成双键
【答案】碳原子与氯、氢、溴元素的原子间形成单键,碳原子与碳、氮、氧、硫元素的原子间形成了单键或双键。
3.找出碳原子与碳原子之间形成的环状和链状结构,碳原子与其他原子之间形成的环状结构。
【答案】两种有机物中均存在碳原子与碳原子之间形成的苯环结构和链状结构,及多个碳原子与氮原子之间形成环状结构。
【核心归纳】
1.有机物中碳碳单键、双键和三键的性质
碳碳单键 碳碳双键 碳碳三键
键能 347 kJ·mol-1 614 kJ·mol-1 839 kJ·mol-1
键长 0.154 nm 0.134 nm 0.121 nm
碳原子是否饱和 饱和 不饱和 不饱和
稳定性 稳定 一个键较另一个键易断裂 两个键较另一个键易断裂
溴的CCl4溶液 不反应 加成反应 加成反应
酸性KMnO4溶液 不反应 氧化反应 氧化反应
2.基本结构四类型
(1)甲烷——sp3杂化
①甲烷分子为正四面体结构。
②甲基上的四个原子不共面。
(2)乙烯——sp2杂化
①乙烯分子为平面形结构。
②乙烯分子中双键碳原子和与之相连的4个氢原子在同一平面上。
③烯烃分子中双键碳原子和与双键碳原子直接相连的4个原子在同一平面上。
(3)苯——sp2杂化
①苯分子为平面形结构。
②苯分子中6个碳原子和与之相连的6个氢原子在同一平面上。
③芳香烃中苯环上的6个碳原子和与其直接相连的6个原子一定在同一平面上。
(4)乙炔——sp杂化
H—C≡C—H
①乙炔分子为直线形结构。
②乙炔分子中三键碳原子和与之相连的2个氢原子在同一直线上。
③炔烃中三键碳原子和与三键碳原子直接相连的2个原子在同一直线上。
(5)组合结构
组合结构就是将前面的四种类型的基团按一定方式连接成某种有机物。如,作如下分析(图示)
其中可能共平面的原子最多有20个(M+N),最少有14个(N),一定共直线的原子最多有6个(L)。
(6)有机物共线、共面问题的分析思路
①若要分析有机物中碳原子的共线、共面问题,则要进行单元分割,必要时要兼顾分子对称性。
②单键可以旋转,双键和三键则不能旋转。
③若在分子结构中有一个碳原子形成四个单键,则该分子中不是所有原子都在同一平面上。
【典型例题】
【例1】下列有机化合物中碳原子的连接方式不可能的是( )。
A. B.
C. D.
【答案】C
【解析】碳原子周围形成四个共价键,常见的可以形成碳碳单键、碳碳双键和碳碳三键,C项中2号碳形成了五个共价键,不符合价键原理,C项错误。
【例2】下列有机物分子中,所有原子不可能在同一平面上的是( )。
A.CH2CH—C≡N B.CH2CH—CHCH2
C. D.
【答案】D
【解析】据甲烷、乙烯、乙炔、苯的结构可知A、B、C三项中所有原子均可能在同一平面上,只有D项中含有—CH3,所有原子不可能共平面。
【例3】有机物的表示方法多种多样,下面是常用的有机物的表示方法:
① ② ③CH4
④ ⑤
⑥
⑦
⑧
⑨
⑩
(1)上述表示方法中属于结构简式的为 ;属于结构式的为 ;属于键线式的为 ;属于空间填充模型的为 ;属于球棍模型的为 。
(2)写出⑨的分子式: 。
(3)写出⑩中官能团的电子式: 、 。
(4)②的分子式为 ,最简式为 。
【答案】(1)①③④⑦ ⑩ ②⑥⑨ ⑤ ⑧
(2)C11H18O2 (3)···H ···H
(4)C6H12 CH2
【灵犀一点】
有机物分子结构的表示方法
种类 实例 含义
分子式 CH4 用元素符号表示物质分子组成的式子,可反映出一个分子中原子的种类和数目
最简式 (实验式) 乙烷C2H6 最简式为CH3 ①表示物质组成的各元素原子最简整数比的式子 ②由最简式可求最简式量
电子式 H 用小黑点等记号代替电子,表示原子最外层电子成键情况的式子
结构式 ①具有化学式所能表示的意义,能反映物质的结构 ②表示分子中原子的结合或排列顺序的式子,但不表示空间结构
结构简式 (示性式) CH2CHCH3 将结构式中碳碳单键、碳氢键等短线省略后得到的式子即为结构简式,它比结构式书写简单,比较常用。结构式的简便写法,着重突出结构特点(官能团)
键线式 (丁烷) (丙烯) (氯乙烷) 只要求写出碳碳键及与碳原子相连的官能团,并用近似的键角表示,每个拐点或终点均表示一个碳原子,即为键线式
球棍 模型 小球表示原子,短棍表示价键,用于表示分子的空间结构(立体形状)
空间 填充 模型 ①用不同体积的小球表示不同大小的原子 ②用于表示分子中各原子的相对大小和结合顺序
任务2 极性键和非极性键
情境导入 乙醇与钠反应时能够产生氢气,乙醇分子中含有六个氢原子,精确实验表明产生的氢气中的氢原子来自O—H键上的氢原子,而不是C—H键上的。
问题生成
1.为什么产生的氢气中的氢原子来自O—H键上的氢原子
【答案】因为氧的电负性大于碳的电负性,O—H键的极性比C—H键的极性强,O—H键易断裂,C—H键难断裂。
2.共价键为什么会表现出极性
【答案】不同原子对电子的吸引能力不同,造成共用电子对发生偏移。
3.共价键的极性对有机物的性质有何影响
【答案】乙醇能与钠反应放出氢气,而乙烷与钠不反应,原因是乙醇中O—H键的极性比乙烷中C—H键的强。
4.共价键的极性与成键原子的得电子能力有何关系 影响共价键极性的因素还有哪些
【答案】两个成键原子得电子能力(吸引共用电子对的能力)差别越大,形成的共价键的极性越强。如H—F键的极性比C—H键的极性强得多。共价键的极性及其强弱还会受分子中邻近基团或外界环境的影响。
【核心归纳】
共价键极性的判断和比较
(1)可以根据成键元素原子吸引电子能力或电负性的差异来判断,差异越大,键的极性越强。如:H—O键、H—C键、H—Cl键的极性大小关系是H—O键>H—Cl键>H—C键。
(2)共价键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响。
【典型例题】
【例4】下列关于苯乙炔()的说法错误的是( )。
A.该分子有8个σ键和5个π键
B.该分子中碳原子有sp和sp2杂化
C.该分子中含有极性键和非极性键
D.该分子中有8个碳原子在同一平面上
【答案】A
【解析】A项,苯乙炔分子中含有14个σ键,苯环中有1个大π键,碳碳三键(C≡C)中有2个π键,故共含有3个π键,错误;B项,苯环中碳原子都采取sp2杂化,碳碳三键碳原子采取sp杂化,故该分子中碳原子有sp和sp2杂化,正确;C项,同种原子间形成的共价键为非极性键,不同原子间形成的共价键为极性键,该分子中碳原子间形成非极性键,碳与氢原子间形成极性键,正确;D项,苯环是平面形结构,碳碳三键是直线形结构,因此该分子中有8个碳原子在同一平面上,正确。
【例5】某有机物的结构如图所示:
根据该有机物的结构回答下列问题:
(1)该物质的1个分子中含有 个不饱和碳原子。
(2)分子中的单键分别为 (写名称,下同);分子中的双键分别为 ;1个分子中三键的数目为 。
(3)写出两种极性键: ;写出两种非极性键: 。
【答案】(1)4
(2)碳氢单键、碳氯单键、碳硫单键、碳碳单键 碳氧双键、碳碳双键 1
(3)碳氢单键、碳氯单键、碳硫单键、碳氧双键、碳氮三键(写两种即可) 碳碳单键、碳碳双键
【随堂检测】
1.下列化学用语书写正确的是( )。
A.甲烷的电子式:H
B.丙烯的键线式:
C.乙醇的结构式:
D.乙炔的结构简式:CHCH
【答案】A
【解析】丙烯的键线式为;乙醇的结构式为;乙炔的结构简式为CH≡CH。
2.下列说法正确的是( )。
A.碳骨架为的烃的结构简式为(CH3)2CCH2
B.有机物分子里一定既有非极性键又有极性键
C.有的烃分子中,一个碳原子形成3个共价键
D.乙烷的键线式为
【答案】A
【解析】根据碳原子的成键特点,碳原子之间可形成非极性共价键,碳原子与其他原子之间则以极性共价键结合,但是甲烷分子中只有极性键,B项错误。有机物中碳原子通过4个共价键与其他原子相连,C项错误。应为丙烷的键线式,D项错误。
3.据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
下列对该物质的说法中正确的是( )。
A.①处的化学键表示碳碳双键
B.此星际分子属于烃类
C.③处的原子可能是氯原子或氟原子
D.②处的化学键表示碳碳单键,是非极性键
【答案】D
【解析】有机物分子中碳原子要满足4个价键,推测其结构简式为H—C≡C—C≡,所以①处是碳碳三键,③处是N原子(若为F或Cl,则C原子不能满足4个价键),②处是碳碳单键。
4.下列关于CH3—C≡C—CH2—CH3的说法正确的是( )。
A.分子中含有极性共价键和非极性共价键
B.分子中只有极性键
C.碳碳三键键能是碳碳单键键能的三倍
D.分子中只有非极性键
【答案】A
【解析】在题给分子中,碳碳单键和碳碳三键均属于非极性键,碳氢单键属于极性键,A项正确,B、D两项错误;碳碳三键键能要小于碳碳单键键能的三倍,C项错误。
5.已知下列物质:①CH4 ②CH≡CH ③CH2CH2
④ ⑤CCl4
其中,只含有极性键的是 ,既含有极性键又含有非极性键的是 ;既含单键又含双键的是 ,既含σ键、又含π键的是 。
【答案】①⑤ ②③④ ③ ②③④
【解析】CH4中只含有C—H,C—H为极性键;CH≡CH中含有C≡C(非极性键)与C—H(极性键);CH2CH2中含有非极性键CC和极性键C—H;苯中碳和碳之间是非极性键,C—H是极性键;CCl4中只含有极性键C—Cl。碳氢键为σ键,碳碳双键中有一个σ键和一个π键,碳碳三键中有一个σ键和两个π键,苯分子中碳碳之间存在大π键。①⑤中只有σ键,②③④既含σ键、又含π键。
2
