2024届高三化学二轮复习专题14:水溶液中的离子平衡(共21张PPT)
文档属性
| 名称 | 2024届高三化学二轮复习专题14:水溶液中的离子平衡(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-05 22:23:28 | ||
图片预览




文档简介
(共21张PPT)
2024届高三化学二轮复习专题
专题十四: 水溶液中的离子平衡
【新课程标准】
1.理解电解质在水中的电离以及电解质溶液的导电性。
2.了解水的电离、离子积常数。
3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
4.了解盐类水解的原理、影响盐类水解程度的主要因素,盐类水解的应用。
5.了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算
【命题热点及近五年考频考题】
2023年湖南卷T12;2023年海南卷T14;2023年河北卷T8;2023年河北卷T14;2023年辽宁卷T15;2023年全国新课标T13;2023年全国甲卷T13;
2022年湖南卷T10;2022年山东卷T14;2022全国乙卷T13;2022年湖北卷T15;2022年海南卷T14;2022江苏卷T12
2021湖南卷T9;2021海南卷T13;2021浙江卷T15;2021全国甲卷T12;2021辽宁卷T15;2021湖北卷T14;2021天津卷T10;2021江苏卷T13;
2020全国l卷T13;2020年全国Ⅱ卷T12;2020山东卷T15;2020浙江卷T17、T23;2020天津卷T7;2020北京卷T11;
2019浙江卷T21;2019江苏卷T14;2019天津卷T13;2019海南卷T14
【研磨典题】
【例题】(2023年海南卷改编)25℃下,Na2CO3水溶液的
pH随其浓度的变化关系如图所示。下列说法正确( )
A. c(Na2CO3)=0.6mol.L-1时,溶液中c(OH-)<0.01mol.L-1
B. Na2CO3水解程度随其浓度增大而增大
C. 在水中H2CO3的Ka2<4 x 10-11
D. 0.2mol.L-1的Na2CO3溶液和0.3mol.L-1的NaHCO3溶液等体积混合,得到的溶液c(OH-)<2 x 10-4mol.L-1
D
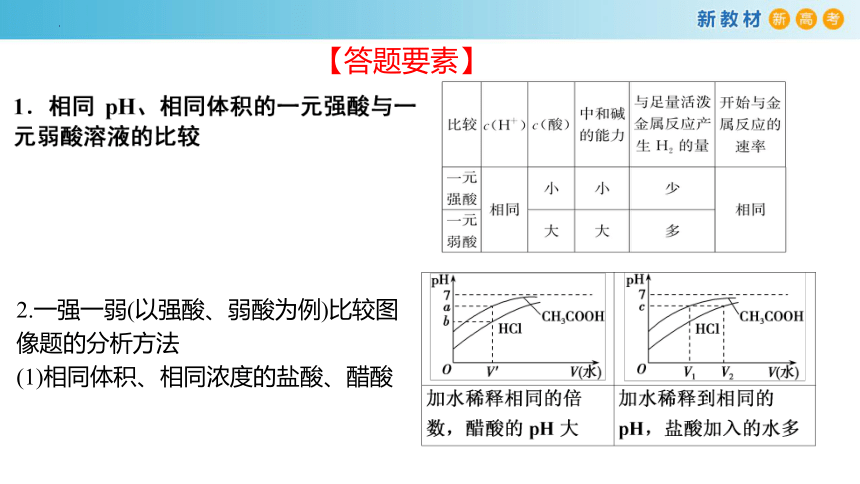
【答题要素】
2.一强一弱(以强酸、弱酸为例)比较图像题的分析方法
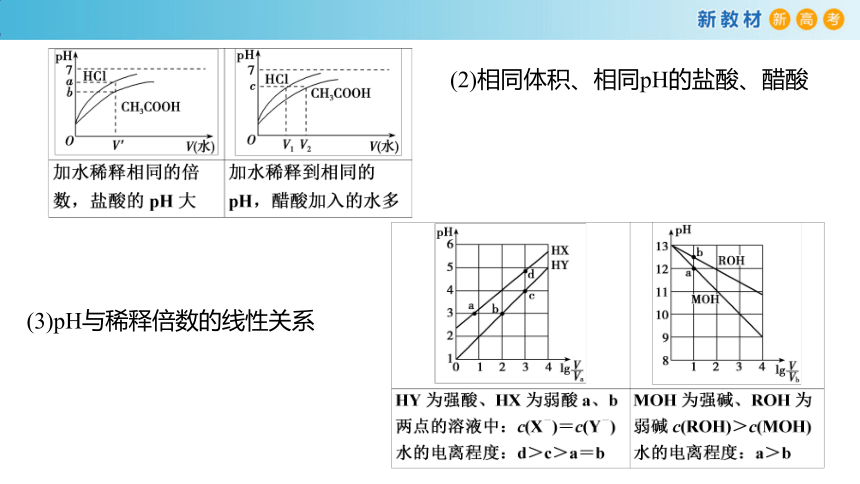
(1)相同体积、相同浓度的盐酸、醋酸
(2)相同体积、相同pH的盐酸、醋酸
(3)pH与稀释倍数的线性关系
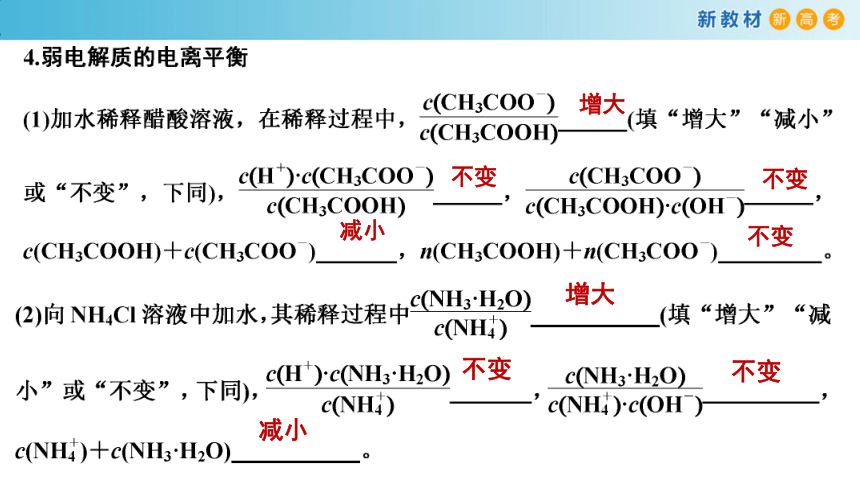
增大
不变
不变
减小
不变
增大
不变
不变
减小
(1)写出H2C2O4的电离方程式及电离平衡常数表达式:
①H2C2O4 H++HC2O4-,
Ka1=
②HC2O4- H++C2O42-,
Ka2 = 。
(2)根据A点,Ka1=10-1.2,根据B点Ka2=10-4.2。
(3)在pH=2.7的溶液中, =1 000。
(4)0.1 mol/L的NaHC2O4溶液呈酸性,其离子浓度从大到小的顺序为
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
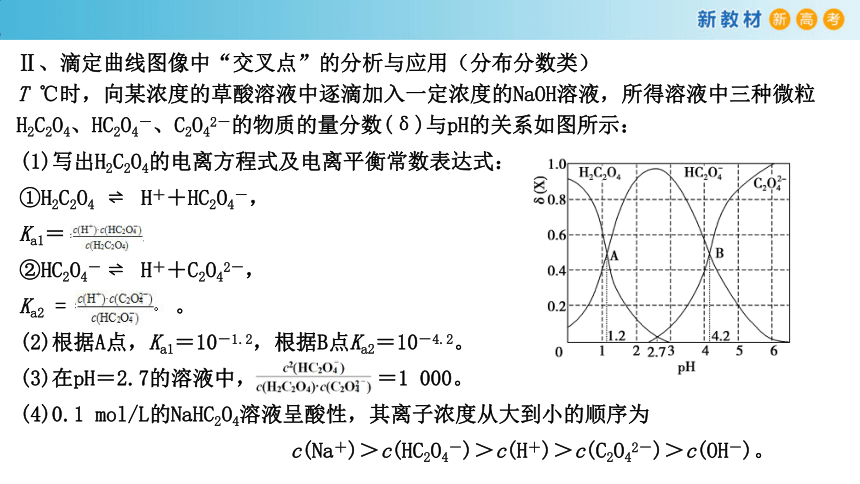
Ⅱ、滴定曲线图像中“交叉点”的分析与应用(分布分数类)
T ℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数(δ)与pH的关系如图所示:
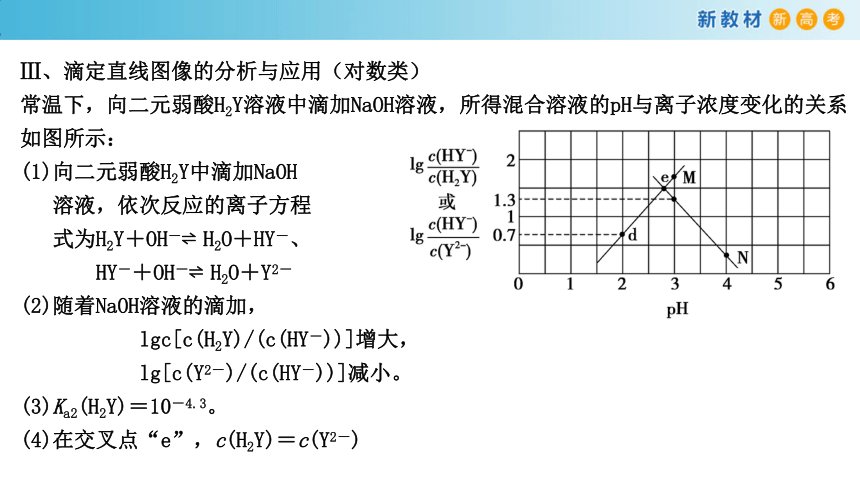
Ⅲ、滴定直线图像的分析与应用(对数类)
常温下,向二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
(1)向二元弱酸H2Y中滴加NaOH
溶液,依次反应的离子方程
式为H2Y+OH- H2O+HY-、
HY-+OH- H2O+Y2-
(2)随着NaOH溶液的滴加,
lgc[c(H2Y)/(c(HY-))]增大,
lg[c(Y2-)/(c(HY-))]减小。
(3)Ka2(H2Y)=10-4.3。
(4)在交叉点“e”,c(H2Y)=c(Y2-)
【真题再练】
(2023年湖南卷)1、常温下,用浓度为0.0200mol.L-1的NaOH标准溶液滴定浓度均为0.0200mol.L-1 的HCl和CH3COOH的混合溶液,滴定过程中溶液的PH随
的变化曲线如图所示。下列说法错误的是( )
A. 约为10-4.36
B. 点a:
C 点b:
D. 水的电离程度:
【分析】NaOH溶液和HCl、CH3COOH混酸反应时,先与强酸
反应,然后再与弱酸反应,由滴定曲线可知,a点时NaOH溶
液和HCl恰好完全反应生成NaCl和水,CH3COOH未发生反应,
溶质成分为NaCl和CH3COOH;b点时NaOH溶液反应掉一半的CH3COOH,溶质成分为NaCl、CH3COOH和 CH3COONa;c点时NaOH溶液与CH3COOH恰好完全反应,溶质成分为NaCl、CH3COONa;d点时NaOH过量,溶质成分为NaCl、CH3COONa和NaOH,据此解答。
D
(2022年湖南卷)5、室温时,用0.100mol·L-1的标准AgNO3溶液滴定15.00mL浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17)。
下列说法正确的是( )
A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100mol·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
C
【分析】向含浓度相等的 Cl-、 Br-和 I-混合溶液中滴
加硝酸银溶液,根据三种沉淀的溶度积常数,三种离
子沉淀的先后顺序为I-、Br-、Cl-,根据滴定图示,当
滴入4.50mL硝酸银溶液时,Cl-恰好沉淀完全,此时共消耗硝酸银的物质的量为4.50mL×10-3L/mL×0.1000mol/L=4.5×10-4mol,所以Cl-、 Br-和 I-均为1.5×10-4mol。
(2022年湖北卷)6、下图是亚砷酸As(OH)3和酒石酸(H2T,lgKa1=-3.04,lgKa2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4mol·L-1,总T为1.0×10-3mol·L-1)下列说法错误( )
A.As(OH)3的lgKa1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物种为As(OH)3
D
(2022年山东卷)7、工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1mol·L-1、1.0mol·L-1Na2CO3溶液,含SrSO4(s)的0.1mol·L-1、1.0mol·L-1Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是 ( )
A.反应SrSO4(s)+CO32- SrCO3(s)+SO42-的平衡常数
B. a = -6.5
C.曲线④代表含SrCO3(s)的1.0mol·L-1Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为
1.0mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
D
【分析】溶液pH变化,含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,pH相同时,溶液中硫酸根离子越大,锶离子浓度越小,所以曲线①代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1mol/L硫酸钠溶液的变化曲线;碳酸是弱酸,溶液pH减小,溶液中碳酸根离子离子浓度越小,锶离子浓度越大,pH相同时,1mol/L碳酸钠溶液中碳酸根离子浓度大于0.1mol/L碳酸钠溶液,则曲线③表示含碳酸锶固体的0.1mol/L碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线。
【预测押题】
1、NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
C
2、取两份10 mL 0.05 mol/L的NaHCO3溶液,一份滴
加0.05mol/L-1的盐酸,另一份滴加0.05 mol/L-1
NaOH溶液,溶液的pH随加入酸(或碱)体积的变化
如图。下列说法不正确的是( )
A.由a点可知:NaHCO3溶液中HCO的水解程度大于电离程度
B.a→b→c过程中:c(HCO3-)+2c(CO32-)+c(OH-)逐渐减小
C.a→d→e过程中:c(Na+)<c(HCO3-)+c(CO32-)+c(H2CO3)
D.令c点的c(Na+)+c(H+)=x,e点的c(Na+)+c(H+)=y,则x>y
C
3、常温下,用0.1000 mol/L的盐酸分别滴定20.00 mL浓度均为0.1000 mol/L三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如
图所示。下列判断错误的是( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别加20mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
C
4、以酚酞为指示剂,用0.1000mol/L的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体
积VNaOH的变化关系如图所示.[比如A2-的分
布系数:
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol/L
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中:c(Na+)<2c(A2-)+c(HA-)
C
下列叙述正确的是( )
5、已知相同温度Ksp(BaSO4)A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值
为1.0×10-10
C.加适量BaCl2固体可使溶液由
a点变到b点
D.C(Ba2+)=10-5.1时两溶液中
B
6、用0.1000mol/L盐酸滴定20.00mLNa2A溶
液,溶液中H2A、HA-、A2-的分布分数δ 随
PH变化曲线及滴定曲线如图下列说法正确
的是( )
【如A2-分布分数: 】
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A )
C.第一次突变,可选酚酞作指示剂 D.c(Na2A)=0.2000mol/L
C
7、常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1mol/L-1,溶液中各含磷物种的pc—pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)说法正确( )
A. 曲线①表示Pc(H3PO3)随pOH的变化
B. H3PO3的结构简式为
C. pH=4的溶液中:c(H2PO3-)<0.1mol/L-2c(HPO32-)
D. H3PO3+HPO32- 2H2PO3-的平衡常数K>1.0×105
D
2024届高三化学二轮复习专题
专题十四: 水溶液中的离子平衡
【新课程标准】
1.理解电解质在水中的电离以及电解质溶液的导电性。
2.了解水的电离、离子积常数。
3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
4.了解盐类水解的原理、影响盐类水解程度的主要因素,盐类水解的应用。
5.了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算
【命题热点及近五年考频考题】
2023年湖南卷T12;2023年海南卷T14;2023年河北卷T8;2023年河北卷T14;2023年辽宁卷T15;2023年全国新课标T13;2023年全国甲卷T13;
2022年湖南卷T10;2022年山东卷T14;2022全国乙卷T13;2022年湖北卷T15;2022年海南卷T14;2022江苏卷T12
2021湖南卷T9;2021海南卷T13;2021浙江卷T15;2021全国甲卷T12;2021辽宁卷T15;2021湖北卷T14;2021天津卷T10;2021江苏卷T13;
2020全国l卷T13;2020年全国Ⅱ卷T12;2020山东卷T15;2020浙江卷T17、T23;2020天津卷T7;2020北京卷T11;
2019浙江卷T21;2019江苏卷T14;2019天津卷T13;2019海南卷T14
【研磨典题】
【例题】(2023年海南卷改编)25℃下,Na2CO3水溶液的
pH随其浓度的变化关系如图所示。下列说法正确( )
A. c(Na2CO3)=0.6mol.L-1时,溶液中c(OH-)<0.01mol.L-1
B. Na2CO3水解程度随其浓度增大而增大
C. 在水中H2CO3的Ka2<4 x 10-11
D. 0.2mol.L-1的Na2CO3溶液和0.3mol.L-1的NaHCO3溶液等体积混合,得到的溶液c(OH-)<2 x 10-4mol.L-1
D
【答题要素】
2.一强一弱(以强酸、弱酸为例)比较图像题的分析方法
(1)相同体积、相同浓度的盐酸、醋酸
(2)相同体积、相同pH的盐酸、醋酸
(3)pH与稀释倍数的线性关系
增大
不变
不变
减小
不变
增大
不变
不变
减小
(1)写出H2C2O4的电离方程式及电离平衡常数表达式:
①H2C2O4 H++HC2O4-,
Ka1=
②HC2O4- H++C2O42-,
Ka2 = 。
(2)根据A点,Ka1=10-1.2,根据B点Ka2=10-4.2。
(3)在pH=2.7的溶液中, =1 000。
(4)0.1 mol/L的NaHC2O4溶液呈酸性,其离子浓度从大到小的顺序为
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
Ⅱ、滴定曲线图像中“交叉点”的分析与应用(分布分数类)
T ℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数(δ)与pH的关系如图所示:
Ⅲ、滴定直线图像的分析与应用(对数类)
常温下,向二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
(1)向二元弱酸H2Y中滴加NaOH
溶液,依次反应的离子方程
式为H2Y+OH- H2O+HY-、
HY-+OH- H2O+Y2-
(2)随着NaOH溶液的滴加,
lgc[c(H2Y)/(c(HY-))]增大,
lg[c(Y2-)/(c(HY-))]减小。
(3)Ka2(H2Y)=10-4.3。
(4)在交叉点“e”,c(H2Y)=c(Y2-)
【真题再练】
(2023年湖南卷)1、常温下,用浓度为0.0200mol.L-1的NaOH标准溶液滴定浓度均为0.0200mol.L-1 的HCl和CH3COOH的混合溶液,滴定过程中溶液的PH随
的变化曲线如图所示。下列说法错误的是( )
A. 约为10-4.36
B. 点a:
C 点b:
D. 水的电离程度:
【分析】NaOH溶液和HCl、CH3COOH混酸反应时,先与强酸
反应,然后再与弱酸反应,由滴定曲线可知,a点时NaOH溶
液和HCl恰好完全反应生成NaCl和水,CH3COOH未发生反应,
溶质成分为NaCl和CH3COOH;b点时NaOH溶液反应掉一半的CH3COOH,溶质成分为NaCl、CH3COOH和 CH3COONa;c点时NaOH溶液与CH3COOH恰好完全反应,溶质成分为NaCl、CH3COONa;d点时NaOH过量,溶质成分为NaCl、CH3COONa和NaOH,据此解答。
D
(2022年湖南卷)5、室温时,用0.100mol·L-1的标准AgNO3溶液滴定15.00mL浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17)。
下列说法正确的是( )
A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100mol·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
C
【分析】向含浓度相等的 Cl-、 Br-和 I-混合溶液中滴
加硝酸银溶液,根据三种沉淀的溶度积常数,三种离
子沉淀的先后顺序为I-、Br-、Cl-,根据滴定图示,当
滴入4.50mL硝酸银溶液时,Cl-恰好沉淀完全,此时共消耗硝酸银的物质的量为4.50mL×10-3L/mL×0.1000mol/L=4.5×10-4mol,所以Cl-、 Br-和 I-均为1.5×10-4mol。
(2022年湖北卷)6、下图是亚砷酸As(OH)3和酒石酸(H2T,lgKa1=-3.04,lgKa2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4mol·L-1,总T为1.0×10-3mol·L-1)下列说法错误( )
A.As(OH)3的lgKa1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高
D.pH=7.0时,溶液中浓度最高的物种为As(OH)3
D
(2022年山东卷)7、工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1mol·L-1、1.0mol·L-1Na2CO3溶液,含SrSO4(s)的0.1mol·L-1、1.0mol·L-1Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是 ( )
A.反应SrSO4(s)+CO32- SrCO3(s)+SO42-的平衡常数
B. a = -6.5
C.曲线④代表含SrCO3(s)的1.0mol·L-1Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为
1.0mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
D
【分析】溶液pH变化,含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,pH相同时,溶液中硫酸根离子越大,锶离子浓度越小,所以曲线①代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1mol/L硫酸钠溶液的变化曲线;碳酸是弱酸,溶液pH减小,溶液中碳酸根离子离子浓度越小,锶离子浓度越大,pH相同时,1mol/L碳酸钠溶液中碳酸根离子浓度大于0.1mol/L碳酸钠溶液,则曲线③表示含碳酸锶固体的0.1mol/L碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线。
【预测押题】
1、NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
C
2、取两份10 mL 0.05 mol/L的NaHCO3溶液,一份滴
加0.05mol/L-1的盐酸,另一份滴加0.05 mol/L-1
NaOH溶液,溶液的pH随加入酸(或碱)体积的变化
如图。下列说法不正确的是( )
A.由a点可知:NaHCO3溶液中HCO的水解程度大于电离程度
B.a→b→c过程中:c(HCO3-)+2c(CO32-)+c(OH-)逐渐减小
C.a→d→e过程中:c(Na+)<c(HCO3-)+c(CO32-)+c(H2CO3)
D.令c点的c(Na+)+c(H+)=x,e点的c(Na+)+c(H+)=y,则x>y
C
3、常温下,用0.1000 mol/L的盐酸分别滴定20.00 mL浓度均为0.1000 mol/L三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如
图所示。下列判断错误的是( )
A.该NaX溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.三种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别加20mL盐酸后,再将三种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
C
4、以酚酞为指示剂,用0.1000mol/L的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体
积VNaOH的变化关系如图所示.[比如A2-的分
布系数:
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol/L
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中:c(Na+)<2c(A2-)+c(HA-)
C
下列叙述正确的是( )
5、已知相同温度Ksp(BaSO4)
B.该温度下BaSO4的Ksp(BaSO4)值
为1.0×10-10
C.加适量BaCl2固体可使溶液由
a点变到b点
D.C(Ba2+)=10-5.1时两溶液中
B
6、用0.1000mol/L盐酸滴定20.00mLNa2A溶
液,溶液中H2A、HA-、A2-的分布分数δ 随
PH变化曲线及滴定曲线如图下列说法正确
的是( )
【如A2-分布分数: 】
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A )
C.第一次突变,可选酚酞作指示剂 D.c(Na2A)=0.2000mol/L
C
7、常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1mol/L-1,溶液中各含磷物种的pc—pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)说法正确( )
A. 曲线①表示Pc(H3PO3)随pOH的变化
B. H3PO3的结构简式为
C. pH=4的溶液中:c(H2PO3-)<0.1mol/L-2c(HPO32-)
D. H3PO3+HPO32- 2H2PO3-的平衡常数K>1.0×105
D
同课章节目录
