5.2.3 硝酸及硝酸与金属反应的计算 课件(共22张PPT)-2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3 硝酸及硝酸与金属反应的计算 课件(共22张PPT)-2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 70.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:57:44 | ||
图片预览








文档简介
(共22张PPT)
第二节 氮及其化合物
第五章 化工生产中的重要非金属元素
第3课时 硝酸及硝酸与金属反应的计算
掌握硝酸的性质和用途,熟悉硝酸的强氧化性
01
掌握硝酸与金属反应计算技巧——电子守恒法、原子守恒法、电荷守恒法
02
学习目标
PART 01
硝酸
1、物理性质
纯硝酸是 色、易 (沸点为83℃)、有 气味的 体,常用浓HNO3的质量分数为69%,能跟水以任意比互溶,打开盛浓硝酸的试剂瓶盖,有白雾产生(与浓盐酸相同)。质量分数为98%以上的浓硝酸挥发出来的HNO3蒸气遇空气中的水蒸气形成极微小的硝酸液滴而产生“发烟现象”。因此,质量分数为98%以上的浓硝酸通常叫做“发烟硝酸”
一、硝酸
无
挥发
刺激性
液
【微点拨】
① 稀硝酸使石蕊试液变红色,浓硝酸使紫色石蕊试液先变红后褪色
(酸性和强氧化性)
② 硝酸具有酸的一些通性,但硝酸与活泼金属反应时无 产生
2、化学性质
(1)酸性:属于强酸,溶于水完全电离: ,具有酸的通性,能与碱、碱性氧化物、某些盐反应
CaCO3与HNO3反应:
(若无稀盐酸可用稀硝酸代替室制CO2)
一、硝酸
氢气
HNO3===H++NO3-
CaCO3+2HNO3(稀)===Ca(NO3)2+CO2↑+H2O
一、硝酸
(2)不稳定性:硝酸见光或受热易发生分解,HNO3越浓,越易分解,温度越高分解越快,光照越强分解越快
。
①实验室中浓硝酸显黄色的原因:浓硝酸分解生成的 又溶于硝酸
所致。消除黄色的方法是向浓硝酸中通入空气或O2,发生反应为
②硝酸一般保存在 试剂瓶中,并放置在 处
【微点拨】
4HNO3
4NO2↑+O 2↑+2H 2O
4NO2+O2+2H2O===4HNO3
棕色
阴凉
NO2
金属与硝酸反应规律
一、硝酸
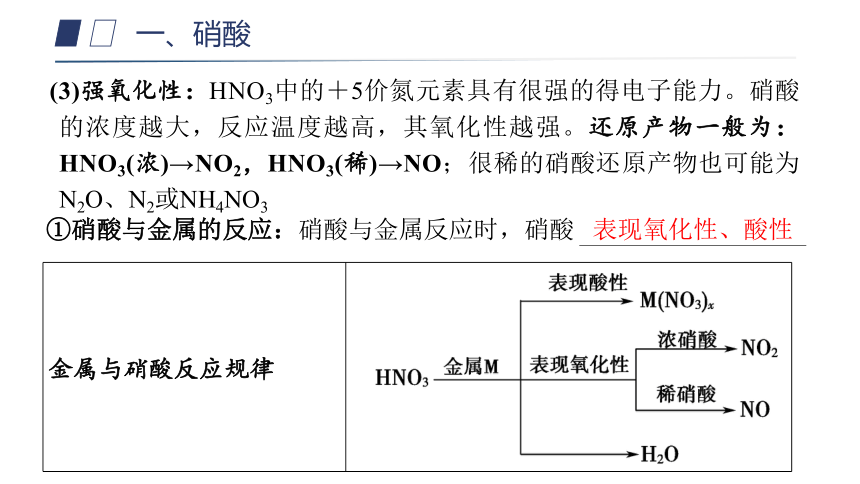
(3)强氧化性:HNO3中的+5价氮元素具有很强的得电子能力。硝酸的浓度越大,反应温度越高,其氧化性越强。还原产物一般为:HNO3(浓)→NO2,HNO3(稀)→NO;很稀的硝酸还原产物也可能为N2O、N2或NH4NO3
表现氧化性、酸性
①硝酸与金属的反应:硝酸与金属反应时,硝酸
一、硝酸
d.与Fe、Al反应:常温下,浓硝酸能使Fe、Al发生钝化,这是因为浓硝酸将Fe、Al表面氧化,使Fe、Al的表面形成一层 薄膜,阻止了反应的进一步进行。常温下,可用 或 制容器盛放浓硝酸,但要注意密封,以防止硝酸挥发变稀后与铁、铝反应。当加热时,加热时可以与Fe、Al发生反应,铁在加热时,与过量的浓硝酸反应: 。
e.铁与稀硝酸反应:先生成Fe(NO3)3,若Fe过量,Fe(NO3)3再与Fe v
反应生成Fe(NO3)2 ,
。
氧化物
Fe+6HNO3(浓)
Fe(NO3)3+3NO2↑+3H2O
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
1∶3
铁
铝
f.王水是浓硝酸和浓盐酸按体积比 的混合物,能使一些不溶于
硝酸的金属如金、铂等溶解
一、硝酸
金属与非硝酸反应规律 非金属单质+浓硝酸 最高价氧化物或其含氧酸
+NO2↑+H2O
②硝酸与非金属的反应:硝酸与非金属反应时,硝酸只表现出
a.木炭与浓硝酸反应:
b.硫与浓硝酸反应:
c.红磷与浓硝酸反应:
CO2↑+4NO2↑+2H2O
C+4HNO3(浓)
S + 6HNO 3(浓)
H2SO4+6 NO2↑+4H2O
H3PO4+5 NO2↑+H2O
P + 5HNO3(浓)
氧化性
一、硝酸
③硝酸与还原性化合物的反应:硝酸可氧化H2S、SO2、Na2SO3、HI(I-)、
Fe2+、FeO等还原性物质
a.稀硝酸与H2S反应的离子方程式:
b.稀硝酸与SO2反应的离子方程式:
c.稀硝酸与Na2SO3反应的离子方程式:
d.稀硝酸与HI反应的离子方程式:
e.稀硝酸与Fe2+反应的离子方程式:
f.稀硝酸与FeO反应的离子方程式:
3H2S+2HNO3(稀)===3S↓+2NO↑+4H2O
3SO2+2NO3-+2H2O===3SO42-+2NO↑+4H+
3SO32-+2NO3-+2H+===3SO42-+2NO↑+H2O
6I-+2NO3-+8H+===3I2+2NO↑+4H2O
3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
3FeO+NO3-+10H+===3Fe3++NO↑+5H2O
一、硝酸
④ NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性
a.在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧
化为Fe3+
b.过量的Cu与浓硝酸反应,待反应停止后,再加入稀盐酸或硫酸,此时铜片上有 生成,这是因为:加入的稀盐酸或硫酸电离出的H+与Cu(NO3)2中的NO3-结合具有强氧化性,能使Cu继续溶解
c.铜片与稀硝酸、稀硫酸反应
。
⑤能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤
无色气体
3Cu+2HNO3+3H2SO4===3CuSO4+2NO↑+4H2O
一、硝酸
3、用途
硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐、氮肥等
4、硝酸的保存方法
硝酸易挥发,见光或受热易分解,具有强氧化性而腐蚀橡胶,因此,实验室保存硝酸时,应将硝酸保存在棕色、细口、磨口玻璃塞的玻璃试剂瓶中,并放置在黑暗且温度较低的地方
5、硝酸的工业制法
一、硝酸
流程示意图
主要流程 将氨和空气的混合气(氧∶氮≈2∶1)通入灼热(760~840 ℃)的铂铑合金网,在合金网的催化作用下,氨被氧化成一氧化氮(NO),生成的一氧化氮结合反应后残余的氧气继续被氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸
各步反应的化学方程式
尾气吸收
,2NO+O2===2NO2,3NO2+H2O===2HNO3+NO
NO2+NO+2NaOH===2NaNO2+ H2O,2NO2 + 2NaOH===NaNO2 + NaNO3 + H2O
一、硝酸
【对点训练1】
1、下列有关浓硝酸的说法中不正确的是( )
A.实验室常用浓硝酸与金属锌反应制备氢气
B.常温下浓硝酸能使金属铝钝化
C.浓硝酸不稳定,见光易分解,需要避光保存
D.浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
2、下列实验事实与硝酸性质不相对应的一组是( )
A.稀硝酸使紫色石蕊溶液变红——酸性
B.铁与稀硝酸反应不能放出氢气——强氧化性
C.要用棕色试剂瓶盛装浓硝酸——不稳定性
D.氢氧化亚铁固体与稀硝酸混合——仅强酸性
C
D
3、将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应剧烈程度:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
①①
②
③
一、硝酸
4、列实验中均有红棕色气体产生,对比分析所得
结论不正确的是( )
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
①
B
D
一、硝酸
5、利用如图所示装置进行铜与硝酸反应的实验。
(1)硝酸一般盛放在棕色试剂瓶中,请用化学方程式说明其原因_______________________________________________
(2)使用稀硝酸进行实验:反应开始后,铜丝逐渐变细,有气泡产生,溶液变蓝①铜与稀硝酸反应的离子方程式为_______________________________________________
②实验中观察到试管中的气体略有红棕色,其原因是___________________________(用化学方程式表示)
3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
2NO+O2===2NO2
硝酸见光易分解:4HNO3 4NO2↑+O2↑+2H2O
一、硝酸
(3)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体
①铜与浓硝酸反应的化学方程式为___________________________________________________
②某同学推测反应后溶液呈绿色的原因是NO2在溶液中达到饱和,NO2的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。他取少量该绿色溶液,向其中加入适量水后溶液变为蓝色,可能的原因是__________________________________(用化学方程式表示)
4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O
3NO2+H2O===2HNO3+NO
PART 02
硝酸与金属反应的计算
二、硝酸与金属反应的计算
1、原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量
例2、3.2 g铜与过量硝酸(8 mol·L-1、30 mL)充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+,则此时溶液中所含NO3-的物质的量为( )
A.(0.2+a)mol B.(0.1+a)mol C.(0.05+a)mol D.a mol
例1、38.4克的Cu与适量的浓HNO3反应,铜全部溶解,共收集到22.4L气体,则反应消耗HNO3的物质的量为________
2.2mol
B
一、硝酸
2、得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量
例3、铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与5.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A.16g B.32g C.64g D.无法计算
例4、1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )mL
A.168 B.224 C. 336 D.504
B
C
一、硝酸
3、离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO进行相关计算,且溶液中要符合电荷守恒
例5、① 19.2g Cu与100ml,2mol/L的HNO3反应可产生标准状况下气体 L
② 19.2g Cu与100ml,2mol/L的HNO3及100ml、2mol/L H2SO4的混合液反应时,可产生标准状况下气体 mol
4、金属与酸再与碱反应:转移的电子的物质的量等于消耗的OH-物质的量
例6、铜镁合金4.6 g 完全溶于浓硝酸中,若反应中硝酸被还原,只产生 4480 mL NO2 气体和 336 mL N2O4气体(标准状况下),反应后的溶液中加足量NaOH溶液,生成沉淀的质量为 g
1.12
0.15
8.51
感谢您的观看
Thank you for watching
第二节 氮及其化合物
第五章 化工生产中的重要非金属元素
第3课时 硝酸及硝酸与金属反应的计算
掌握硝酸的性质和用途,熟悉硝酸的强氧化性
01
掌握硝酸与金属反应计算技巧——电子守恒法、原子守恒法、电荷守恒法
02
学习目标
PART 01
硝酸
1、物理性质
纯硝酸是 色、易 (沸点为83℃)、有 气味的 体,常用浓HNO3的质量分数为69%,能跟水以任意比互溶,打开盛浓硝酸的试剂瓶盖,有白雾产生(与浓盐酸相同)。质量分数为98%以上的浓硝酸挥发出来的HNO3蒸气遇空气中的水蒸气形成极微小的硝酸液滴而产生“发烟现象”。因此,质量分数为98%以上的浓硝酸通常叫做“发烟硝酸”
一、硝酸
无
挥发
刺激性
液
【微点拨】
① 稀硝酸使石蕊试液变红色,浓硝酸使紫色石蕊试液先变红后褪色
(酸性和强氧化性)
② 硝酸具有酸的一些通性,但硝酸与活泼金属反应时无 产生
2、化学性质
(1)酸性:属于强酸,溶于水完全电离: ,具有酸的通性,能与碱、碱性氧化物、某些盐反应
CaCO3与HNO3反应:
(若无稀盐酸可用稀硝酸代替室制CO2)
一、硝酸
氢气
HNO3===H++NO3-
CaCO3+2HNO3(稀)===Ca(NO3)2+CO2↑+H2O
一、硝酸
(2)不稳定性:硝酸见光或受热易发生分解,HNO3越浓,越易分解,温度越高分解越快,光照越强分解越快
。
①实验室中浓硝酸显黄色的原因:浓硝酸分解生成的 又溶于硝酸
所致。消除黄色的方法是向浓硝酸中通入空气或O2,发生反应为
②硝酸一般保存在 试剂瓶中,并放置在 处
【微点拨】
4HNO3
4NO2↑+O 2↑+2H 2O
4NO2+O2+2H2O===4HNO3
棕色
阴凉
NO2
金属与硝酸反应规律
一、硝酸
(3)强氧化性:HNO3中的+5价氮元素具有很强的得电子能力。硝酸的浓度越大,反应温度越高,其氧化性越强。还原产物一般为:HNO3(浓)→NO2,HNO3(稀)→NO;很稀的硝酸还原产物也可能为N2O、N2或NH4NO3
表现氧化性、酸性
①硝酸与金属的反应:硝酸与金属反应时,硝酸
一、硝酸
d.与Fe、Al反应:常温下,浓硝酸能使Fe、Al发生钝化,这是因为浓硝酸将Fe、Al表面氧化,使Fe、Al的表面形成一层 薄膜,阻止了反应的进一步进行。常温下,可用 或 制容器盛放浓硝酸,但要注意密封,以防止硝酸挥发变稀后与铁、铝反应。当加热时,加热时可以与Fe、Al发生反应,铁在加热时,与过量的浓硝酸反应: 。
e.铁与稀硝酸反应:先生成Fe(NO3)3,若Fe过量,Fe(NO3)3再与Fe v
反应生成Fe(NO3)2 ,
。
氧化物
Fe+6HNO3(浓)
Fe(NO3)3+3NO2↑+3H2O
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
1∶3
铁
铝
f.王水是浓硝酸和浓盐酸按体积比 的混合物,能使一些不溶于
硝酸的金属如金、铂等溶解
一、硝酸
金属与非硝酸反应规律 非金属单质+浓硝酸 最高价氧化物或其含氧酸
+NO2↑+H2O
②硝酸与非金属的反应:硝酸与非金属反应时,硝酸只表现出
a.木炭与浓硝酸反应:
b.硫与浓硝酸反应:
c.红磷与浓硝酸反应:
CO2↑+4NO2↑+2H2O
C+4HNO3(浓)
S + 6HNO 3(浓)
H2SO4+6 NO2↑+4H2O
H3PO4+5 NO2↑+H2O
P + 5HNO3(浓)
氧化性
一、硝酸
③硝酸与还原性化合物的反应:硝酸可氧化H2S、SO2、Na2SO3、HI(I-)、
Fe2+、FeO等还原性物质
a.稀硝酸与H2S反应的离子方程式:
b.稀硝酸与SO2反应的离子方程式:
c.稀硝酸与Na2SO3反应的离子方程式:
d.稀硝酸与HI反应的离子方程式:
e.稀硝酸与Fe2+反应的离子方程式:
f.稀硝酸与FeO反应的离子方程式:
3H2S+2HNO3(稀)===3S↓+2NO↑+4H2O
3SO2+2NO3-+2H2O===3SO42-+2NO↑+4H+
3SO32-+2NO3-+2H+===3SO42-+2NO↑+H2O
6I-+2NO3-+8H+===3I2+2NO↑+4H2O
3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
3FeO+NO3-+10H+===3Fe3++NO↑+5H2O
一、硝酸
④ NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性
a.在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧
化为Fe3+
b.过量的Cu与浓硝酸反应,待反应停止后,再加入稀盐酸或硫酸,此时铜片上有 生成,这是因为:加入的稀盐酸或硫酸电离出的H+与Cu(NO3)2中的NO3-结合具有强氧化性,能使Cu继续溶解
c.铜片与稀硝酸、稀硫酸反应
。
⑤能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤
无色气体
3Cu+2HNO3+3H2SO4===3CuSO4+2NO↑+4H2O
一、硝酸
3、用途
硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐、氮肥等
4、硝酸的保存方法
硝酸易挥发,见光或受热易分解,具有强氧化性而腐蚀橡胶,因此,实验室保存硝酸时,应将硝酸保存在棕色、细口、磨口玻璃塞的玻璃试剂瓶中,并放置在黑暗且温度较低的地方
5、硝酸的工业制法
一、硝酸
流程示意图
主要流程 将氨和空气的混合气(氧∶氮≈2∶1)通入灼热(760~840 ℃)的铂铑合金网,在合金网的催化作用下,氨被氧化成一氧化氮(NO),生成的一氧化氮结合反应后残余的氧气继续被氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸
各步反应的化学方程式
尾气吸收
,2NO+O2===2NO2,3NO2+H2O===2HNO3+NO
NO2+NO+2NaOH===2NaNO2+ H2O,2NO2 + 2NaOH===NaNO2 + NaNO3 + H2O
一、硝酸
【对点训练1】
1、下列有关浓硝酸的说法中不正确的是( )
A.实验室常用浓硝酸与金属锌反应制备氢气
B.常温下浓硝酸能使金属铝钝化
C.浓硝酸不稳定,见光易分解,需要避光保存
D.浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
2、下列实验事实与硝酸性质不相对应的一组是( )
A.稀硝酸使紫色石蕊溶液变红——酸性
B.铁与稀硝酸反应不能放出氢气——强氧化性
C.要用棕色试剂瓶盛装浓硝酸——不稳定性
D.氢氧化亚铁固体与稀硝酸混合——仅强酸性
C
D
3、将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应剧烈程度:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
①①
②
③
一、硝酸
4、列实验中均有红棕色气体产生,对比分析所得
结论不正确的是( )
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
①
B
D
一、硝酸
5、利用如图所示装置进行铜与硝酸反应的实验。
(1)硝酸一般盛放在棕色试剂瓶中,请用化学方程式说明其原因_______________________________________________
(2)使用稀硝酸进行实验:反应开始后,铜丝逐渐变细,有气泡产生,溶液变蓝①铜与稀硝酸反应的离子方程式为_______________________________________________
②实验中观察到试管中的气体略有红棕色,其原因是___________________________(用化学方程式表示)
3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
2NO+O2===2NO2
硝酸见光易分解:4HNO3 4NO2↑+O2↑+2H2O
一、硝酸
(3)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体
①铜与浓硝酸反应的化学方程式为___________________________________________________
②某同学推测反应后溶液呈绿色的原因是NO2在溶液中达到饱和,NO2的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。他取少量该绿色溶液,向其中加入适量水后溶液变为蓝色,可能的原因是__________________________________(用化学方程式表示)
4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O
3NO2+H2O===2HNO3+NO
PART 02
硝酸与金属反应的计算
二、硝酸与金属反应的计算
1、原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量
例2、3.2 g铜与过量硝酸(8 mol·L-1、30 mL)充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+,则此时溶液中所含NO3-的物质的量为( )
A.(0.2+a)mol B.(0.1+a)mol C.(0.05+a)mol D.a mol
例1、38.4克的Cu与适量的浓HNO3反应,铜全部溶解,共收集到22.4L气体,则反应消耗HNO3的物质的量为________
2.2mol
B
一、硝酸
2、得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量
例3、铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与5.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A.16g B.32g C.64g D.无法计算
例4、1.92 g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672 mL 的气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )mL
A.168 B.224 C. 336 D.504
B
C
一、硝酸
3、离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO进行相关计算,且溶液中要符合电荷守恒
例5、① 19.2g Cu与100ml,2mol/L的HNO3反应可产生标准状况下气体 L
② 19.2g Cu与100ml,2mol/L的HNO3及100ml、2mol/L H2SO4的混合液反应时,可产生标准状况下气体 mol
4、金属与酸再与碱反应:转移的电子的物质的量等于消耗的OH-物质的量
例6、铜镁合金4.6 g 完全溶于浓硝酸中,若反应中硝酸被还原,只产生 4480 mL NO2 气体和 336 mL N2O4气体(标准状况下),反应后的溶液中加足量NaOH溶液,生成沉淀的质量为 g
1.12
0.15
8.51
感谢您的观看
Thank you for watching
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
