4.2.1电解池原理课件 (共23张PPT)人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.1电解池原理课件 (共23张PPT)人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 61.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 01:01:15 | ||
图片预览




文档简介
(共23张PPT)
阅读课本的21-22页,思考以下问题:
1.电解的概念、电解池的构成条件。
2.阴极:与电源 相连, 电子,发生 反应。
阳极:与电源 相连, 电子,发生 反应。
3.离子的放电顺序如何
4.电解原理模型
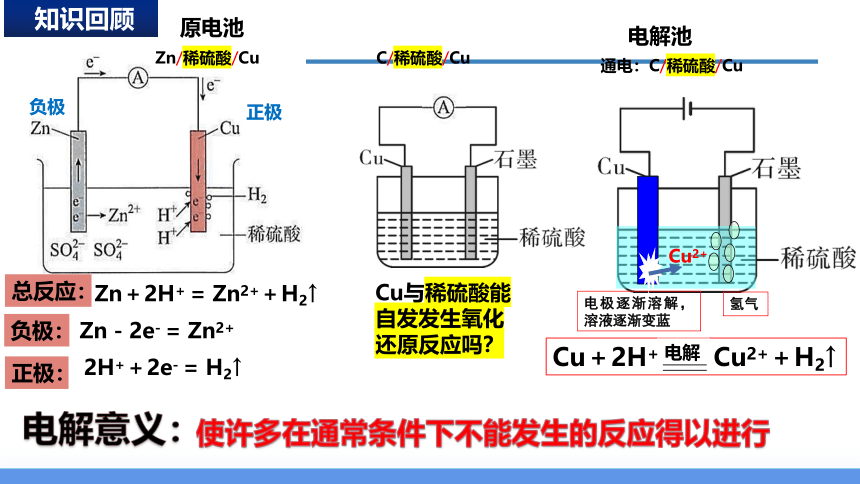
5.电解池电极反应式的书写方法
正极
负极
Zn-2e- = Zn2+
2H++2e- = H2↑
负极:
正极:
总反应:
Zn+2H+ = Zn2++H2↑
Zn/稀硫酸/Cu
C/稀硫酸/Cu
Cu与稀硫酸能自发发生氧化还原反应吗?
通电:C/稀硫酸/Cu
Cu+2H+ Cu2++H2↑
电解
电解意义:
使许多在通常条件下不能发生的反应得以进行
原电池
电解池
Cu2+
电极逐渐溶解,溶液逐渐变蓝
氢气
知识回顾
第1讲 电解池
新人教版 化学 选择性必修一
第四章 化学反应与电能
第二节 电解池
学习目标:
1.了解电解的概念。
2.了解电解池的构成,理解电解池的工作原理。(重点)
3.熟悉常见阴离子的还原性或阳离子的氧化性强弱,
掌握电解池电极反应式和电解反应方程式的书写。
一、电解原理
实验4-2
1.实验探究——电解氯化铜溶液
实验现象 实验分析
电流表指针__________
刺激性
蓝
电解质溶液导电,形成闭合回路
极上逐渐覆盖一层 物质
电解
析出金属铜:
(还原反应)
产生了氯气:
(氧化反应)
红色
一、电解原理
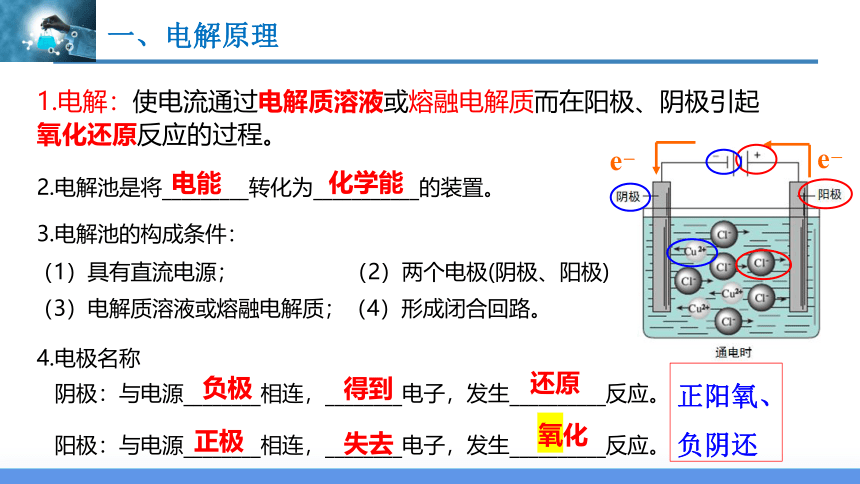
1.电解:使电流通过电解质溶液或熔融电解质而在阳极、阴极引起氧化还原反应的过程。
2.电解池是将_________转化为___________的装置。
电能
化学能
3.电解池的构成条件:
(1)具有直流电源; (2)两个电极(阴极、阳极);
(3)电解质溶液或熔融电解质;(4)形成闭合回路。
4.电极名称
阴极:与电源________相连,________电子,发生__________反应。
阳极:与电源________相连,________电子,发生__________反应。
负极
正极
还原
氧化
得到
失去
e-
e-
正阳氧、
负阴还
一、电解原理
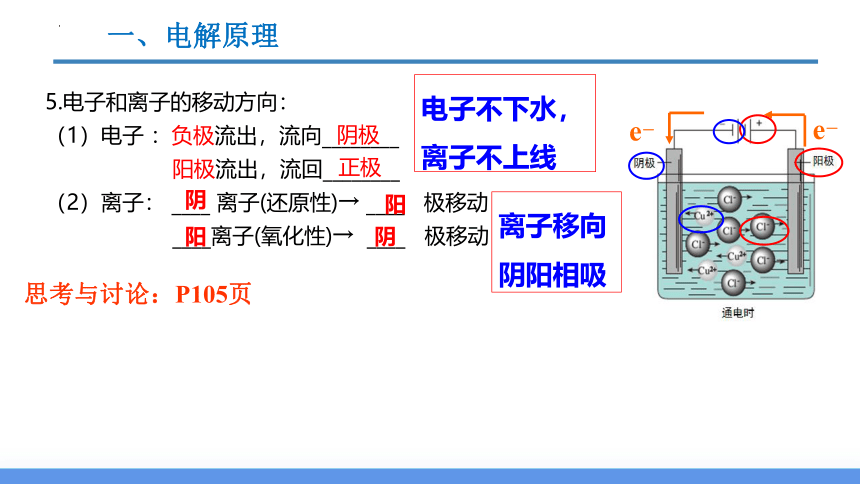
5.电子和离子的移动方向:
(1)电子 :负极流出,流向________
阳极流出,流回________
(2)离子: ____ 离子(还原性)→ ____ 极移动
____离子(氧化性)→ ____ 极移动
离子移向
阴阳相吸
阳
阳
阴
阴
阴极
正极
e-
e-
电子不下水,
离子不上线
思考与讨论:P105页
一、电解原理
阴极电极本身不参与反应
达标检测
区分关键:是否有外接电源
③⑥
下列装置属于电解池的是( )
【自我诊断】
(1)在电解池中与外接电源负极相连的电极是阳极( )
×
(2)在电解池的阳极上发生氧化反应( )
√
(3)电子从电解池的阴极通过电解质溶液流入电解池的阳极( )
×
(4)某些不能自发进行的氧化还原反应,通过电解可以实现( )
√
(5)金属导电是物理变化,电解质溶液导电是化学变化( )
√
(6)电解
( )
×
1.某同学将电解池工作时电子、离子的移动方向及电极种类等信息表示在
下图中,下列有关分析完全正确的是( )
选项 A B C D
B
电解池阴极和阳极的判断依据
通电前:
CuCl2
Cu2+
+
2Cl-
通电时
向阴极迁移
向阳极迁移
2Cl--2e- =Cl2↑
氧化反应
氧化性
Cl- > OH-
Cu2++2e- = Cu
还原反应
Cu2+ > H+
还原性
H2O
H+
OH-
+
总反应:
Cu2+ +2Cl- Cu + Cl2↑
电解
用石墨电极电解CuCl2溶液
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
得失电子的
能力不同,
谁强谁先反应
溶液中氢离子和氢氧根离子定向移动吗?
为什么它们没有放电?
实验4-2
2.阳极(优先考虑电极材料):发生氧化反应,溶液中的阴离子失电子。
1.阴极(与电极材料无关):发生还原反应,溶液中的阳离子得电子。
氧化性
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
阳离子得电子能力
还原性
活性电极>S2->I->Fe2+>Br->Cl->OH->含氧酸根(SO42-、NO3-、CO32-)>F-
阴离子失电子能力
金属活动顺序表倒过来
水溶液(含H+)中不放电,
熔融状态才得电子
K\Ca\Na在水溶液中与直接水反应而不能作电极材料
活性电极:Mg--Ag;惰性电极:Pt、C
电解质离子放电顺序
阳极:
阴极:
总反应:
阳极:
阴极:
总反应:
阳极:
阴极:
总反应:
1.找不同
二、电极反应的书写方法:
辨电极→找离子→排顺序→电极反应式 → 总反应
Cu2++ 2e- = Cu
Cu -2e- =Cu2+
2Cl--2e- =Cl2↑
金属搬家
Cu
Cu2++ 2e- = Cu
Cu2+ +2Cl- Cu + Cl2↑
电解
2Cl--2e- =Cl2↑
Cu2++ 2e- = Cu
Cu2++ Cu= Cu+ Cu2+
电解
思维建模
阳极:与电极材料有关
阴极:与电极材料无关
2.写出电极反应式
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+
三、酸、碱、盐溶液的电解规律(惰性电极)
2.酸、碱、盐溶液的电解规律(惰性电极)
(1)电解水型
电解质
阳极反应式
阴极反应式
总反应
复原加入物质 _____ 减小
增大
不变
2H2O-4e-=
4H+ +O2↑
4H+ +4e-=2H2 ↑
4OH--4e-=2H2O +O2↑
4H2O +4e-=2H2 ↑+ 4OH-
2H2O-4e-=
4H+ +O2↑
4H2O +4e-=2H2 ↑+ 4OH-
电解质溶液复原方法(元素守恒法):
看总反应的产物中什么元素脱离溶液(生成固体或气体),加入阴极与阳极的固\气产物元素的合并的化合物
“少什么加什么,少多少加多少”
2H2O O2↑ +2H2↑
电解
含氧酸
强碱
活泼金属的含氧酸盐
(2)电解电解质型
电解质
阳极反应式 阴极反应式 __________________ _________________
总反应
复原加(通)入物质 _______ _________
增大
2HCl Cl2↑ + H2↑
电解
2Cl -- 2e-=Cl2↑
CuCl2 Cl2↑ + Cu
电解
无氧酸
不活泼金属的无氧酸盐
(3)电解质和水都发生电解型
电解质
阳极反应式 ___________________ _____________________
阴极反应式 _____________________ ___________________
复原加(通)入物质 _______ __________________
<
增大
减小
活泼金属的无氧酸盐
不活泼金属的含氧酸盐
放氢生碱型
放氧生酸型
3.为了加深对电解规律的理解,某同学做了以下探究,要求从
电解。
(1)以碳棒为电极,电解过程中电解质的质量减小,水量不变,则采用
的电解质是____________。若要恢复到电解前的状态,应加入或通入的物
质是____________。
(2)以碳棒为电极,电解过程中电解质的质量不变,水量减少,则采用
的电解质是________________。若要恢复到电解前的状态,应加入或通入
的物质是_____。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水的量都减少,
则采用的电解质是______________。若要恢复到电解前的状态,应加入或
通入的物质是_______________________。
1.写出下列物质中所含离子,
2.判断阴极是何种物质放电,3.写出阴极电极反应。
1)H2SO4溶液
2)HBr溶液
3) NaOH溶液
4)CuBr2溶液
5)AgNO3溶液:
H+、OH―、SO42―
H+、Br―、OH―
H+、 Na+、 OH―
Cu2+、 H+、Br―、OH―
Ag+、 H+、NO3― 、OH―
2H+ + 2e- = H2↑
2H+ + 2e- = H2↑
2H+ + 2e- = H2↑
Cu2+ + 2e- = Cu
Ag+ + e- = Ag
用惰性电极电解下列溶液
达标检测
辨电极→找离子→排顺序→电极反应式 → 总反应
阅读课本的21-22页,思考以下问题:
1.电解的概念、电解池的构成条件。
2.阴极:与电源 相连, 电子,发生 反应。
阳极:与电源 相连, 电子,发生 反应。
3.离子的放电顺序如何
4.电解原理模型
5.电解池电极反应式的书写方法
正极
负极
Zn-2e- = Zn2+
2H++2e- = H2↑
负极:
正极:
总反应:
Zn+2H+ = Zn2++H2↑
Zn/稀硫酸/Cu
C/稀硫酸/Cu
Cu与稀硫酸能自发发生氧化还原反应吗?
通电:C/稀硫酸/Cu
Cu+2H+ Cu2++H2↑
电解
电解意义:
使许多在通常条件下不能发生的反应得以进行
原电池
电解池
Cu2+
电极逐渐溶解,溶液逐渐变蓝
氢气
知识回顾
第1讲 电解池
新人教版 化学 选择性必修一
第四章 化学反应与电能
第二节 电解池
学习目标:
1.了解电解的概念。
2.了解电解池的构成,理解电解池的工作原理。(重点)
3.熟悉常见阴离子的还原性或阳离子的氧化性强弱,
掌握电解池电极反应式和电解反应方程式的书写。
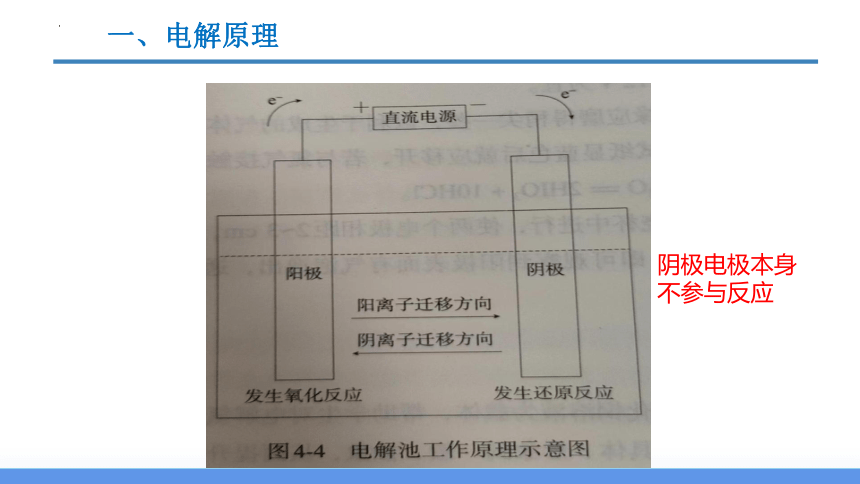
一、电解原理
实验4-2
1.实验探究——电解氯化铜溶液
实验现象 实验分析
电流表指针__________
刺激性
蓝
电解质溶液导电,形成闭合回路
极上逐渐覆盖一层 物质
电解
析出金属铜:
(还原反应)
产生了氯气:
(氧化反应)
红色
一、电解原理
1.电解:使电流通过电解质溶液或熔融电解质而在阳极、阴极引起氧化还原反应的过程。
2.电解池是将_________转化为___________的装置。
电能
化学能
3.电解池的构成条件:
(1)具有直流电源; (2)两个电极(阴极、阳极);
(3)电解质溶液或熔融电解质;(4)形成闭合回路。
4.电极名称
阴极:与电源________相连,________电子,发生__________反应。
阳极:与电源________相连,________电子,发生__________反应。
负极
正极
还原
氧化
得到
失去
e-
e-
正阳氧、
负阴还
一、电解原理
5.电子和离子的移动方向:
(1)电子 :负极流出,流向________
阳极流出,流回________
(2)离子: ____ 离子(还原性)→ ____ 极移动
____离子(氧化性)→ ____ 极移动
离子移向
阴阳相吸
阳
阳
阴
阴
阴极
正极
e-
e-
电子不下水,
离子不上线
思考与讨论:P105页
一、电解原理
阴极电极本身不参与反应
达标检测
区分关键:是否有外接电源
③⑥
下列装置属于电解池的是( )
【自我诊断】
(1)在电解池中与外接电源负极相连的电极是阳极( )
×
(2)在电解池的阳极上发生氧化反应( )
√
(3)电子从电解池的阴极通过电解质溶液流入电解池的阳极( )
×
(4)某些不能自发进行的氧化还原反应,通过电解可以实现( )
√
(5)金属导电是物理变化,电解质溶液导电是化学变化( )
√
(6)电解
( )
×
1.某同学将电解池工作时电子、离子的移动方向及电极种类等信息表示在
下图中,下列有关分析完全正确的是( )
选项 A B C D
B
电解池阴极和阳极的判断依据
通电前:
CuCl2
Cu2+
+
2Cl-
通电时
向阴极迁移
向阳极迁移
2Cl--2e- =Cl2↑
氧化反应
氧化性
Cl- > OH-
Cu2++2e- = Cu
还原反应
Cu2+ > H+
还原性
H2O
H+
OH-
+
总反应:
Cu2+ +2Cl- Cu + Cl2↑
电解
用石墨电极电解CuCl2溶液
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
得失电子的
能力不同,
谁强谁先反应
溶液中氢离子和氢氧根离子定向移动吗?
为什么它们没有放电?
实验4-2
2.阳极(优先考虑电极材料):发生氧化反应,溶液中的阴离子失电子。
1.阴极(与电极材料无关):发生还原反应,溶液中的阳离子得电子。
氧化性
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
阳离子得电子能力
还原性
活性电极>S2->I->Fe2+>Br->Cl->OH->含氧酸根(SO42-、NO3-、CO32-)>F-
阴离子失电子能力
金属活动顺序表倒过来
水溶液(含H+)中不放电,
熔融状态才得电子
K\Ca\Na在水溶液中与直接水反应而不能作电极材料
活性电极:Mg--Ag;惰性电极:Pt、C
电解质离子放电顺序
阳极:
阴极:
总反应:
阳极:
阴极:
总反应:
阳极:
阴极:
总反应:
1.找不同
二、电极反应的书写方法:
辨电极→找离子→排顺序→电极反应式 → 总反应
Cu2++ 2e- = Cu
Cu -2e- =Cu2+
2Cl--2e- =Cl2↑
金属搬家
Cu
Cu2++ 2e- = Cu
Cu2+ +2Cl- Cu + Cl2↑
电解
2Cl--2e- =Cl2↑
Cu2++ 2e- = Cu
Cu2++ Cu= Cu+ Cu2+
电解
思维建模
阳极:与电极材料有关
阴极:与电极材料无关
2.写出电极反应式
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+
三、酸、碱、盐溶液的电解规律(惰性电极)
2.酸、碱、盐溶液的电解规律(惰性电极)
(1)电解水型
电解质
阳极反应式
阴极反应式
总反应
复原加入物质 _____ 减小
增大
不变
2H2O-4e-=
4H+ +O2↑
4H+ +4e-=2H2 ↑
4OH--4e-=2H2O +O2↑
4H2O +4e-=2H2 ↑+ 4OH-
2H2O-4e-=
4H+ +O2↑
4H2O +4e-=2H2 ↑+ 4OH-
电解质溶液复原方法(元素守恒法):
看总反应的产物中什么元素脱离溶液(生成固体或气体),加入阴极与阳极的固\气产物元素的合并的化合物
“少什么加什么,少多少加多少”
2H2O O2↑ +2H2↑
电解
含氧酸
强碱
活泼金属的含氧酸盐
(2)电解电解质型
电解质
阳极反应式 阴极反应式 __________________ _________________
总反应
复原加(通)入物质 _______ _________
增大
2HCl Cl2↑ + H2↑
电解
2Cl -- 2e-=Cl2↑
CuCl2 Cl2↑ + Cu
电解
无氧酸
不活泼金属的无氧酸盐
(3)电解质和水都发生电解型
电解质
阳极反应式 ___________________ _____________________
阴极反应式 _____________________ ___________________
复原加(通)入物质 _______ __________________
<
增大
减小
活泼金属的无氧酸盐
不活泼金属的含氧酸盐
放氢生碱型
放氧生酸型
3.为了加深对电解规律的理解,某同学做了以下探究,要求从
电解。
(1)以碳棒为电极,电解过程中电解质的质量减小,水量不变,则采用
的电解质是____________。若要恢复到电解前的状态,应加入或通入的物
质是____________。
(2)以碳棒为电极,电解过程中电解质的质量不变,水量减少,则采用
的电解质是________________。若要恢复到电解前的状态,应加入或通入
的物质是_____。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水的量都减少,
则采用的电解质是______________。若要恢复到电解前的状态,应加入或
通入的物质是_______________________。
1.写出下列物质中所含离子,
2.判断阴极是何种物质放电,3.写出阴极电极反应。
1)H2SO4溶液
2)HBr溶液
3) NaOH溶液
4)CuBr2溶液
5)AgNO3溶液:
H+、OH―、SO42―
H+、Br―、OH―
H+、 Na+、 OH―
Cu2+、 H+、Br―、OH―
Ag+、 H+、NO3― 、OH―
2H+ + 2e- = H2↑
2H+ + 2e- = H2↑
2H+ + 2e- = H2↑
Cu2+ + 2e- = Cu
Ag+ + e- = Ag
用惰性电极电解下列溶液
达标检测
辨电极→找离子→排顺序→电极反应式 → 总反应
