2024届高三化学二轮复习 专题课件(共56张PPT)-化学反应与平衡
文档属性
| 名称 | 2024届高三化学二轮复习 专题课件(共56张PPT)-化学反应与平衡 |

|
|
| 格式 | pptx | ||
| 文件大小 | 466.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览











文档简介
(共56张PPT)
考 纲 要 求
1、 了解化学反应的可逆性
2、结合图象考查化学平衡建立的过程
3、化学平衡状态的分析、判断与比较
4、理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算,并判断反应进行的方向 5 、理解外界条件(温度、压强、浓度、催化剂)对化学反应平衡的影响,认识其一般规律
6、了解化学平衡的调控在生活、生产和科学研究领域中的重要作用
7、以图象题综合考查勒夏特列原理的应用以及速率与平衡之间的关系
1、可逆反应的特点:
①在相同的条件下,两个方向相反的反应同时进行.
②无论什么条件下,反应都不可能进行彻底.
一、化学平衡状态
2、平衡过程的建立:
在容积为1L的密闭容器里,加0.01molCO和0.01molH2O(g),CO+H2O CO2+H2
c(CO) 、c(H2O)最大,c(CO2) 和c(H2)为0
c(CO) 、c(H2O)逐渐减小
c(CO2) 、c(H2)逐渐增大
所以,正反应速率逐渐减小,逆反应速率逐渐增大.进行到一定程度,正反应速率和逆反应速率的大小不再变化 ,
◆开始瞬时浓度:
◆反应过程中:
正反应速率=逆反应速率
CO、H2O的消耗量等于CO2、H2反应生成的CO、H2O量
特别标志
V(正)
V(逆)
V(正)= V(逆)
时间
V速率
但反应仍在进行;四种物质的浓度均保持不变,即达到了动态平衡
一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态
3、化学平衡状态
三要素
前提条件:
实质:
标志:
可逆反应
正反应速率=逆反应速率
反应混合物中各组分的浓度保持不变
逆:可逆反应(或可逆过程)
等:正、逆反应速率相等,V正=V逆
动:反应并没有停止,是动态的平衡. V正=V逆 ≠0
定:在平衡混合物中,各组分的物质的量,质量,浓度及物质的量分数、质量分数、体积分数保持一定,不再变化
变:当外界的条件发生改变,化学平衡状态会随之改变,发生化学平衡的移动
4、 化学平衡特征:
(1)根本标志:
速率标志:“等”
①对于同一物质:
②对于不同的物质:
含量标志:“定”
反应混合物中各组成成分的含量(体积分数、摩尔分数、物质的量浓度等)不随时间改变而改变
生成速率等于消耗速率
相反方向的速率之比等于方程式中的系数之比
★考点突破——判断是否达到平衡状态的标志
(3)不定标志:
①体系中气体物质的总质量保持不变
②体系中气体物质的总物质的量保持不变
③体系中气体物质的平均相对分子质量保持不变
④气体的总压强不再发生改变
⑤体系中气体的密度不再发生改变
(2)等价标志:
①反应物的转化率不随时间改变而改变
②体系的颜色不随时间改变而改变
③产物的产率保持不变
④绝热的恒容反应体系中的温度保持不变
思考:2A(g)+B(g) 2C(g)
A(g)+B(g) 2C(g)
2A(g)+B(s) 2C(g)
(假设容器体积恒定)
★考点突破——判断是否达到平衡状态的标志
(1)对于反应前后的气体物质的分子总数不相等的可逆反应(如2SO2+O2 2SO3)来说,可利用“不定标志”判断是否达到平衡
(2)对于反应前后气体物质的分子数相等的可逆反应:(如H2+I2(g) 2HI),不能用 “不定标志” 判断平衡是否到达,因为在此反应过程中,气体的总压、总体积、总物质的量都不随时间的改变而改变
(3)对于有非气态物质参加的可逆反应来说, “密度不变”可以作为标志
(4)对于恒压下的可逆反应来说, “密度不变”也可以作为标志
说明:
1、在固定体积的的密闭容器中发生反应:
2NO2 2NO + O2 该反应达到平衡的标志是:
(1)混合气体的颜色不再改变 ( )
(2)混合气体的平均相对分子质量不变 ( )
(3)混合气体的密度不变 ( )
(4)混合气体的压强不变 ( )
(5)单位时间内消耗2nmolNO2的同时生成nmolO2 ( )
(6) O2气体的物质的量浓度不变 ( )
练吧!
2. 能够说明N2 +3H2 2NH3反应在恒容密闭容器中已达到平衡状态的是 ( )
①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度比恰为1:3:2
④t min内生成1molNH3同时消耗0.5molN2
⑤t min内,生成1molN2同时消耗3molH2
⑥ 某时间内断裂3molH-H键的同时,断裂6molN-H键
⑦容器内质量不随时间的变化而变化
⑧容器内压强不随时间的变化而变化
⑨容器内密度不再发生变化
⑩容器内的平均摩尔质量不再发生变化
⑤ ⑥ ⑧ ⑩
3、在一定条件下进行可逆反应H2(g)+I2(g) 2HI(g),下列各项可以说明反应已经达到平衡的是
A.反应混合气体压强不变
B. 反应混合气体平均分子量不变
C. 反应混合气体颜色不变
D. 反应混合气体总的物质的量不变
C
4、在一定条件下进行可逆反应 2A(g)+B(s)
2C(g),下列各项可以说明反应已经达到平衡的是
A.反应混合气体压强不变
B. 反应混合气体平均分子量不变
C. 反应混合气体密度不变
D. 反应混合气体总的物质的量不变
BC
二、化学平衡的移动
1、化学平衡是在一定的条件下建立并保持,当外界条件改变,旧的化学平衡必将被破坏并在新条件下建立起新的平衡状态。
2、研究对象:
已建立化学平衡状态的反应体系
3、平衡移动的原因及结果
反应混合物中各组分的浓度发生改变
条件改变使V正≠ V逆
(1)原因
(2)结果
4、影响平衡移动的因素
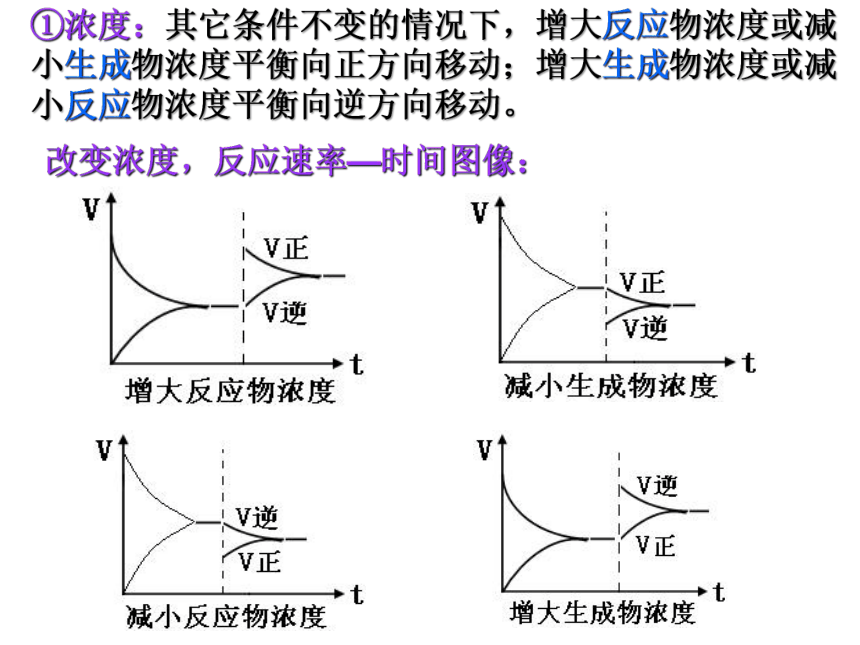
改变浓度,反应速率—时间图像:
①浓度:其它条件不变的情况下,增大反应物浓度或减小生成物浓度平衡向正方向移动;增大生成物浓度或减小反应物浓度平衡向逆方向移动。
②温度:在其它条件不变的情况下, 升高温度,平衡向吸热反应方向移动; 降低温度,平衡向放热反应方向移动。
改变温度,吸、放热反应速率—时间图像:
对于可逆反应aA(g) + bB(g) cC(g) + dD(g)
改变压强,反应速率—时间图像:
③压强:在其它条件不变的情况下,
增大压强,平衡向气体物质系数减小的方向移动;
减小压强,平衡向气体物质系数增多的方向移动。
若方程式两边气体的系数和相等,改变压强, 平衡不发生移动。
④催化剂的影响
催化剂能同等程度地改变正逆反应速率,所以催化剂不能使平衡发生移动。
加入催化剂的速率—时间图像
★小心陷阱!
缩小体积增大压强
扩大体积减小压强
增大N2或H2的浓度
减小NH3的浓度
增大压强
降低温度
使用催化剂
1、对于反应N2+3H2 2NH3(正反应放热反)分析下图,确定t1—t5各点所改变的条件分别是什么?
t1
t3
t4
t5
t2
练吧!
2、对于一个平衡体系,采取下列措施一定会使平衡发生移动的是( )
A.加入一种反应物 B.增大体系压强
C.升高温度 D.使用催化剂
3、反应NH4HS(s) NH3(g) + H2S(g) 在一定温度下达到平衡,下列各种情况下不能使平衡发生移动的是( )
A.温度、容积不变时通入SO2气体
B.移走一部分NH4HS固体
C.保持温度、容积不变,充入氮气
D.保持温度、压强不变,充入氮气
C
BC
5、恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是:
A. a>b+c B. a<b+c
C. a=b+c D. a=b=c
4、下列事实中不能用平衡移动原理解释的是:
A、密闭、低温是存放氨水的必要条件 B、实验室用排饱和食盐水法收集氯气
C、硝酸工业生产中,使用过量空气以提高NH3的利用率
D、在FeSO4溶液中,加入铁粉以防止氧化
D
A
6、已知反应mX (g) + nY (g) qZ (g)的△H < 0, m + n > q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/ n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
B
7、将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g) CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
Z
催化效率高且活性温度低
★考点突破——化学平衡中的图像
1、速率 —(条件改变)— 时间
2、某量(n、浓度、n%、转化率等)对条件的改变
注意:横纵坐标意义;起点、终点、转折点;总趋势
3、某量—(条件改变)— 时间
mA(g)+nB(g)?? pC(g)+qD(g),若m+n>p+q且ΔH>0
P
C(c)
T1
T2
T1>T2
T
C(c)
P1
P2
P1>P2
1、对于反应:A2(g)+3B2(g)??2AB3(g) ΔH<0
下图中正确的是( )
A
练吧!
2、对于反应2A(g) + B(g) 2C(g) △H<0,下列图像正确的是( )
400℃
200℃
600℃
400℃
200℃
1.01×109Pa
1.01×108Pa
1.01×105Pa
1.01×109Pa
1.01×108Pa
1.01×105Pa
AD
A
B
C
D
3、下图曲线a表示放热反应X(g) + Y(g) Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A。升高温度
B。加大X的投入量
C。加催化剂
D。增大体积
C
4、温度和压强对反应 X+Y 2Z 的影响如图,图中纵坐标表示平衡混和气体中Z的体积分数,下列叙述正确的是( )
A。上述可逆反应的正反应为放热反应
B。X、Y、Z均为气态
C。X和Y中至多有一种为气体,Z为气体
D。上述反应的逆反应的△H>0
C
5、
mA(g)+nB(g)? ? pC(g)+qD(g),若m+n T2)
P
A的转化率
T1
T2
1. 定义:
在一定温度下,可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。这个常数就是该反应的化学平衡常数。(以化学方程式中计量数为幂)
2. 表达式:
m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时:
3.单位:
K的单位与反应的化学方程式有关,
由化学方程式决定,无固定的单位。
三、化学平衡常数
[C]p · [D]q
[A]m · [B]n
K=
或
4. K仅受温度影响
正向吸热反应,升高温度,K值增大;
正向放热反应,升高温度,K值减小。
(2)平衡常数K值的大小,可推断反应进行的程度。 K值越大,表示反应进行的程度越大,反应物的转化率越大; K值越小,表示反应进行的程度越小,反应物的转化率越小。
(1)平衡常数K与温度有关,与浓度无关,由K随温度的变化可推断正反应是吸热反应还是放热。
(4)反应的平衡常数与反应可能进行的程度。 一般来说,反应的平衡常数KC≥105,认为正反应进行得较完全;KC ≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。
★平衡常数的意义
(3) 借助平衡常数,可以判断一个化学反应是否达到平衡状态。 对于化学反应aA+bB cC+dD的任意状态, cc(C) cd(D) /[ca(A) cb(B)]称为浓度商(Q)。若Q= K,则说明该反应已经达到平衡状态。若Q≠ K,则说明该反应没有达到平衡状态。
Q > K 反应向逆向进行 V正 < V逆
Q < K 反应向正向进行 V正 > V逆
①若反应的平衡常数数值极小,说明正反应在该条件下几乎不可能进行。如:N2+O2 2NO K=10-30(298K)
所以常温下用此反应固氮是不可能的。因此没有必要在该条件下进行实验,以免浪费人力物力。或者改变条件使反应在新的条件下进行。
注意理解:
②平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:2SO2(g)+O2===2SO3(g)
298K时K很大,但由于速度太慢,常温时,几乎不发生反应。
【例】现有反应:CO(g)+H2O(g) CO2(g)+H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2) 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
小于
逆反应
0﹤x<3.0
小于
(1)如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。如:
CaCO3(s) CaO(s)+CO2(g) K=[CO2] CO2(g)+H2(g) CO(g)+H2O(l) K=[CO]/([CO2][H2])
★考点突破——书写平衡常数关系式的规则
(2)同一化学反应,可以用不同的化学反应方程式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
如:N2 (g) + 3 H2 (g) 2NH3 (g) K1 = 1.60 10 5
1/2N2 (g) + 3/2 H2 (g) NH3 (g) K2 = 3.87 10 2
K1 K2
K1 = K22
如:2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) + O2(g) N2O4 (g) K
K = K1 K2
(3)多重平衡规则:若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)
练习: C (s) + CO2(g) 2CO(g) K
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/K2
★考点突破——有关平衡常数的计算
对于可逆反应达到平衡后各物质的浓度变化关系,在计算中注意:
(2)生成物:平衡浓度=初始浓度 + 转化浓度
生成物D: [D] = c0(D) +△c(D)
(3)各物质的转化浓度之比等于它们在化学方程式中相应的化学计量数之比。△c(A):△c(D)=a:d
(1)反应物:平衡浓度=初始浓度 - 转化浓度;
反应物A: [A] = c0(A) - △c(A)
(4)反应物A的平衡转化率:
也可用n计算
例:合成氨的反应 N2+3H2 2NH3 在某温度下各物质的平衡浓度是:[N2]=3mol·L-1,[H2]=9mol·L-1 [NH3] =4mol·L-1 ,求该反应的平衡常数和N2、 H2的初始浓度以及N2的转化率。
解:①求平衡常数K
K=[NH3]2/([N2][H2]3)=16/(3×93)=7.32×10-3
②求N2、H2的初始浓度。
N2 + 3H2 2NH3
初始(mol·L-1)
变化(mol·L-1) 2 6 4
平衡(mol·L-1) 3 9 4
(3+2) (9+6) 0
③ N2的转化率:
a=40%
1、恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1mol H2的混合气体,发生如下反应:
N2(g)+3H2(g) 2NH3(g),△H<0,一段时间后,达到平衡,若平衡时氨气的物质的量为0.4mol。
(1)计算此温度时该反应的K值为 ; (2)若在此温度下,向另一容积为1 L的恒容容器B中按物质的量分别为2 mol 、1 mol 、1 mol充入N2、H2、NH3此时,该反应是否处于平衡状态______(填“是”或“否”),此时,反应向 方向进行。
(3)若降低A容器的温度,该反应K值 (填“增大”、“减小”或“不变”)
12.5
否
正
增大
练吧!
2、在一定体积的密闭容器中,进行如下反应:CO+H2O(g) CO2+H2 △H>0。其化学平衡常数K与温度T的关系如下表:
①写出反应的平衡常数表达式 ;
②某温度下平衡浓度符合下式:[CO2] [H2]=[CO] [H2O] 试判断此时的温度为 K;
③若维持此温度不变,测得密闭容器中H2O(g)、CO2、H2的平衡浓度分别为1.8mol/L、1.2mol/L、1.2mol/L。则CO平衡浓度为 .
T(K) 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
0.8mol/L
830
3:在2L的容器中充入 1mol CO和 1mol H2O(g),发生反应:CO(g)+H2O(g) CO2(g)+H2(g) 800℃时反应达平衡,若k=1.求:
(1)CO的平衡浓度和转化率。
(2)若温度不变,上容器中充入 的是1mol CO和 4mol H2O(g), CO和H2O(g)的平衡浓度和转化率是多少。
0. 25mol/L、50%
CO: 0.1mol/L、80% H2O:1.6mol/L、20%
4.(1)化学平衡常数K表示可逆反应的进行程度,K值大小与温度的关系是:温度升高,K值___。(填一定增大、一定减小、或可能增大也可能减小)。 (2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO和H2O浓度变化如右图,则0~4min的平均反应速率v(CO)=______mol/(L·min)(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表
①表中3min~4min之间反应处于_____状态.C1数值___0.08mol/L(填“>、<或=”)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是____(单选),
表中5min—6min之间数值发生变化,可能的原因是____(单选)。
A 增加水蒸气 B 降低温度
C 使用催化剂 D 增加氢气浓度
0.030
平衡
>
D
A
CO(g)+H2O(g) CO2(g)+H2(g)
△H=-Q KJ/mol(Q>0)
1、定义: 外界条件相同时,可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。
2、概念的理解:
(2)相同的平衡状态:通常是指平衡混合物各组分的百 分含量对应相同,但各组分的物质的量、浓度可能不同。
(1)外界条件相同:通常可以是①同T同V,②同T同P
四、等效平衡
(3)平衡状态(终态)只与始态有关,而与途径无关,(如:①无论反应从什么方向开始②投料是一次还是分成几次③反应容器经过扩大—缩小或缩小—扩大的过程,)只要起始浓度相当,就达到相同的平衡状态。
I类:对于一般的可逆反应,通过化学计量数比换算成同一边物质的物质的量与原平衡相同,则二平衡等效(等同)。
3、等效平衡的分类
Ⅱ类:m+m=p+q,通过化学计量数比换算成同一边物质的物质的量的比例与原平衡相同,则二平衡等效。
Ⅲ类:换算成平衡式同一边物质的物质的量与原平衡比例相同,则达平衡后与原平衡等效。
(2)定T、定p下
(1)定温(T)、定容(V)
mA(气)+nB(气) pC(气)+qD(气)
例1:
例2:
例3:
例4:
例5:
1、步骤
2、起始浓度相当的判断
(1)同T同V下
A、对于反应前后气体体积发生变化的反应来说:
B、对于反应前后气体体积没有变化的反应来说:
(2)同T同P下(即体积可变化)
等效转化后,对应各物质起始投料的物质的量成比例。
等效转化后,对应各物质起始投料的物质的量成比例。
等效转化后,对应各物质起始投料的物质的量均相同。
(1)进行等效转化;(2)判断起始浓度是否相当
4、等效平衡的解题思路
例:体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这一过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A。等于p% B。大于p%
C。小于p% D。无法判断
B
对于有固体参加的可逆反应:
处理方法:
①不考虑固体物质,先进行等效转化,应该符合上述的规律。
②根据题意计算出达到平衡时选定物质的物质的量,以及所需的固体物质的最小量,那么,只要固体物质的起始投料大于这个最小量即可保证达到同一平衡状态(因为固体物质的量多与少不影响化学反应速率或化学平衡)
例 : 在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:2A(g)+B(g) 3C(g)+D(s)
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。
(1)维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是( )
A、3mol C+xmol D(x>0.6)
B、1mol A+0.5mol B+1.5mol C+xmol D(x>0.1)
C、2mol A+1mol B+xmolD(x≥0)
D、1mol A+0.5mol B+4.5mol C+xmol D(x>0.7)
ABC
正反应为气体体积_____的反应
_____反应
正反应为_____反应
反应特点
五、补充:
(1)合成氨
N2+3H2 2NH3 △H<0
分析:合成氨的反应特点
可逆
放热
减小
理论分析结论:低温、高压有利于化学平衡正向移动,N2、H2浓度比为1:3有利于化学平衡正向移动。
合成氨适宜条件
催化剂____________
温度____________
根据设备动力选择压强________________
N2、H2投料比______
及时分离________
铁
700K左右
1×107~ 1×108Pa
1:2.8
氨气
实际工业生产中:
说明:①选择合成氨条件时,要综合考虑反应速率和平衡转化率的影响因素(应寻找以较高的反应速率获得适当平衡转化率的反应条件),另外还应考虑原料的价格、未转化的合成气的循环使用、反应热的综合利用等问题。
②温度选择700K左右原因:一是催化剂的活性大;二是加快反应速率
(2)化学反应的方向
③ N2、H2投料比为1:2.8的原因:因氮气在催化剂上的吸附为总反应中最难发生的步骤,是影响反应速率的关键步骤;实验表明适当提高氮气比例,即N2、H2物质的量之比为1:2.8时更能加快合成氨反应的进行。
④在中压工艺条件下,合成氨厂出口气中的氨含量一般为13%~14%,产率较低,采取分离出氨、循环使用氮气、氢气。
例1. 在一个固定容积的密闭容器中,加入2molA和1molB,发生反应 ,达到平衡时,C的浓度为cmol/L,若维持容器的容积和温度不变,按下列4种配比作为起始物质,达到平衡时,C的浓度仍为cmol/L的是( )。
A、4molA+2molB
B、2molA+1molB+3molC+1molD
C、3molC+1molD+1molB
D、3molC+1molD
E、1molA+0.5molB+1.5molC+0.5molD
DE
例2:在恒容的密闭容器中充入2molA和1molB的气体后发生反应2A(g)+B(g) xC(g), 达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为( )
A、1 B、2
C、3 D、4
BC
例3:在等温、等容条件下有下列反应:2A(g)+2B(g)
C(g)+3D(g)。现分别从两条途径建立平衡:
Ⅰ、A和B的起始浓度均为2mol/L;
Ⅱ、C和D的起始浓度分别为2mol/L和6mol/L。
下列叙述正确的是( )
A、Ⅰ和Ⅱ两途径达到平衡时,体系内混合气体的体积分数相同
B、Ⅰ和Ⅱ两途径达到平衡时,体系内混合气体的体积分数不同
C、达平衡时,Ⅰ途径的反应速率等于Ⅱ途径的反应速率
D、达平衡时,Ⅰ途径混合气体密度为Ⅱ途径混合气体密度的1/2
AD
例4:在一定温度、压强下,在容积可变的密闭容器内充有1molA和1molB,此时容积为VL,保持恒温恒压,使反应:A(g)+B(g) C(g)达到平衡时,C的体积分数为40%,试回答下列问题:
欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2molA和2molB,则反应达到平衡时容器的容积为 ,C的体积分数为 。
40%
10V
例5:在恒温恒压条件下,向可变的密闭容器中充入3LA和2LB发生如下反应3A(g)+2B(g) xC(g)+yD(g),达到平衡时C的体积分数为m%。若维持温度不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%。则x、y的值可能为( )
A、x=3、y=1 B、x=4、y=1
C、x=5、y=1 D、x=10、y=2
CD
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
例: 2SO2+ O2 2SO3
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
以上两个平衡,有什么异同?
1、某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是---------------。
(2)恒定T、P:
[1]若X=0、Y=0,则Z-----------。
[2]若X=0.75,则Y---------,Z---------------。
[3]X、Y、Z应满足的一般条件是----------------。
2mol
2.25mol
0.5mol
>0
=2.25mol
≥0
Y=3X,Z≥0
X+Z/2=1 , Y+3Z/2=3
练吧!
2、在一个固定体积的密闭容器中,保持一定温度,进行以下反应,H2(气)+Br2(气) 2HBr(气),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)-(3)的状态,填写表中空白:
2a
0
0.5
2(n-2m)
(n-m)a
3、在一个盛有催化剂的容积可变的密闭容器中,保持一定温度压强,进行以下反应,N2(气)+3H2(气) 2NH3(气),已知加入1mol N2和4molH2时,达到平衡后生成amolNH3,在相同条件下,且保持平衡时各组分的百分含量不变,填写表中空白:
1.5a
0
0.5
2(n-4m)
(n-3m)a
考 纲 要 求
1、 了解化学反应的可逆性
2、结合图象考查化学平衡建立的过程
3、化学平衡状态的分析、判断与比较
4、理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算,并判断反应进行的方向 5 、理解外界条件(温度、压强、浓度、催化剂)对化学反应平衡的影响,认识其一般规律
6、了解化学平衡的调控在生活、生产和科学研究领域中的重要作用
7、以图象题综合考查勒夏特列原理的应用以及速率与平衡之间的关系
1、可逆反应的特点:
①在相同的条件下,两个方向相反的反应同时进行.
②无论什么条件下,反应都不可能进行彻底.
一、化学平衡状态
2、平衡过程的建立:
在容积为1L的密闭容器里,加0.01molCO和0.01molH2O(g),CO+H2O CO2+H2
c(CO) 、c(H2O)最大,c(CO2) 和c(H2)为0
c(CO) 、c(H2O)逐渐减小
c(CO2) 、c(H2)逐渐增大
所以,正反应速率逐渐减小,逆反应速率逐渐增大.进行到一定程度,正反应速率和逆反应速率的大小不再变化 ,
◆开始瞬时浓度:
◆反应过程中:
正反应速率=逆反应速率
CO、H2O的消耗量等于CO2、H2反应生成的CO、H2O量
特别标志
V(正)
V(逆)
V(正)= V(逆)
时间
V速率
但反应仍在进行;四种物质的浓度均保持不变,即达到了动态平衡
一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态
3、化学平衡状态
三要素
前提条件:
实质:
标志:
可逆反应
正反应速率=逆反应速率
反应混合物中各组分的浓度保持不变
逆:可逆反应(或可逆过程)
等:正、逆反应速率相等,V正=V逆
动:反应并没有停止,是动态的平衡. V正=V逆 ≠0
定:在平衡混合物中,各组分的物质的量,质量,浓度及物质的量分数、质量分数、体积分数保持一定,不再变化
变:当外界的条件发生改变,化学平衡状态会随之改变,发生化学平衡的移动
4、 化学平衡特征:
(1)根本标志:
速率标志:“等”
①对于同一物质:
②对于不同的物质:
含量标志:“定”
反应混合物中各组成成分的含量(体积分数、摩尔分数、物质的量浓度等)不随时间改变而改变
生成速率等于消耗速率
相反方向的速率之比等于方程式中的系数之比
★考点突破——判断是否达到平衡状态的标志
(3)不定标志:
①体系中气体物质的总质量保持不变
②体系中气体物质的总物质的量保持不变
③体系中气体物质的平均相对分子质量保持不变
④气体的总压强不再发生改变
⑤体系中气体的密度不再发生改变
(2)等价标志:
①反应物的转化率不随时间改变而改变
②体系的颜色不随时间改变而改变
③产物的产率保持不变
④绝热的恒容反应体系中的温度保持不变
思考:2A(g)+B(g) 2C(g)
A(g)+B(g) 2C(g)
2A(g)+B(s) 2C(g)
(假设容器体积恒定)
★考点突破——判断是否达到平衡状态的标志
(1)对于反应前后的气体物质的分子总数不相等的可逆反应(如2SO2+O2 2SO3)来说,可利用“不定标志”判断是否达到平衡
(2)对于反应前后气体物质的分子数相等的可逆反应:(如H2+I2(g) 2HI),不能用 “不定标志” 判断平衡是否到达,因为在此反应过程中,气体的总压、总体积、总物质的量都不随时间的改变而改变
(3)对于有非气态物质参加的可逆反应来说, “密度不变”可以作为标志
(4)对于恒压下的可逆反应来说, “密度不变”也可以作为标志
说明:
1、在固定体积的的密闭容器中发生反应:
2NO2 2NO + O2 该反应达到平衡的标志是:
(1)混合气体的颜色不再改变 ( )
(2)混合气体的平均相对分子质量不变 ( )
(3)混合气体的密度不变 ( )
(4)混合气体的压强不变 ( )
(5)单位时间内消耗2nmolNO2的同时生成nmolO2 ( )
(6) O2气体的物质的量浓度不变 ( )
练吧!
2. 能够说明N2 +3H2 2NH3反应在恒容密闭容器中已达到平衡状态的是 ( )
①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度比恰为1:3:2
④t min内生成1molNH3同时消耗0.5molN2
⑤t min内,生成1molN2同时消耗3molH2
⑥ 某时间内断裂3molH-H键的同时,断裂6molN-H键
⑦容器内质量不随时间的变化而变化
⑧容器内压强不随时间的变化而变化
⑨容器内密度不再发生变化
⑩容器内的平均摩尔质量不再发生变化
⑤ ⑥ ⑧ ⑩
3、在一定条件下进行可逆反应H2(g)+I2(g) 2HI(g),下列各项可以说明反应已经达到平衡的是
A.反应混合气体压强不变
B. 反应混合气体平均分子量不变
C. 反应混合气体颜色不变
D. 反应混合气体总的物质的量不变
C
4、在一定条件下进行可逆反应 2A(g)+B(s)
2C(g),下列各项可以说明反应已经达到平衡的是
A.反应混合气体压强不变
B. 反应混合气体平均分子量不变
C. 反应混合气体密度不变
D. 反应混合气体总的物质的量不变
BC
二、化学平衡的移动
1、化学平衡是在一定的条件下建立并保持,当外界条件改变,旧的化学平衡必将被破坏并在新条件下建立起新的平衡状态。
2、研究对象:
已建立化学平衡状态的反应体系
3、平衡移动的原因及结果
反应混合物中各组分的浓度发生改变
条件改变使V正≠ V逆
(1)原因
(2)结果
4、影响平衡移动的因素
改变浓度,反应速率—时间图像:
①浓度:其它条件不变的情况下,增大反应物浓度或减小生成物浓度平衡向正方向移动;增大生成物浓度或减小反应物浓度平衡向逆方向移动。
②温度:在其它条件不变的情况下, 升高温度,平衡向吸热反应方向移动; 降低温度,平衡向放热反应方向移动。
改变温度,吸、放热反应速率—时间图像:
对于可逆反应aA(g) + bB(g) cC(g) + dD(g)
改变压强,反应速率—时间图像:
③压强:在其它条件不变的情况下,
增大压强,平衡向气体物质系数减小的方向移动;
减小压强,平衡向气体物质系数增多的方向移动。
若方程式两边气体的系数和相等,改变压强, 平衡不发生移动。
④催化剂的影响
催化剂能同等程度地改变正逆反应速率,所以催化剂不能使平衡发生移动。
加入催化剂的速率—时间图像
★小心陷阱!
缩小体积增大压强
扩大体积减小压强
增大N2或H2的浓度
减小NH3的浓度
增大压强
降低温度
使用催化剂
1、对于反应N2+3H2 2NH3(正反应放热反)分析下图,确定t1—t5各点所改变的条件分别是什么?
t1
t3
t4
t5
t2
练吧!
2、对于一个平衡体系,采取下列措施一定会使平衡发生移动的是( )
A.加入一种反应物 B.增大体系压强
C.升高温度 D.使用催化剂
3、反应NH4HS(s) NH3(g) + H2S(g) 在一定温度下达到平衡,下列各种情况下不能使平衡发生移动的是( )
A.温度、容积不变时通入SO2气体
B.移走一部分NH4HS固体
C.保持温度、容积不变,充入氮气
D.保持温度、压强不变,充入氮气
C
BC
5、恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是:
A. a>b+c B. a<b+c
C. a=b+c D. a=b=c
4、下列事实中不能用平衡移动原理解释的是:
A、密闭、低温是存放氨水的必要条件 B、实验室用排饱和食盐水法收集氯气
C、硝酸工业生产中,使用过量空气以提高NH3的利用率
D、在FeSO4溶液中,加入铁粉以防止氧化
D
A
6、已知反应mX (g) + nY (g) qZ (g)的△H < 0, m + n > q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/ n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
B
7、将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g) CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
Z
催化效率高且活性温度低
★考点突破——化学平衡中的图像
1、速率 —(条件改变)— 时间
2、某量(n、浓度、n%、转化率等)对条件的改变
注意:横纵坐标意义;起点、终点、转折点;总趋势
3、某量—(条件改变)— 时间
mA(g)+nB(g)?? pC(g)+qD(g),若m+n>p+q且ΔH>0
P
C(c)
T1
T2
T1>T2
T
C(c)
P1
P2
P1>P2
1、对于反应:A2(g)+3B2(g)??2AB3(g) ΔH<0
下图中正确的是( )
A
练吧!
2、对于反应2A(g) + B(g) 2C(g) △H<0,下列图像正确的是( )
400℃
200℃
600℃
400℃
200℃
1.01×109Pa
1.01×108Pa
1.01×105Pa
1.01×109Pa
1.01×108Pa
1.01×105Pa
AD
A
B
C
D
3、下图曲线a表示放热反应X(g) + Y(g) Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A。升高温度
B。加大X的投入量
C。加催化剂
D。增大体积
C
4、温度和压强对反应 X+Y 2Z 的影响如图,图中纵坐标表示平衡混和气体中Z的体积分数,下列叙述正确的是( )
A。上述可逆反应的正反应为放热反应
B。X、Y、Z均为气态
C。X和Y中至多有一种为气体,Z为气体
D。上述反应的逆反应的△H>0
C
5、
mA(g)+nB(g)? ? pC(g)+qD(g),若m+n
P
A的转化率
T1
T2
1. 定义:
在一定温度下,可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。这个常数就是该反应的化学平衡常数。(以化学方程式中计量数为幂)
2. 表达式:
m A(g) + n B(g) p C(g) + q D(g)
在一定温度下达到化学平衡时:
3.单位:
K的单位与反应的化学方程式有关,
由化学方程式决定,无固定的单位。
三、化学平衡常数
[C]p · [D]q
[A]m · [B]n
K=
或
4. K仅受温度影响
正向吸热反应,升高温度,K值增大;
正向放热反应,升高温度,K值减小。
(2)平衡常数K值的大小,可推断反应进行的程度。 K值越大,表示反应进行的程度越大,反应物的转化率越大; K值越小,表示反应进行的程度越小,反应物的转化率越小。
(1)平衡常数K与温度有关,与浓度无关,由K随温度的变化可推断正反应是吸热反应还是放热。
(4)反应的平衡常数与反应可能进行的程度。 一般来说,反应的平衡常数KC≥105,认为正反应进行得较完全;KC ≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。
★平衡常数的意义
(3) 借助平衡常数,可以判断一个化学反应是否达到平衡状态。 对于化学反应aA+bB cC+dD的任意状态, cc(C) cd(D) /[ca(A) cb(B)]称为浓度商(Q)。若Q= K,则说明该反应已经达到平衡状态。若Q≠ K,则说明该反应没有达到平衡状态。
Q > K 反应向逆向进行 V正 < V逆
Q < K 反应向正向进行 V正 > V逆
①若反应的平衡常数数值极小,说明正反应在该条件下几乎不可能进行。如:N2+O2 2NO K=10-30(298K)
所以常温下用此反应固氮是不可能的。因此没有必要在该条件下进行实验,以免浪费人力物力。或者改变条件使反应在新的条件下进行。
注意理解:
②平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:2SO2(g)+O2===2SO3(g)
298K时K很大,但由于速度太慢,常温时,几乎不发生反应。
【例】现有反应:CO(g)+H2O(g) CO2(g)+H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2) 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
小于
逆反应
0﹤x<3.0
小于
(1)如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。如:
CaCO3(s) CaO(s)+CO2(g) K=[CO2] CO2(g)+H2(g) CO(g)+H2O(l) K=[CO]/([CO2][H2])
★考点突破——书写平衡常数关系式的规则
(2)同一化学反应,可以用不同的化学反应方程式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
如:N2 (g) + 3 H2 (g) 2NH3 (g) K1 = 1.60 10 5
1/2N2 (g) + 3/2 H2 (g) NH3 (g) K2 = 3.87 10 2
K1 K2
K1 = K22
如:2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) + O2(g) N2O4 (g) K
K = K1 K2
(3)多重平衡规则:若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之乘积(商)
练习: C (s) + CO2(g) 2CO(g) K
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/K2
★考点突破——有关平衡常数的计算
对于可逆反应达到平衡后各物质的浓度变化关系,在计算中注意:
(2)生成物:平衡浓度=初始浓度 + 转化浓度
生成物D: [D] = c0(D) +△c(D)
(3)各物质的转化浓度之比等于它们在化学方程式中相应的化学计量数之比。△c(A):△c(D)=a:d
(1)反应物:平衡浓度=初始浓度 - 转化浓度;
反应物A: [A] = c0(A) - △c(A)
(4)反应物A的平衡转化率:
也可用n计算
例:合成氨的反应 N2+3H2 2NH3 在某温度下各物质的平衡浓度是:[N2]=3mol·L-1,[H2]=9mol·L-1 [NH3] =4mol·L-1 ,求该反应的平衡常数和N2、 H2的初始浓度以及N2的转化率。
解:①求平衡常数K
K=[NH3]2/([N2][H2]3)=16/(3×93)=7.32×10-3
②求N2、H2的初始浓度。
N2 + 3H2 2NH3
初始(mol·L-1)
变化(mol·L-1) 2 6 4
平衡(mol·L-1) 3 9 4
(3+2) (9+6) 0
③ N2的转化率:
a=40%
1、恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1mol H2的混合气体,发生如下反应:
N2(g)+3H2(g) 2NH3(g),△H<0,一段时间后,达到平衡,若平衡时氨气的物质的量为0.4mol。
(1)计算此温度时该反应的K值为 ; (2)若在此温度下,向另一容积为1 L的恒容容器B中按物质的量分别为2 mol 、1 mol 、1 mol充入N2、H2、NH3此时,该反应是否处于平衡状态______(填“是”或“否”),此时,反应向 方向进行。
(3)若降低A容器的温度,该反应K值 (填“增大”、“减小”或“不变”)
12.5
否
正
增大
练吧!
2、在一定体积的密闭容器中,进行如下反应:CO+H2O(g) CO2+H2 △H>0。其化学平衡常数K与温度T的关系如下表:
①写出反应的平衡常数表达式 ;
②某温度下平衡浓度符合下式:[CO2] [H2]=[CO] [H2O] 试判断此时的温度为 K;
③若维持此温度不变,测得密闭容器中H2O(g)、CO2、H2的平衡浓度分别为1.8mol/L、1.2mol/L、1.2mol/L。则CO平衡浓度为 .
T(K) 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
0.8mol/L
830
3:在2L的容器中充入 1mol CO和 1mol H2O(g),发生反应:CO(g)+H2O(g) CO2(g)+H2(g) 800℃时反应达平衡,若k=1.求:
(1)CO的平衡浓度和转化率。
(2)若温度不变,上容器中充入 的是1mol CO和 4mol H2O(g), CO和H2O(g)的平衡浓度和转化率是多少。
0. 25mol/L、50%
CO: 0.1mol/L、80% H2O:1.6mol/L、20%
4.(1)化学平衡常数K表示可逆反应的进行程度,K值大小与温度的关系是:温度升高,K值___。(填一定增大、一定减小、或可能增大也可能减小)。 (2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO和H2O浓度变化如右图,则0~4min的平均反应速率v(CO)=______mol/(L·min)(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表
①表中3min~4min之间反应处于_____状态.C1数值___0.08mol/L(填“>、<或=”)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是____(单选),
表中5min—6min之间数值发生变化,可能的原因是____(单选)。
A 增加水蒸气 B 降低温度
C 使用催化剂 D 增加氢气浓度
0.030
平衡
>
D
A
CO(g)+H2O(g) CO2(g)+H2(g)
△H=-Q KJ/mol(Q>0)
1、定义: 外界条件相同时,可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。
2、概念的理解:
(2)相同的平衡状态:通常是指平衡混合物各组分的百 分含量对应相同,但各组分的物质的量、浓度可能不同。
(1)外界条件相同:通常可以是①同T同V,②同T同P
四、等效平衡
(3)平衡状态(终态)只与始态有关,而与途径无关,(如:①无论反应从什么方向开始②投料是一次还是分成几次③反应容器经过扩大—缩小或缩小—扩大的过程,)只要起始浓度相当,就达到相同的平衡状态。
I类:对于一般的可逆反应,通过化学计量数比换算成同一边物质的物质的量与原平衡相同,则二平衡等效(等同)。
3、等效平衡的分类
Ⅱ类:m+m=p+q,通过化学计量数比换算成同一边物质的物质的量的比例与原平衡相同,则二平衡等效。
Ⅲ类:换算成平衡式同一边物质的物质的量与原平衡比例相同,则达平衡后与原平衡等效。
(2)定T、定p下
(1)定温(T)、定容(V)
mA(气)+nB(气) pC(气)+qD(气)
例1:
例2:
例3:
例4:
例5:
1、步骤
2、起始浓度相当的判断
(1)同T同V下
A、对于反应前后气体体积发生变化的反应来说:
B、对于反应前后气体体积没有变化的反应来说:
(2)同T同P下(即体积可变化)
等效转化后,对应各物质起始投料的物质的量成比例。
等效转化后,对应各物质起始投料的物质的量成比例。
等效转化后,对应各物质起始投料的物质的量均相同。
(1)进行等效转化;(2)判断起始浓度是否相当
4、等效平衡的解题思路
例:体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这一过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A。等于p% B。大于p%
C。小于p% D。无法判断
B
对于有固体参加的可逆反应:
处理方法:
①不考虑固体物质,先进行等效转化,应该符合上述的规律。
②根据题意计算出达到平衡时选定物质的物质的量,以及所需的固体物质的最小量,那么,只要固体物质的起始投料大于这个最小量即可保证达到同一平衡状态(因为固体物质的量多与少不影响化学反应速率或化学平衡)
例 : 在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:2A(g)+B(g) 3C(g)+D(s)
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。
(1)维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是( )
A、3mol C+xmol D(x>0.6)
B、1mol A+0.5mol B+1.5mol C+xmol D(x>0.1)
C、2mol A+1mol B+xmolD(x≥0)
D、1mol A+0.5mol B+4.5mol C+xmol D(x>0.7)
ABC
正反应为气体体积_____的反应
_____反应
正反应为_____反应
反应特点
五、补充:
(1)合成氨
N2+3H2 2NH3 △H<0
分析:合成氨的反应特点
可逆
放热
减小
理论分析结论:低温、高压有利于化学平衡正向移动,N2、H2浓度比为1:3有利于化学平衡正向移动。
合成氨适宜条件
催化剂____________
温度____________
根据设备动力选择压强________________
N2、H2投料比______
及时分离________
铁
700K左右
1×107~ 1×108Pa
1:2.8
氨气
实际工业生产中:
说明:①选择合成氨条件时,要综合考虑反应速率和平衡转化率的影响因素(应寻找以较高的反应速率获得适当平衡转化率的反应条件),另外还应考虑原料的价格、未转化的合成气的循环使用、反应热的综合利用等问题。
②温度选择700K左右原因:一是催化剂的活性大;二是加快反应速率
(2)化学反应的方向
③ N2、H2投料比为1:2.8的原因:因氮气在催化剂上的吸附为总反应中最难发生的步骤,是影响反应速率的关键步骤;实验表明适当提高氮气比例,即N2、H2物质的量之比为1:2.8时更能加快合成氨反应的进行。
④在中压工艺条件下,合成氨厂出口气中的氨含量一般为13%~14%,产率较低,采取分离出氨、循环使用氮气、氢气。
例1. 在一个固定容积的密闭容器中,加入2molA和1molB,发生反应 ,达到平衡时,C的浓度为cmol/L,若维持容器的容积和温度不变,按下列4种配比作为起始物质,达到平衡时,C的浓度仍为cmol/L的是( )。
A、4molA+2molB
B、2molA+1molB+3molC+1molD
C、3molC+1molD+1molB
D、3molC+1molD
E、1molA+0.5molB+1.5molC+0.5molD
DE
例2:在恒容的密闭容器中充入2molA和1molB的气体后发生反应2A(g)+B(g) xC(g), 达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为( )
A、1 B、2
C、3 D、4
BC
例3:在等温、等容条件下有下列反应:2A(g)+2B(g)
C(g)+3D(g)。现分别从两条途径建立平衡:
Ⅰ、A和B的起始浓度均为2mol/L;
Ⅱ、C和D的起始浓度分别为2mol/L和6mol/L。
下列叙述正确的是( )
A、Ⅰ和Ⅱ两途径达到平衡时,体系内混合气体的体积分数相同
B、Ⅰ和Ⅱ两途径达到平衡时,体系内混合气体的体积分数不同
C、达平衡时,Ⅰ途径的反应速率等于Ⅱ途径的反应速率
D、达平衡时,Ⅰ途径混合气体密度为Ⅱ途径混合气体密度的1/2
AD
例4:在一定温度、压强下,在容积可变的密闭容器内充有1molA和1molB,此时容积为VL,保持恒温恒压,使反应:A(g)+B(g) C(g)达到平衡时,C的体积分数为40%,试回答下列问题:
欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2molA和2molB,则反应达到平衡时容器的容积为 ,C的体积分数为 。
40%
10V
例5:在恒温恒压条件下,向可变的密闭容器中充入3LA和2LB发生如下反应3A(g)+2B(g) xC(g)+yD(g),达到平衡时C的体积分数为m%。若维持温度不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%。则x、y的值可能为( )
A、x=3、y=1 B、x=4、y=1
C、x=5、y=1 D、x=10、y=2
CD
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
例: 2SO2+ O2 2SO3
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
以上两个平衡,有什么异同?
1、某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是---------------。
(2)恒定T、P:
[1]若X=0、Y=0,则Z-----------。
[2]若X=0.75,则Y---------,Z---------------。
[3]X、Y、Z应满足的一般条件是----------------。
2mol
2.25mol
0.5mol
>0
=2.25mol
≥0
Y=3X,Z≥0
X+Z/2=1 , Y+3Z/2=3
练吧!
2、在一个固定体积的密闭容器中,保持一定温度,进行以下反应,H2(气)+Br2(气) 2HBr(气),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)-(3)的状态,填写表中空白:
2a
0
0.5
2(n-2m)
(n-m)a
3、在一个盛有催化剂的容积可变的密闭容器中,保持一定温度压强,进行以下反应,N2(气)+3H2(气) 2NH3(气),已知加入1mol N2和4molH2时,达到平衡后生成amolNH3,在相同条件下,且保持平衡时各组分的百分含量不变,填写表中空白:
1.5a
0
0.5
2(n-4m)
(n-3m)a
同课章节目录
