1.2 第2课时 核外电子排布与元素周期表 原子半径 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 1.2 第2课时 核外电子排布与元素周期表 原子半径 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修2 |
|
|
| 格式 | docx | ||
| 文件大小 | 287.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 14:28:17 | ||
图片预览



文档简介
1.2 第2课时 核外电子排布与元素周期表 原子半径
【学习目标】
1.认识核外电子排布与元素周期表的关系,了解元素周期表中各区、周期、族的划分依据。
2.了解原子结构与原子半径周期性变化的联系。
【自主预习】
一、核外电子排布与元素周期表
1.核外电子排布与周期划分
(1)周期与能级组、原子轨道的对应关系
周期 序数 对应能级组 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族
1 1s 1 2 1s1 1s2 2
2 2s2p 4 8 2s1 2s22p6 8
3 3s3p 4 8 3s1 3s23p6 8
4 4s3d4p 9 18 4s1 4s24p6 18
5 5s4d5p 9 18 5s1 5s25p6 18
6 6s4f5d6p 16 32 6s1 6s26p6 32
7 7s5f6d7p 16 32 7s1 7s27p6 32
(2)规律
a.7个能级组对应7个周期。
b.周期序数= 。
c.本周期所包含元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
2.核外电子排布与族的划分
(1)划分依据:取决于原子的 和价电子排布。
(2)规律
a.主族元素
b.过渡元素
c.稀有气体→价电子排布: ( 除外)
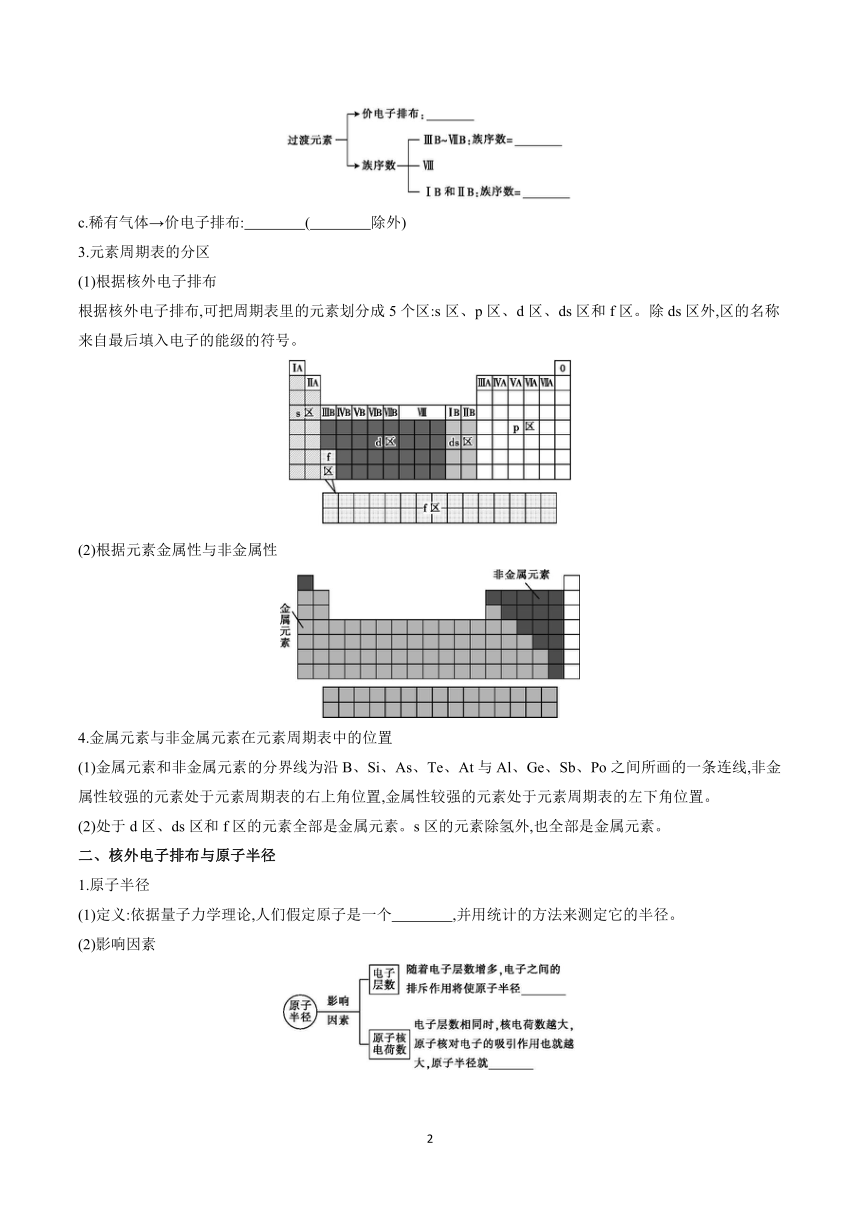
3.元素周期表的分区
(1)根据核外电子排布
根据核外电子排布,可把周期表里的元素划分成5个区:s区、p区、d区、ds区和f区。除ds区外,区的名称来自最后填入电子的能级的符号。
(2)根据元素金属性与非金属性
4.金属元素与非金属元素在元素周期表中的位置
(1)金属元素和非金属元素的分界线为沿B、Si、As、Te、At与Al、Ge、Sb、Po之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。
(2)处于d区、ds区和f区的元素全部是金属元素。s区的元素除氢外,也全部是金属元素。
二、核外电子排布与原子半径
1.原子半径
(1)定义:依据量子力学理论,人们假定原子是一个 ,并用统计的方法来测定它的半径。
(2)影响因素
2.原子半径的周期性变化
(1)同周期(稀有气体元素除外)
a.规律:原子半径自左至右逐渐 。
b.原因:增加的电子所产生的电子间的 小于核电荷数增加导致的核对外层电子的 。
(2)同主族
a.规律:原子半径自上而下逐渐 。
b.原因:电子层数依次增加,电子间的 的影响大于核对外层电子的 的影响。
(3)过渡元素
a.规律:从总的变化趋势来看,从左到右原子半径的变化幅度 。
b.原因:增加的电子都分布在 轨道上,电子间的 与核对外层电子的 大致相当。
【参考答案】一、1.最外层电子所在轨道的电子层数 2.价电子数目 ns1~2 ns2np1~5 价电子数 (n-1)d1~10ns1~2 价电子数 ns电子数 ns2np6 He
二、1.球体 增大 越小 2.减小 排斥作用
吸引作用 增大 排斥作用 吸引作用 不大
(n-1)d 排斥作用 吸引作用
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)元素原子的价层电子就是最外层电子。 ( )
(2)除氦外,0族元素原子的价电子排布为ns2np6。 ( )
(3)最外层电子排布式为ns1或ns2的元素一定为金属元素。 ( )
(4)价电子排布为4s24p3的元素位于第4周期ⅤA族,是p区元素。 ( )
(5)在元素周期表中,s区、d区和ds区的元素都是金属元素。 ( )
(6)元素周期表有7个横行,即7个周期;有18个纵列,即18个族。 ( )
(7)每一周期都是碱金属元素开始,稀有气体元素结束。 ( )
【答案】(1)× (2)√ (3)× (4)√ (5)× (6)× (7)×
2.元素周期表中周期的划分与原子结构的哪部分有关
【答案】与原子的电子层数有关。
3.除氦外,0族价电子排布有何特点
【答案】除氦外,0族最外层均有8个电子,价电子排布为ns2np6。
4.主族元素从左到右价电子排布有何特点
【答案】主族元素从左到右价电子排布从ns1~ns2np5。
5.元素周期表划分区的依据是什么
【答案】依据是原子的价电子排布。
【合作探究】
任务1:核外电子排布与元素周期表
【实验探究】
1.价电子排布为5s25p1的元素,在元素周期表中处于什么位置 据此分析元素的价电子排布与元素在周期表中的位置有何关系。
【答案】该元素位于第5周期ⅢA族。元素能级中最高能层序数=周期序数,主族元素原子的价电子数=该元素在元素周期表中的主族序数。
2.某元素位于元素周期表中第4周期ⅤA族,你能否据此写出该元素的价电子排布和电子排布式
【答案】该元素的价电子排布为4s24p3;电子排布式为1s22s22p63s23p63d104s24p3。
3.原子序数1~36的某元素基态原子的最外层电子排布式为ns2,该元素可能属于哪一族
【答案】0族(He)、ⅡA族、ⅡB族、ⅢB族、ⅣB族、ⅤB族、ⅦB族、Ⅷ族。
4.基态原子的最外层电子排布为ns2的元素一定处于s区吗 基态原子的价电子排布为ns2的元素一定处于s区吗
【答案】不一定,基态原子的最外层电子排布为ns2的元素可能为ⅡA族元素(s区)、副族元素(d区、ds区、f区)、0族元素He(p区);基态原子的价电子排布为ns2的元素不一定处于s区,可能为ⅡA族元素(s区)、0族元素He(p区)。
【核心归纳】
一、核外电子排布与周期的划分
二、核外电子排布与族的划分
三、原子核外电子排布与元素周期表的分区
分区 元素分布 价电子排布 元素性质特点
s区 ⅠA族、ⅡA族 ns1~2 除H外都是活泼金属元素
p区 ⅢA族~ⅦA族、0族 ns2np1~6 最外层电子参与反应(稀有气体除外)
d区 ⅢB族~ⅦB族、Ⅷ族 (n-1)d1~9ns1~2(除Pd外) d轨道也不同程度地参与化学键的形成
ds区 ⅠB族、ⅡB族 (n-1)d10ns1~2 金属元素
f区 镧系、锕系 (n-2)f0~14(n-1)d0~2ns2 镧系元素化学性质相近,锕系元素化学性质相近
【典型例题】
【例1】下面的元素周期表中全都是金属元素的区域为( )。
A.只有s区 B.只有d区
C.s区、d区和ds区 D.f区、d区和ds区
【答案】D
【解析】s区中的H不是金属元素,过渡元素(f区、d区和ds区)全部是金属元素。
【例2】原子结构与元素周期表存在着内在联系。根据已学知识,回答下列问题:
(1)已知用s,p,d,f等符号表示的下列元素原子的电子排布式,判断它们所在的周期和族。
①1s22s22p63s23p1 ;
②1s22s22p63s23p63d54s1 ;
③1s22s22p63s23p63d64s2 ;
④1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2 。
(2)已知下列元素在周期表中的位置,写出它们的元素符号和价电子排布式。
①第4周期ⅣB族 ;
②第5周期ⅦA族 。
【答案】(1)①第3周期ⅢA族
②第4周期ⅥB族
③第4周期Ⅷ族
④第6周期ⅣA族
(2)①Ti,3d24s2
②I,5s25p5
【解析】(1)在核外电子排布式中,能级序数最大的数为该元素所在的周期序数。①④的最外层的p轨道上都填充有电子,故①在ⅢA族、④在ⅣA族;②③元素的d轨道上都填充有电子但未满,故②在ⅥB族而③在Ⅷ族。
任务2:核外电子排布与微粒半径比较
情境导入 海洋是蔚蓝色的资源宝库。海洋中含有80多种元素,其中除氢、氧外,氯、钠、镁、硫、钙、钾、碳、锶、溴、硼、氟、硅12种称为常量元素,海水中所含有的元素大部分以盐溶液的形式存在,在这些盐类物质中氯化钠占80%以上。
问题生成
1.如何判断H、Li、Na、K原子半径的大小 理由是什么
【答案】H、Li、Na、K最外层电子数相同,而原子的电子层数依次增多,故半径依次增大。
2.如何比较Na+、Mg2+、Al3+半径的大小
【答案】Na+、Mg2+、Al3+的电子层构型相同,离子核外电子数相同,而核电荷数依次增大,故半径依次减小。
3.r(Na+)与r(Na) 哪个大 r(Cl-)与r(Cl)呢
【答案】根据同一种元素离子和原子的质子数相同,但是阴离子核外电子数大于质子数,阳离子核外电子数小于质子数,故可知r(Na)大于r(Na+),r(Cl-)大于r(Cl)。
4.r(Ca2+)与r(Cl-) 哪个大
【答案】Ca2+和Cl-核外电子排布相同,因原子序数Ca>Cl,则r(Ca2+)【核心归纳】
微粒半径大小的比较方法
1.影响微粒半径的因素主要是核电荷数和电子的层数。同周期中,核电荷数越大,微粒半径越小;同主族中,电子层数越多,微粒半径越大。
2.阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,如r(Na+)3.电子层结构相同的离子,随核电荷数增大,离子半径减小,如r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。
4.不同价态的同种元素的离子,核外电子多的半径大,如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
5.“三看”法快速判断简单微粒半径大小
(1)“一看”电子的层数:最外层电子数相同时,电子的电子层数越多,半径越大。
(2)“二看”核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
(3)“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
【典型例题】
【例3】下列微粒半径依次增大的是( )。
A.同一主族元素随着原子序数的递增
B.同一周期元素随着原子序数的递增
C.Na+、Mg2+、Al3+、F-
D.P、S、S2-、Cl-
【答案】A
【解析】依据比较微粒半径大小的规律进行分析,同一主族元素随着原子序数的递增,电子的层数依次增加,原子半径依次增大,A项正确;同一周期元素随着原子序数的递增,原子半径逐渐减小,B项错误;各微粒电子层结构相同,核电荷数越大,半径越小,故F-半径最大,Al3+最小,C项错误;微粒半径P>S,S2->Cl-,D项错误。
【例4】下列各组微粒的半径比较中,正确的是( )。
①FA.①③ B.②③ C.③④ D.①②
【答案】A
【解析】同一元素的微粒半径:r(阴离子)>r(原子)>r(阳离子);具有相同电子层结构的离子,核电荷数越大,离子半径越小;电子层数相同的原子,随着原子序数递增,原子半径递减;最外层电子数相同的原子,电子层数越多,原子半径越大。据此可判断出:①正确;②应为O2->Mg2+>Al3+;③正确;④应为P>S>Cl。
易错警示:对微粒半径的认识误区
1.微粒半径受电子层数和核电荷数的综合影响,并不是单独地取决于某一方面的因素。
2.电子层数多的原子半径不一定大,如锂的原子半径为0.152 nm,而氯的原子半径为0.099 nm。
3.对于同一种元素,并不是原子半径一定大于离子半径。如Cl-的半径大于Cl的半径。
【随堂检测】
1.据报道,我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在元素周期表中的位置是( )。
A.第3周期ⅠA族 B.第4周期ⅠA族
C.第5周期ⅠA族 D.第3周期ⅡA族
【答案】C
【解析】镤-239的质子数为239-148=91,则A元素的一种同位素的质子数为91-54=37,该原子电子排布式为1s22s22p63s23p63d104s24p65s1,该元素位于第5周期ⅠA族。
2.某元素的价电子排布是3d64s2,下列对该元素的说法中错误的是( )。
A.该元素位于元素周期表中第4周期Ⅷ族
B.该元素只有2个价电子
C.该元素的+3价离子比+2价离子的氧化性强
D.常温下,其单质难溶于浓硝酸
【答案】B
【解析】A项,该元素的价电子数为8,有4个电子层,则位于第4周期Ⅷ族;B项,价电子数为8;C项,该元素为Fe,Fe3+比Fe2+氧化性强;D项,常温下,Fe遇浓硝酸发生钝化。
3.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )。
A.基态原子的N层上只有一个电子的元素一定是第ⅠA族元素
B.基态原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级半充满的元素可能位于s区
D.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
【答案】B
【解析】基态原子的N层上只有一个电子的元素,可能为K、Cr或Cu,K为ⅠA族元素,Cr、Cu分别为ⅥB、ⅠB 族元素,A项错误;原子的价电子排布为(n-1)d6~8ns2的元素为Ⅷ族元素,Ⅷ族属于副族,B项正确;基态原子的p能级半充满的元素,电子最后填充p能级,属于p区,C项错误;基态原子的价电子排布为(n-1)dxnsy的元素,若是ⅢB~ⅦB族及Ⅷ族第1列元素,其族序数为价电子排布式中d、s能级所含电子数目之和,族序数一定为x+y,若是ⅠB、ⅡB族元素,其族序数等于价电子排布中s能级所含电子数y,D项错误。
4.X、Y、Z是第ⅠA~ⅦA族的三种非金属元素,它们在周期表中的位置如图所示。
回答下列问题:
(1)X元素对应单质的化学式是 。
(2)Y元素的原子结构示意图为 ,Y与Na所形成的化合物的电子式为 。
(3)Z元素的名称是 ,从元素原子得失电子的角度分析,Z元素具有 性;若从Z元素在周期表中所处位置分析,它具有这种性质的原因是 ,其价层电子排布为 。
【答案】(1)F2
(2) Na+]2-Na+
(3)砷 两 Z位于元素周期表中金属与非金属交界线附近 4s24p3
【解析】非金属元素位于元素周期表中的右上方,X、Y、Z均为非金属元素,必位于ⅤA、ⅥA、ⅦA三个主族,则可认定X必为氟元素,Y为硫元素,Z为砷元素。
5.请完成下列各题的填空:
(1)氢化钠(NaH)的电子式为 ,H-的结构示意图为 。
(2)元素X的最外层电子数是次外层电子数的2倍,该元素的名称是 ,该元素原子的核外电子排布式为 ,该元素的价电子轨道表示式为 。
(3)前4周期元素中,未成对电子数为5的元素符号是 ,该元素在周期表中的位置为第 周期 族,属于 区。
(4)C、N、O三种元素的原子核外未成对电子数依次为 。
【答案】(1)Na+H]-
(2)碳 1s22s22p2
(3)Mn 4 ⅦB d
(4)2、3、2
【解析】(3)前4周期元素中,未成对电子数为5,即价电子排布式为3d54s2,原子序数为25,即为Mn,该元素在周期表中的位置为第4周期ⅦB族,位于d区。(4)C、N、O三种元素的原子核外未成对电子数依次为2、3、2。
2
【学习目标】
1.认识核外电子排布与元素周期表的关系,了解元素周期表中各区、周期、族的划分依据。
2.了解原子结构与原子半径周期性变化的联系。
【自主预习】
一、核外电子排布与元素周期表
1.核外电子排布与周期划分
(1)周期与能级组、原子轨道的对应关系
周期 序数 对应能级组 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族
1 1s 1 2 1s1 1s2 2
2 2s2p 4 8 2s1 2s22p6 8
3 3s3p 4 8 3s1 3s23p6 8
4 4s3d4p 9 18 4s1 4s24p6 18
5 5s4d5p 9 18 5s1 5s25p6 18
6 6s4f5d6p 16 32 6s1 6s26p6 32
7 7s5f6d7p 16 32 7s1 7s27p6 32
(2)规律
a.7个能级组对应7个周期。
b.周期序数= 。
c.本周期所包含元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
2.核外电子排布与族的划分
(1)划分依据:取决于原子的 和价电子排布。
(2)规律
a.主族元素
b.过渡元素
c.稀有气体→价电子排布: ( 除外)
3.元素周期表的分区
(1)根据核外电子排布
根据核外电子排布,可把周期表里的元素划分成5个区:s区、p区、d区、ds区和f区。除ds区外,区的名称来自最后填入电子的能级的符号。
(2)根据元素金属性与非金属性
4.金属元素与非金属元素在元素周期表中的位置
(1)金属元素和非金属元素的分界线为沿B、Si、As、Te、At与Al、Ge、Sb、Po之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。
(2)处于d区、ds区和f区的元素全部是金属元素。s区的元素除氢外,也全部是金属元素。
二、核外电子排布与原子半径
1.原子半径
(1)定义:依据量子力学理论,人们假定原子是一个 ,并用统计的方法来测定它的半径。
(2)影响因素
2.原子半径的周期性变化
(1)同周期(稀有气体元素除外)
a.规律:原子半径自左至右逐渐 。
b.原因:增加的电子所产生的电子间的 小于核电荷数增加导致的核对外层电子的 。
(2)同主族
a.规律:原子半径自上而下逐渐 。
b.原因:电子层数依次增加,电子间的 的影响大于核对外层电子的 的影响。
(3)过渡元素
a.规律:从总的变化趋势来看,从左到右原子半径的变化幅度 。
b.原因:增加的电子都分布在 轨道上,电子间的 与核对外层电子的 大致相当。
【参考答案】一、1.最外层电子所在轨道的电子层数 2.价电子数目 ns1~2 ns2np1~5 价电子数 (n-1)d1~10ns1~2 价电子数 ns电子数 ns2np6 He
二、1.球体 增大 越小 2.减小 排斥作用
吸引作用 增大 排斥作用 吸引作用 不大
(n-1)d 排斥作用 吸引作用
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)元素原子的价层电子就是最外层电子。 ( )
(2)除氦外,0族元素原子的价电子排布为ns2np6。 ( )
(3)最外层电子排布式为ns1或ns2的元素一定为金属元素。 ( )
(4)价电子排布为4s24p3的元素位于第4周期ⅤA族,是p区元素。 ( )
(5)在元素周期表中,s区、d区和ds区的元素都是金属元素。 ( )
(6)元素周期表有7个横行,即7个周期;有18个纵列,即18个族。 ( )
(7)每一周期都是碱金属元素开始,稀有气体元素结束。 ( )
【答案】(1)× (2)√ (3)× (4)√ (5)× (6)× (7)×
2.元素周期表中周期的划分与原子结构的哪部分有关
【答案】与原子的电子层数有关。
3.除氦外,0族价电子排布有何特点
【答案】除氦外,0族最外层均有8个电子,价电子排布为ns2np6。
4.主族元素从左到右价电子排布有何特点
【答案】主族元素从左到右价电子排布从ns1~ns2np5。
5.元素周期表划分区的依据是什么
【答案】依据是原子的价电子排布。
【合作探究】
任务1:核外电子排布与元素周期表
【实验探究】
1.价电子排布为5s25p1的元素,在元素周期表中处于什么位置 据此分析元素的价电子排布与元素在周期表中的位置有何关系。
【答案】该元素位于第5周期ⅢA族。元素能级中最高能层序数=周期序数,主族元素原子的价电子数=该元素在元素周期表中的主族序数。
2.某元素位于元素周期表中第4周期ⅤA族,你能否据此写出该元素的价电子排布和电子排布式
【答案】该元素的价电子排布为4s24p3;电子排布式为1s22s22p63s23p63d104s24p3。
3.原子序数1~36的某元素基态原子的最外层电子排布式为ns2,该元素可能属于哪一族
【答案】0族(He)、ⅡA族、ⅡB族、ⅢB族、ⅣB族、ⅤB族、ⅦB族、Ⅷ族。
4.基态原子的最外层电子排布为ns2的元素一定处于s区吗 基态原子的价电子排布为ns2的元素一定处于s区吗
【答案】不一定,基态原子的最外层电子排布为ns2的元素可能为ⅡA族元素(s区)、副族元素(d区、ds区、f区)、0族元素He(p区);基态原子的价电子排布为ns2的元素不一定处于s区,可能为ⅡA族元素(s区)、0族元素He(p区)。
【核心归纳】
一、核外电子排布与周期的划分
二、核外电子排布与族的划分
三、原子核外电子排布与元素周期表的分区
分区 元素分布 价电子排布 元素性质特点
s区 ⅠA族、ⅡA族 ns1~2 除H外都是活泼金属元素
p区 ⅢA族~ⅦA族、0族 ns2np1~6 最外层电子参与反应(稀有气体除外)
d区 ⅢB族~ⅦB族、Ⅷ族 (n-1)d1~9ns1~2(除Pd外) d轨道也不同程度地参与化学键的形成
ds区 ⅠB族、ⅡB族 (n-1)d10ns1~2 金属元素
f区 镧系、锕系 (n-2)f0~14(n-1)d0~2ns2 镧系元素化学性质相近,锕系元素化学性质相近
【典型例题】
【例1】下面的元素周期表中全都是金属元素的区域为( )。
A.只有s区 B.只有d区
C.s区、d区和ds区 D.f区、d区和ds区
【答案】D
【解析】s区中的H不是金属元素,过渡元素(f区、d区和ds区)全部是金属元素。
【例2】原子结构与元素周期表存在着内在联系。根据已学知识,回答下列问题:
(1)已知用s,p,d,f等符号表示的下列元素原子的电子排布式,判断它们所在的周期和族。
①1s22s22p63s23p1 ;
②1s22s22p63s23p63d54s1 ;
③1s22s22p63s23p63d64s2 ;
④1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p2 。
(2)已知下列元素在周期表中的位置,写出它们的元素符号和价电子排布式。
①第4周期ⅣB族 ;
②第5周期ⅦA族 。
【答案】(1)①第3周期ⅢA族
②第4周期ⅥB族
③第4周期Ⅷ族
④第6周期ⅣA族
(2)①Ti,3d24s2
②I,5s25p5
【解析】(1)在核外电子排布式中,能级序数最大的数为该元素所在的周期序数。①④的最外层的p轨道上都填充有电子,故①在ⅢA族、④在ⅣA族;②③元素的d轨道上都填充有电子但未满,故②在ⅥB族而③在Ⅷ族。
任务2:核外电子排布与微粒半径比较
情境导入 海洋是蔚蓝色的资源宝库。海洋中含有80多种元素,其中除氢、氧外,氯、钠、镁、硫、钙、钾、碳、锶、溴、硼、氟、硅12种称为常量元素,海水中所含有的元素大部分以盐溶液的形式存在,在这些盐类物质中氯化钠占80%以上。
问题生成
1.如何判断H、Li、Na、K原子半径的大小 理由是什么
【答案】H、Li、Na、K最外层电子数相同,而原子的电子层数依次增多,故半径依次增大。
2.如何比较Na+、Mg2+、Al3+半径的大小
【答案】Na+、Mg2+、Al3+的电子层构型相同,离子核外电子数相同,而核电荷数依次增大,故半径依次减小。
3.r(Na+)与r(Na) 哪个大 r(Cl-)与r(Cl)呢
【答案】根据同一种元素离子和原子的质子数相同,但是阴离子核外电子数大于质子数,阳离子核外电子数小于质子数,故可知r(Na)大于r(Na+),r(Cl-)大于r(Cl)。
4.r(Ca2+)与r(Cl-) 哪个大
【答案】Ca2+和Cl-核外电子排布相同,因原子序数Ca>Cl,则r(Ca2+)
微粒半径大小的比较方法
1.影响微粒半径的因素主要是核电荷数和电子的层数。同周期中,核电荷数越大,微粒半径越小;同主族中,电子层数越多,微粒半径越大。
2.阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,如r(Na+)
4.不同价态的同种元素的离子,核外电子多的半径大,如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
5.“三看”法快速判断简单微粒半径大小
(1)“一看”电子的层数:最外层电子数相同时,电子的电子层数越多,半径越大。
(2)“二看”核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
(3)“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
【典型例题】
【例3】下列微粒半径依次增大的是( )。
A.同一主族元素随着原子序数的递增
B.同一周期元素随着原子序数的递增
C.Na+、Mg2+、Al3+、F-
D.P、S、S2-、Cl-
【答案】A
【解析】依据比较微粒半径大小的规律进行分析,同一主族元素随着原子序数的递增,电子的层数依次增加,原子半径依次增大,A项正确;同一周期元素随着原子序数的递增,原子半径逐渐减小,B项错误;各微粒电子层结构相同,核电荷数越大,半径越小,故F-半径最大,Al3+最小,C项错误;微粒半径P>S,S2->Cl-,D项错误。
【例4】下列各组微粒的半径比较中,正确的是( )。
①F
【答案】A
【解析】同一元素的微粒半径:r(阴离子)>r(原子)>r(阳离子);具有相同电子层结构的离子,核电荷数越大,离子半径越小;电子层数相同的原子,随着原子序数递增,原子半径递减;最外层电子数相同的原子,电子层数越多,原子半径越大。据此可判断出:①正确;②应为O2->Mg2+>Al3+;③正确;④应为P>S>Cl。
易错警示:对微粒半径的认识误区
1.微粒半径受电子层数和核电荷数的综合影响,并不是单独地取决于某一方面的因素。
2.电子层数多的原子半径不一定大,如锂的原子半径为0.152 nm,而氯的原子半径为0.099 nm。
3.对于同一种元素,并不是原子半径一定大于离子半径。如Cl-的半径大于Cl的半径。
【随堂检测】
1.据报道,我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在元素周期表中的位置是( )。
A.第3周期ⅠA族 B.第4周期ⅠA族
C.第5周期ⅠA族 D.第3周期ⅡA族
【答案】C
【解析】镤-239的质子数为239-148=91,则A元素的一种同位素的质子数为91-54=37,该原子电子排布式为1s22s22p63s23p63d104s24p65s1,该元素位于第5周期ⅠA族。
2.某元素的价电子排布是3d64s2,下列对该元素的说法中错误的是( )。
A.该元素位于元素周期表中第4周期Ⅷ族
B.该元素只有2个价电子
C.该元素的+3价离子比+2价离子的氧化性强
D.常温下,其单质难溶于浓硝酸
【答案】B
【解析】A项,该元素的价电子数为8,有4个电子层,则位于第4周期Ⅷ族;B项,价电子数为8;C项,该元素为Fe,Fe3+比Fe2+氧化性强;D项,常温下,Fe遇浓硝酸发生钝化。
3.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )。
A.基态原子的N层上只有一个电子的元素一定是第ⅠA族元素
B.基态原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级半充满的元素可能位于s区
D.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
【答案】B
【解析】基态原子的N层上只有一个电子的元素,可能为K、Cr或Cu,K为ⅠA族元素,Cr、Cu分别为ⅥB、ⅠB 族元素,A项错误;原子的价电子排布为(n-1)d6~8ns2的元素为Ⅷ族元素,Ⅷ族属于副族,B项正确;基态原子的p能级半充满的元素,电子最后填充p能级,属于p区,C项错误;基态原子的价电子排布为(n-1)dxnsy的元素,若是ⅢB~ⅦB族及Ⅷ族第1列元素,其族序数为价电子排布式中d、s能级所含电子数目之和,族序数一定为x+y,若是ⅠB、ⅡB族元素,其族序数等于价电子排布中s能级所含电子数y,D项错误。
4.X、Y、Z是第ⅠA~ⅦA族的三种非金属元素,它们在周期表中的位置如图所示。
回答下列问题:
(1)X元素对应单质的化学式是 。
(2)Y元素的原子结构示意图为 ,Y与Na所形成的化合物的电子式为 。
(3)Z元素的名称是 ,从元素原子得失电子的角度分析,Z元素具有 性;若从Z元素在周期表中所处位置分析,它具有这种性质的原因是 ,其价层电子排布为 。
【答案】(1)F2
(2) Na+]2-Na+
(3)砷 两 Z位于元素周期表中金属与非金属交界线附近 4s24p3
【解析】非金属元素位于元素周期表中的右上方,X、Y、Z均为非金属元素,必位于ⅤA、ⅥA、ⅦA三个主族,则可认定X必为氟元素,Y为硫元素,Z为砷元素。
5.请完成下列各题的填空:
(1)氢化钠(NaH)的电子式为 ,H-的结构示意图为 。
(2)元素X的最外层电子数是次外层电子数的2倍,该元素的名称是 ,该元素原子的核外电子排布式为 ,该元素的价电子轨道表示式为 。
(3)前4周期元素中,未成对电子数为5的元素符号是 ,该元素在周期表中的位置为第 周期 族,属于 区。
(4)C、N、O三种元素的原子核外未成对电子数依次为 。
【答案】(1)Na+H]-
(2)碳 1s22s22p2
(3)Mn 4 ⅦB d
(4)2、3、2
【解析】(3)前4周期元素中,未成对电子数为5,即价电子排布式为3d54s2,原子序数为25,即为Mn,该元素在周期表中的位置为第4周期ⅦB族,位于d区。(4)C、N、O三种元素的原子核外未成对电子数依次为2、3、2。
2
