2.2 第3课时 分子的空间结构与分子性质 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.2 第3课时 分子的空间结构与分子性质 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 292.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览



文档简介
2.2 第3课时 分子的空间结构与分子性质
【学习目标】
1.知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
2.结合实例初步认识分子的手性对其性质的影响。培养宏观辨识与微观探析的核心素养。
【自主预习】
一、分子中的原子排布与对称性
1.对称分子
(1)依据 的旋转或借助 的反映能够复原的分子。
(2)对称性与分子性质:分子的许多性质如 、 等都与分子的对称性有关。
2.手性分子
旋光性 在光通过某些化合物时,光波振动的方向会旋转一定的角度,这种性质称为旋光性
手性 具有旋光性的分子本身和它们在镜中的像,就如同人的左手和右手,相似但不能重叠,因而称这类分子表现出手性
手性分子 具有手性的分子叫作手性分子
不对称 碳原子 对于仅通过单键连接其他原子的碳原子,当其所连接的四个原子或基团均 时,这个碳原子称为不对称碳原子
应用 ①手性分子缩合制蛋白质和核酸 ②分析药物有效成分异构体的生物活性和毒副作用 ③药物的不对称合成
二、分子中的电荷分布与极性
1.分子极性的实验探究
实验 操作 在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,将用毛皮摩擦过的橡胶棒靠近四氯化碳液流 再向另一酸式滴定管中加入蒸馏水,打开活塞让蒸馏水缓缓流下,并将用毛皮摩擦过的橡胶棒靠近水流
现象 四氯化碳液流方向 水流方向
结论 四氯化碳液流与橡胶棒之间 电性作用 水流与橡胶棒之间 电性作用
解释 四氯化碳分子中无正极和负极之分 水分子中存在正、负两极
2.极性分子与非极性分子
(1)极性分子:分子内存在正、负两极的分子。
(2)非极性分子:分子内不存在正、负两极的分子。
3.分子极性的判断
【参考答案】一、1.(1)对称轴 对称面 (2)极性 旋光性
2.不相同
二、1.不变 发生改变 无 有 3.非极性 极性 非极性 非极性 极性
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)极性分子中不可能含有非极性键。 ( )
(2)离子化合物中不可能含有非极性键。 ( )
(3)非极性分子中不可能含有极性键。 ( )
(4)一般极性分子中含有极性键。 ( )
(5)H2O、CO2、CH4都是非极性分子。 ( )
(6)非极性分子中一定含有非极性键。 ( )
【答案】(1)× (2)× (3)× (4)√ (5)× (6)×
2.判断某有机物是否具有手性异构体的关键是什么
【答案】关键是分析其含有的碳原子是否连有4个互不相同的原子或基团。
3.手性异构体的性质相同吗
【答案】不完全相同,某些性质差异很大。
4.“含有极性键的双原子分子一定是极性分子,含有非极性键的双原子分子一定是非极性分子”。这句话是否正确
【答案】正确,双原子分子的极性和化学键的性质一致。
5.既含极性键,又含非极性键的分子一定是极性分子吗
【答案】不一定。是否为极性分子与分子空间结构有关。例如,H2O2、N2H4都是非直线形分子,它们是极性分子。而CH≡CH(直线形)、CH2CH2(共平面)、C6H6(共平面)、C8H8(立方烷)、CH3CH3等对称分子为非极性分子。
【合作探究】
任务1:分子的手性
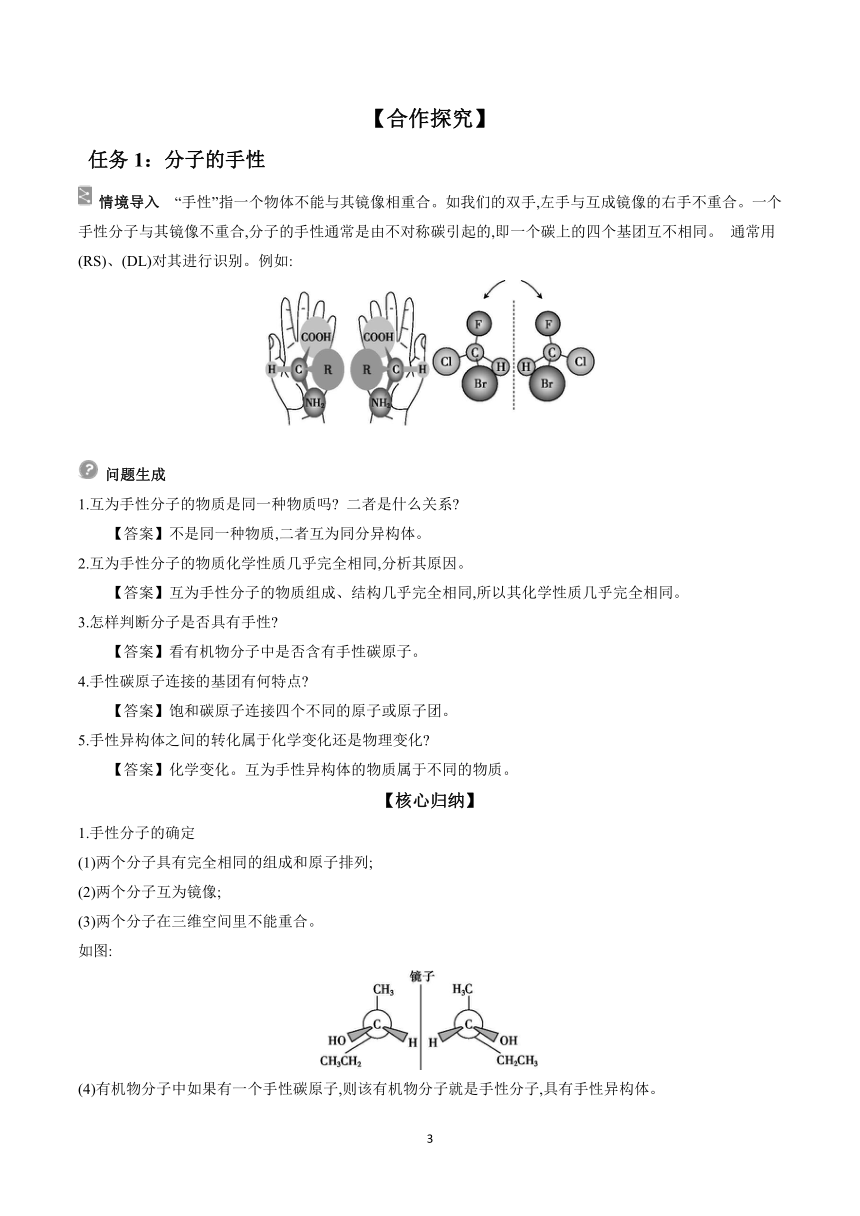
情境导入 “手性”指一个物体不能与其镜像相重合。如我们的双手,左手与互成镜像的右手不重合。一个手性分子与其镜像不重合,分子的手性通常是由不对称碳引起的,即一个碳上的四个基团互不相同。 通常用(RS)、(DL)对其进行识别。例如:
问题生成
1.互为手性分子的物质是同一种物质吗 二者是什么关系
【答案】不是同一种物质,二者互为同分异构体。
2.互为手性分子的物质化学性质几乎完全相同,分析其原因。
【答案】互为手性分子的物质组成、结构几乎完全相同,所以其化学性质几乎完全相同。
3.怎样判断分子是否具有手性
【答案】看有机物分子中是否含有手性碳原子。
4.手性碳原子连接的基团有何特点
【答案】饱和碳原子连接四个不同的原子或原子团。
5.手性异构体之间的转化属于化学变化还是物理变化
【答案】化学变化。互为手性异构体的物质属于不同的物质。
【核心归纳】
1.手性分子的确定
(1)两个分子具有完全相同的组成和原子排列;
(2)两个分子互为镜像;
(3)两个分子在三维空间里不能重合。
如图:
(4)有机物分子中如果有一个手性碳原子,则该有机物分子就是手性分子,具有手性异构体。
2.手性碳原子的确定
(1)碳原子连接了四个不同的原子或基团,形成的化合物存在手性异构,则该碳原子称为手性碳原子。如,其中*C即为手性碳原子。
(2)不饱和碳原子(如、—C≡C—中的碳原子)一定不是手性碳原子。
【典型例题】
【例1】下列有机物中含有两个手性碳原子的是( )。
A. B.
C. D.
【答案】B
【解析】由有机物的结构可以看出,A、C、D三项中没有手性碳原子;B项中每个与氯原子相连的碳原子都是手性碳原子。
【例2】下列分子含有手性碳原子,属于手性分子的是( )。
A. B.H2NCH2COOH
C. D.
【答案】C
【解析】抓住“手性”的含义,C原子上连接有四个不同的原子或原子团,即为手性碳原子,只有1个手性碳原子的分子一定为手性分子。
任务2:判断分子极性的方法
情境导入 PH3又称磷化氢,在常温下是一种无色、有大蒜气味的气体,电石气的杂质中常含有它。它的结构与NH3分子结构相似。如果遇到痕量其他磷的氢化物如乙磷化氢,会引起自燃。磷化氢按照高毒性且自燃的气体处理。吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。
问题生成
1.PH3分子的中心磷原子的杂化类型是什么 空间结构是什么
【答案】根据杂化轨道的判断方法可知,PH3分子的中心磷原子的杂化类型为sp3杂化;根据价电子对互斥理论,由于磷原子有1对孤电子对,故其空间结构是三角锥形。
2.PH3分子中的P—H键是哪种共价键 该分子是极性分子还是非极性分子
【答案】PH3分子中的P—H键是极性键,PH3是极性分子。
【核心归纳】
1.分子极性的判断方法
(1)根据键的类型及分子的空间结构判断
键无极性,分子必无极性;键有极性,各键空间排列均匀,使键的极性相互抵消,分子无极性;键有极性,各键的空间排列不均匀,不能使键的极性相互抵消,分子有极性。
共价键的极性与分子极性的关系可总结如下:
(2)根据中心原子最外层电子是否全部成键判断
分子中的中心原子最外层电子若全部成键,则此分子一般为非极性分子;分子中的中心原子最外层电子若未全部成键,则此分子一般为极性分子。
SiF4、BCl3、CS2等分子中的中心原子的最外层电子均全部成键,所以它们都是非极性分子。而H2Se、AsH3等分子中的中心原子的最外层电子均未全部成键,所以它们都是极性分子。
(3)判断ABn型分子极性的经验方法
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。如SO2为极性分子,SO3为非极性分子。
2.分子的极性与键的极性和分子空间结构的关系
分子类型 键的极性 分子空间结构 分子极性 代表分子
双原子 分子 A2 非极性键 直线形(对称) 非极性 N2等
AB 极性键 直线形(不对称) 极性 CO、HF等
三原子 分子 AB2 直线形(对称) 非极性 CO2、CS2、BeCl2等
角形(不对称) 极性 H2O、H2S、SO2等
四原子 分子 AB3 平面三角形(对称) 非极性 BF3、BCl3、SO3等
三角锥形 极性 NH3、PCl3、NF3等
五原子 分子 AB4 正四面体形(对称) 非极性 CH4、SiF4等
ABn 四面体形(不对称) 极性 CH2Cl2等
3.分子的极性对物质溶解性的影响
(1)根据物质的“相似相溶”原理,极性分子(如HCl)或离子化合物易溶于水等极性溶剂,非极性分子(如Cl2、Br2、I2、S8)易溶于苯、四氯化碳等非极性溶剂。
(2)一般来说,同是非极性分子,相对分子质量越大,溶解度越大。
(3)乙醇是一种“两栖”溶剂,既能溶解氢化钠等离子化合物;又能溶解非极性物质。例如,亚硫酸钠与硫反应,可以用乙醇润湿。
4.物质溶解度的比较方法
(1)根据外界条件判断
对于气体物质,一般来说,压强一定时,温度越高,溶解度越小;温度一定时,压强越大,溶解度越大。对于固体和液体物质,一般来说,压强对物质的溶解度影响不大;温度越高,一般来说,物质的溶解度越大(氢氧化钙的溶解度随温度的升高而减小)。
(2)根据“相似相溶”原理判断
非极性溶质一般易溶于非极性溶剂,极性溶质一般易能溶于极性溶剂。如蔗糖和氨易溶于水,难溶于四氯化碳;萘和碘易溶于四氯化碳,难溶于水。
(3)根据溶质分子和溶剂分子间是否存在氢键判断
如果溶质和溶剂分子之间能形成氢键,则溶质的溶解度较大,且形成的氢键越多,溶解度越大。如NH3、HF极易溶于水,甲醇、乙醇、甲酸、乙酸、甲醛、乙醛和氨基乙酸等都易溶于水是因为它们与水分子间能形成氢键。
(4)根据溶质是否与水反应判断
溶质与水发生反应,溶质的溶解度会增大。如SO2与水反应生成的H2SO3可溶于水,故SO2的溶解度较大。
【典型例题】
【例3】在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有直线形结构的非极性分子是 。
(3)以极性键相结合,具有三角锥形结构的极性分子是 。
(4)以极性键相结合,具有正四面体结构的非极性分子是 。
(5)以极性键相结合,具有角形结构的极性分子是 。
(6)以极性键相结合,而且分子极性最大的是 。
【答案】(1)N2 (2)CS2 (3)NH3 (4)CH4 (5)H2O (6)HF
【例4】双氧水(H2O2)是一种医用消毒杀菌剂。H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52',而两个O—H键与O—O键的夹角均为96°52'。试回答:
(1)H2O2分子的电子式为 ,结构式为 。
(2)H2O2分子中存在 键和 键,为 (填“极性”或“非极性”)分子。
(3)H2O2难溶于CS2,其原因是 。
(4)H2O2分子中氧元素的化合价为 ,原因是 。
【答案】(1) H—O—O—H
(2)极性 非极性 极性
(3)H2O2为极性分子,CS2为非极性分子,根据“相似相溶”原理可知H2O2难溶于CS2
(4)-1 O—O键为非极性键,O—H键为极性键,共用电子对偏向于氧,故氧元素显-1价
【解析】(2)H2O2分子的空间结构为不对称结构,应为极性分子,含有O—O非极性键和O—H极性键。(3)根据“相似相溶”原理可知,H2O2难溶于非极性溶剂CS2。
(4)共用电子对的偏移决定了元素在化合物中的化合价。
【随堂检测】
1.下列关于粒子结构的描述错误的是( )。
A.CS2、C2H2、BeCl2都是直线形分子
B.CCl4和CH2Cl2均是四面体结构的非极性分子
C.H2S和NH3均是由极性键构成的极性分子
D.HCl和HS-均是含有一个极性键的18电子粒子
【答案】B
【解析】由于C—H键的键长小于C—Cl键的键长,故CH2Cl2的空间结构不是对称的正四面体结构,因而属于极性分子,B项错误。
2.两种非金属元素原子A、B所形成的下列分子中一定属于极性分子的是( )。
A. B.B—A—B
C. D.
【答案】D
【解析】A项,如果是甲烷,则为正四面体结构,属于非极性分子;B项,如果是呈直线形的BeCl2,则为非极性分子;C项,如果是BF3,则呈平面三角形,属于非极性分子;D项,呈三角锥形,一定属于极性分子。
3.(双选)反应Cl2+2NaOHNaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是( )。
A.Cl2是非极性分子
B.NaOH的电子式为NH
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
【答案】AC
【解析】Cl2分子正、负电荷重心重合,为非极性分子,A项正确;NaOH中含有离子键,其电子式为Na+H]-,B项错误;NaClO中钠离子和次氯酸根离子之间存在离子键,次氯酸根离子中的Cl—O为共价键,该物质含有离子键和共价键,C项正确;氯离子核外有3个电子层,钠离子核外有2个电子层,二者电子层结构不同,D项错误。
4.观察模型并结合有关信息,下列说法不正确的是( )。
B12结构单元 SF6分子 S8分子 HCN
结构示意图
备注 熔点1873 K — 易溶于CS2 —
A.单质B12中只含有非极性键
B.SF6是由极性键构成的非极性分子
C.固态S8中S原子为sp2杂化
D.HCN分子中σ键与π键数目之比为1∶1
【答案】C
【解析】B12中只存在B—B非极性键,A项正确;SF6的空间结构为对称结构,分子极性抵消,SF6为非极性分子,B项正确;S8是一个环形分子,每个S与两个其他S原子相连,S原子最外层有6个电子,两对孤电子对,原子杂化轨道数为4,所以S是sp3杂化,C项错误;HCN的结构式为H—C≡N,单键为σ键,三键为1个σ键和2个π键,HCN分子中σ键与π键数目之比为1∶1,D项正确。
5.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )。
A.苹果酸 HOOC—*CH2—CHOH—COOH
B.丙氨酸
C.葡萄糖
D.甘油醛
【答案】A
【解析】A项,HOOC—*CH2—CHOH—COOH中*C连接了2个氢原子,不是手性碳原子。
6.下列有机物分子中带“*”的碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )。
A.与乙酸发生酯化反应
B.与NaOH水溶液反应
C.与银氨溶液作用发生银镜反应
D.催化剂作用下与H2反应
【答案】C
【解析】该物质与乙酸发生酯化反应所生成的物质中*C连有两个CH3COOCH2—,不具有手性,A项不符合;该物质水解或与氢气加成后,*C上有两个—CH2OH,故产物无手性碳原子,B、D两项不符合;通过氧化反应,醛基变成—COONH4,*C上的4个基团仍不相同,故产物中仍含有手性碳原子,C项符合。
2
【学习目标】
1.知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
2.结合实例初步认识分子的手性对其性质的影响。培养宏观辨识与微观探析的核心素养。
【自主预习】
一、分子中的原子排布与对称性
1.对称分子
(1)依据 的旋转或借助 的反映能够复原的分子。
(2)对称性与分子性质:分子的许多性质如 、 等都与分子的对称性有关。
2.手性分子
旋光性 在光通过某些化合物时,光波振动的方向会旋转一定的角度,这种性质称为旋光性
手性 具有旋光性的分子本身和它们在镜中的像,就如同人的左手和右手,相似但不能重叠,因而称这类分子表现出手性
手性分子 具有手性的分子叫作手性分子
不对称 碳原子 对于仅通过单键连接其他原子的碳原子,当其所连接的四个原子或基团均 时,这个碳原子称为不对称碳原子
应用 ①手性分子缩合制蛋白质和核酸 ②分析药物有效成分异构体的生物活性和毒副作用 ③药物的不对称合成
二、分子中的电荷分布与极性
1.分子极性的实验探究
实验 操作 在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,将用毛皮摩擦过的橡胶棒靠近四氯化碳液流 再向另一酸式滴定管中加入蒸馏水,打开活塞让蒸馏水缓缓流下,并将用毛皮摩擦过的橡胶棒靠近水流
现象 四氯化碳液流方向 水流方向
结论 四氯化碳液流与橡胶棒之间 电性作用 水流与橡胶棒之间 电性作用
解释 四氯化碳分子中无正极和负极之分 水分子中存在正、负两极
2.极性分子与非极性分子
(1)极性分子:分子内存在正、负两极的分子。
(2)非极性分子:分子内不存在正、负两极的分子。
3.分子极性的判断
【参考答案】一、1.(1)对称轴 对称面 (2)极性 旋光性
2.不相同
二、1.不变 发生改变 无 有 3.非极性 极性 非极性 非极性 极性
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)极性分子中不可能含有非极性键。 ( )
(2)离子化合物中不可能含有非极性键。 ( )
(3)非极性分子中不可能含有极性键。 ( )
(4)一般极性分子中含有极性键。 ( )
(5)H2O、CO2、CH4都是非极性分子。 ( )
(6)非极性分子中一定含有非极性键。 ( )
【答案】(1)× (2)× (3)× (4)√ (5)× (6)×
2.判断某有机物是否具有手性异构体的关键是什么
【答案】关键是分析其含有的碳原子是否连有4个互不相同的原子或基团。
3.手性异构体的性质相同吗
【答案】不完全相同,某些性质差异很大。
4.“含有极性键的双原子分子一定是极性分子,含有非极性键的双原子分子一定是非极性分子”。这句话是否正确
【答案】正确,双原子分子的极性和化学键的性质一致。
5.既含极性键,又含非极性键的分子一定是极性分子吗
【答案】不一定。是否为极性分子与分子空间结构有关。例如,H2O2、N2H4都是非直线形分子,它们是极性分子。而CH≡CH(直线形)、CH2CH2(共平面)、C6H6(共平面)、C8H8(立方烷)、CH3CH3等对称分子为非极性分子。
【合作探究】
任务1:分子的手性
情境导入 “手性”指一个物体不能与其镜像相重合。如我们的双手,左手与互成镜像的右手不重合。一个手性分子与其镜像不重合,分子的手性通常是由不对称碳引起的,即一个碳上的四个基团互不相同。 通常用(RS)、(DL)对其进行识别。例如:
问题生成
1.互为手性分子的物质是同一种物质吗 二者是什么关系
【答案】不是同一种物质,二者互为同分异构体。
2.互为手性分子的物质化学性质几乎完全相同,分析其原因。
【答案】互为手性分子的物质组成、结构几乎完全相同,所以其化学性质几乎完全相同。
3.怎样判断分子是否具有手性
【答案】看有机物分子中是否含有手性碳原子。
4.手性碳原子连接的基团有何特点
【答案】饱和碳原子连接四个不同的原子或原子团。
5.手性异构体之间的转化属于化学变化还是物理变化
【答案】化学变化。互为手性异构体的物质属于不同的物质。
【核心归纳】
1.手性分子的确定
(1)两个分子具有完全相同的组成和原子排列;
(2)两个分子互为镜像;
(3)两个分子在三维空间里不能重合。
如图:
(4)有机物分子中如果有一个手性碳原子,则该有机物分子就是手性分子,具有手性异构体。
2.手性碳原子的确定
(1)碳原子连接了四个不同的原子或基团,形成的化合物存在手性异构,则该碳原子称为手性碳原子。如,其中*C即为手性碳原子。
(2)不饱和碳原子(如、—C≡C—中的碳原子)一定不是手性碳原子。
【典型例题】
【例1】下列有机物中含有两个手性碳原子的是( )。
A. B.
C. D.
【答案】B
【解析】由有机物的结构可以看出,A、C、D三项中没有手性碳原子;B项中每个与氯原子相连的碳原子都是手性碳原子。
【例2】下列分子含有手性碳原子,属于手性分子的是( )。
A. B.H2NCH2COOH
C. D.
【答案】C
【解析】抓住“手性”的含义,C原子上连接有四个不同的原子或原子团,即为手性碳原子,只有1个手性碳原子的分子一定为手性分子。
任务2:判断分子极性的方法
情境导入 PH3又称磷化氢,在常温下是一种无色、有大蒜气味的气体,电石气的杂质中常含有它。它的结构与NH3分子结构相似。如果遇到痕量其他磷的氢化物如乙磷化氢,会引起自燃。磷化氢按照高毒性且自燃的气体处理。吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。
问题生成
1.PH3分子的中心磷原子的杂化类型是什么 空间结构是什么
【答案】根据杂化轨道的判断方法可知,PH3分子的中心磷原子的杂化类型为sp3杂化;根据价电子对互斥理论,由于磷原子有1对孤电子对,故其空间结构是三角锥形。
2.PH3分子中的P—H键是哪种共价键 该分子是极性分子还是非极性分子
【答案】PH3分子中的P—H键是极性键,PH3是极性分子。
【核心归纳】
1.分子极性的判断方法
(1)根据键的类型及分子的空间结构判断
键无极性,分子必无极性;键有极性,各键空间排列均匀,使键的极性相互抵消,分子无极性;键有极性,各键的空间排列不均匀,不能使键的极性相互抵消,分子有极性。
共价键的极性与分子极性的关系可总结如下:
(2)根据中心原子最外层电子是否全部成键判断
分子中的中心原子最外层电子若全部成键,则此分子一般为非极性分子;分子中的中心原子最外层电子若未全部成键,则此分子一般为极性分子。
SiF4、BCl3、CS2等分子中的中心原子的最外层电子均全部成键,所以它们都是非极性分子。而H2Se、AsH3等分子中的中心原子的最外层电子均未全部成键,所以它们都是极性分子。
(3)判断ABn型分子极性的经验方法
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。如SO2为极性分子,SO3为非极性分子。
2.分子的极性与键的极性和分子空间结构的关系
分子类型 键的极性 分子空间结构 分子极性 代表分子
双原子 分子 A2 非极性键 直线形(对称) 非极性 N2等
AB 极性键 直线形(不对称) 极性 CO、HF等
三原子 分子 AB2 直线形(对称) 非极性 CO2、CS2、BeCl2等
角形(不对称) 极性 H2O、H2S、SO2等
四原子 分子 AB3 平面三角形(对称) 非极性 BF3、BCl3、SO3等
三角锥形 极性 NH3、PCl3、NF3等
五原子 分子 AB4 正四面体形(对称) 非极性 CH4、SiF4等
ABn 四面体形(不对称) 极性 CH2Cl2等
3.分子的极性对物质溶解性的影响
(1)根据物质的“相似相溶”原理,极性分子(如HCl)或离子化合物易溶于水等极性溶剂,非极性分子(如Cl2、Br2、I2、S8)易溶于苯、四氯化碳等非极性溶剂。
(2)一般来说,同是非极性分子,相对分子质量越大,溶解度越大。
(3)乙醇是一种“两栖”溶剂,既能溶解氢化钠等离子化合物;又能溶解非极性物质。例如,亚硫酸钠与硫反应,可以用乙醇润湿。
4.物质溶解度的比较方法
(1)根据外界条件判断
对于气体物质,一般来说,压强一定时,温度越高,溶解度越小;温度一定时,压强越大,溶解度越大。对于固体和液体物质,一般来说,压强对物质的溶解度影响不大;温度越高,一般来说,物质的溶解度越大(氢氧化钙的溶解度随温度的升高而减小)。
(2)根据“相似相溶”原理判断
非极性溶质一般易溶于非极性溶剂,极性溶质一般易能溶于极性溶剂。如蔗糖和氨易溶于水,难溶于四氯化碳;萘和碘易溶于四氯化碳,难溶于水。
(3)根据溶质分子和溶剂分子间是否存在氢键判断
如果溶质和溶剂分子之间能形成氢键,则溶质的溶解度较大,且形成的氢键越多,溶解度越大。如NH3、HF极易溶于水,甲醇、乙醇、甲酸、乙酸、甲醛、乙醛和氨基乙酸等都易溶于水是因为它们与水分子间能形成氢键。
(4)根据溶质是否与水反应判断
溶质与水发生反应,溶质的溶解度会增大。如SO2与水反应生成的H2SO3可溶于水,故SO2的溶解度较大。
【典型例题】
【例3】在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有直线形结构的非极性分子是 。
(3)以极性键相结合,具有三角锥形结构的极性分子是 。
(4)以极性键相结合,具有正四面体结构的非极性分子是 。
(5)以极性键相结合,具有角形结构的极性分子是 。
(6)以极性键相结合,而且分子极性最大的是 。
【答案】(1)N2 (2)CS2 (3)NH3 (4)CH4 (5)H2O (6)HF
【例4】双氧水(H2O2)是一种医用消毒杀菌剂。H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52',而两个O—H键与O—O键的夹角均为96°52'。试回答:
(1)H2O2分子的电子式为 ,结构式为 。
(2)H2O2分子中存在 键和 键,为 (填“极性”或“非极性”)分子。
(3)H2O2难溶于CS2,其原因是 。
(4)H2O2分子中氧元素的化合价为 ,原因是 。
【答案】(1) H—O—O—H
(2)极性 非极性 极性
(3)H2O2为极性分子,CS2为非极性分子,根据“相似相溶”原理可知H2O2难溶于CS2
(4)-1 O—O键为非极性键,O—H键为极性键,共用电子对偏向于氧,故氧元素显-1价
【解析】(2)H2O2分子的空间结构为不对称结构,应为极性分子,含有O—O非极性键和O—H极性键。(3)根据“相似相溶”原理可知,H2O2难溶于非极性溶剂CS2。
(4)共用电子对的偏移决定了元素在化合物中的化合价。
【随堂检测】
1.下列关于粒子结构的描述错误的是( )。
A.CS2、C2H2、BeCl2都是直线形分子
B.CCl4和CH2Cl2均是四面体结构的非极性分子
C.H2S和NH3均是由极性键构成的极性分子
D.HCl和HS-均是含有一个极性键的18电子粒子
【答案】B
【解析】由于C—H键的键长小于C—Cl键的键长,故CH2Cl2的空间结构不是对称的正四面体结构,因而属于极性分子,B项错误。
2.两种非金属元素原子A、B所形成的下列分子中一定属于极性分子的是( )。
A. B.B—A—B
C. D.
【答案】D
【解析】A项,如果是甲烷,则为正四面体结构,属于非极性分子;B项,如果是呈直线形的BeCl2,则为非极性分子;C项,如果是BF3,则呈平面三角形,属于非极性分子;D项,呈三角锥形,一定属于极性分子。
3.(双选)反应Cl2+2NaOHNaClO+NaCl+H2O可用于制备含氯消毒剂。下列说法正确的是( )。
A.Cl2是非极性分子
B.NaOH的电子式为NH
C.NaClO既含离子键又含共价键
D.Cl-与Na+具有相同的电子层结构
【答案】AC
【解析】Cl2分子正、负电荷重心重合,为非极性分子,A项正确;NaOH中含有离子键,其电子式为Na+H]-,B项错误;NaClO中钠离子和次氯酸根离子之间存在离子键,次氯酸根离子中的Cl—O为共价键,该物质含有离子键和共价键,C项正确;氯离子核外有3个电子层,钠离子核外有2个电子层,二者电子层结构不同,D项错误。
4.观察模型并结合有关信息,下列说法不正确的是( )。
B12结构单元 SF6分子 S8分子 HCN
结构示意图
备注 熔点1873 K — 易溶于CS2 —
A.单质B12中只含有非极性键
B.SF6是由极性键构成的非极性分子
C.固态S8中S原子为sp2杂化
D.HCN分子中σ键与π键数目之比为1∶1
【答案】C
【解析】B12中只存在B—B非极性键,A项正确;SF6的空间结构为对称结构,分子极性抵消,SF6为非极性分子,B项正确;S8是一个环形分子,每个S与两个其他S原子相连,S原子最外层有6个电子,两对孤电子对,原子杂化轨道数为4,所以S是sp3杂化,C项错误;HCN的结构式为H—C≡N,单键为σ键,三键为1个σ键和2个π键,HCN分子中σ键与π键数目之比为1∶1,D项正确。
5.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )。
A.苹果酸 HOOC—*CH2—CHOH—COOH
B.丙氨酸
C.葡萄糖
D.甘油醛
【答案】A
【解析】A项,HOOC—*CH2—CHOH—COOH中*C连接了2个氢原子,不是手性碳原子。
6.下列有机物分子中带“*”的碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )。
A.与乙酸发生酯化反应
B.与NaOH水溶液反应
C.与银氨溶液作用发生银镜反应
D.催化剂作用下与H2反应
【答案】C
【解析】该物质与乙酸发生酯化反应所生成的物质中*C连有两个CH3COOCH2—,不具有手性,A项不符合;该物质水解或与氢气加成后,*C上有两个—CH2OH,故产物无手性碳原子,B、D两项不符合;通过氧化反应,醛基变成—COONH4,*C上的4个基团仍不相同,故产物中仍含有手性碳原子,C项符合。
2
