第2章 微项目 补铁剂中铁元素的检验——应用配合物进行物质检验 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章 微项目 补铁剂中铁元素的检验——应用配合物进行物质检验 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修2 |
|
|
| 格式 | docx | ||
| 文件大小 | 286.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 15:09:06 | ||
图片预览


文档简介
微项目:补铁剂中铁元素的检验——应用配合物进行物质检验
【学习目标】
1.了解金属离子可以形成丰富多彩的配合物,许多配合物都具有颜色;知道可以利用形成的配合物的特征颜色对金属离子进行定性检验。
2.了解配合物的稳定性各不相同,配合物之间可以发生转化;知道如何在实验过程中根据配合物的稳定性及转化关系选择实验条件。
【自主预习】
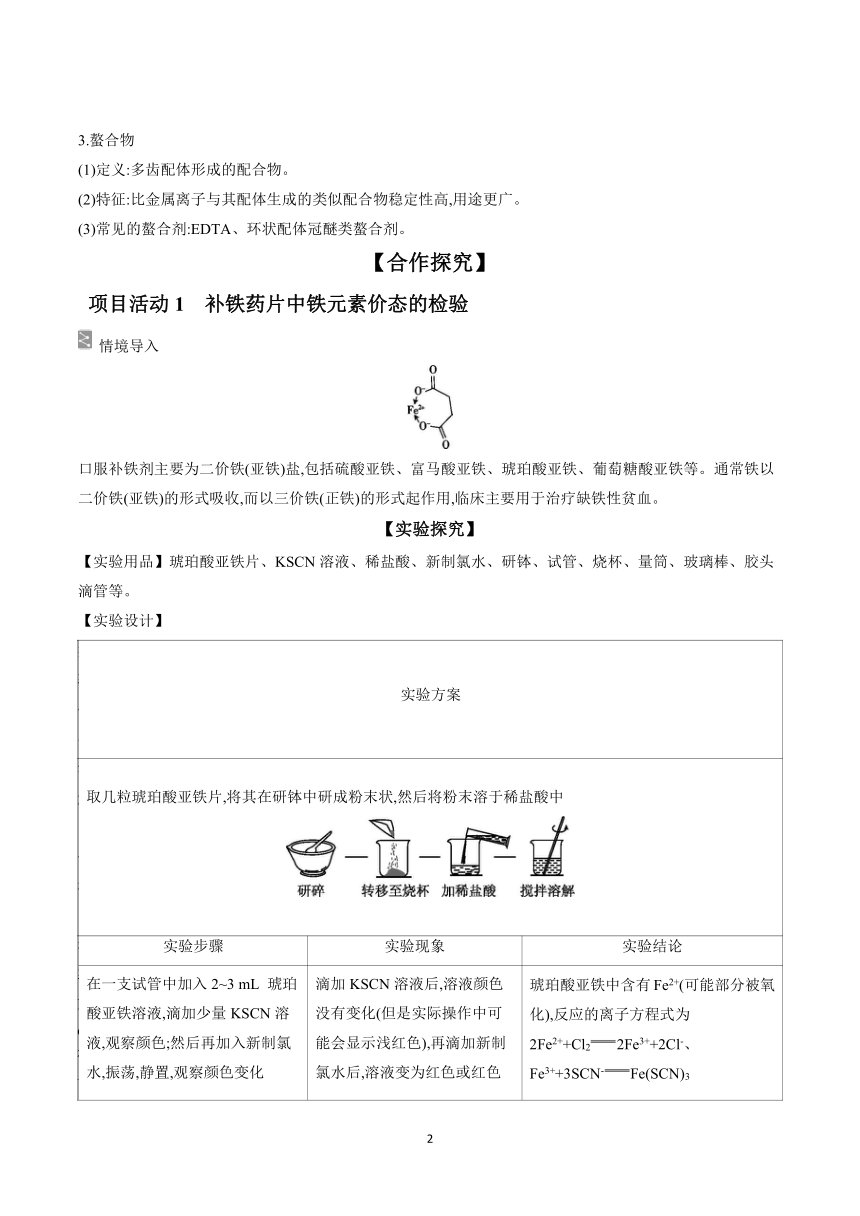
1.常见的Fe2+和Fe3+的检验方法
Fe2+ Fe3+
颜色 浅绿色 黄色
NaOH Fe2++2OH-Fe(OH)2↓,白色沉淀→灰绿色→红褐色 Fe3++3OH-Fe(OH)3↓(红褐色沉淀)
KSCN Fe2+不变色变红 Fe3++3SCN-Fe(SCN)3(血红色溶液)
氧化性 和还原性 主要体现为还原性 氧化性
2Fe2++Cl22Fe3++2Cl- 2Fe3++Cu2Fe2++Cu2+
2Fe2++H2O2+2H+2Fe3++2H2O 2Fe3++Fe3Fe2+
5Fe2++8H++Mn5Fe3++Mn2++4H2O 2Fe3++2I-2Fe2++I2
沉淀法(可用于定量检验) 加入K3[Fe(CN)6],产生蓝色沉淀 加入K4[Fe(CN)6],产生蓝色沉淀
2.Fe2+和Fe3+形成的配合物的颜色
中心原子 配体 形成的配合物 颜色
Fe2+ H2O [Fe(H2O)6]2+ 浅绿色
Fe3+ H2O [Fe(H2O)6]3+ 淡紫色
Fe3+ OH- [Fe(OH)]2+ 黄色
Fe2+ SCN- [Fe(SCN)n]2-n 无色
Fe3+ SCN- [Fe(SCN)n]3-n 红色
Fe2+ phen [Fe(phen)3]2+ 橙红色
Fe2+ EDTA4- [Fe(EDTA)]2- 浅绿色
Fe3+ EDTA4- [Fe(EDTA)]- 黄色
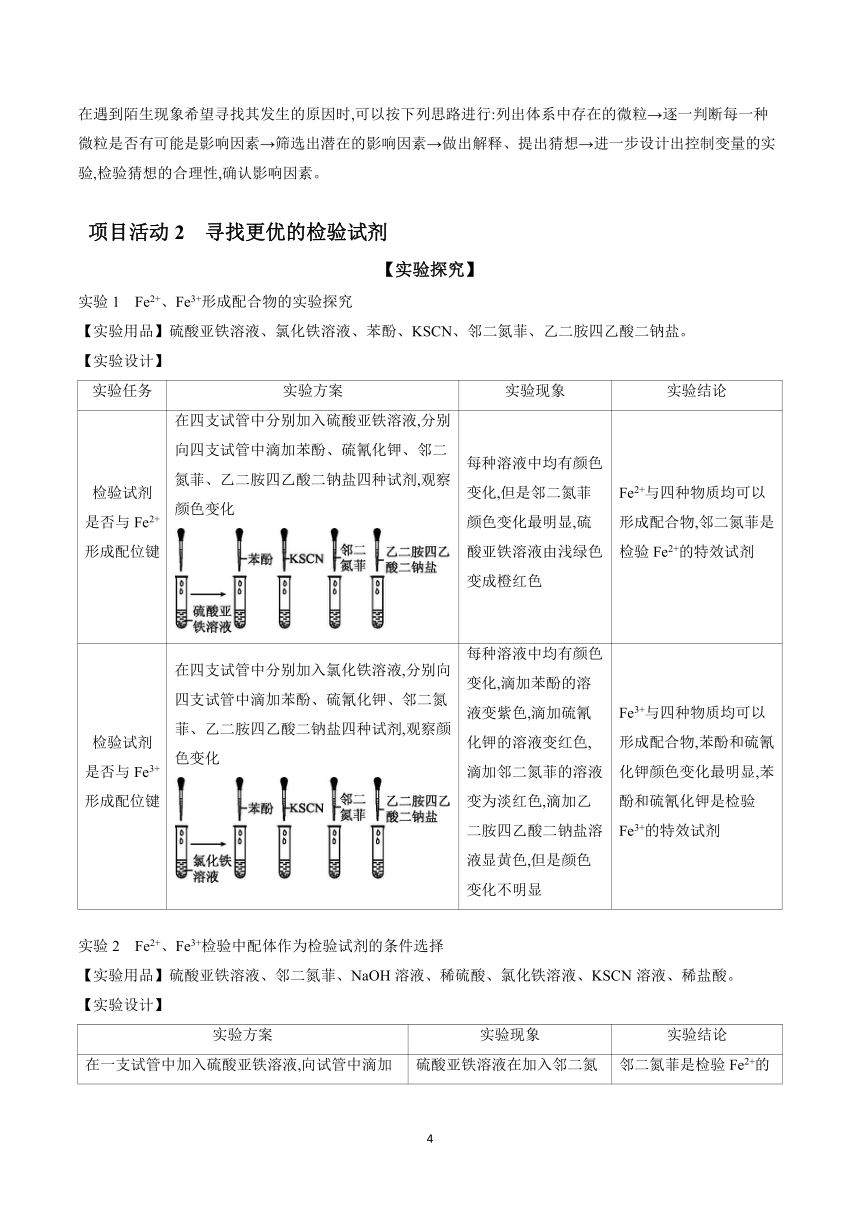
3.螯合物
(1)定义:多齿配体形成的配合物。
(2)特征:比金属离子与其配体生成的类似配合物稳定性高,用途更广。
(3)常见的螯合剂:EDTA、环状配体冠醚类螯合剂。
【合作探究】
项目活动1 补铁药片中铁元素价态的检验
情境导入
口服补铁剂主要为二价铁(亚铁)盐,包括硫酸亚铁、富马酸亚铁、琥珀酸亚铁、葡萄糖酸亚铁等。通常铁以二价铁(亚铁)的形式吸收,而以三价铁(正铁)的形式起作用,临床主要用于治疗缺铁性贫血。
【实验探究】
【实验用品】琥珀酸亚铁片、KSCN溶液、稀盐酸、新制氯水、研钵、试管、烧杯、量筒、玻璃棒、胶头滴管等。
【实验设计】
实验 任务 实验方案
溶解 固体 样品 取几粒琥珀酸亚铁片,将其在研钵中研成粉末状,然后将粉末溶于稀盐酸中
检验 Fe2+、 Fe3+ 实验步骤 实验现象 实验结论
在一支试管中加入2~3 mL 琥珀酸亚铁溶液,滴加少量KSCN溶液,观察颜色;然后再加入新制氯水,振荡,静置,观察颜色变化 滴加KSCN溶液后,溶液颜色没有变化(但是实际操作中可能会显示浅红色),再滴加新制氯水后,溶液变为红色或红色变深 琥珀酸亚铁中含有Fe2+(可能部分被氧化),反应的离子方程式为2Fe2++Cl22Fe3++2Cl-、Fe3++3SCN-Fe(SCN)3
问题讨论
1.在做Fe2+的检验的实验中,加入KSCN溶液后,有些同学在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是什么
【答案】Fe2+可能被空气中的氧气氧化为Fe3+。
2.用同一批药片做Fe3+的检验的实验时,老师将所有同学分成两组,一组用蒸馏水溶解琥珀酸亚铁片形成悬浊液,一组用盐酸溶解琥珀酸亚铁片形成悬浊液,结果用蒸馏水的一组未见红色,而用盐酸的一组看到了红色,这是什么原因
【答案】Fe3+的水合离子[Fe(H2O)6]3+呈淡紫色,但因Fe3+极易水解,故未充分酸化的水溶液会由于有[Fe(OH)]2+存在显黄色,随着pH的升高,Fe3+水解程度增加,可以生成Fe(OH)3胶体或沉淀,用SCN-检验Fe3+时,在pH>3时,SCN-无法竞争到Fe3+,故不会变色;当pH<3时,OH-浓度很小,这时SCN-会与Fe3+结合而变红色。
3.有小组向酸性高锰酸钾溶液中加入补铁剂后发现溶液褪色,能否说明补铁剂中含Fe2+
【答案】不能。因为补铁剂中可能含有其他还原性物质。
【核心归纳】
1.不同价态的铁的检验
(1)Fe2+的检验方法
①方法:加入KSCN溶液无明显现象,再滴入新制氯水变成红色溶液。
②发生的反应:2Fe2++Cl22Fe3++2Cl-,Fe3++3SCN-Fe(SCN)3(红色)。
(2)Fe3+的检验方法
①方法:加入KSCN溶液,溶液变为红色。
②发生的反应:Fe3++3SCN-Fe(SCN)3(红色)。
(3)注意事项
①用SCN-检验时,在pH>3时,SCN-无法竞争到Fe3+,故不会变色;当pH<3时,OH-浓度很小,这时SCN-会与Fe3+结合而变红色,故检验Fe3+须在酸性条件下进行。
②检验Fe2+和Fe3+最好都用形成配合物的方式进行检验,否则很容易产生误差。
2.探究陌生现象产生的原因的基本思路
在遇到陌生现象希望寻找其发生的原因时,可以按下列思路进行:列出体系中存在的微粒→逐一判断每一种微粒是否有可能是影响因素→筛选出潜在的影响因素→做出解释、提出猜想→进一步设计出控制变量的实验,检验猜想的合理性,确认影响因素。
项目活动2 寻找更优的检验试剂
【实验探究】
实验1 Fe2+、Fe3+形成配合物的实验探究
【实验用品】硫酸亚铁溶液、氯化铁溶液、苯酚、KSCN、邻二氮菲、乙二胺四乙酸二钠盐。
【实验设计】
实验任务 实验方案 实验现象 实验结论
检验试剂 是否与Fe2+ 形成配位键 在四支试管中分别加入硫酸亚铁溶液,分别向四支试管中滴加苯酚、硫氰化钾、邻二氮菲、乙二胺四乙酸二钠盐四种试剂,观察颜色变化 每种溶液中均有颜色变化,但是邻二氮菲颜色变化最明显,硫酸亚铁溶液由浅绿色变成橙红色 Fe2+与四种物质均可以形成配合物,邻二氮菲是检验Fe2+的特效试剂
检验试剂 是否与Fe3+ 形成配位键 在四支试管中分别加入氯化铁溶液,分别向四支试管中滴加苯酚、硫氰化钾、邻二氮菲、乙二胺四乙酸二钠盐四种试剂,观察颜色变化 每种溶液中均有颜色变化,滴加苯酚的溶液变紫色,滴加硫氰化钾的溶液变红色,滴加邻二氮菲的溶液变为淡红色,滴加乙二胺四乙酸二钠盐溶液显黄色,但是颜色变化不明显 Fe3+与四种物质均可以形成配合物,苯酚和硫氰化钾颜色变化最明显,苯酚和硫氰化钾是检验Fe3+的特效试剂
实验2 Fe2+、Fe3+检验中配体作为检验试剂的条件选择
【实验用品】硫酸亚铁溶液、邻二氮菲、NaOH溶液、稀硫酸、氯化铁溶液、KSCN溶液、稀盐酸。
【实验设计】
实验方案 实验现象 实验结论
在一支试管中加入硫酸亚铁溶液,向试管中滴加邻二氮菲,观察颜色变化;然后将溶液分成两份,一份滴加NaOH溶液,观察现象,另一份滴加稀硫酸,观察颜色变化 硫酸亚铁溶液在加入邻二氮菲后由浅绿色变成橙红色,加入NaOH溶液后,溶液颜色变浅直至产生白色沉淀;加入稀硫酸后溶液颜色变浅,直至消失 邻二氮菲是检验Fe2+的特效试剂,其显色与溶液的pH有关,适宜pH范围为2~9
在一支试管中加入氯化铁溶液,向试管中滴加硫氰化钾,观察颜色变化;将溶液分成两份,一份中加入NaOH溶液,另一份中加入盐酸,观察溶液颜色的变化 开始滴加硫氰化钾后溶液变红色,一份滴加NaOH后溶液颜色变浅,最终生成红褐色沉淀;一份加入盐酸后溶液颜色没有明显变化 硫氰化钾检验Fe3+时受溶液pH的影响,检验时溶液的pH<3
问题讨论
1.根据EDTA的结构式:
分析EDTA能否当作配位剂。
【答案】能。因为EDTA中含N、O原子,N、O原子存在孤电子对。EDTA是一种常用的螯合剂。
2.根据以上实验说出什么试剂在什么条件下适用于检验Fe2+、Fe3+
【答案】邻二氮菲是检验Fe2+的特效试剂,其显色与溶液的pH有关,适宜pH范围在2~9之间;硫氰化钾检验Fe3+时受溶液pH的影响,检验时溶液的pH<3。
3.试分析用邻二氮菲检验Fe2+时,溶液的pH需控制在2~9 的理由。
【答案】邻二氮菲()在H+浓度较高时,N原子易与H+形成类似于N的配位键;若OH-浓度较高,OH-又会与Fe2+作用。故需控制溶液的pH在2~9。
【核心归纳】
1.检验Fe2+、Fe3+的特效试剂与使用条件
Fe2+的检验:邻二氮菲是检验Fe2+的特效试剂,其显色与溶液的pH有关,适宜范围为2~9。
2.利用配合物检验金属离子的流程
【迁移应用】
1.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是( )。
试剂 选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
【答案】B
【解析】甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。溴水符合条件,实验现象是溴水颜色变浅,酸性KMnO4溶液也符合条件,实验现象是溶液紫色变浅。乙组,在Fe2+存在的条件下检验Fe3+,用KSCN溶液即可,Fe2+不会造成干扰。
2.已知某紫色配合物的组成为CoCl3·5NH3·H2O,其水溶液显弱酸性,加入强碱加热至沸腾有NH3放出,同时产生Co2O3沉淀;向一定量该配合物溶液中加过量AgNO3溶液,有AgCl沉淀生成,待沉淀完全后过滤,再加过量AgNO3溶液于滤液中,无明显变化,但加热至沸腾又有AgCl沉淀生成,且第二次沉淀量为第一次沉淀量的二分之一。该配合物的化学式最可能为( )。
A.[CoCl2(NH3)4]Cl·NH3·H2O
B.[Co(NH3)5(H2O)]Cl3
C.[CoCl(NH3)3(H2O)]Cl2·2NH3
D.[CoCl(NH3)5]Cl2·H2O
【答案】D
【解析】CoCl3·5NH3·H2O的水溶液显弱酸性,加入强碱加热至沸腾有NH3放出,说明NH3均在内界;向该配合物溶液中加过量AgNO3溶液,有AgCl沉淀生成,说明该配合物外界有Cl-;过滤后再加过量AgNO3溶液于滤液中无明显变化,但加热至沸腾又有AgCl沉淀生成,且第二次沉淀量为第一次沉淀量的二分之一,说明该配合物内界也含有Cl-,且外界的Cl-与内界的Cl-个数之比为2∶1。综上分析,D项最有可能。
3.测定水的总硬度一般采用配位滴定法,即在pH=10的碱性溶液中,以铬黑T作为指示剂,用EDTA(乙二胺四乙酸)标准溶液直接滴定水中的Ca2+、Mg2+,测定中涉及的反应有:
①M2+(金属离子)+Y4-(EDTA)MY2-;
②M2++EBT(铬黑T,蓝色)MEBT(酒红色);
③MEBT+Y4-(EDTA)MY2-+EBT。
下列说法正确的是( )。
A.配合物MEBT的稳定性大于MY2-
B.在滴定过程中眼睛要随时观察滴定管中液面的变化
C.达到滴定终点的现象是溶液恰好由酒红色变为蓝色,且半分钟内不恢复原色
D.实验时装有EDTA标准液的滴定管只用蒸馏水洗涤而未用标准液润洗,测定结果将偏小
【答案】C
【解析】根据题目所给信息可知,MEBT溶液滴加Y4-时会转化为MY2-,说明金属离子更容易与Y4-配位,则MY2-更稳定,A项错误;在滴定过程中眼睛要随时观察锥形瓶中溶液的颜色变化,确定滴定终点,B项错误;滴入标准液前,金属离子与EBT结合生成MEBT,此时溶液呈酒红色,当达到滴定终点时,MEBT全部转化为蓝色的EBT,所以滴定终点的现象为溶液恰好由酒红色变为蓝色,且半分钟内不恢复原色,C项正确;只用蒸馏水洗涤而未用标准液润洗会使标准液被稀释,导致标准液的用量偏大,测定结果偏高,D项错误。
4.下列关于化合物[Cu(EDTA)]SO4(EDTA的结构简式如图)的说法正确的是( )。
A.[Cu(EDTA)]SO4中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为sp2、sp3
C.[Cu(EDTA)]SO4中部分组成元素的第一电离能顺序为O>N>C
D.S与P互为等电子体,但空间结构不同
【答案】B
【解析】[Cu(EDTA)]SO4中所含的化学键有硫酸根离子与配离子之间的离子键,硫酸根离子、EDTA内部的共价键,EDTA与铜离子之间的配位键,氢键不属于化学键,A项错误;EDTA中有“—COOH”和“—CH2—”,故EDTA中碳原子的杂化轨道类型为sp2、sp3,B项正确;同一主族中,从上到下,元素第一电离能逐渐减小,同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但N原子最外层的2p能级处于半充满状态,是一种较稳定结构,所以它的第一电离能高于同周期相邻的元素,第一电离能顺序为N>O>C,C项错误;S中S原子价电子对数为4+=4,没有孤电子对,故S为正四面体结构,S与P互为等电子体,P也为正四面体结构,D项错误。
5.碳元素在自然界中分布很广,在地壳中其丰富程度远低于氧、硅、铝、铁等元素。但是,碳却是存在形式最复杂的元素。请回答下列问题:
(1)基态碳原子的电子排布式为 。
(2)在CO2分子中,碳原子采用 杂化轨道与氧原子成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,应用价层电子对互斥理论,预测COCl2分子的空间结构为 。
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲(),它能与Fe2+形成橙红色配合物(如图)。该配离子中Fe2+与氮原子形成的配位键共有 个。
【答案】(1)1s22s22p2 (2)sp (3)平面三角形 (4)6
【解析】(2)二氧化碳分子中碳原子价层电子对数是2且不含孤电子对,所以碳原子采用sp杂化。(3)碳原子价电子对数是3且不含孤电子对,所以其空间结构为平面三角形。(4)铁与氮原子之间形成配位键,由图可知,该配离子中亚铁离子与氮原子形成的配位键共有6个。
2
【学习目标】
1.了解金属离子可以形成丰富多彩的配合物,许多配合物都具有颜色;知道可以利用形成的配合物的特征颜色对金属离子进行定性检验。
2.了解配合物的稳定性各不相同,配合物之间可以发生转化;知道如何在实验过程中根据配合物的稳定性及转化关系选择实验条件。
【自主预习】
1.常见的Fe2+和Fe3+的检验方法
Fe2+ Fe3+
颜色 浅绿色 黄色
NaOH Fe2++2OH-Fe(OH)2↓,白色沉淀→灰绿色→红褐色 Fe3++3OH-Fe(OH)3↓(红褐色沉淀)
KSCN Fe2+不变色变红 Fe3++3SCN-Fe(SCN)3(血红色溶液)
氧化性 和还原性 主要体现为还原性 氧化性
2Fe2++Cl22Fe3++2Cl- 2Fe3++Cu2Fe2++Cu2+
2Fe2++H2O2+2H+2Fe3++2H2O 2Fe3++Fe3Fe2+
5Fe2++8H++Mn5Fe3++Mn2++4H2O 2Fe3++2I-2Fe2++I2
沉淀法(可用于定量检验) 加入K3[Fe(CN)6],产生蓝色沉淀 加入K4[Fe(CN)6],产生蓝色沉淀
2.Fe2+和Fe3+形成的配合物的颜色
中心原子 配体 形成的配合物 颜色
Fe2+ H2O [Fe(H2O)6]2+ 浅绿色
Fe3+ H2O [Fe(H2O)6]3+ 淡紫色
Fe3+ OH- [Fe(OH)]2+ 黄色
Fe2+ SCN- [Fe(SCN)n]2-n 无色
Fe3+ SCN- [Fe(SCN)n]3-n 红色
Fe2+ phen [Fe(phen)3]2+ 橙红色
Fe2+ EDTA4- [Fe(EDTA)]2- 浅绿色
Fe3+ EDTA4- [Fe(EDTA)]- 黄色
3.螯合物
(1)定义:多齿配体形成的配合物。
(2)特征:比金属离子与其配体生成的类似配合物稳定性高,用途更广。
(3)常见的螯合剂:EDTA、环状配体冠醚类螯合剂。
【合作探究】
项目活动1 补铁药片中铁元素价态的检验
情境导入
口服补铁剂主要为二价铁(亚铁)盐,包括硫酸亚铁、富马酸亚铁、琥珀酸亚铁、葡萄糖酸亚铁等。通常铁以二价铁(亚铁)的形式吸收,而以三价铁(正铁)的形式起作用,临床主要用于治疗缺铁性贫血。
【实验探究】
【实验用品】琥珀酸亚铁片、KSCN溶液、稀盐酸、新制氯水、研钵、试管、烧杯、量筒、玻璃棒、胶头滴管等。
【实验设计】
实验 任务 实验方案
溶解 固体 样品 取几粒琥珀酸亚铁片,将其在研钵中研成粉末状,然后将粉末溶于稀盐酸中
检验 Fe2+、 Fe3+ 实验步骤 实验现象 实验结论
在一支试管中加入2~3 mL 琥珀酸亚铁溶液,滴加少量KSCN溶液,观察颜色;然后再加入新制氯水,振荡,静置,观察颜色变化 滴加KSCN溶液后,溶液颜色没有变化(但是实际操作中可能会显示浅红色),再滴加新制氯水后,溶液变为红色或红色变深 琥珀酸亚铁中含有Fe2+(可能部分被氧化),反应的离子方程式为2Fe2++Cl22Fe3++2Cl-、Fe3++3SCN-Fe(SCN)3
问题讨论
1.在做Fe2+的检验的实验中,加入KSCN溶液后,有些同学在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是什么
【答案】Fe2+可能被空气中的氧气氧化为Fe3+。
2.用同一批药片做Fe3+的检验的实验时,老师将所有同学分成两组,一组用蒸馏水溶解琥珀酸亚铁片形成悬浊液,一组用盐酸溶解琥珀酸亚铁片形成悬浊液,结果用蒸馏水的一组未见红色,而用盐酸的一组看到了红色,这是什么原因
【答案】Fe3+的水合离子[Fe(H2O)6]3+呈淡紫色,但因Fe3+极易水解,故未充分酸化的水溶液会由于有[Fe(OH)]2+存在显黄色,随着pH的升高,Fe3+水解程度增加,可以生成Fe(OH)3胶体或沉淀,用SCN-检验Fe3+时,在pH>3时,SCN-无法竞争到Fe3+,故不会变色;当pH<3时,OH-浓度很小,这时SCN-会与Fe3+结合而变红色。
3.有小组向酸性高锰酸钾溶液中加入补铁剂后发现溶液褪色,能否说明补铁剂中含Fe2+
【答案】不能。因为补铁剂中可能含有其他还原性物质。
【核心归纳】
1.不同价态的铁的检验
(1)Fe2+的检验方法
①方法:加入KSCN溶液无明显现象,再滴入新制氯水变成红色溶液。
②发生的反应:2Fe2++Cl22Fe3++2Cl-,Fe3++3SCN-Fe(SCN)3(红色)。
(2)Fe3+的检验方法
①方法:加入KSCN溶液,溶液变为红色。
②发生的反应:Fe3++3SCN-Fe(SCN)3(红色)。
(3)注意事项
①用SCN-检验时,在pH>3时,SCN-无法竞争到Fe3+,故不会变色;当pH<3时,OH-浓度很小,这时SCN-会与Fe3+结合而变红色,故检验Fe3+须在酸性条件下进行。
②检验Fe2+和Fe3+最好都用形成配合物的方式进行检验,否则很容易产生误差。
2.探究陌生现象产生的原因的基本思路
在遇到陌生现象希望寻找其发生的原因时,可以按下列思路进行:列出体系中存在的微粒→逐一判断每一种微粒是否有可能是影响因素→筛选出潜在的影响因素→做出解释、提出猜想→进一步设计出控制变量的实验,检验猜想的合理性,确认影响因素。
项目活动2 寻找更优的检验试剂
【实验探究】
实验1 Fe2+、Fe3+形成配合物的实验探究
【实验用品】硫酸亚铁溶液、氯化铁溶液、苯酚、KSCN、邻二氮菲、乙二胺四乙酸二钠盐。
【实验设计】
实验任务 实验方案 实验现象 实验结论
检验试剂 是否与Fe2+ 形成配位键 在四支试管中分别加入硫酸亚铁溶液,分别向四支试管中滴加苯酚、硫氰化钾、邻二氮菲、乙二胺四乙酸二钠盐四种试剂,观察颜色变化 每种溶液中均有颜色变化,但是邻二氮菲颜色变化最明显,硫酸亚铁溶液由浅绿色变成橙红色 Fe2+与四种物质均可以形成配合物,邻二氮菲是检验Fe2+的特效试剂
检验试剂 是否与Fe3+ 形成配位键 在四支试管中分别加入氯化铁溶液,分别向四支试管中滴加苯酚、硫氰化钾、邻二氮菲、乙二胺四乙酸二钠盐四种试剂,观察颜色变化 每种溶液中均有颜色变化,滴加苯酚的溶液变紫色,滴加硫氰化钾的溶液变红色,滴加邻二氮菲的溶液变为淡红色,滴加乙二胺四乙酸二钠盐溶液显黄色,但是颜色变化不明显 Fe3+与四种物质均可以形成配合物,苯酚和硫氰化钾颜色变化最明显,苯酚和硫氰化钾是检验Fe3+的特效试剂
实验2 Fe2+、Fe3+检验中配体作为检验试剂的条件选择
【实验用品】硫酸亚铁溶液、邻二氮菲、NaOH溶液、稀硫酸、氯化铁溶液、KSCN溶液、稀盐酸。
【实验设计】
实验方案 实验现象 实验结论
在一支试管中加入硫酸亚铁溶液,向试管中滴加邻二氮菲,观察颜色变化;然后将溶液分成两份,一份滴加NaOH溶液,观察现象,另一份滴加稀硫酸,观察颜色变化 硫酸亚铁溶液在加入邻二氮菲后由浅绿色变成橙红色,加入NaOH溶液后,溶液颜色变浅直至产生白色沉淀;加入稀硫酸后溶液颜色变浅,直至消失 邻二氮菲是检验Fe2+的特效试剂,其显色与溶液的pH有关,适宜pH范围为2~9
在一支试管中加入氯化铁溶液,向试管中滴加硫氰化钾,观察颜色变化;将溶液分成两份,一份中加入NaOH溶液,另一份中加入盐酸,观察溶液颜色的变化 开始滴加硫氰化钾后溶液变红色,一份滴加NaOH后溶液颜色变浅,最终生成红褐色沉淀;一份加入盐酸后溶液颜色没有明显变化 硫氰化钾检验Fe3+时受溶液pH的影响,检验时溶液的pH<3
问题讨论
1.根据EDTA的结构式:
分析EDTA能否当作配位剂。
【答案】能。因为EDTA中含N、O原子,N、O原子存在孤电子对。EDTA是一种常用的螯合剂。
2.根据以上实验说出什么试剂在什么条件下适用于检验Fe2+、Fe3+
【答案】邻二氮菲是检验Fe2+的特效试剂,其显色与溶液的pH有关,适宜pH范围在2~9之间;硫氰化钾检验Fe3+时受溶液pH的影响,检验时溶液的pH<3。
3.试分析用邻二氮菲检验Fe2+时,溶液的pH需控制在2~9 的理由。
【答案】邻二氮菲()在H+浓度较高时,N原子易与H+形成类似于N的配位键;若OH-浓度较高,OH-又会与Fe2+作用。故需控制溶液的pH在2~9。
【核心归纳】
1.检验Fe2+、Fe3+的特效试剂与使用条件
Fe2+的检验:邻二氮菲是检验Fe2+的特效试剂,其显色与溶液的pH有关,适宜范围为2~9。
2.利用配合物检验金属离子的流程
【迁移应用】
1.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是( )。
试剂 选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
【答案】B
【解析】甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。溴水符合条件,实验现象是溴水颜色变浅,酸性KMnO4溶液也符合条件,实验现象是溶液紫色变浅。乙组,在Fe2+存在的条件下检验Fe3+,用KSCN溶液即可,Fe2+不会造成干扰。
2.已知某紫色配合物的组成为CoCl3·5NH3·H2O,其水溶液显弱酸性,加入强碱加热至沸腾有NH3放出,同时产生Co2O3沉淀;向一定量该配合物溶液中加过量AgNO3溶液,有AgCl沉淀生成,待沉淀完全后过滤,再加过量AgNO3溶液于滤液中,无明显变化,但加热至沸腾又有AgCl沉淀生成,且第二次沉淀量为第一次沉淀量的二分之一。该配合物的化学式最可能为( )。
A.[CoCl2(NH3)4]Cl·NH3·H2O
B.[Co(NH3)5(H2O)]Cl3
C.[CoCl(NH3)3(H2O)]Cl2·2NH3
D.[CoCl(NH3)5]Cl2·H2O
【答案】D
【解析】CoCl3·5NH3·H2O的水溶液显弱酸性,加入强碱加热至沸腾有NH3放出,说明NH3均在内界;向该配合物溶液中加过量AgNO3溶液,有AgCl沉淀生成,说明该配合物外界有Cl-;过滤后再加过量AgNO3溶液于滤液中无明显变化,但加热至沸腾又有AgCl沉淀生成,且第二次沉淀量为第一次沉淀量的二分之一,说明该配合物内界也含有Cl-,且外界的Cl-与内界的Cl-个数之比为2∶1。综上分析,D项最有可能。
3.测定水的总硬度一般采用配位滴定法,即在pH=10的碱性溶液中,以铬黑T作为指示剂,用EDTA(乙二胺四乙酸)标准溶液直接滴定水中的Ca2+、Mg2+,测定中涉及的反应有:
①M2+(金属离子)+Y4-(EDTA)MY2-;
②M2++EBT(铬黑T,蓝色)MEBT(酒红色);
③MEBT+Y4-(EDTA)MY2-+EBT。
下列说法正确的是( )。
A.配合物MEBT的稳定性大于MY2-
B.在滴定过程中眼睛要随时观察滴定管中液面的变化
C.达到滴定终点的现象是溶液恰好由酒红色变为蓝色,且半分钟内不恢复原色
D.实验时装有EDTA标准液的滴定管只用蒸馏水洗涤而未用标准液润洗,测定结果将偏小
【答案】C
【解析】根据题目所给信息可知,MEBT溶液滴加Y4-时会转化为MY2-,说明金属离子更容易与Y4-配位,则MY2-更稳定,A项错误;在滴定过程中眼睛要随时观察锥形瓶中溶液的颜色变化,确定滴定终点,B项错误;滴入标准液前,金属离子与EBT结合生成MEBT,此时溶液呈酒红色,当达到滴定终点时,MEBT全部转化为蓝色的EBT,所以滴定终点的现象为溶液恰好由酒红色变为蓝色,且半分钟内不恢复原色,C项正确;只用蒸馏水洗涤而未用标准液润洗会使标准液被稀释,导致标准液的用量偏大,测定结果偏高,D项错误。
4.下列关于化合物[Cu(EDTA)]SO4(EDTA的结构简式如图)的说法正确的是( )。
A.[Cu(EDTA)]SO4中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为sp2、sp3
C.[Cu(EDTA)]SO4中部分组成元素的第一电离能顺序为O>N>C
D.S与P互为等电子体,但空间结构不同
【答案】B
【解析】[Cu(EDTA)]SO4中所含的化学键有硫酸根离子与配离子之间的离子键,硫酸根离子、EDTA内部的共价键,EDTA与铜离子之间的配位键,氢键不属于化学键,A项错误;EDTA中有“—COOH”和“—CH2—”,故EDTA中碳原子的杂化轨道类型为sp2、sp3,B项正确;同一主族中,从上到下,元素第一电离能逐渐减小,同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但N原子最外层的2p能级处于半充满状态,是一种较稳定结构,所以它的第一电离能高于同周期相邻的元素,第一电离能顺序为N>O>C,C项错误;S中S原子价电子对数为4+=4,没有孤电子对,故S为正四面体结构,S与P互为等电子体,P也为正四面体结构,D项错误。
5.碳元素在自然界中分布很广,在地壳中其丰富程度远低于氧、硅、铝、铁等元素。但是,碳却是存在形式最复杂的元素。请回答下列问题:
(1)基态碳原子的电子排布式为 。
(2)在CO2分子中,碳原子采用 杂化轨道与氧原子成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,应用价层电子对互斥理论,预测COCl2分子的空间结构为 。
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲(),它能与Fe2+形成橙红色配合物(如图)。该配离子中Fe2+与氮原子形成的配位键共有 个。
【答案】(1)1s22s22p2 (2)sp (3)平面三角形 (4)6
【解析】(2)二氧化碳分子中碳原子价层电子对数是2且不含孤电子对,所以碳原子采用sp杂化。(3)碳原子价电子对数是3且不含孤电子对,所以其空间结构为平面三角形。(4)铁与氮原子之间形成配位键,由图可知,该配离子中亚铁离子与氮原子形成的配位键共有6个。
2
