第3章 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第3章 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用 学案(含答案) 2023-2024学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 386.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览


文档简介
微项目:揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
(见学生用书P150)
1.通过认识制碱工业中更复杂平衡体系,学会分析溶液中的微粒和平衡,理解平衡之间的相互影响,能根据实际需求选择调控平衡移动的方法。
2.通过了解工业制碱的原理,体会化学原理的巧妙应用,了解我国科学家对制碱工业做出的巨大贡献。
1.碳酸钠与碳酸氢钠
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
热稳定性 稳定,受热不分解 不稳定,受热易分解:2NaHCO3Na2CO3+CO2↑+H2O
与H+反应 2H++CH2O+CO2↑(H+过量)或H++CHC(H+不足) H++HCH2O+CO2↑(在水溶液中,同浓度的NaHCO3产生CO2的速率比Na2CO3快)
与NaOH溶液 反应 不反应 NaOH+NaHCO3Na2CO3+H2O
与Ca(OH)2 溶液反应 Ca2++CCaCO3↓ 碱过量,离子方程式为Ca2++OH-+HCCaCO3↓+H2O;碱不足,离子方程式为Ca2++2OH-+2HCCaCO3↓+C+2H2O
与BaCl2 溶液反应 离子方程式为Ba2++CBaCO3↓ 不反应
主要用途 制玻璃、造纸、制皂、洗涤 制发酵粉、医药、灭火器
相互转化 Na2CO3NaHCO3
2.影响化学平衡的因素
改变的条件(其他条件不变) 化学平衡移动的方向
浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动
减小反应物浓度或增大生成物浓度 向逆反应方向移动
压强(对有气体 参加的反应) 反应前后气体体积改变 增大压强 向气体分子总数减小的方向移动
减小压强 向气体分子总数增大的方向移动
反应前后气体体积不变 改变压强 平衡不移动
温度 升高温度 向吸热反应方向移动
降低温度 向放热反应方向移动
催化剂 同等程度改变v正、v逆,平衡不移动
3.侯氏制碱法
生产流程可简要表示如下:
注意事项:
(1)先在冷却的条件下将氨气通入饱和食盐水中,再通入CO2。
(2)主要反应原理:NH3+H2O+CO2+NaClNaHCO3↓+NH4Cl、2NaHCO3Na2CO3+CO2↑+H2O。
(3)循环Ⅰ的设计使原料氯化钠的利用率从70%提高到90%以上。
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用:增大N的浓度,使NH4Cl更多地析出;使NaHCO3转化为Na2CO3;提高析出的NH4Cl的纯度。
项目活动1 解读索尔维制碱法
无水碳酸钠,俗名纯碱、苏打。它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。它的工业制法主要有索尔维制碱法和侯氏制碱法两种。
索尔维法(又称氨碱法),是比利时工程师索尔维于1861年发明的纯碱制法。氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,但最大的优点还在于成本低廉。1867年索尔维设厂制造的产品在巴黎世界博览会上获得铜制奖章,此法被正式命名为索尔维法。
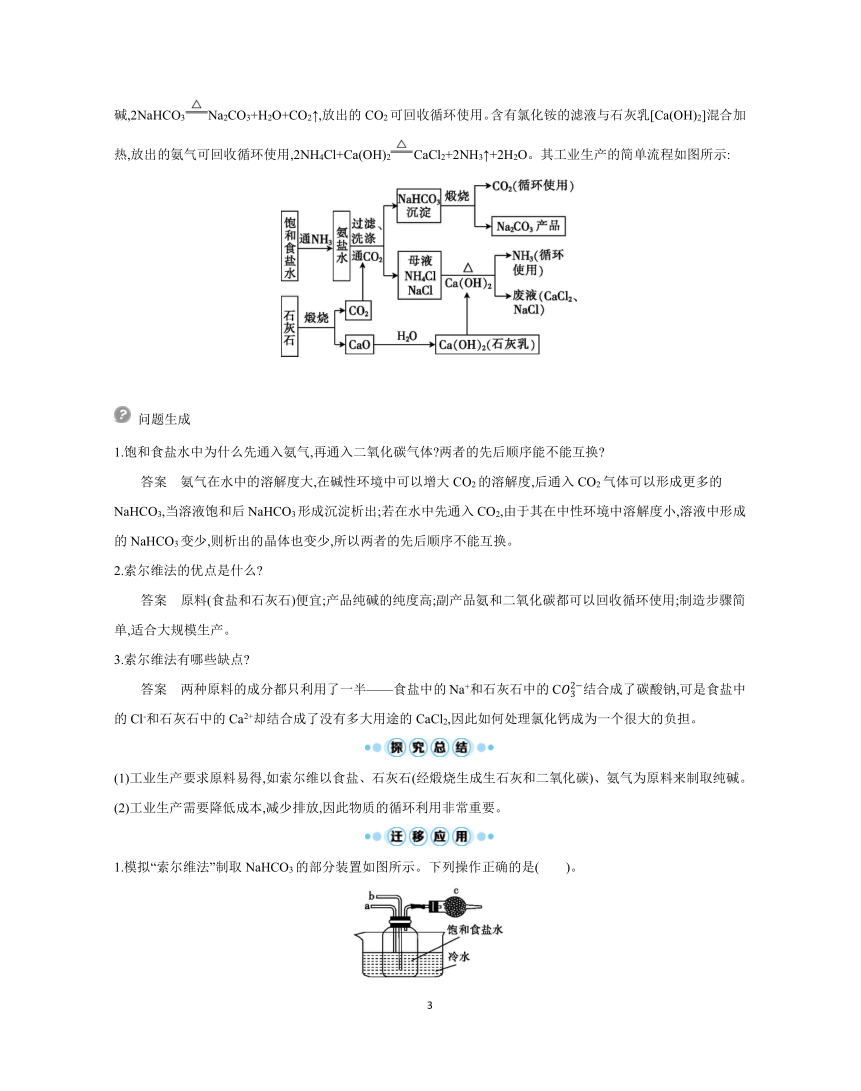
索尔维以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。先使氨气通入饱和食盐水中制成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,其化学反应原理是NaCl+NH3+H2O+CO2NaHCO3↓+NH4Cl。将经过滤、洗涤得到的NaHCO3晶体煅烧制成纯碱,2NaHCO3Na2CO3+H2O+CO2↑,放出的CO2可回收循环使用。含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,放出的氨气可回收循环使用,2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。其工业生产的简单流程如图所示:
问题生成
1.饱和食盐水中为什么先通入氨气,再通入二氧化碳气体 两者的先后顺序能不能互换
答案 氨气在水中的溶解度大,在碱性环境中可以增大CO2的溶解度,后通入CO2气体可以形成更多的NaHCO3,当溶液饱和后NaHCO3形成沉淀析出;若在水中先通入CO2,由于其在中性环境中溶解度小,溶液中形成的NaHCO3变少,则析出的晶体也变少,所以两者的先后顺序不能互换。
2.索尔维法的优点是什么
答案 原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合大规模生产。
3.索尔维法有哪些缺点
答案 两种原料的成分都只利用了一半——食盐中的Na+和石灰石中的C结合成了碳酸钠,可是食盐中的Cl-和石灰石中的Ca2+却结合成了没有多大用途的CaCl2,因此如何处理氯化钙成为一个很大的负担。
(1)工业生产要求原料易得,如索尔维以食盐、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
(2)工业生产需要降低成本,减少排放,因此物质的循环利用非常重要。
1.模拟“索尔维法”制取NaHCO3的部分装置如图所示。下列操作正确的是( )。
A.a口通入CO2,然后b口通入NH3,c中放碱石灰
B.b口通入NH3,然后a口通入CO2,c中放碱石灰
C.a口通入NH3,然后b口通入CO2,c中放蘸稀硫酸的脱脂棉
D.b口通入CO2,然后a口通入NH3,c中放蘸稀硫酸的脱脂棉
答案 C
解析 索尔维法的原理是向饱和的NaCl溶液中先通入NH3,然后通入CO2,生成的碳酸氢钠因溶解度小而析出。所以a口通入NH3,然后b口通入CO2。考虑NH3的尾气处理,所以选择放蘸稀硫酸的脱脂棉,C项正确。
2.工业生产纯碱的工艺流程如图所示:
完成下列填空:
(1)粗盐水加入沉淀剂A、B去除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A ,B 。
(2)工业生产纯碱的工艺流程中,碳酸化时产生的现象是 。碳酸化时没有析出碳酸钠晶体,其原因是
。
(3)碳酸化后过滤,滤液D中最主要的成分是 (填化学式),检验这一成分的阴离子的具体方法是
。
(4)索尔维法流程中氨可循环使用,因此向滤液D中加入石灰水产生氨。加石灰水后发生反应的离子方程式为 ,向滤液D中加石灰水前先要加热,原因是
。
答案 (1)Ca(OH)2(或CaO) Na2CO3
(2)有晶体析出(或出现浑浊) 碳酸钠的溶解度比碳酸氢钠的大
(3)NH4Cl 取样,先加硝酸酸化,后加硝酸银溶液,若有白色沉淀产生,则该阴离子是氯离子
(4)N+OH-NH3↑+H2O 防止加石灰水时产生碳酸钙沉淀
解析 (1)沉淀剂A来源于石灰窑,说明其是生石灰或熟石灰;粗盐中的镁离子和钙离子一般用碳酸钠除去,多余的C可以用盐酸除去。(4)滤液D中主要含有的是氯化铵,氯化铵和石灰水发生反应N+OH-NH3↑+H2O;由于滤液中还含有一定量的碳酸氢钠,因此加石灰水前先加热,是为了防止加石灰水时产生碳酸钙沉淀。
项目活动2 体会侯氏制碱法的创新
索尔维制碱法的缺点主要在于原料中各有一半的成分没有利用上,只用了食盐中的Na+和石灰中的C,二者结合才生成了纯碱。食盐中的Cl-和石灰中的Ca2+结合生成了氯化钙,这个产物没有利用上。侯氏制碱法,又称联合制碱法,是侯德榜先生在索尔维制碱法的基础上,通过不断试验改良,依据离子反应发生的原理制造碳酸钠的技术。因为是侯德榜先生首先发现的,故命名为侯氏制碱法。
侯氏制碱法是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。
侯氏制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水中制成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3晶体,再煅烧NaHCO3制得纯碱,过滤所得滤液中含有氯化铵和氯化钠。第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多。因此在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用。其工业生产的简单流程如图所示:
问题生成
1.侯氏制碱法与索尔维制碱法相比,其最大的优点是什么
答案 食盐的利用率可达98%,应用同量的食盐比索尔维制碱法生产更多的纯碱。
2.侯氏制碱法可获得哪些工业产品
答案 纯碱和氯化铵。将氨厂的废气二氧化碳转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵。
3.侯氏制碱法的优越性体现在何处
答案 不再生成没有多大用处,又难以处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
1.分析真实溶液问题的一般思路
(1)分析溶液的物质组成、微粒和相互作用
真实溶液的复杂问题归根结底是溶液中的物质及其相互作用的问题。例如,要寻找索尔维法食盐利用率低的原因,需要分析制碱母液的组成及微粒,母液处理过程中的反应和平衡移动,以及废液的组成及微粒。
(2)根据目标确定待解决的关键问题
真实问题解决需要明确目标,有目的地调控溶液中的物质组成、微粒和平衡。例如,要提高食盐利用率、避免Na+的浪费,就需要重新利用索尔维法排放的废液。为此,需要设法增大母液中有用微粒Na+和HC的浓度,同时考虑母液中其他微粒是否会影响生产,以及如何处理。
(3)基于信息和数据进行推理
真实溶液中,物质可能发生多次、多种相互作用。基于信息和数据,可以进行合理的推论。例如,基于氯化铵的溶解度数据以及氯化钠的溶解度随温度的变化,可以推测“冷析”过程的产物及目的。
2.侯氏制碱法对制碱工业的巨大贡献
侯氏制碱法的食盐利用率可达98%,并可与合成氨工业联合生产,充分利用合成氨工业提供的氨气、二氧化碳等原料。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献,至今仍是我国纯碱生产的主要方法之一。
1.与索尔维制碱法相比,侯氏制碱法最突出的优点是( )。
A.原料利用率高 B.设备少
C.循环利用的物质多 D.原料易得
答案 A
解析 索尔维法缺点:大量CaCl2用途不大,NaCl利用率只有70%,约有30%的NaCl留在母液中。侯氏制碱法的优点:把合成氨和纯碱两种产品联合生产,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的生产成本,保留了索尔维法的优点,消除了它的缺点,食盐的利用率可达98%。
2.侯氏制碱法的主要生产流程如图所示:
(1)沉淀池中发生反应的化学方程式为 ;煅烧炉中发生反应的化学方程式为
。
(2)常温下,向饱和Na2CO3溶液中通入足量的CO2会有晶体析出,此晶体是NaHCO3。析出该晶体的原因是 ;在饱和食盐水中先通入足量的氨,再通入足量的CO2,会有NaHCO3晶体析出,若在饱和食盐水中先通入足量的CO2,再通入氨气,往往没有晶体析出,原因是
。
(3)检验产品碳酸钠中是否含有氯化钠的操作方法为
。
答案 (1)NH3+H2O+NaCl+CO2NaHCO3↓+NH4Cl 2NaHCO3Na2CO3+H2O+CO2↑
(2)Na2CO3+H2O+CO22NaHCO3↓,碳酸氢钠的溶解度小于碳酸钠,故会有碳酸氢钠晶体析出 CO2在水中的溶解度很小,产生NaHCO3的量太少,不会析出晶体
(3)取少量产品于试管中,加水溶解,先加足量硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,则产品中含有氯化钠,若无白色沉淀生成,则不含氯化钠
2
(见学生用书P150)
1.通过认识制碱工业中更复杂平衡体系,学会分析溶液中的微粒和平衡,理解平衡之间的相互影响,能根据实际需求选择调控平衡移动的方法。
2.通过了解工业制碱的原理,体会化学原理的巧妙应用,了解我国科学家对制碱工业做出的巨大贡献。
1.碳酸钠与碳酸氢钠
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
热稳定性 稳定,受热不分解 不稳定,受热易分解:2NaHCO3Na2CO3+CO2↑+H2O
与H+反应 2H++CH2O+CO2↑(H+过量)或H++CHC(H+不足) H++HCH2O+CO2↑(在水溶液中,同浓度的NaHCO3产生CO2的速率比Na2CO3快)
与NaOH溶液 反应 不反应 NaOH+NaHCO3Na2CO3+H2O
与Ca(OH)2 溶液反应 Ca2++CCaCO3↓ 碱过量,离子方程式为Ca2++OH-+HCCaCO3↓+H2O;碱不足,离子方程式为Ca2++2OH-+2HCCaCO3↓+C+2H2O
与BaCl2 溶液反应 离子方程式为Ba2++CBaCO3↓ 不反应
主要用途 制玻璃、造纸、制皂、洗涤 制发酵粉、医药、灭火器
相互转化 Na2CO3NaHCO3
2.影响化学平衡的因素
改变的条件(其他条件不变) 化学平衡移动的方向
浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动
减小反应物浓度或增大生成物浓度 向逆反应方向移动
压强(对有气体 参加的反应) 反应前后气体体积改变 增大压强 向气体分子总数减小的方向移动
减小压强 向气体分子总数增大的方向移动
反应前后气体体积不变 改变压强 平衡不移动
温度 升高温度 向吸热反应方向移动
降低温度 向放热反应方向移动
催化剂 同等程度改变v正、v逆,平衡不移动
3.侯氏制碱法
生产流程可简要表示如下:
注意事项:
(1)先在冷却的条件下将氨气通入饱和食盐水中,再通入CO2。
(2)主要反应原理:NH3+H2O+CO2+NaClNaHCO3↓+NH4Cl、2NaHCO3Na2CO3+CO2↑+H2O。
(3)循环Ⅰ的设计使原料氯化钠的利用率从70%提高到90%以上。
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用:增大N的浓度,使NH4Cl更多地析出;使NaHCO3转化为Na2CO3;提高析出的NH4Cl的纯度。
项目活动1 解读索尔维制碱法
无水碳酸钠,俗名纯碱、苏打。它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。它的工业制法主要有索尔维制碱法和侯氏制碱法两种。
索尔维法(又称氨碱法),是比利时工程师索尔维于1861年发明的纯碱制法。氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,但最大的优点还在于成本低廉。1867年索尔维设厂制造的产品在巴黎世界博览会上获得铜制奖章,此法被正式命名为索尔维法。
索尔维以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。先使氨气通入饱和食盐水中制成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,其化学反应原理是NaCl+NH3+H2O+CO2NaHCO3↓+NH4Cl。将经过滤、洗涤得到的NaHCO3晶体煅烧制成纯碱,2NaHCO3Na2CO3+H2O+CO2↑,放出的CO2可回收循环使用。含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,放出的氨气可回收循环使用,2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。其工业生产的简单流程如图所示:
问题生成
1.饱和食盐水中为什么先通入氨气,再通入二氧化碳气体 两者的先后顺序能不能互换
答案 氨气在水中的溶解度大,在碱性环境中可以增大CO2的溶解度,后通入CO2气体可以形成更多的NaHCO3,当溶液饱和后NaHCO3形成沉淀析出;若在水中先通入CO2,由于其在中性环境中溶解度小,溶液中形成的NaHCO3变少,则析出的晶体也变少,所以两者的先后顺序不能互换。
2.索尔维法的优点是什么
答案 原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合大规模生产。
3.索尔维法有哪些缺点
答案 两种原料的成分都只利用了一半——食盐中的Na+和石灰石中的C结合成了碳酸钠,可是食盐中的Cl-和石灰石中的Ca2+却结合成了没有多大用途的CaCl2,因此如何处理氯化钙成为一个很大的负担。
(1)工业生产要求原料易得,如索尔维以食盐、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
(2)工业生产需要降低成本,减少排放,因此物质的循环利用非常重要。
1.模拟“索尔维法”制取NaHCO3的部分装置如图所示。下列操作正确的是( )。
A.a口通入CO2,然后b口通入NH3,c中放碱石灰
B.b口通入NH3,然后a口通入CO2,c中放碱石灰
C.a口通入NH3,然后b口通入CO2,c中放蘸稀硫酸的脱脂棉
D.b口通入CO2,然后a口通入NH3,c中放蘸稀硫酸的脱脂棉
答案 C
解析 索尔维法的原理是向饱和的NaCl溶液中先通入NH3,然后通入CO2,生成的碳酸氢钠因溶解度小而析出。所以a口通入NH3,然后b口通入CO2。考虑NH3的尾气处理,所以选择放蘸稀硫酸的脱脂棉,C项正确。
2.工业生产纯碱的工艺流程如图所示:
完成下列填空:
(1)粗盐水加入沉淀剂A、B去除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A ,B 。
(2)工业生产纯碱的工艺流程中,碳酸化时产生的现象是 。碳酸化时没有析出碳酸钠晶体,其原因是
。
(3)碳酸化后过滤,滤液D中最主要的成分是 (填化学式),检验这一成分的阴离子的具体方法是
。
(4)索尔维法流程中氨可循环使用,因此向滤液D中加入石灰水产生氨。加石灰水后发生反应的离子方程式为 ,向滤液D中加石灰水前先要加热,原因是
。
答案 (1)Ca(OH)2(或CaO) Na2CO3
(2)有晶体析出(或出现浑浊) 碳酸钠的溶解度比碳酸氢钠的大
(3)NH4Cl 取样,先加硝酸酸化,后加硝酸银溶液,若有白色沉淀产生,则该阴离子是氯离子
(4)N+OH-NH3↑+H2O 防止加石灰水时产生碳酸钙沉淀
解析 (1)沉淀剂A来源于石灰窑,说明其是生石灰或熟石灰;粗盐中的镁离子和钙离子一般用碳酸钠除去,多余的C可以用盐酸除去。(4)滤液D中主要含有的是氯化铵,氯化铵和石灰水发生反应N+OH-NH3↑+H2O;由于滤液中还含有一定量的碳酸氢钠,因此加石灰水前先加热,是为了防止加石灰水时产生碳酸钙沉淀。
项目活动2 体会侯氏制碱法的创新
索尔维制碱法的缺点主要在于原料中各有一半的成分没有利用上,只用了食盐中的Na+和石灰中的C,二者结合才生成了纯碱。食盐中的Cl-和石灰中的Ca2+结合生成了氯化钙,这个产物没有利用上。侯氏制碱法,又称联合制碱法,是侯德榜先生在索尔维制碱法的基础上,通过不断试验改良,依据离子反应发生的原理制造碳酸钠的技术。因为是侯德榜先生首先发现的,故命名为侯氏制碱法。
侯氏制碱法是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。
侯氏制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水中制成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3晶体,再煅烧NaHCO3制得纯碱,过滤所得滤液中含有氯化铵和氯化钠。第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多。因此在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用。其工业生产的简单流程如图所示:
问题生成
1.侯氏制碱法与索尔维制碱法相比,其最大的优点是什么
答案 食盐的利用率可达98%,应用同量的食盐比索尔维制碱法生产更多的纯碱。
2.侯氏制碱法可获得哪些工业产品
答案 纯碱和氯化铵。将氨厂的废气二氧化碳转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵。
3.侯氏制碱法的优越性体现在何处
答案 不再生成没有多大用处,又难以处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
1.分析真实溶液问题的一般思路
(1)分析溶液的物质组成、微粒和相互作用
真实溶液的复杂问题归根结底是溶液中的物质及其相互作用的问题。例如,要寻找索尔维法食盐利用率低的原因,需要分析制碱母液的组成及微粒,母液处理过程中的反应和平衡移动,以及废液的组成及微粒。
(2)根据目标确定待解决的关键问题
真实问题解决需要明确目标,有目的地调控溶液中的物质组成、微粒和平衡。例如,要提高食盐利用率、避免Na+的浪费,就需要重新利用索尔维法排放的废液。为此,需要设法增大母液中有用微粒Na+和HC的浓度,同时考虑母液中其他微粒是否会影响生产,以及如何处理。
(3)基于信息和数据进行推理
真实溶液中,物质可能发生多次、多种相互作用。基于信息和数据,可以进行合理的推论。例如,基于氯化铵的溶解度数据以及氯化钠的溶解度随温度的变化,可以推测“冷析”过程的产物及目的。
2.侯氏制碱法对制碱工业的巨大贡献
侯氏制碱法的食盐利用率可达98%,并可与合成氨工业联合生产,充分利用合成氨工业提供的氨气、二氧化碳等原料。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献,至今仍是我国纯碱生产的主要方法之一。
1.与索尔维制碱法相比,侯氏制碱法最突出的优点是( )。
A.原料利用率高 B.设备少
C.循环利用的物质多 D.原料易得
答案 A
解析 索尔维法缺点:大量CaCl2用途不大,NaCl利用率只有70%,约有30%的NaCl留在母液中。侯氏制碱法的优点:把合成氨和纯碱两种产品联合生产,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的生产成本,保留了索尔维法的优点,消除了它的缺点,食盐的利用率可达98%。
2.侯氏制碱法的主要生产流程如图所示:
(1)沉淀池中发生反应的化学方程式为 ;煅烧炉中发生反应的化学方程式为
。
(2)常温下,向饱和Na2CO3溶液中通入足量的CO2会有晶体析出,此晶体是NaHCO3。析出该晶体的原因是 ;在饱和食盐水中先通入足量的氨,再通入足量的CO2,会有NaHCO3晶体析出,若在饱和食盐水中先通入足量的CO2,再通入氨气,往往没有晶体析出,原因是
。
(3)检验产品碳酸钠中是否含有氯化钠的操作方法为
。
答案 (1)NH3+H2O+NaCl+CO2NaHCO3↓+NH4Cl 2NaHCO3Na2CO3+H2O+CO2↑
(2)Na2CO3+H2O+CO22NaHCO3↓,碳酸氢钠的溶解度小于碳酸钠,故会有碳酸氢钠晶体析出 CO2在水中的溶解度很小,产生NaHCO3的量太少,不会析出晶体
(3)取少量产品于试管中,加水溶解,先加足量硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,则产品中含有氯化钠,若无白色沉淀生成,则不含氯化钠
2
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
