1.3 课时1 认识同周期元素性质的递变规律 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 1.3 课时1 认识同周期元素性质的递变规律 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第二册 |
|
|
| 格式 | docx | ||
| 文件大小 | 224.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览



文档简介
1.3 课时1 认识同周期元素性质的递变规律
【学习目标】
1.以第3周期元素为例,掌握同周期元素性质的递变规律。
2.能运用原子结构理论初步解释同周期元素性质的递变规律,能根据元素的原子结构、元素周期表中的位置预测元素的性质。
3.通过“第3周期元素原子得失电子能力的比较”的探究,学会判断元素原子得失电子能力强弱的方法,培养设计实验和实验操作的能力。
【自主预习】
一、第3周期元素原子得失电子能力的比较
1.钠、镁、铝三种元素失电子能力的比较
实验方案 实验操作 实验现象 实验结论
钠、镁、铝与水的反应 钠与水剧烈反应;镁与水加热前不反应,加热后反应缓慢,有 ,溶液变为 色;铝放入冷水中 ,将水加热后, 钠与冷水反应,化学方程式:2Na+2H2O2NaOH+H2↑;镁与冷水 ,能与热水反应,反应的化学方程式为Mg+2H2OMg(OH)2+H2↑;铝与水不反应
镁和铝与酸的反应 两支试管内都有无色气泡冒出,但放 的试管中生成气体的速率较大 镁、铝都能置换出酸中的氢,但 更容易,反应的化学方程式分别为Mg+2HClMgCl2+H2↑,2Al+6HCl2AlCl3+3H2↑
比较NaOH、Mg(OH)2的碱性强弱 加入NaOH溶液后产生白色沉淀,把沉淀分成两等份,其中一份加入稀盐酸,沉淀 ,另一份加入NaOH溶液,沉淀 碱性由强到弱的顺序为
比较NaOH、Al(OH)3的碱性强弱 加入NaOH溶液后产生白色沉淀,把沉淀分成两等份,其中一份加入稀盐酸,沉淀 ,另一份加入NaOH溶液,沉淀
结论 钠、镁、铝元素原子失电子能力:
2.硅、磷、硫、氯四种元素原子得电子能力的比较
元素 Si P S Cl
单质与H2 反应的条件 高温,生成少量化合物 磷蒸气与H2能反应 需加热 光照或点 燃,剧烈 反应
单质与H2 化合的难易 由 到
气态氢 化物 化学式 SiH4 PH3 H2S HCl
稳定性 很不稳定 不稳定 较稳定 很稳定
由 到
最高价氧化物 SiO2 P2O5 SO3 Cl2O7
最高价氧 化物对应 的水化物 化学式
酸性 强于硫酸
由 到
结论 硅、磷、硫、氯元素原子得电子能力:
二、同周期元素原子的得失电子能力的变化规律及原因
1.变化规律
同周期的主族元素从左到右,元素原子的得电子能力 ,失电子能力 。
2.同周期主族元素的性质递变的原因
同周期主族元素的原子,核外电子层数 ,随着核电荷数的递增:
【答案】一、1.无色气泡冒出 浅红 无明显现象 无明显现象
不反应 镁条 镁 溶解 不溶解 溶解 溶解 NaOH>Mg(OH)2>Al(OH)3 Na>Mg>Al
2.难 易 弱 强 H2SiO3 H3PO4 H2SO4 HClO4 弱酸 中强酸 强酸
弱 强 Si二、1.逐渐增强 逐渐减弱
2.相同 逐渐增加 逐渐减小 逐渐减弱
逐渐增强
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)
(1)熔点、硬度:Al>Na,故原子失电子能力:Na>Al。 ( )
(2)金属元素原子失电子越多,还原性越强。 ( )
(3)PH3的稳定性比SiH4强。 ( )
(4)同一周期元素的原子,半径越小越容易失去电子。 ( )
(5)第3周期非金属元素含氧酸的酸性从左到右依次增强。 ( )
(6)酸性:HCl>H3PO4,故得电子能力:Cl>P。 ( )
(7)碱性:NaOH>Mg(OH)2,故原子失电子能力:Na>Mg。 ( )
(8)热稳定性:NH3【答案】(1)× (2)× (3)√ (4)× (5)× (6)×
(7)√ (8)√
2.同周期元素的离子半径从左到右依次减小吗 以第3周期元素的离子半径说明。
【答案】不是。如第3周期部分元素的离子半径由大到小的顺序为r(P3-)>r(S2-)>r(Cl-)>r(Na+)>r(Mg2+)>r(Al3+)。
3.第2周期元素从C→F是否也有类似于第3周期从Si→Cl的性质变化规律
【答案】有。C、N、O、F也是随原子序数的递增,得电子能力增强,与氢气化合越来越容易,气态氢化物的稳定性越来越强,但要注意,O、F无最高价氧化物对应的水化物。
4.你能根据元素周期律,比较H3PO4、H2SO4、HClO4的酸性强弱以及P3-、S2-、Cl-的还原性强弱吗
【答案】酸性:H3PO4S2->Cl-。
5.根据周期表中第3周期主族元素相关知识,回答下列问题:
(1)原子半径最小的元素的原子结构示意图为 ,原子失电子能力最强的元素是 (填元素符号),氧化性最弱的简单阳离子是 (填离子符号)。
(2)最不稳定的气态氢化物是 (填化学式)。
(3)最高价氧化物对应水化物中,碱性最强的是 (填化学式,下同),酸性最强的是 ,显两性的是 ,该两性氢氧化物与盐酸、烧碱溶液分别反应的离子方程式为 、 。
【答案】(1) Na Na+
(2)SiH4
(3)NaOH HClO4 Al(OH)3 Al(OH)3+3H+A+3H2O Al(OH)3+OH-[Al(OH)4]-
【合作探究】
任务1 第3周期元素原子得失电子能力的比较
情境导入 美丽的螺壳,是大自然的鬼斧神工造就的。一圈圈的螺纹不仅是自身漂亮的外衣,还揭示了大自然中万事万物的发展规律。这种图案引领着人们去思考,去发现。元素周期表是螺纹模式的直接体现者,让我们来探寻元素周期表中蕴含的奥秘吧!
问题生成
1.实验探究第3周期元素Na、Mg、Al原子失电子能力的强弱。
(1)科学猜想:从Na到Al,随着核电荷数的增大,原子半径逐渐 ,原子核对电子的引力逐渐 ,失电子能力逐渐 。原子失电子能力的强弱可以从金属与 或 反应产生H2的剧烈程度来判断,也可从最高价氧化物对应水化物的 来判断。
(2)实验探究
元素 钠 镁 铝
单质与水反应 实验 操作 向如图所示装置的三格中加入等量蒸馏水,再分别滴入2~3滴酚酞溶液,分别将吸去表面煤油的钠,除去氧化膜的镁和铝三种金属放入相应的三格中。将三格中的水换成等体积等浓度的盐酸,再做相应实验
实验 现象 与冷水反应 ,迅速产生气泡,与酸反应更剧烈 与冷水反应较 ,与稀盐酸反应比较迅速,产生气泡 与冷水反应 ,与稀盐酸反应,产生气泡
反应 方程 式 2Na+2H2O2NaOH+H2↑; 2Na+2H+2Na++H2↑ Mg+2H2OMg(OH)2+H2↑; Mg+2H+Mg2++H2↑ 2Al+6H+2Al3++3H2↑
结论 原子失电子能力:Na Mg Al
氢氧化物的碱性 实验 操作 向试管中加入2 mL 1 mol·L-1AlCl3溶液(或MgCl2溶液),然后滴加氨水,直到不再产生白色沉淀为止。将沉淀分装在两支试管中,向一支试管中滴加2 mol·L-1盐酸,边滴加边振荡,向另一支试管中滴加2 mol·L-1氢氧化钠溶液,边滴加边振荡
实验 现象 — 最初产生的沉淀在盐酸中 ,在NaOH溶液中 最初产生的沉淀在盐酸和NaOH溶液中均
反应 方程 式 — Mg(OH)2+2H+Mg2++2H2O Al(OH)3+3H+Al3++3H2O; Al(OH)3+OH-[Al(OH)4]-
结论 NaOH是强碱 Mg(OH)2是中强碱 Al(OH)3是两性氢氧化物
原子失电子能力:Na Mg Al
【答案】(1)减小 增强 减弱 水 酸 碱性
(2)剧烈 缓慢 很微弱 > > 溶解 不溶解 溶解 > >
2.探究第3周期元素Si、P、S、Cl原子得电子能力的强弱。
(1)科学猜想:从Si到Cl,随着核电荷数的增大,原子半径逐渐 ,原子核对电子的吸引力逐渐 ,得电子能力逐渐 。原子得电子能力的强弱可以从非金属单质与 化合的难易程度来判断,也可从最高价氧化物对应水化物的 来判断。
(2)信息获取与结论分析
元素 Si P S Cl
判断依据 对应单 质与氢 气化合 高温 磷蒸气与 氢气反应 加热 光照或点燃
由易到难的顺序是
稳定性:SiH4 PH3 H2S HCl
最高价氧 化物对应 水化物及 其酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4 强酸
酸性:HClO4 H2SO4 H3PO4 H2SiO3
结论 硅、磷、硫、氯的原子得电子能力逐渐
【答案】(1)减小 增强 增强 氢气 酸性
(2)Cl2、S、P、Si < < < > > > 增强
【核心归纳】
1.判断金属元素原子失电子能力强弱的依据
判断依据 判断方法
原子半径 同周期或同主族元素,原子半径越大,原子失电子能力越强
与水(或酸)反应 越易置换出H2,原子失电子能力越强
最高价氧化物对应水化物的碱性 碱性越强,原子失电子能力越强
金属单质间的置换反应 A能从B的盐溶液中置换出B,A的原子失电子能力比B强
单质的还原性或简单阳离子的氧化性 单质还原性越强,原子失电子能力越强;简单阳离子氧化性越弱,原子失电子能力越强
2.判断非金属元素原子得电子能力强弱的依据
判断依据 判断方法
原子半径 同周期或同主族元素,原子半径越小,原子得电子能力越强
单质与H2化合的难易或气态氢化物的稳定性 单质与H2越易化合,气态氢化物越稳定,原子得电子能力越强
最高价含氧酸的酸性 酸性越强,原子得电子能力越强
非金属单质的置换反应 A能从水溶液或气体中置换出B,A的原子得电子能力比B强
单质的氧化性或简单阴离子的还原性 单质氧化性越强,简单阴离子还原性越弱,原子得电子能力越强
单质与变价金属反应的产物 产物中金属的化合价越高,原子得电子能力越强。如2Fe+3Cl22FeCl3,Fe+SFeS,说明氧化性Cl2>S,原子得电子能力Cl>S
元素的化合价 共价化合物AmBn中显负价的元素的原子得电子能力更强
【典型例题】
【例1】 下列不能说明氯元素的原子得电子能力比硫元素强的事实是( )。
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强 ③HClO4的酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
【答案】A
【解析】元素的原子得电子能力强弱可根据元素最高价氧化物对应水化物(最高价含氧酸)的酸性强弱来判断;最外层电子数多的元素原子得电子能力不一定强,如最外层电子数I>O,但原子得电子能力I【例2】 A、B两元素原子的电子层数相同,如果A的原子半径比B的大,则下列说法正确的是( )。
A.若同为非金属元素,则两元素形成的最高价氧化物对应水化物的酸性:A>B
B.若同为非金属元素,则A的气态氢化物比B的稳定
C.若同为金属元素,则A元素的原子失电子能力比B的强
D.若同为非金属元素,则A的阴离子的还原性比B的弱
【答案】C
【解析】A、B两元素位于同周期,A的原子半径比B的大,则A位于B的左边,A元素的原子失电子能力比B的强。
【规律方法】
关于元素周期律(表)的认识误区
常见误区 出错原因
误区1 误认为元素的原子得电子能力越强,其氧化物对应水化物的酸性就越强 忽视了关键词“最高价”
误区2 误认为失电子难的原子得电子的能力一定强 忽视了稀有气体元素的原子失电子难,得电子也难
误区3 误认为同周期相邻两主族元素原子序数之差都等于1 长周期也有相差11或25的情况
误区4 误认为得失电子的数目越多,元素的原子得失电子能力越强 元素原子得失电子的数目多少与元素的原子得失电子能力强弱没有必然的联系
【随堂检测】
1.下列递变规律正确的是( )。
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.Na+、Mg2+、Al3+的离子半径逐渐增大
【答案】C
【解析】HClO4、H2SO4、H3PO4的酸性依次减弱,A项错误;HCl、HBr、HI的稳定性依次减弱,B项错误;钠、镁、铝的还原性依次减弱,C项正确;Na+、Mg2+、Al3+的离子半径逐渐减小,D项错误。
2.下列各组元素是按最高正价由高到低、最低负价绝对值由低到高顺序排列的是( )。
A.Na、Mg、Al B.F、O、N C.N、O、F D.S、P、Si
【答案】D
【解析】A项中最高正价由低到高,但无负价;B项中F无正价,O无最高正价;C项中负价绝对值由高到低,A、B、C三项不符合题意;D项中最高正价分别为+6、+5、+4,最低负价绝对值分别为2、3、4,正确。
3.下列各组元素性质的递变情况错误的是( )。
A.B、C、N原子最外层电子数依次增多
B.Na、Mg、Al元素最高正价依次升高
C.Li、Be、B原子半径依次增大
D.Be、Mg、Ca的电子层数依次增多
【答案】C
【解析】B、C、N原子的最外层电子数分别为3、4、5,A项正确;Na、Mg、Al元素最高正价依次为+1、+2、+3,B项正确;Li、Be、B属于第2周期的元素,原子半径依次减小,C项错误;Be、Mg、Ca的电子层数分别为2、3、4,D项正确。
4.下表给出14~17号元素的一些性质,请回答:
14Si 15P 16S 17Cl
单质与H2 反应的条件 高温 磷蒸气与 H2能反应 加热 光照或点燃 时发生爆炸
最高价氧化 物的水化物 H4SiO4 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4 最强含氧酸
(1)它们所形成的气态氢化物中稳定性最差的是 (填化学式,下同),还原性最弱的是 。
(2)四种元素的原子得电子能力随着元素原子序数的递增而逐渐 ,试从原子结构的角度加以解释: 。
(3)一定条件下,在溶液中反应H2S+Cl22HCl+S↓ (填“能”或“不能”)发生,简述理由: 。
【答案】(1)SiH4 HCl
(2)增强 四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数递增,原子半径依次减小,原子核对最外层电子的引力逐渐增大,得电子能力逐渐增强
(3)能 因原子得电子能力Cl>S,氧化性Cl2>S,故Cl2能置换出H2S中的硫
【解析】(1)根据表中信息可判断,硅与氢气化合的条件最高,因此形成的氢化物中稳定性最差的是SiH4。氯气与氢气最容易化合,这说明氯元素的原子得电子能力最强,原子得电子能力越强,相应氢化物的还原性越弱,则还原性最弱的是HCl。
5.为了验证氯元素的原子得电子能力比硫元素的原子得电子能力强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中所盛试剂的名称是 ,烧瓶中加入试剂的化学式是 。
(2)装置B中饱和食盐水的作用是 。
(3)装置C中盛放的试剂是 (填字母),实验时该装置中可观察到的现象是 ,反应的化学方程式是 。
a.Na2S溶液 b.Na2SO3溶液 c.Na2SO4溶液
(4)装置D的作用是 ,发生反应的离子方程式为 。
(5)从原子结构的角度简要分析氯元素的原子得电子能力比硫元素的原子得电子能力强的原因: ,试再举一例能够说明氯元素的原子得电子能力比硫元素的原子得电子能力强的实验事实: 。
【答案】(1)浓盐酸 MnO2
(2)除去Cl2中的HCl气体
(3)a 有淡黄色沉淀生成 Na2S+Cl22NaCl+S↓
(4)吸收反应后剩余的气体,防止污染空气 Cl2+2OH-Cl-+ClO-+H2O
(5)Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl2
【学习目标】
1.以第3周期元素为例,掌握同周期元素性质的递变规律。
2.能运用原子结构理论初步解释同周期元素性质的递变规律,能根据元素的原子结构、元素周期表中的位置预测元素的性质。
3.通过“第3周期元素原子得失电子能力的比较”的探究,学会判断元素原子得失电子能力强弱的方法,培养设计实验和实验操作的能力。
【自主预习】
一、第3周期元素原子得失电子能力的比较
1.钠、镁、铝三种元素失电子能力的比较
实验方案 实验操作 实验现象 实验结论
钠、镁、铝与水的反应 钠与水剧烈反应;镁与水加热前不反应,加热后反应缓慢,有 ,溶液变为 色;铝放入冷水中 ,将水加热后, 钠与冷水反应,化学方程式:2Na+2H2O2NaOH+H2↑;镁与冷水 ,能与热水反应,反应的化学方程式为Mg+2H2OMg(OH)2+H2↑;铝与水不反应
镁和铝与酸的反应 两支试管内都有无色气泡冒出,但放 的试管中生成气体的速率较大 镁、铝都能置换出酸中的氢,但 更容易,反应的化学方程式分别为Mg+2HClMgCl2+H2↑,2Al+6HCl2AlCl3+3H2↑
比较NaOH、Mg(OH)2的碱性强弱 加入NaOH溶液后产生白色沉淀,把沉淀分成两等份,其中一份加入稀盐酸,沉淀 ,另一份加入NaOH溶液,沉淀 碱性由强到弱的顺序为
比较NaOH、Al(OH)3的碱性强弱 加入NaOH溶液后产生白色沉淀,把沉淀分成两等份,其中一份加入稀盐酸,沉淀 ,另一份加入NaOH溶液,沉淀
结论 钠、镁、铝元素原子失电子能力:
2.硅、磷、硫、氯四种元素原子得电子能力的比较
元素 Si P S Cl
单质与H2 反应的条件 高温,生成少量化合物 磷蒸气与H2能反应 需加热 光照或点 燃,剧烈 反应
单质与H2 化合的难易 由 到
气态氢 化物 化学式 SiH4 PH3 H2S HCl
稳定性 很不稳定 不稳定 较稳定 很稳定
由 到
最高价氧化物 SiO2 P2O5 SO3 Cl2O7
最高价氧 化物对应 的水化物 化学式
酸性 强于硫酸
由 到
结论 硅、磷、硫、氯元素原子得电子能力:
二、同周期元素原子的得失电子能力的变化规律及原因
1.变化规律
同周期的主族元素从左到右,元素原子的得电子能力 ,失电子能力 。
2.同周期主族元素的性质递变的原因
同周期主族元素的原子,核外电子层数 ,随着核电荷数的递增:
【答案】一、1.无色气泡冒出 浅红 无明显现象 无明显现象
不反应 镁条 镁 溶解 不溶解 溶解 溶解 NaOH>Mg(OH)2>Al(OH)3 Na>Mg>Al
2.难 易 弱 强 H2SiO3 H3PO4 H2SO4 HClO4 弱酸 中强酸 强酸
弱 强 Si
2.相同 逐渐增加 逐渐减小 逐渐减弱
逐渐增强
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)
(1)熔点、硬度:Al>Na,故原子失电子能力:Na>Al。 ( )
(2)金属元素原子失电子越多,还原性越强。 ( )
(3)PH3的稳定性比SiH4强。 ( )
(4)同一周期元素的原子,半径越小越容易失去电子。 ( )
(5)第3周期非金属元素含氧酸的酸性从左到右依次增强。 ( )
(6)酸性:HCl>H3PO4,故得电子能力:Cl>P。 ( )
(7)碱性:NaOH>Mg(OH)2,故原子失电子能力:Na>Mg。 ( )
(8)热稳定性:NH3
(7)√ (8)√
2.同周期元素的离子半径从左到右依次减小吗 以第3周期元素的离子半径说明。
【答案】不是。如第3周期部分元素的离子半径由大到小的顺序为r(P3-)>r(S2-)>r(Cl-)>r(Na+)>r(Mg2+)>r(Al3+)。
3.第2周期元素从C→F是否也有类似于第3周期从Si→Cl的性质变化规律
【答案】有。C、N、O、F也是随原子序数的递增,得电子能力增强,与氢气化合越来越容易,气态氢化物的稳定性越来越强,但要注意,O、F无最高价氧化物对应的水化物。
4.你能根据元素周期律,比较H3PO4、H2SO4、HClO4的酸性强弱以及P3-、S2-、Cl-的还原性强弱吗
【答案】酸性:H3PO4
5.根据周期表中第3周期主族元素相关知识,回答下列问题:
(1)原子半径最小的元素的原子结构示意图为 ,原子失电子能力最强的元素是 (填元素符号),氧化性最弱的简单阳离子是 (填离子符号)。
(2)最不稳定的气态氢化物是 (填化学式)。
(3)最高价氧化物对应水化物中,碱性最强的是 (填化学式,下同),酸性最强的是 ,显两性的是 ,该两性氢氧化物与盐酸、烧碱溶液分别反应的离子方程式为 、 。
【答案】(1) Na Na+
(2)SiH4
(3)NaOH HClO4 Al(OH)3 Al(OH)3+3H+A+3H2O Al(OH)3+OH-[Al(OH)4]-
【合作探究】
任务1 第3周期元素原子得失电子能力的比较
情境导入 美丽的螺壳,是大自然的鬼斧神工造就的。一圈圈的螺纹不仅是自身漂亮的外衣,还揭示了大自然中万事万物的发展规律。这种图案引领着人们去思考,去发现。元素周期表是螺纹模式的直接体现者,让我们来探寻元素周期表中蕴含的奥秘吧!
问题生成
1.实验探究第3周期元素Na、Mg、Al原子失电子能力的强弱。
(1)科学猜想:从Na到Al,随着核电荷数的增大,原子半径逐渐 ,原子核对电子的引力逐渐 ,失电子能力逐渐 。原子失电子能力的强弱可以从金属与 或 反应产生H2的剧烈程度来判断,也可从最高价氧化物对应水化物的 来判断。
(2)实验探究
元素 钠 镁 铝
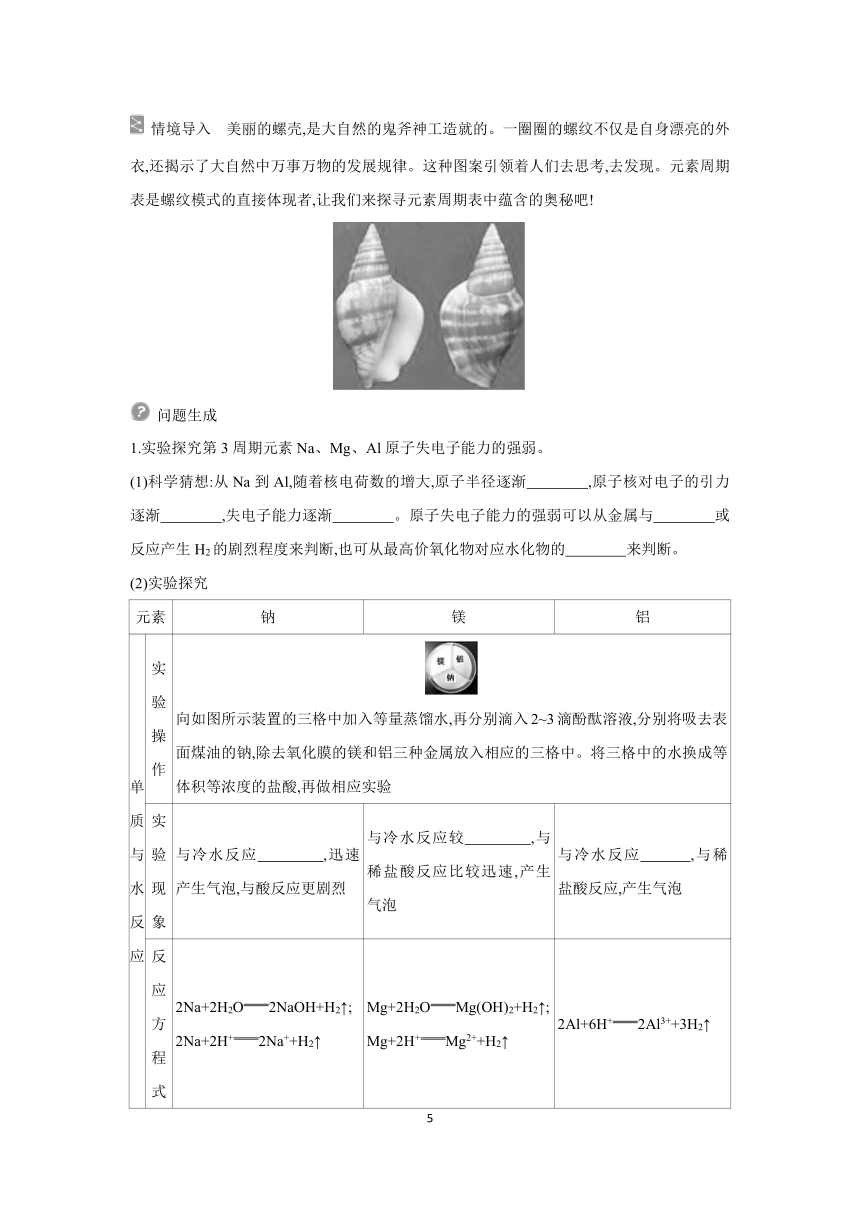
单质与水反应 实验 操作 向如图所示装置的三格中加入等量蒸馏水,再分别滴入2~3滴酚酞溶液,分别将吸去表面煤油的钠,除去氧化膜的镁和铝三种金属放入相应的三格中。将三格中的水换成等体积等浓度的盐酸,再做相应实验
实验 现象 与冷水反应 ,迅速产生气泡,与酸反应更剧烈 与冷水反应较 ,与稀盐酸反应比较迅速,产生气泡 与冷水反应 ,与稀盐酸反应,产生气泡
反应 方程 式 2Na+2H2O2NaOH+H2↑; 2Na+2H+2Na++H2↑ Mg+2H2OMg(OH)2+H2↑; Mg+2H+Mg2++H2↑ 2Al+6H+2Al3++3H2↑
结论 原子失电子能力:Na Mg Al
氢氧化物的碱性 实验 操作 向试管中加入2 mL 1 mol·L-1AlCl3溶液(或MgCl2溶液),然后滴加氨水,直到不再产生白色沉淀为止。将沉淀分装在两支试管中,向一支试管中滴加2 mol·L-1盐酸,边滴加边振荡,向另一支试管中滴加2 mol·L-1氢氧化钠溶液,边滴加边振荡
实验 现象 — 最初产生的沉淀在盐酸中 ,在NaOH溶液中 最初产生的沉淀在盐酸和NaOH溶液中均
反应 方程 式 — Mg(OH)2+2H+Mg2++2H2O Al(OH)3+3H+Al3++3H2O; Al(OH)3+OH-[Al(OH)4]-
结论 NaOH是强碱 Mg(OH)2是中强碱 Al(OH)3是两性氢氧化物
原子失电子能力:Na Mg Al
【答案】(1)减小 增强 减弱 水 酸 碱性
(2)剧烈 缓慢 很微弱 > > 溶解 不溶解 溶解 > >
2.探究第3周期元素Si、P、S、Cl原子得电子能力的强弱。
(1)科学猜想:从Si到Cl,随着核电荷数的增大,原子半径逐渐 ,原子核对电子的吸引力逐渐 ,得电子能力逐渐 。原子得电子能力的强弱可以从非金属单质与 化合的难易程度来判断,也可从最高价氧化物对应水化物的 来判断。
(2)信息获取与结论分析
元素 Si P S Cl
判断依据 对应单 质与氢 气化合 高温 磷蒸气与 氢气反应 加热 光照或点燃
由易到难的顺序是
稳定性:SiH4 PH3 H2S HCl
最高价氧 化物对应 水化物及 其酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4 强酸
酸性:HClO4 H2SO4 H3PO4 H2SiO3
结论 硅、磷、硫、氯的原子得电子能力逐渐
【答案】(1)减小 增强 增强 氢气 酸性
(2)Cl2、S、P、Si < < < > > > 增强
【核心归纳】
1.判断金属元素原子失电子能力强弱的依据
判断依据 判断方法
原子半径 同周期或同主族元素,原子半径越大,原子失电子能力越强
与水(或酸)反应 越易置换出H2,原子失电子能力越强
最高价氧化物对应水化物的碱性 碱性越强,原子失电子能力越强
金属单质间的置换反应 A能从B的盐溶液中置换出B,A的原子失电子能力比B强
单质的还原性或简单阳离子的氧化性 单质还原性越强,原子失电子能力越强;简单阳离子氧化性越弱,原子失电子能力越强
2.判断非金属元素原子得电子能力强弱的依据
判断依据 判断方法
原子半径 同周期或同主族元素,原子半径越小,原子得电子能力越强
单质与H2化合的难易或气态氢化物的稳定性 单质与H2越易化合,气态氢化物越稳定,原子得电子能力越强
最高价含氧酸的酸性 酸性越强,原子得电子能力越强
非金属单质的置换反应 A能从水溶液或气体中置换出B,A的原子得电子能力比B强
单质的氧化性或简单阴离子的还原性 单质氧化性越强,简单阴离子还原性越弱,原子得电子能力越强
单质与变价金属反应的产物 产物中金属的化合价越高,原子得电子能力越强。如2Fe+3Cl22FeCl3,Fe+SFeS,说明氧化性Cl2>S,原子得电子能力Cl>S
元素的化合价 共价化合物AmBn中显负价的元素的原子得电子能力更强
【典型例题】
【例1】 下列不能说明氯元素的原子得电子能力比硫元素强的事实是( )。
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强 ③HClO4的酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
【答案】A
【解析】元素的原子得电子能力强弱可根据元素最高价氧化物对应水化物(最高价含氧酸)的酸性强弱来判断;最外层电子数多的元素原子得电子能力不一定强,如最外层电子数I>O,但原子得电子能力I
A.若同为非金属元素,则两元素形成的最高价氧化物对应水化物的酸性:A>B
B.若同为非金属元素,则A的气态氢化物比B的稳定
C.若同为金属元素,则A元素的原子失电子能力比B的强
D.若同为非金属元素,则A的阴离子的还原性比B的弱
【答案】C
【解析】A、B两元素位于同周期,A的原子半径比B的大,则A位于B的左边,A元素的原子失电子能力比B的强。
【规律方法】
关于元素周期律(表)的认识误区
常见误区 出错原因
误区1 误认为元素的原子得电子能力越强,其氧化物对应水化物的酸性就越强 忽视了关键词“最高价”
误区2 误认为失电子难的原子得电子的能力一定强 忽视了稀有气体元素的原子失电子难,得电子也难
误区3 误认为同周期相邻两主族元素原子序数之差都等于1 长周期也有相差11或25的情况
误区4 误认为得失电子的数目越多,元素的原子得失电子能力越强 元素原子得失电子的数目多少与元素的原子得失电子能力强弱没有必然的联系
【随堂检测】
1.下列递变规律正确的是( )。
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.Na+、Mg2+、Al3+的离子半径逐渐增大
【答案】C
【解析】HClO4、H2SO4、H3PO4的酸性依次减弱,A项错误;HCl、HBr、HI的稳定性依次减弱,B项错误;钠、镁、铝的还原性依次减弱,C项正确;Na+、Mg2+、Al3+的离子半径逐渐减小,D项错误。
2.下列各组元素是按最高正价由高到低、最低负价绝对值由低到高顺序排列的是( )。
A.Na、Mg、Al B.F、O、N C.N、O、F D.S、P、Si
【答案】D
【解析】A项中最高正价由低到高,但无负价;B项中F无正价,O无最高正价;C项中负价绝对值由高到低,A、B、C三项不符合题意;D项中最高正价分别为+6、+5、+4,最低负价绝对值分别为2、3、4,正确。
3.下列各组元素性质的递变情况错误的是( )。
A.B、C、N原子最外层电子数依次增多
B.Na、Mg、Al元素最高正价依次升高
C.Li、Be、B原子半径依次增大
D.Be、Mg、Ca的电子层数依次增多
【答案】C
【解析】B、C、N原子的最外层电子数分别为3、4、5,A项正确;Na、Mg、Al元素最高正价依次为+1、+2、+3,B项正确;Li、Be、B属于第2周期的元素,原子半径依次减小,C项错误;Be、Mg、Ca的电子层数分别为2、3、4,D项正确。
4.下表给出14~17号元素的一些性质,请回答:
14Si 15P 16S 17Cl
单质与H2 反应的条件 高温 磷蒸气与 H2能反应 加热 光照或点燃 时发生爆炸
最高价氧化 物的水化物 H4SiO4 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4 最强含氧酸
(1)它们所形成的气态氢化物中稳定性最差的是 (填化学式,下同),还原性最弱的是 。
(2)四种元素的原子得电子能力随着元素原子序数的递增而逐渐 ,试从原子结构的角度加以解释: 。
(3)一定条件下,在溶液中反应H2S+Cl22HCl+S↓ (填“能”或“不能”)发生,简述理由: 。
【答案】(1)SiH4 HCl
(2)增强 四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数递增,原子半径依次减小,原子核对最外层电子的引力逐渐增大,得电子能力逐渐增强
(3)能 因原子得电子能力Cl>S,氧化性Cl2>S,故Cl2能置换出H2S中的硫
【解析】(1)根据表中信息可判断,硅与氢气化合的条件最高,因此形成的氢化物中稳定性最差的是SiH4。氯气与氢气最容易化合,这说明氯元素的原子得电子能力最强,原子得电子能力越强,相应氢化物的还原性越弱,则还原性最弱的是HCl。
5.为了验证氯元素的原子得电子能力比硫元素的原子得电子能力强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中所盛试剂的名称是 ,烧瓶中加入试剂的化学式是 。
(2)装置B中饱和食盐水的作用是 。
(3)装置C中盛放的试剂是 (填字母),实验时该装置中可观察到的现象是 ,反应的化学方程式是 。
a.Na2S溶液 b.Na2SO3溶液 c.Na2SO4溶液
(4)装置D的作用是 ,发生反应的离子方程式为 。
(5)从原子结构的角度简要分析氯元素的原子得电子能力比硫元素的原子得电子能力强的原因: ,试再举一例能够说明氯元素的原子得电子能力比硫元素的原子得电子能力强的实验事实: 。
【答案】(1)浓盐酸 MnO2
(2)除去Cl2中的HCl气体
(3)a 有淡黄色沉淀生成 Na2S+Cl22NaCl+S↓
(4)吸收反应后剩余的气体,防止污染空气 Cl2+2OH-Cl-+ClO-+H2O
(5)Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl
