2.2 课时1化学反应中能量变化的本质及转化形式 学案 (含答案)2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 2.2 课时1化学反应中能量变化的本质及转化形式 学案 (含答案)2023-2024学年高一化学鲁科版(2019)必修第二册 |
|
|
| 格式 | docx | ||
| 文件大小 | 307.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览




文档简介
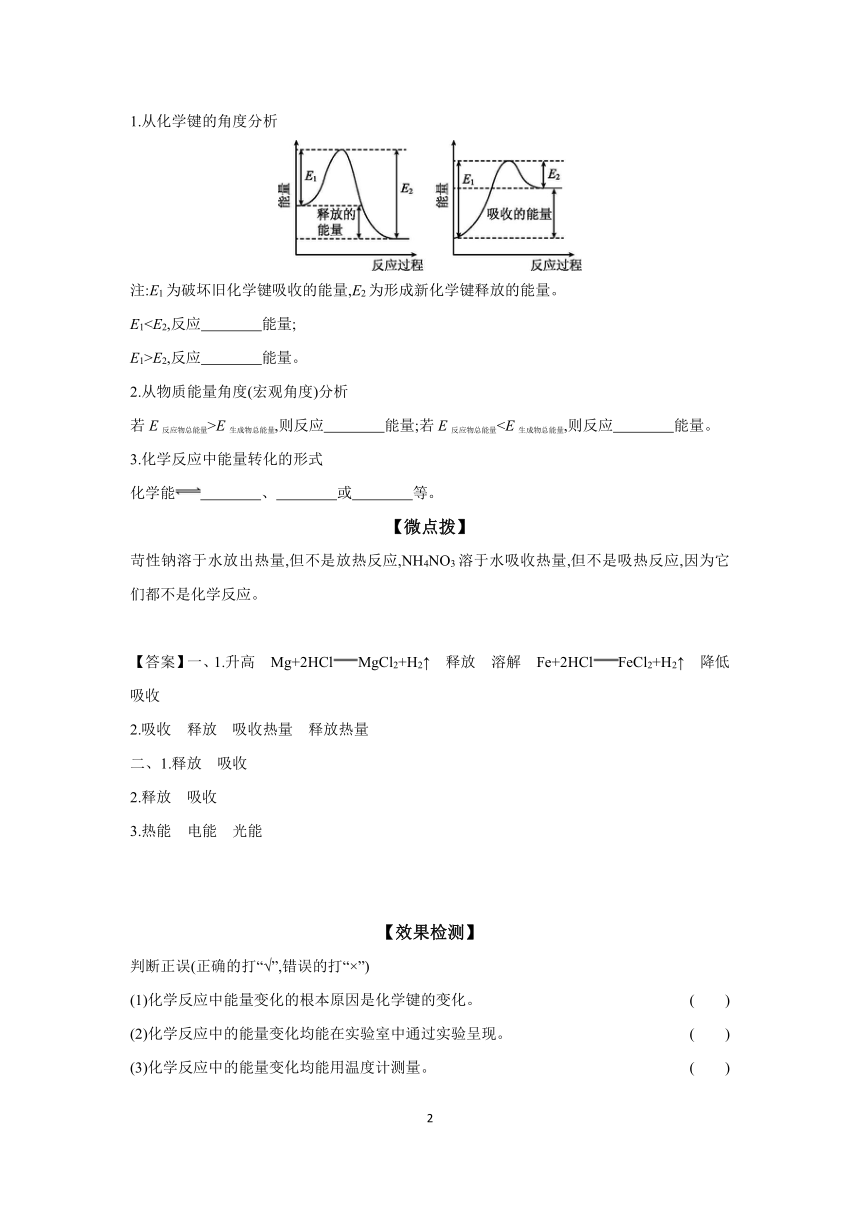
2.2 课时1化学反应中能量变化的本质及转化形式
【学习目标】
1.知道物质具有能量,认识放热反应和吸热反应。
2.知道化学反应可以实现化学能与其他形式能量的转化。
3.能够从化学键的断裂与形成角度理解化学反应的实质及化学反应中能量变化的实质。
4.知道常见的吸热反应与放热反应。
【自主预习】
一、化学反应中能量的转化形式
1.活动探究
实验操作 实验现象 有关化学方 程式及结论
镁粉溶解,有大量气泡产生,反应混合液的温度 ,反应 能量
铁粉逐渐 ,但产生气泡的速率不如Mg与稀盐酸反应的大,溶液温度升高,但温度不如Mg与稀盐酸反应的温度高 ,等量的金属与稀盐酸反应,金属越活泼,释放能量越多
有气泡产生,溶液温度 反应 能量
2.结论
每一个化学反应都伴随着能量的变化,有的反应 能量,有的反应 能量。
吸热反应:最终表现为 的化学反应。
放热反应:最终表现为 的化学反应。
二、化学反应中能量变化的本质
1.从化学键的角度分析
注:E1为破坏旧化学键吸收的能量,E2为形成新化学键释放的能量。
E1E1>E2,反应 能量。
2.从物质能量角度(宏观角度)分析
若E反应物总能量>E生成物总能量,则反应 能量;若E反应物总能量3.化学反应中能量转化的形式
化学能 、 或 等。
【微点拨】
苛性钠溶于水放出热量,但不是放热反应,NH4NO3溶于水吸收热量,但不是吸热反应,因为它们都不是化学反应。
【答案】一、1.升高 Mg+2HClMgCl2+H2↑ 释放 溶解 Fe+2HClFeCl2+H2↑ 降低 吸收
2.吸收 释放 吸收热量 释放热量
二、1.释放 吸收
2.释放 吸收
3.热能 电能 光能
【效果检测】
判断正误(正确的打“√”,错误的打“×”)
(1)化学反应中能量变化的根本原因是化学键的变化。 ( )
(2)化学反应中的能量变化均能在实验室中通过实验呈现。 ( )
(3)化学反应中的能量变化均能用温度计测量。 ( )
(4)化学反应中的能量变化均能用手感知。 ( )
(5)化学变化遵循质量守恒和能量守恒。 ( )
(6)有能量变化的过程一定发生了化学反应。 ( )
(7)化学反应中化学能只能转变为热能。 ( )
(8)需要点燃或加热才能发生的反应一定是吸热反应。 ( )
【答案】(1)√ (2)× (3)× (4)× (5)√
(6)× (7)× (8)×
【合作探究】
任务1 实验探究吸热反应与放热反应
情境导入 现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。化石燃料燃烧会释放大量的热。除了燃烧,其他化学反应也伴随着放热或吸热现象。
实验探究
1.实验探究放热反应与吸热反应
实验操作 实验现象 实验结论
(1)看到有 产生; (2)用手触摸反应后的试管,手感到 ; (3)温度计显示溶液温度 反应的化学方程式为 , 该反应 热量
(1)闻到 气味; (2)用手触摸杯壁下部,有 的感觉; (3)用手拿起烧杯,木片 ; (4)烧杯内反应物呈 状 反应的化学方程式为 , 该反应 热量
【答案】气泡 发烫 升高 Mg+2HClMgCl2+H2↑ 放出 刺激性 冰凉 黏结到烧杯底部 糊
Ba(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O 吸收
2.原理分析
(1)化学反应中的能量变化,是不是都表现为热量变化
【答案】主要表现为热量变化,还有光能等释放出来,或者是热能、电能或光能转化为物质内部的能量(化学能)被“储存”起来。
(2)化学反应过程都伴随着能量变化,伴随能量变化的过程都是化学反应吗
【答案】不一定,如核反应、物质三态变化都有能量变化,但它们不属于化学反应。
(3)NaOH溶于水放出热量,NaOH溶于水是放热反应吗
【答案】吸热反应和放热反应均是化学反应。注意明确某些吸热过程和放热过程不属于化学反应。如:NaOH固体溶于水和浓硫酸稀释均属于放热过程,NH4NO3固体溶于水属于吸热过程。三者都不是化学反应,不属于吸热反应或放热反应。
(4)NaCl溶于水,化学键有没有变化 如果仅从化学键的角度分析,NaCl溶于水是吸热还是放热
【答案】NaCl溶于水,NaClNa++Cl-,只有化学键断裂,没有化学键形成,因此NaCl溶于水是吸收热量。
【核心归纳】
放热反应与吸热反应的比较
放热反应 吸热反应
形成 原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化学 键强弱 的关系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
反应过 程图示
示例 ①金属与水或酸的反应 ②燃烧反应 ③中和反应 ④大部分化合反应 ①Ba(OH)2·8H2O与NH4Cl反应 ②C与H2O(g)、CO2的反应 ③大部分分解反应
【典型例题】
【例1】 下列反应既属于氧化还原反应,又属于吸热反应的是( )。
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.高温下C与CO2的反应
D.甲烷在氧气中的燃烧
【答案】C
【解析】A项,反应2Al+6HCl2AlCl3+3H2↑既属于氧化还原反应,又属于放热反应;B项,反应Ba(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O既属于非氧化还原反应,又属于吸热反应;C项,高温下C与CO2的反应既属于氧化还原反应,又属于吸热反应;D项,甲烷在氧气中的燃烧既属于氧化还原反应,又属于放热反应。
【例2】 将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )。
A.NH4HCO3和盐酸的反应是放热反应
B.NH4HCO3和盐酸的反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3只含有共价键
【答案】B
【解析】醋酸逐渐凝固,说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,A项错误;该反应为吸热反应,即吸收的热量转化为产物内部的能量,B项正确;因反应为吸热反应,故反应物的总能量低于生成物的总能量,C项错误;NH4HCO3属于离子化合物,含有离子键和共价键,D项错误。
【方法技巧】
正确理解吸热反应和放热反应
1.“三个不一定”
(1)需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应。
(2)放热反应在常温下不一定容易发生,如物质燃烧。
(3)吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
2.区分吸、放热反应和吸、放热过程
吸热反应和放热反应都是化学变化。如NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。
任务2 化学反应中能量变化的本质及转化形式
情境导入 明代于谦的《石灰吟》:千锤万凿出深山,烈火焚烧若等闲;粉骨碎身浑不怕,要留清白在人间。这是一首托物言志诗,作者以石灰做比喻,表达自己为国尽忠,不怕牺牲的意愿和坚守高洁的决心。通过古诗的描述,制取石灰的反应是放热反应还是吸热反应 石灰遇水的反应呢 能量如何转化
问题生成
某学生用如图所示装置对物质变化过程中的能量变化进行探究。探究发现向试管中加入Ba(OH)2·8H2O晶体与NH4Cl晶体时,甲管液面高于乙管,向试管中加入CaO(s)时,甲管液面低于乙管。
1.将Ba(OH)2·8H2O晶体与NH4Cl晶体加入水中后,发生了什么样的化学反应,导致甲管液面高于乙管
【答案】Ba(OH)2·8H2O晶体与NH4Cl晶体反应吸热,使锥形瓶内压强降低。
2.向水中加入CaO后,为什么甲管液面低于乙管
【答案】CaO与水反应放热,使锥形瓶内空气膨胀,所以甲管液面低于乙管。
3.化学反应中的能量变化与化学键的断裂和形成有何关系
【答案】反应物中旧化学键的断裂吸收能量为E1,生成物中新化学键的形成释放能量为E2。若E1>E2,反应吸收能量;若E1【核心归纳】
1.从反应物、生成物总能量角度判断化学反应中的能量变化
放出能量 吸收能量
反应物的总能量>生成物的总能量 反应物的总能量<生成物的总能量
反应物的总能量>生成物的总能量 反应物的总能量<生成物的总能量
2.从化学键角度判断化学反应中的能量变化
用Q(吸)表示反应物化学键断裂时吸收的总能量,Q(放)表示生成物化学键形成时放出的总能量。
公式:ΔQ=Q(吸)-Q(放)
利用化学键形成和断裂时的能量变化计算化学反应中的能量变化:
(1)若ΔQ>0,说明反应物断键时吸收的总能量>生成物成键时放出的总能量,即反应吸收能量。
(2)若ΔQ<0,说明反应物断键时吸收的总能量<生成物成键时放出的总能量,即反应放出能量。
【典型例题】
【例3】 根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )。
A.H2O分解为H2与O2时放出热量
B.生成1 mol H2O(g)时吸收热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D.氢气和氧气的总能量小于水的能量
【答案】C
【解析】根据能量变化可知,1 mol H2与 mol O2断键时吸收685 kJ能量,而生成1 mol H2O(g)放出930 kJ能量,所以H2(g)燃烧生成H2O(g)的反应是放热反应,则H2O(g)的分解是吸热反应。
【规律方法】
化学反应中反应热的计算方法及注意事项
1.反应热计算公式
ΔQ=反应物的总键能-生成物的总键能=生成物的总能量-反应物的总能量。
ΔQ<0,为放热反应。
ΔQ>0,为吸热反应。
2.注意共价化合物中的共价键数目,如1 mol H2O中含有2 mol H—O,1 mol H2O2中含有2 mol H—O和1 mol O—O。
3.计算时要注意化学计量数与共价键总数的关系,不能都按1 mol计算,要根据实际配平的反应方程式计算反应物断键吸收或生成物成键释放的总能量。
【随堂检测】
1.下列对化学反应的认识错误的是( )。
A.会引起化学键的变化
B.会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
【答案】C
【解析】化学反应的本质是化学键的断裂和形成,表现为有新物质生成,并伴随着能量的变化,而化学变化中的反应物和生成物的状态在反应前后可能相同,也可能不相同,故C项错误。
2.下列变化中属于吸热反应的是( )。
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
【答案】D
【解析】放热反应和吸热反应都是化学反应。⑤为放热反应,②④为吸热反应,①液态水汽化是吸热过程,③浓H2SO4稀释是放热过程,二者均为物理变化,D项正确。
3.下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )。
A B
C D
【答案】C
【解析】C和CO2反应生成CO是吸热反应,生成物的总能量应大于反应物的总能量,C项正确。
4.2021年12月,“中国航天”入选年度中国媒体流行语。航天领域常用“液氧-煤油”、“液氧-液氢”等火箭推进剂。下列关于火箭推进剂的说法错误的是( )。
A.推进剂中燃料燃烧的反应是吸热反应
B.“液氧-煤油”推进剂的燃烧产物含有CO2
C.“液氧-液氢”推进剂具有清洁等优点,但储存和运输较为困难
D.火箭推进剂的发展对人类社会的进步具有促进作用
【答案】A
【解析】A项,推进剂中燃料燃烧的反应是放热反应,错误。
5.已知2SO2+O22SO3为放热反应,下列关于该反应的说法正确的是( )。
A.1 mol O2具有的能量一定高于2 mol SO2具有的能量
B.2 mol SO2和1 mol O2具有的总能量一定高于2 mol SO3具有的总能量
C.2 mol SO2的总键能一定低于2 mol SO3的总键能
D.因该反应为放热反应,故不必加热就可以发生
【答案】B
【解析】反应物的总能量高于生成物的总能量,反应放热,A项错误,B项正确;反应物的总键能低于生成物的总键能的反应为放热反应,C项错误;放热反应只表明反应物的总能量比生成物的总能量高,而加热是反应的条件,两者无必然联系,许多放热反应也必须加热才能开始进行,D项错误。
6.已知反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )。
A.图中a→b的过程为放热过程
B.1 mol NO2和1 mol CO的键能总和大于1 mol NO和1 mol CO2的键能总和
C.该反应为氧化还原反应
D.1 mol NO2(g)和1 mol CO(g)的总能量低于1 mol NO (g)和1 mol CO2(g)的总能量
【答案】C
【解析】a状态的能量低于b状态,则图中a→b的过程为吸热过程,A项错误;反应物总能量高于生成物总能量,反应为放热反应,即断键吸收的能量低于成键放出的能量,则1 mol NO2和1 mol CO的键能总和小于1 mol NO和1 mol CO2的键能总和,B项错误;反应中C和N元素化合价发生变化,则该反应为氧化还原反应,C项正确;由图可知,反应物总能量高于生成物总能量,则1 mol NO2(g)和1 mol CO(g)的总能量高于1 mol NO(g)和1 mol CO2(g)的总能量,D项错误。
2
【学习目标】
1.知道物质具有能量,认识放热反应和吸热反应。
2.知道化学反应可以实现化学能与其他形式能量的转化。
3.能够从化学键的断裂与形成角度理解化学反应的实质及化学反应中能量变化的实质。
4.知道常见的吸热反应与放热反应。
【自主预习】
一、化学反应中能量的转化形式
1.活动探究
实验操作 实验现象 有关化学方 程式及结论
镁粉溶解,有大量气泡产生,反应混合液的温度 ,反应 能量
铁粉逐渐 ,但产生气泡的速率不如Mg与稀盐酸反应的大,溶液温度升高,但温度不如Mg与稀盐酸反应的温度高 ,等量的金属与稀盐酸反应,金属越活泼,释放能量越多
有气泡产生,溶液温度 反应 能量
2.结论
每一个化学反应都伴随着能量的变化,有的反应 能量,有的反应 能量。
吸热反应:最终表现为 的化学反应。
放热反应:最终表现为 的化学反应。
二、化学反应中能量变化的本质
1.从化学键的角度分析
注:E1为破坏旧化学键吸收的能量,E2为形成新化学键释放的能量。
E1
2.从物质能量角度(宏观角度)分析
若E反应物总能量>E生成物总能量,则反应 能量;若E反应物总能量
化学能 、 或 等。
【微点拨】
苛性钠溶于水放出热量,但不是放热反应,NH4NO3溶于水吸收热量,但不是吸热反应,因为它们都不是化学反应。
【答案】一、1.升高 Mg+2HClMgCl2+H2↑ 释放 溶解 Fe+2HClFeCl2+H2↑ 降低 吸收
2.吸收 释放 吸收热量 释放热量
二、1.释放 吸收
2.释放 吸收
3.热能 电能 光能
【效果检测】
判断正误(正确的打“√”,错误的打“×”)
(1)化学反应中能量变化的根本原因是化学键的变化。 ( )
(2)化学反应中的能量变化均能在实验室中通过实验呈现。 ( )
(3)化学反应中的能量变化均能用温度计测量。 ( )
(4)化学反应中的能量变化均能用手感知。 ( )
(5)化学变化遵循质量守恒和能量守恒。 ( )
(6)有能量变化的过程一定发生了化学反应。 ( )
(7)化学反应中化学能只能转变为热能。 ( )
(8)需要点燃或加热才能发生的反应一定是吸热反应。 ( )
【答案】(1)√ (2)× (3)× (4)× (5)√
(6)× (7)× (8)×
【合作探究】
任务1 实验探究吸热反应与放热反应
情境导入 现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。化石燃料燃烧会释放大量的热。除了燃烧,其他化学反应也伴随着放热或吸热现象。
实验探究
1.实验探究放热反应与吸热反应
实验操作 实验现象 实验结论
(1)看到有 产生; (2)用手触摸反应后的试管,手感到 ; (3)温度计显示溶液温度 反应的化学方程式为 , 该反应 热量
(1)闻到 气味; (2)用手触摸杯壁下部,有 的感觉; (3)用手拿起烧杯,木片 ; (4)烧杯内反应物呈 状 反应的化学方程式为 , 该反应 热量
【答案】气泡 发烫 升高 Mg+2HClMgCl2+H2↑ 放出 刺激性 冰凉 黏结到烧杯底部 糊
Ba(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O 吸收
2.原理分析
(1)化学反应中的能量变化,是不是都表现为热量变化
【答案】主要表现为热量变化,还有光能等释放出来,或者是热能、电能或光能转化为物质内部的能量(化学能)被“储存”起来。
(2)化学反应过程都伴随着能量变化,伴随能量变化的过程都是化学反应吗
【答案】不一定,如核反应、物质三态变化都有能量变化,但它们不属于化学反应。
(3)NaOH溶于水放出热量,NaOH溶于水是放热反应吗
【答案】吸热反应和放热反应均是化学反应。注意明确某些吸热过程和放热过程不属于化学反应。如:NaOH固体溶于水和浓硫酸稀释均属于放热过程,NH4NO3固体溶于水属于吸热过程。三者都不是化学反应,不属于吸热反应或放热反应。
(4)NaCl溶于水,化学键有没有变化 如果仅从化学键的角度分析,NaCl溶于水是吸热还是放热
【答案】NaCl溶于水,NaClNa++Cl-,只有化学键断裂,没有化学键形成,因此NaCl溶于水是吸收热量。
【核心归纳】
放热反应与吸热反应的比较
放热反应 吸热反应
形成 原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化学 键强弱 的关系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
反应过 程图示
示例 ①金属与水或酸的反应 ②燃烧反应 ③中和反应 ④大部分化合反应 ①Ba(OH)2·8H2O与NH4Cl反应 ②C与H2O(g)、CO2的反应 ③大部分分解反应
【典型例题】
【例1】 下列反应既属于氧化还原反应,又属于吸热反应的是( )。
A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.高温下C与CO2的反应
D.甲烷在氧气中的燃烧
【答案】C
【解析】A项,反应2Al+6HCl2AlCl3+3H2↑既属于氧化还原反应,又属于放热反应;B项,反应Ba(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O既属于非氧化还原反应,又属于吸热反应;C项,高温下C与CO2的反应既属于氧化还原反应,又属于吸热反应;D项,甲烷在氧气中的燃烧既属于氧化还原反应,又属于放热反应。
【例2】 将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )。
A.NH4HCO3和盐酸的反应是放热反应
B.NH4HCO3和盐酸的反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3只含有共价键
【答案】B
【解析】醋酸逐渐凝固,说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,A项错误;该反应为吸热反应,即吸收的热量转化为产物内部的能量,B项正确;因反应为吸热反应,故反应物的总能量低于生成物的总能量,C项错误;NH4HCO3属于离子化合物,含有离子键和共价键,D项错误。
【方法技巧】
正确理解吸热反应和放热反应
1.“三个不一定”
(1)需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应。
(2)放热反应在常温下不一定容易发生,如物质燃烧。
(3)吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
2.区分吸、放热反应和吸、放热过程
吸热反应和放热反应都是化学变化。如NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。
任务2 化学反应中能量变化的本质及转化形式
情境导入 明代于谦的《石灰吟》:千锤万凿出深山,烈火焚烧若等闲;粉骨碎身浑不怕,要留清白在人间。这是一首托物言志诗,作者以石灰做比喻,表达自己为国尽忠,不怕牺牲的意愿和坚守高洁的决心。通过古诗的描述,制取石灰的反应是放热反应还是吸热反应 石灰遇水的反应呢 能量如何转化
问题生成
某学生用如图所示装置对物质变化过程中的能量变化进行探究。探究发现向试管中加入Ba(OH)2·8H2O晶体与NH4Cl晶体时,甲管液面高于乙管,向试管中加入CaO(s)时,甲管液面低于乙管。
1.将Ba(OH)2·8H2O晶体与NH4Cl晶体加入水中后,发生了什么样的化学反应,导致甲管液面高于乙管
【答案】Ba(OH)2·8H2O晶体与NH4Cl晶体反应吸热,使锥形瓶内压强降低。
2.向水中加入CaO后,为什么甲管液面低于乙管
【答案】CaO与水反应放热,使锥形瓶内空气膨胀,所以甲管液面低于乙管。
3.化学反应中的能量变化与化学键的断裂和形成有何关系
【答案】反应物中旧化学键的断裂吸收能量为E1,生成物中新化学键的形成释放能量为E2。若E1>E2,反应吸收能量;若E1
1.从反应物、生成物总能量角度判断化学反应中的能量变化
放出能量 吸收能量
反应物的总能量>生成物的总能量 反应物的总能量<生成物的总能量
反应物的总能量>生成物的总能量 反应物的总能量<生成物的总能量
2.从化学键角度判断化学反应中的能量变化
用Q(吸)表示反应物化学键断裂时吸收的总能量,Q(放)表示生成物化学键形成时放出的总能量。
公式:ΔQ=Q(吸)-Q(放)
利用化学键形成和断裂时的能量变化计算化学反应中的能量变化:
(1)若ΔQ>0,说明反应物断键时吸收的总能量>生成物成键时放出的总能量,即反应吸收能量。
(2)若ΔQ<0,说明反应物断键时吸收的总能量<生成物成键时放出的总能量,即反应放出能量。
【典型例题】
【例3】 根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )。
A.H2O分解为H2与O2时放出热量
B.生成1 mol H2O(g)时吸收热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D.氢气和氧气的总能量小于水的能量
【答案】C
【解析】根据能量变化可知,1 mol H2与 mol O2断键时吸收685 kJ能量,而生成1 mol H2O(g)放出930 kJ能量,所以H2(g)燃烧生成H2O(g)的反应是放热反应,则H2O(g)的分解是吸热反应。
【规律方法】
化学反应中反应热的计算方法及注意事项
1.反应热计算公式
ΔQ=反应物的总键能-生成物的总键能=生成物的总能量-反应物的总能量。
ΔQ<0,为放热反应。
ΔQ>0,为吸热反应。
2.注意共价化合物中的共价键数目,如1 mol H2O中含有2 mol H—O,1 mol H2O2中含有2 mol H—O和1 mol O—O。
3.计算时要注意化学计量数与共价键总数的关系,不能都按1 mol计算,要根据实际配平的反应方程式计算反应物断键吸收或生成物成键释放的总能量。
【随堂检测】
1.下列对化学反应的认识错误的是( )。
A.会引起化学键的变化
B.会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
【答案】C
【解析】化学反应的本质是化学键的断裂和形成,表现为有新物质生成,并伴随着能量的变化,而化学变化中的反应物和生成物的状态在反应前后可能相同,也可能不相同,故C项错误。
2.下列变化中属于吸热反应的是( )。
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
【答案】D
【解析】放热反应和吸热反应都是化学反应。⑤为放热反应,②④为吸热反应,①液态水汽化是吸热过程,③浓H2SO4稀释是放热过程,二者均为物理变化,D项正确。
3.下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )。
A B
C D
【答案】C
【解析】C和CO2反应生成CO是吸热反应,生成物的总能量应大于反应物的总能量,C项正确。
4.2021年12月,“中国航天”入选年度中国媒体流行语。航天领域常用“液氧-煤油”、“液氧-液氢”等火箭推进剂。下列关于火箭推进剂的说法错误的是( )。
A.推进剂中燃料燃烧的反应是吸热反应
B.“液氧-煤油”推进剂的燃烧产物含有CO2
C.“液氧-液氢”推进剂具有清洁等优点,但储存和运输较为困难
D.火箭推进剂的发展对人类社会的进步具有促进作用
【答案】A
【解析】A项,推进剂中燃料燃烧的反应是放热反应,错误。
5.已知2SO2+O22SO3为放热反应,下列关于该反应的说法正确的是( )。
A.1 mol O2具有的能量一定高于2 mol SO2具有的能量
B.2 mol SO2和1 mol O2具有的总能量一定高于2 mol SO3具有的总能量
C.2 mol SO2的总键能一定低于2 mol SO3的总键能
D.因该反应为放热反应,故不必加热就可以发生
【答案】B
【解析】反应物的总能量高于生成物的总能量,反应放热,A项错误,B项正确;反应物的总键能低于生成物的总键能的反应为放热反应,C项错误;放热反应只表明反应物的总能量比生成物的总能量高,而加热是反应的条件,两者无必然联系,许多放热反应也必须加热才能开始进行,D项错误。
6.已知反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )。
A.图中a→b的过程为放热过程
B.1 mol NO2和1 mol CO的键能总和大于1 mol NO和1 mol CO2的键能总和
C.该反应为氧化还原反应
D.1 mol NO2(g)和1 mol CO(g)的总能量低于1 mol NO (g)和1 mol CO2(g)的总能量
【答案】C
【解析】a状态的能量低于b状态,则图中a→b的过程为吸热过程,A项错误;反应物总能量高于生成物总能量,反应为放热反应,即断键吸收的能量低于成键放出的能量,则1 mol NO2和1 mol CO的键能总和小于1 mol NO和1 mol CO2的键能总和,B项错误;反应中C和N元素化合价发生变化,则该反应为氧化还原反应,C项正确;由图可知,反应物总能量高于生成物总能量,则1 mol NO2(g)和1 mol CO(g)的总能量高于1 mol NO(g)和1 mol CO2(g)的总能量,D项错误。
2
