3.3 课时1 乙醇 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 3.3 课时1 乙醇 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 234.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 21:15:32 | ||
图片预览


文档简介
3.3 课时1 乙醇
【学习目标】
1.了解乙醇的组成、物理性质和主要应用。
2.掌握乙醇的化学性质,特别是乙醇的催化氧化。
3.掌握乙醇的分子结构特点,弄清结构与性质的关系。
4.能利用乙醇的主要性质进行物质鉴别。
【自主预习】
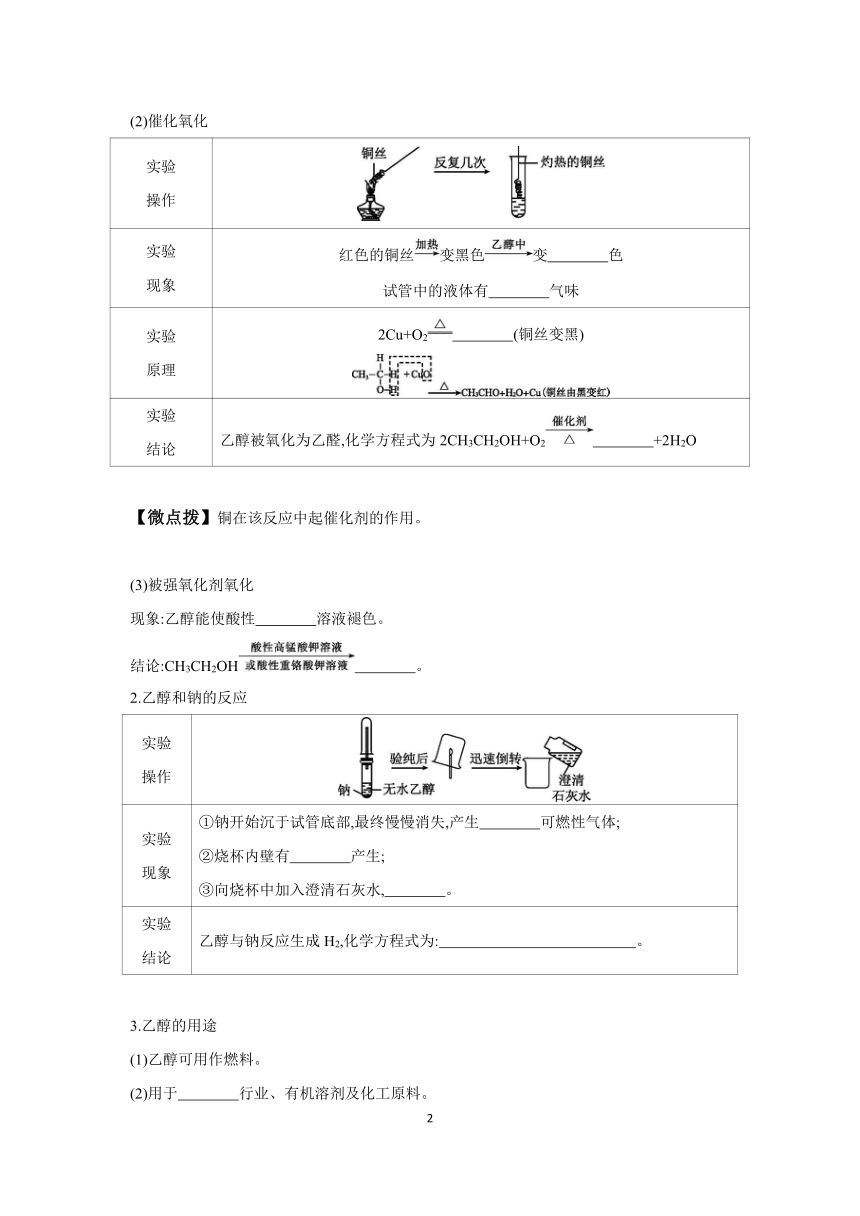
一、乙醇的物理性质与分子结构
1.物理性质
俗称 颜色 状态 气味
特殊香味
密度 溶解性(在水中) 挥发性
比水 能与水以任意比互溶 易挥发
2.分子结构
【微点拨】
乙醇是优良的有机溶剂,但不能用来萃取溴水、碘水中的Br2和I2。
二、乙醇的化学性质及用途
1.氧化反应
(1)燃烧现象:乙醇在空气中燃烧,产生 色火焰,放出大量的热。
化学方程式:C2H5OH+3O2 +3H2O。
(2)催化氧化
实验 操作
实验 现象 红色的铜丝变黑色变 色 试管中的液体有 气味
实验 原理 2Cu+O2 (铜丝变黑)
实验 结论 乙醇被氧化为乙醛,化学方程式为2CH3CH2OH+O2 +2H2O
【微点拨】铜在该反应中起催化剂的作用。
(3)被强氧化剂氧化
现象:乙醇能使酸性 溶液褪色。
结论:CH3CH2OH 。
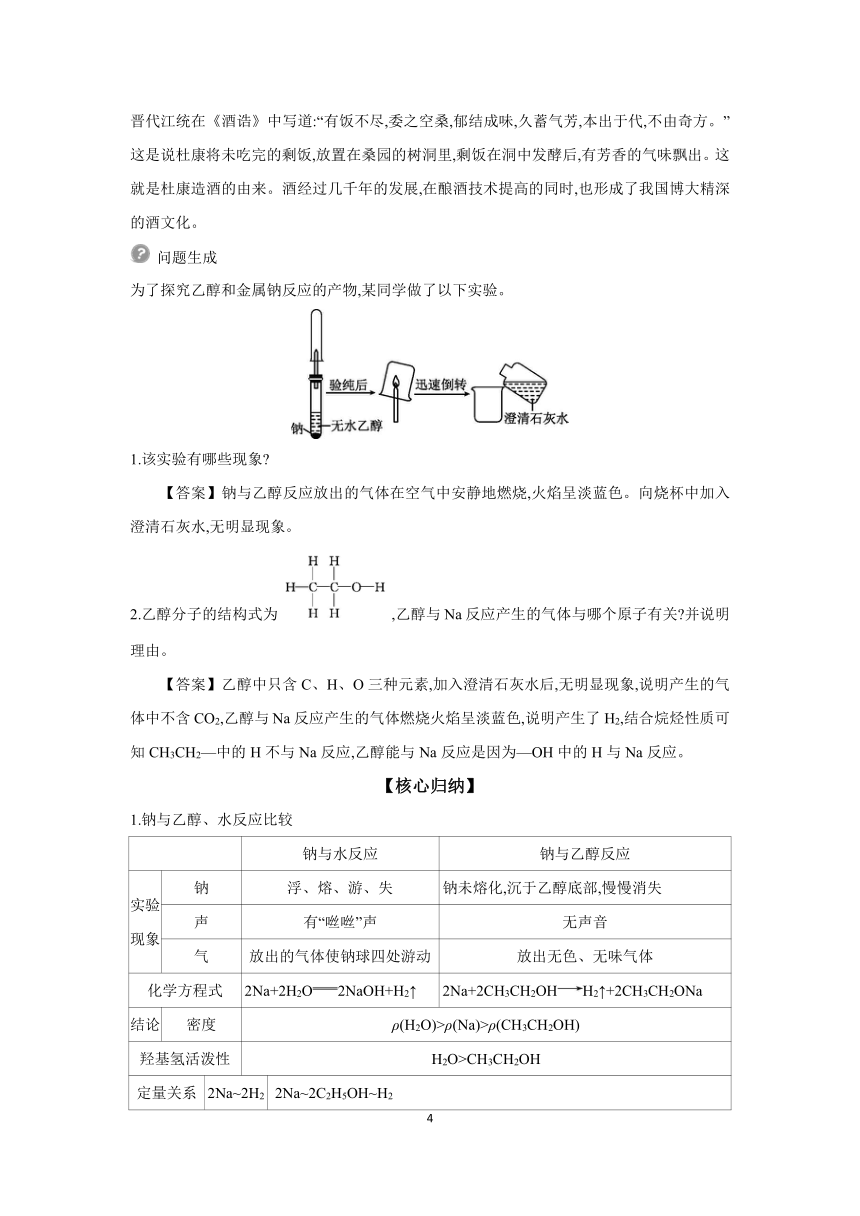
2.乙醇和钠的反应
实验 操作
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生 可燃性气体; ②烧杯内壁有 产生; ③向烧杯中加入澄清石灰水, 。
实验 结论 乙醇与钠反应生成H2,化学方程式为: 。
3.乙醇的用途
(1)乙醇可用作燃料。
(2)用于 行业、有机溶剂及化工原料。
(3)医疗上用 (体积分数)的乙醇溶液作 。
【答案】一、1.酒精 无色 液体 小 2.C2H6O
—OH CH3CH2OH C2H5OH
二、1.(1)淡蓝 2CO2
(2)红 刺激性 2CuO 2CH3CHO
(3)KMnO4 CH3COOH
2.无色 水珠 无明显现象 2CH3CH2OH+2Na2CH3CH2ONa+H2↑
3.(2)造酒 (3)75% 消毒剂
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)
(1)除去乙醇中微量水可加入金属钠,使其完全反应。 ( )
(2)乙醇结构中有—OH,所以乙醇溶于水可以电离出OH-而显碱性。 ( )
(3)乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性。 ( )
(4)乙醇与钠反应可以产生氢气,所以乙醇显酸性。 ( )
(5)乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中羟基上的氢原子活泼。 ( )
(6)乙醇在水溶液中能电离出少量的H+,所以乙醇是电解质。 ( )
(7)乙醇与O2发生不完全燃烧反应生成乙醛。 ( )
(8)乙醇分子中所有的氢原子都可被钠置换出来。 ( )
【答案】(1)× (2)× (3)× (4)× (5)√ (6)× (7)× (8)×
2.如何除去乙醇中含有的少量水
【答案】乙醇和水互溶,但是二者都是易挥发性物质,因此不能用直接蒸馏的方法将二者分离,一般加入生石灰,生石灰与水反应生成氢氧化钙,然后蒸馏。
3.交警利用乙醇能使橙色的酸性重铬酸钾变绿的性质,检查司机是否酒后驾车,试写出相关离子方程式。
【答案】3CH3CH2OH+2Cr2+16H+3CH3COOH+4Cr3++11H2O
【合作探究】
任务1 乙醇的结构
情境导入 古往今来,无数咏酒的故事和诗篇都证明了酒是一种奇特而富有魅力的饮品。晋代江统在《酒诰》中写道:“有饭不尽,委之空桑,郁结成味,久蓄气芳,本出于代,不由奇方。”这是说杜康将未吃完的剩饭,放置在桑园的树洞里,剩饭在洞中发酵后,有芳香的气味飘出。这就是杜康造酒的由来。酒经过几千年的发展,在酿酒技术提高的同时,也形成了我国博大精深的酒文化。
问题生成
为了探究乙醇和金属钠反应的产物,某同学做了以下实验。
1.该实验有哪些现象
【答案】钠与乙醇反应放出的气体在空气中安静地燃烧,火焰呈淡蓝色。向烧杯中加入澄清石灰水,无明显现象。
2.乙醇分子的结构式为,乙醇与Na反应产生的气体与哪个原子有关 并说明理由。
【答案】乙醇中只含C、H、O三种元素,加入澄清石灰水后,无明显现象,说明产生的气体中不含CO2,乙醇与Na反应产生的气体燃烧火焰呈淡蓝色,说明产生了H2,结合烷烃性质可知CH3CH2—中的H不与Na反应,乙醇能与Na反应是因为—OH中的H与Na反应。
【核心归纳】
1.钠与乙醇、水反应比较
钠与水反应 钠与乙醇反应
实验 现象 钠 浮、熔、游、失 钠未熔化,沉于乙醇底部,慢慢消失
声 有“咝咝”声 无声音
气 放出的气体使钠球四处游动 放出无色、无味气体
化学方程式 2Na+2H2O2NaOH+H2↑ 2Na+2CH3CH2OHH2↑+2CH3CH2ONa
结论 密度 ρ(H2O)>ρ(Na)>ρ(CH3CH2OH)
羟基氢活泼性 H2O>CH3CH2OH
定量关系 2Na~2H2O~H2 2Na~2C2H5OH~H2
2.乙醇与钠反应的拓展应用
(1)在乙醇分子里,被钠置换的氢原子是羟基中的氢原子,而不是乙基上的氢原子。由此,可以依据产生氢气的量来判断醇分子中的羟基的数目。
(2)除了Na外,K、Ca、Mg等活泼的金属也能置换出乙醇分子中羟基中的氢原子而生成H2,如2CH3CH2OH+Ca(CH3CH2O)2Ca+H2↑。
【典型例题】
【例1】 下列方法中可以证明乙醇分子中有一个氢原子与其他氢原子不同的是( )。
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇跟足量的Na充分反应得0.5 mol H2
D.1 mol乙醇可生成1 mol乙醛
【答案】C
【解析】A项,乙醇燃烧时,所有的氢原子均参与反应生成H2O,不符合题意;B项无法证明,不符合题意;C项,乙醇和足量钠反应,参与反应的氢原子占乙醇分子中氢原子总数的,说明其中一个氢原子与另外五个不同,符合题意;D项,乙醇氧化成乙醛时,O—H键虽参与反应,可C—H键也参与反应,无法证明其中一个氢原子的不同,不符合题意。
【例2】 关于乙醇的说法中正确的是( )。
A.乙醇结构中有—OH,所以乙醇溶于水可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
【答案】D
【解析】乙醇不能电离出氢氧根离子,—OH和OH-是完全不同的微粒,A项错误;乙醇燃烧发生的是氧化反应,乙醇的氧化反应表现的是乙醇的还原性,B项错误;乙醇含有羟基,可与钠反应生成氢气,乙醇为非电解质,不显酸性,C项错误;乙醇与钠反应比水与钠反应缓慢,说明乙醇分子中羟基上的氢原子不如水分子中的氢原子活泼,D项正确。
任务2 乙醇的催化氧化
情境导入 人们在喝酒过后,视觉能力变差,不能发现和正确领会交通信号、标志和标线,易发生事故。交警查酒驾的原理是利用驾驶员呼出气体。若有乙醇蒸气,则在乙醇被催化氧化成乙醛(或CO2)和水的过程中会释放出化学能,化学能经电化学装置转化为电能,可用电压表测量其电压。电压表示数越高,则乙醇浓度越高。
问题生成
1.乙醇的催化氧化反应中有无还原反应发生
【答案】乙醇催化氧化的同时,氧气被还原,发生还原反应。有机化学中的氧化还原反应仍是一个完整的氧化还原反应。
2.乙醇催化氧化实验中铜丝是否参加反应 铜丝的作用是什么
【答案】铜丝参与化学反应,铜丝先被氧气氧化为氧化铜,后又被乙醇还原为铜;反应前后铜丝的质量和化学性质不变,起到催化剂的作用。
【核心归纳】
乙醇的催化氧化反应
1.反应历程
2.反应实质
乙醇分子脱去羟基上的氢原子以及与羟基直接相连的碳原子上的氢原子形成碳氧双键,脱下的氢原子与氧化铜中的氧原子结合成水,使氧化铜变成铜。
3.总反应:2CH3CH2OH+O22CH3CHO+2H2O,反应中铜丝作催化剂。
4.醇的催化氧化反应规律
醇在有催化剂(铜或银)存在的条件下,可以发生催化氧化反应生成醛,但并不是所有的醇都能被氧化成醛。
(1)凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛:
2R—CH2OH+O22R—CHO+2H2O
(2)凡是含有结构的醇,在一定条件下也能被氧化,但生成物不是醛,而是酮()。
(3)凡是含有结构的醇,通常情况下不能被催化氧化。
【典型例题】
【例3】 某化学反应过程如图所示,由如图得出的下列判断错误的是( )。
A.乙醇发生了还原反应
B.反应中有“红→黑→红”颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
【答案】A
【解析】乙醇被氧化成乙醛,发生了氧化反应,A项错误;在反应中铜(红色)被氧气氧化为氧化铜(黑色),然后氧化铜又被乙醇还原为铜,因此反应中有“红→黑→红”颜色交替变化的现象,B项正确;根据以上分析可判断铜是此反应的催化剂,C项正确;根据以上分析可知生成物是乙醛,D项正确。
【例4】 乙醇能发生如下反应:
①CH3CH2OH+3O22CO2+3H2O;
②2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+H2O+Cu。
由以上反应不能得出的结论是( )。
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
【答案】D
【解析】由反应①可知,乙醇在氧气中燃烧生成CO2和H2O,由反应②可知乙醇与O2在铜作催化剂的条件下反应生成CH3CHO和H2O,条件不同,乙醇与O2反应的产物不同,A项正确;由反应②可知,Cu参与反应,但在反应前后质量和化学性质不变,是催化剂,B项正确;由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂,C项正确;由反应②可知,乙醇氧化为乙醛时,断开了氢氧键、碳氢键,D项错误。
【随堂检测】
1.下列有关乙醇的表述正确的是( )。
A.乙醇分子中含有甲基,甲基的电子式为H
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为H]-
D.乙醇分子的空间填充模型为
【答案】D
【解析】甲基的电子式为·H,A项错误;乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;羟基的电子式为·H,为中性基团,C项错误。
2.下列醇不能发生催化氧化的是( )。
A.CH3OH B. C. D.
【答案】C
【解析】醇的催化氧化断裂的化学键是O—H和连接羟基的碳原子上的C—H。C项中连接羟基的碳原子上没有C—H,故不能发生催化氧化。
3.有机物Ⅰ和Ⅱ的结构式如下,下列说法中不正确的是( )。
Ⅰ Ⅱ
A.Ⅰ和Ⅱ互为同分异构体
B.Ⅰ和Ⅱ的物理性质有所不同
C.Ⅰ和Ⅱ的化学性质相同
D.Ⅰ和Ⅱ含C的质量分数相同
【答案】C
【解析】Ⅰ和Ⅱ分子式相同、分子结构不同,互为同分异构体,同分异构体不仅物理性质有差异,化学性质也有差异。
4.饱和一元醇的通式为CnH2n+1OH,4.6 g某饱和一元醇与足量金属钠反应,得到1.12 L(标准状况)的氢气。则该饱和一元醇的分子式为( )。
A.CH3OH B.C2H5OH C.C3H7OH D.C4H9OH
【答案】B
【解析】注意该反应的比例关系:2 mol饱和一元醇与足量的钠反应可得1 mol H2。
设该饱和一元醇的摩尔质量为M。
2CnH2n+1OH+2Na2CnH2n+1ONa+H2↑
2M 22.4 L
4.6 g 1.12 L
解得:M=46 g· mol-1。该饱和一元醇的相对分子质量为46,由该饱和一元醇的通式CnH2n+1OH得等式:12n+2n+1+16+1=46,n=2。故该醇为C2H5OH。
2
【学习目标】
1.了解乙醇的组成、物理性质和主要应用。
2.掌握乙醇的化学性质,特别是乙醇的催化氧化。
3.掌握乙醇的分子结构特点,弄清结构与性质的关系。
4.能利用乙醇的主要性质进行物质鉴别。
【自主预习】
一、乙醇的物理性质与分子结构
1.物理性质
俗称 颜色 状态 气味
特殊香味
密度 溶解性(在水中) 挥发性
比水 能与水以任意比互溶 易挥发
2.分子结构
【微点拨】
乙醇是优良的有机溶剂,但不能用来萃取溴水、碘水中的Br2和I2。
二、乙醇的化学性质及用途
1.氧化反应
(1)燃烧现象:乙醇在空气中燃烧,产生 色火焰,放出大量的热。
化学方程式:C2H5OH+3O2 +3H2O。
(2)催化氧化
实验 操作
实验 现象 红色的铜丝变黑色变 色 试管中的液体有 气味
实验 原理 2Cu+O2 (铜丝变黑)
实验 结论 乙醇被氧化为乙醛,化学方程式为2CH3CH2OH+O2 +2H2O
【微点拨】铜在该反应中起催化剂的作用。
(3)被强氧化剂氧化
现象:乙醇能使酸性 溶液褪色。
结论:CH3CH2OH 。
2.乙醇和钠的反应
实验 操作
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生 可燃性气体; ②烧杯内壁有 产生; ③向烧杯中加入澄清石灰水, 。
实验 结论 乙醇与钠反应生成H2,化学方程式为: 。
3.乙醇的用途
(1)乙醇可用作燃料。
(2)用于 行业、有机溶剂及化工原料。
(3)医疗上用 (体积分数)的乙醇溶液作 。
【答案】一、1.酒精 无色 液体 小 2.C2H6O
—OH CH3CH2OH C2H5OH
二、1.(1)淡蓝 2CO2
(2)红 刺激性 2CuO 2CH3CHO
(3)KMnO4 CH3COOH
2.无色 水珠 无明显现象 2CH3CH2OH+2Na2CH3CH2ONa+H2↑
3.(2)造酒 (3)75% 消毒剂
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)
(1)除去乙醇中微量水可加入金属钠,使其完全反应。 ( )
(2)乙醇结构中有—OH,所以乙醇溶于水可以电离出OH-而显碱性。 ( )
(3)乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性。 ( )
(4)乙醇与钠反应可以产生氢气,所以乙醇显酸性。 ( )
(5)乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中羟基上的氢原子活泼。 ( )
(6)乙醇在水溶液中能电离出少量的H+,所以乙醇是电解质。 ( )
(7)乙醇与O2发生不完全燃烧反应生成乙醛。 ( )
(8)乙醇分子中所有的氢原子都可被钠置换出来。 ( )
【答案】(1)× (2)× (3)× (4)× (5)√ (6)× (7)× (8)×
2.如何除去乙醇中含有的少量水
【答案】乙醇和水互溶,但是二者都是易挥发性物质,因此不能用直接蒸馏的方法将二者分离,一般加入生石灰,生石灰与水反应生成氢氧化钙,然后蒸馏。
3.交警利用乙醇能使橙色的酸性重铬酸钾变绿的性质,检查司机是否酒后驾车,试写出相关离子方程式。
【答案】3CH3CH2OH+2Cr2+16H+3CH3COOH+4Cr3++11H2O
【合作探究】
任务1 乙醇的结构
情境导入 古往今来,无数咏酒的故事和诗篇都证明了酒是一种奇特而富有魅力的饮品。晋代江统在《酒诰》中写道:“有饭不尽,委之空桑,郁结成味,久蓄气芳,本出于代,不由奇方。”这是说杜康将未吃完的剩饭,放置在桑园的树洞里,剩饭在洞中发酵后,有芳香的气味飘出。这就是杜康造酒的由来。酒经过几千年的发展,在酿酒技术提高的同时,也形成了我国博大精深的酒文化。
问题生成
为了探究乙醇和金属钠反应的产物,某同学做了以下实验。
1.该实验有哪些现象
【答案】钠与乙醇反应放出的气体在空气中安静地燃烧,火焰呈淡蓝色。向烧杯中加入澄清石灰水,无明显现象。
2.乙醇分子的结构式为,乙醇与Na反应产生的气体与哪个原子有关 并说明理由。
【答案】乙醇中只含C、H、O三种元素,加入澄清石灰水后,无明显现象,说明产生的气体中不含CO2,乙醇与Na反应产生的气体燃烧火焰呈淡蓝色,说明产生了H2,结合烷烃性质可知CH3CH2—中的H不与Na反应,乙醇能与Na反应是因为—OH中的H与Na反应。
【核心归纳】
1.钠与乙醇、水反应比较
钠与水反应 钠与乙醇反应
实验 现象 钠 浮、熔、游、失 钠未熔化,沉于乙醇底部,慢慢消失
声 有“咝咝”声 无声音
气 放出的气体使钠球四处游动 放出无色、无味气体
化学方程式 2Na+2H2O2NaOH+H2↑ 2Na+2CH3CH2OHH2↑+2CH3CH2ONa
结论 密度 ρ(H2O)>ρ(Na)>ρ(CH3CH2OH)
羟基氢活泼性 H2O>CH3CH2OH
定量关系 2Na~2H2O~H2 2Na~2C2H5OH~H2
2.乙醇与钠反应的拓展应用
(1)在乙醇分子里,被钠置换的氢原子是羟基中的氢原子,而不是乙基上的氢原子。由此,可以依据产生氢气的量来判断醇分子中的羟基的数目。
(2)除了Na外,K、Ca、Mg等活泼的金属也能置换出乙醇分子中羟基中的氢原子而生成H2,如2CH3CH2OH+Ca(CH3CH2O)2Ca+H2↑。
【典型例题】
【例1】 下列方法中可以证明乙醇分子中有一个氢原子与其他氢原子不同的是( )。
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇跟足量的Na充分反应得0.5 mol H2
D.1 mol乙醇可生成1 mol乙醛
【答案】C
【解析】A项,乙醇燃烧时,所有的氢原子均参与反应生成H2O,不符合题意;B项无法证明,不符合题意;C项,乙醇和足量钠反应,参与反应的氢原子占乙醇分子中氢原子总数的,说明其中一个氢原子与另外五个不同,符合题意;D项,乙醇氧化成乙醛时,O—H键虽参与反应,可C—H键也参与反应,无法证明其中一个氢原子的不同,不符合题意。
【例2】 关于乙醇的说法中正确的是( )。
A.乙醇结构中有—OH,所以乙醇溶于水可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
【答案】D
【解析】乙醇不能电离出氢氧根离子,—OH和OH-是完全不同的微粒,A项错误;乙醇燃烧发生的是氧化反应,乙醇的氧化反应表现的是乙醇的还原性,B项错误;乙醇含有羟基,可与钠反应生成氢气,乙醇为非电解质,不显酸性,C项错误;乙醇与钠反应比水与钠反应缓慢,说明乙醇分子中羟基上的氢原子不如水分子中的氢原子活泼,D项正确。
任务2 乙醇的催化氧化
情境导入 人们在喝酒过后,视觉能力变差,不能发现和正确领会交通信号、标志和标线,易发生事故。交警查酒驾的原理是利用驾驶员呼出气体。若有乙醇蒸气,则在乙醇被催化氧化成乙醛(或CO2)和水的过程中会释放出化学能,化学能经电化学装置转化为电能,可用电压表测量其电压。电压表示数越高,则乙醇浓度越高。
问题生成
1.乙醇的催化氧化反应中有无还原反应发生
【答案】乙醇催化氧化的同时,氧气被还原,发生还原反应。有机化学中的氧化还原反应仍是一个完整的氧化还原反应。
2.乙醇催化氧化实验中铜丝是否参加反应 铜丝的作用是什么
【答案】铜丝参与化学反应,铜丝先被氧气氧化为氧化铜,后又被乙醇还原为铜;反应前后铜丝的质量和化学性质不变,起到催化剂的作用。
【核心归纳】
乙醇的催化氧化反应
1.反应历程
2.反应实质
乙醇分子脱去羟基上的氢原子以及与羟基直接相连的碳原子上的氢原子形成碳氧双键,脱下的氢原子与氧化铜中的氧原子结合成水,使氧化铜变成铜。
3.总反应:2CH3CH2OH+O22CH3CHO+2H2O,反应中铜丝作催化剂。
4.醇的催化氧化反应规律
醇在有催化剂(铜或银)存在的条件下,可以发生催化氧化反应生成醛,但并不是所有的醇都能被氧化成醛。
(1)凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛:
2R—CH2OH+O22R—CHO+2H2O
(2)凡是含有结构的醇,在一定条件下也能被氧化,但生成物不是醛,而是酮()。
(3)凡是含有结构的醇,通常情况下不能被催化氧化。
【典型例题】
【例3】 某化学反应过程如图所示,由如图得出的下列判断错误的是( )。
A.乙醇发生了还原反应
B.反应中有“红→黑→红”颜色交替变化的现象
C.铜是此反应的催化剂
D.生成物是乙醛
【答案】A
【解析】乙醇被氧化成乙醛,发生了氧化反应,A项错误;在反应中铜(红色)被氧气氧化为氧化铜(黑色),然后氧化铜又被乙醇还原为铜,因此反应中有“红→黑→红”颜色交替变化的现象,B项正确;根据以上分析可判断铜是此反应的催化剂,C项正确;根据以上分析可知生成物是乙醛,D项正确。
【例4】 乙醇能发生如下反应:
①CH3CH2OH+3O22CO2+3H2O;
②2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+H2O+Cu。
由以上反应不能得出的结论是( )。
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
【答案】D
【解析】由反应①可知,乙醇在氧气中燃烧生成CO2和H2O,由反应②可知乙醇与O2在铜作催化剂的条件下反应生成CH3CHO和H2O,条件不同,乙醇与O2反应的产物不同,A项正确;由反应②可知,Cu参与反应,但在反应前后质量和化学性质不变,是催化剂,B项正确;由反应①可知,乙醇燃烧时,碳碳键、碳氢键均断裂,C项正确;由反应②可知,乙醇氧化为乙醛时,断开了氢氧键、碳氢键,D项错误。
【随堂检测】
1.下列有关乙醇的表述正确的是( )。
A.乙醇分子中含有甲基,甲基的电子式为H
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为H]-
D.乙醇分子的空间填充模型为
【答案】D
【解析】甲基的电子式为·H,A项错误;乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;羟基的电子式为·H,为中性基团,C项错误。
2.下列醇不能发生催化氧化的是( )。
A.CH3OH B. C. D.
【答案】C
【解析】醇的催化氧化断裂的化学键是O—H和连接羟基的碳原子上的C—H。C项中连接羟基的碳原子上没有C—H,故不能发生催化氧化。
3.有机物Ⅰ和Ⅱ的结构式如下,下列说法中不正确的是( )。
Ⅰ Ⅱ
A.Ⅰ和Ⅱ互为同分异构体
B.Ⅰ和Ⅱ的物理性质有所不同
C.Ⅰ和Ⅱ的化学性质相同
D.Ⅰ和Ⅱ含C的质量分数相同
【答案】C
【解析】Ⅰ和Ⅱ分子式相同、分子结构不同,互为同分异构体,同分异构体不仅物理性质有差异,化学性质也有差异。
4.饱和一元醇的通式为CnH2n+1OH,4.6 g某饱和一元醇与足量金属钠反应,得到1.12 L(标准状况)的氢气。则该饱和一元醇的分子式为( )。
A.CH3OH B.C2H5OH C.C3H7OH D.C4H9OH
【答案】B
【解析】注意该反应的比例关系:2 mol饱和一元醇与足量的钠反应可得1 mol H2。
设该饱和一元醇的摩尔质量为M。
2CnH2n+1OH+2Na2CnH2n+1ONa+H2↑
2M 22.4 L
4.6 g 1.12 L
解得:M=46 g· mol-1。该饱和一元醇的相对分子质量为46,由该饱和一元醇的通式CnH2n+1OH得等式:12n+2n+1+16+1=46,n=2。故该醇为C2H5OH。
2
