1.2 第1课时 研究物质性质的基本方法 学案 (含答案)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 1.2 第1课时 研究物质性质的基本方法 学案 (含答案)2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 403.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览



文档简介
1.2 第1课时 研究物质性质的基本方法
【学习目标】
1.通过对金属钠的性质研究等一系列科学探究活动,认识钠是一种非常活泼的金属单质,了解钠的物理性质、主要化学性质。
2.通过观察、分析实验现象,体会怎样科学合理地运用观察方法。
3.通过对钠与氧气反应的实验探究,体会实验方法在化学研究中的作用,并认识实验过程中控制实验条件的重要性。
4.在归纳金属钠的性质过程中,体验分类、比较等研究方法在研究和学习物质性质过程中的重要应用。
5.激发学生学习化学的兴趣,使学生乐于探究物质变化的奥秘,同时树立安全意识和环保意识。
【自主预习】
一、研究物质性质的基本方法
1.研究物质的性质有 、 、 、 、假说、模型等方法。
2.观察法
(1)含义:观察是一种 、 地运用 考察研究对象的方法。
(2)常见观察法
①直接观察法
②间接观察法:借助一些仪器进行观察
二、观察法、实验法的应用——金属钠及其与水的反应
1.观察法认识钠的物理性质
操作 观察试剂瓶里面的钠 用 从装有 的试剂瓶中取出金属钠,用 吸干表面的煤油,在干燥的 上用 切下一小块金属钠,观察钠块的切面,剩余钠块放回原试剂瓶
结论 钠性质活泼,需隔绝空气和水保存,实验室中钠保存在煤油中 钠具有 金属光泽,质 ,硬度 ,密度比煤油 ,常温下是
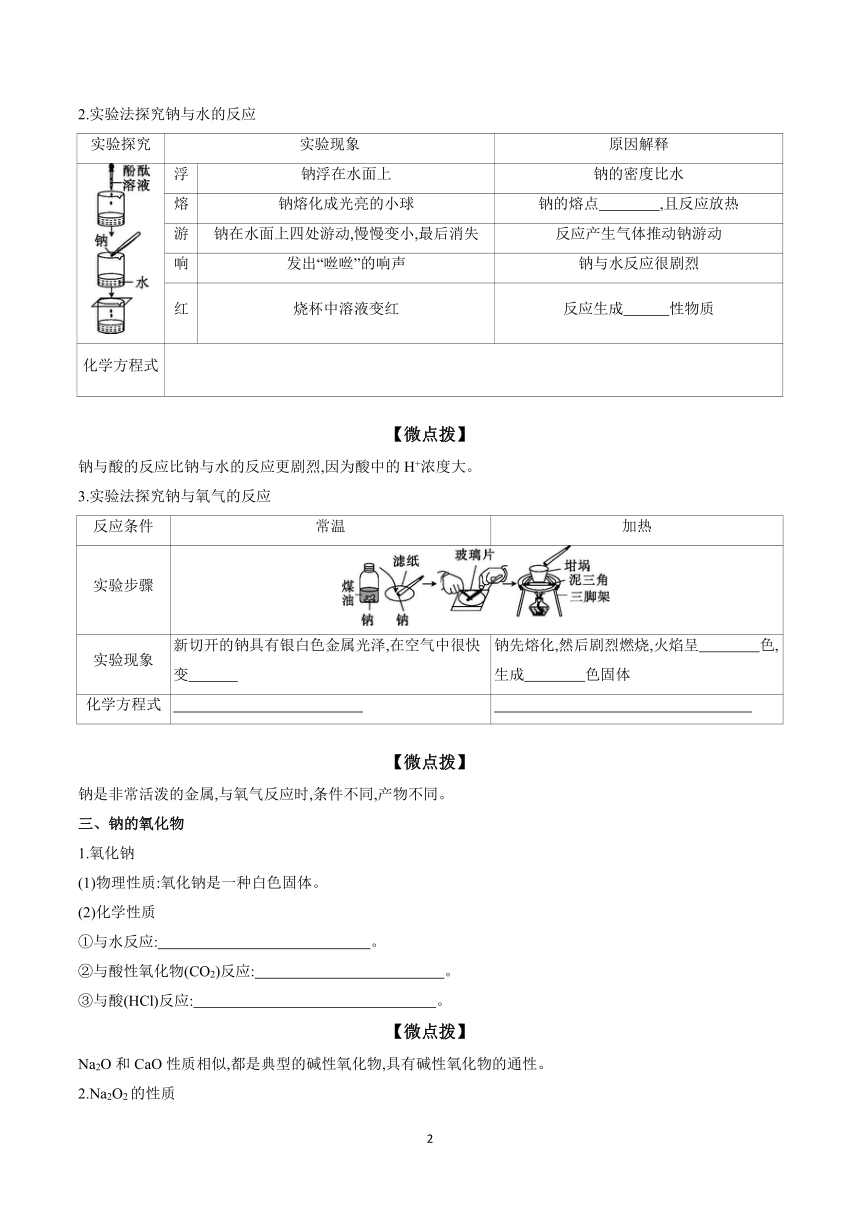
2.实验法探究钠与水的反应
实验探究 实验现象 原因解释
浮 钠浮在水面上 钠的密度比水
熔 钠熔化成光亮的小球 钠的熔点 ,且反应放热
游 钠在水面上四处游动,慢慢变小,最后消失 反应产生气体推动钠游动
响 发出“咝咝”的响声 钠与水反应很剧烈
红 烧杯中溶液变红 反应生成 性物质
化学方程式
【微点拨】
钠与酸的反应比钠与水的反应更剧烈,因为酸中的H+浓度大。
3.实验法探究钠与氧气的反应
反应条件 常温 加热
实验步骤
实验现象 新切开的钠具有银白色金属光泽,在空气中很快变 钠先熔化,然后剧烈燃烧,火焰呈 色,生成 色固体
化学方程式
【微点拨】
钠是非常活泼的金属,与氧气反应时,条件不同,产物不同。
三、钠的氧化物
1.氧化钠
(1)物理性质:氧化钠是一种白色固体。
(2)化学性质
①与水反应: 。
②与酸性氧化物(CO2)反应: 。
③与酸(HCl)反应: 。
【微点拨】
Na2O和CaO性质相似,都是典型的碱性氧化物,具有碱性氧化物的通性。
2.Na2O2的性质
(1)物理性质:是一种淡黄色固体粉末。
(2)化学性质
①Na2O2与H2O反应实验探究
化学方程式: 。
②Na2O2与CO2反应的化学方程式为 。
【微点拨】
(1)Na2O2不是碱性氧化物。
(2)Na2O2不但可以用作呼吸面具或潜水艇中的供氧剂。还可用作漂白剂,若向紫色石蕊溶液中加入Na2O2粉末,振荡后,除了观察到有气体产生外,还能观察到的现象是溶液先变蓝后褪色。
【参考答案】一、1.观察 实验 分类 比较 2.(1)有计划
有目的 感官
二、1.镊子 煤油 滤纸 玻璃片 小刀 银白色 软
小 大 固体 2.小 低 碱
2Na+2H2O 2NaOH+H2↑
3.暗 黄 淡黄 4Na+O2 2Na2O 2Na+O2 Na2O2
三、1.Na2O+H2O2NaOH Na2O+CO2Na2CO3 Na2O+2HCl2NaCl+H2O
2.2Na2O2+2H2O4NaOH+O2↑ 2Na2O2+2CO22Na2CO3+O2
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)实验中取出未用完的钠不能再放回原瓶。 ( )
(2)金属钠易与水反应,不能用手直接接触金属钠。 ( )
(3)金属钠能存放于煤油中,也可存放于CCl4中。 ( )
(4)钠投入酸中时,钠先与酸中的H+反应,当酸反应完时,再与水反应。 ( )
(5)Na2O和Na2O2中氧元素的化合价相同。 ( )
(6)过氧化钠与二氧化碳的反应是置换反应。 ( )
(7)Na2O和Na2O2与盐酸反应所观察到的现象相同。 ( )
(8)Na2O和Na2O2长期放置在空气中的最终产物相同。 ( )
【答案】(1)× (2)√ (3)× (4)√ (5)× (6)× (7)× (8)√
2.实验室用剩的钠如何处理,为什么
【答案】放回原瓶。钠单质比较贵,并且取用钠是在洁净干燥的表面皿上用小刀切下一小块,镊子、小刀、表面皿均未被污染,放回去不会造成污染,若将金属钠扔在废液缸里容易发生爆炸。
3.在灯芯上加一块钠,滴水就能点燃酒精灯,你知道为什么吗
【答案】钠与水反应放出大量热量,使温度达到酒精的着火点,从而酒精燃烧。
4.过氧化钠与水和二氧化碳反应都能产生氧气,根据这点性质,人们可以利用过氧化钠做什么
【答案】可以在呼吸面具或潜水艇中作为供氧剂。
【合作探究】
任务1:钠的化学性质
情境导入 某船员发现水上漂着一个铁桶,并将其打捞上船,打算清洗后使用,但当船员把盖子打开后,桶内冒起浓浓白烟,不小心接触桶内物质,双手立即感到剧烈疼痛,于是他又将其推入江里,一遇水,这个桶就爆炸了,水面可看到黄色火焰。消防队员找来一个较大的白色塑料桶,将打捞上岸的铁桶放入其中,并用煤油浸泡。
问题生成
1.根据你所掌握的知识,猜猜铁桶内物质可能是什么。
【答案】金属钠。
2.该铁桶遇水立刻爆炸的原因是什么
【答案】钠与水剧烈反应,放出大量的热并产生氢气而爆炸。
3.用煤油浸泡钠铁桶的灭火原理是什么
【答案】钠易与空气中的氧气、水等反应,而不与煤油反应,且密度比煤油大,故将钠放入煤油中隔绝空气。
4.钠单质暴露在空气中会不会有Na2O2生成
【答案】钠只有在加热条件下才会与O2反应生成Na2O2,故钠单质暴露在空气中不会有Na2O2生成。
5.金属钠与很稀的盐酸能否发生反应 写出钠与盐酸反应的化学方程式。
【答案】能。钠与酸反应的实质是钠与酸电离出的H+发生置换反应,反应十分剧烈,如2Na+2HCl2NaCl+H2↑。
6.如果金属钠是稍过量的,当盐酸反应完,金属钠会有剩余吗
【答案】金属钠不会有剩余,金属钠会继续和水反应。
7.在金属活动顺序表中,前面的金属可以从后面金属的盐溶液中置换出后面的金属。钾、钙、钠的单质可以从硫酸铜溶液中置换出铜吗 为什么
【答案】钾、钙、钠太活泼,将它们置于硫酸铜溶液中时,它们首先与水发生反应,因此不能从硫酸铜溶液中置换出铜。
【核心归纳】
1.钠与非金属单质的反应
2.钠与水、酸及盐溶液的反应规律
【典型例题】
【例1】已知金属锂的化学性质与金属钠相似。金属锂的密度是0.534 g·cm-3,煤油的密度是0.80 g·cm-3。下列有关金属锂的说法不正确的是( )。
A.自然界中不存在锂单质
B.在盛有煤油和水的烧杯中投入金属锂,金属锂在水层和煤油界面处发生反应
C.金属锂能与氧气、氯气、盐酸发生反应
D.金属锂与金属钠的性质有相似又有不同,体现了分类法和比较法在研究物质性质时的应用
【答案】B
【解析】由金属锂的化学性质与金属钠相似可知,锂是活泼金属,自然界不存在锂单质,A项正确;由金属锂、煤油及水的密度可知,煤油在上层,水在下层,金属锂会浮在煤油液面上而不会和水发生反应,B项错误;根据金属锂的化学性质与金属钠相似可知,金属锂能与氧气、氯气、盐酸发生反应,C项正确;金属锂与钠的性质有相似又有不同,可以用分类法和比较法来研究二者性质的异同,D项正确。
【例2】某同学按如图所示实验装置进行钠与水反应的实验,下列说法中正确的是( )。
A.打开右端软塞,将一小块金属钠加入煤油中,反应前片刻,钠的位置在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升进入长颈漏斗,b处有无色气体产生
D.若用酒精来代替煤油,可观察到相同的实验现象
【答案】C
【解析】钠的密度大于煤油的密度,所以会沉在煤油中,A项错误;钠的密度大于煤油的密度而小于水的密度,所以钠会
沉在煤油底部而漂浮在水面上,上下跳动,不可能在b处液面以下的水中反应,B项错误;钠和水反应生成NaOH和氢气,生成的氢气导致左端液面上升,进入长颈漏斗,b处有无色气体产生,C项正确;乙醇和水互溶,所以不会出现相同的实验现象,D项错误。
灵犀一点:金属钠与可溶性盐溶液反应的思维模板
任务2:钠的氧化物的性质
情境导入
1.滴水生火:把用脱脂棉(特殊处理,易燃烧)包裹的过氧化钠放入蒸发皿中,向其中滴入几滴水,脱脂棉剧烈燃烧。
2.吹气生火:把用脱脂棉包裹的过氧化钠放入蒸发皿中,用长玻璃管对着脱脂棉用力吹气,脱脂棉剧烈燃烧。
问题生成
1.“滴水生火”的化学原理是什么 请用化学方程式和必要文字解释。
【答案】过氧化钠与水反应生成氢氧化钠和氧气,同时放出大量的热,使温度达到脱脂棉的着火点,从而使脱脂棉剧烈燃烧;反应的化学方程式为2Na2O2+2H2O4NaOH+O2↑。
2.“吹气生火”的化学原理是什么 请用化学方程式和必要文字解释。
【答案】人呼出的气体中含有水蒸气和二氧化碳,二者均能和过氧化钠反应生成氧气,并放出大量的热,使温度达到脱脂棉的着火点,从而使脱脂棉剧烈燃烧。过氧化钠与二氧化碳反应的化学方程式为2Na2O2+2CO22Na2CO3+O2。
3.过氧化钠是碱性氧化物吗 过氧化钠与盐酸反应的产物是什么 请写出反应的化学方程式。
【答案】不是,因为过氧化钠与酸反应的产物除了钠盐和水外,还有氧气。过氧化钠先与水反应生成氢氧化钠,NaOH再和盐酸反应,总化学方程式为2Na2O2+4HCl4NaCl+2H2O+O2↑。
4.根据这两个“生火魔术”,人们可以利用过氧化钠做什么
【答案】过氧化钠可以作呼吸面具、潜水艇、航天飞船的供氧剂。
【核心归纳】
1.钠露置于空气中的变化
金属钠长期露置于空气中最终完全转变为Na2CO3粉末,此过程中的主要变化与现象:
主要变化的化学方程式为:
①4Na+O22Na2O
②Na2O+H2O2NaOH
④2NaOH+CO2Na2CO3+H2O,
Na2CO3+10H2ONa2CO3·10H2O
⑤Na2CO3·10H2ONa2CO3+10H2O
2.氧化钠与过氧化钠的比较
项目 氧化钠 过氧化钠
化学式 Na2O Na2O2
颜色 白色 淡黄色
状态 固体 固体
氧元素的化合价 -2 -1
生成条件 常温下缓慢氧化 加热
热稳定性 不稳定,易转化为Na2O2 较稳定
与H2O反应 Na2O+H2O2NaOH 2Na2O2+2H2O4NaOH+O2↑
与CO2反应 Na2O+CO2Na2CO3 2Na2O2+2CO22Na2CO3+O2
主要用途 用于制取Na2CO3 强氧化剂、漂白剂、供氧剂
转化 2Na2O+O22Na2O2
3.Na2O2与CO2、H2O反应的量的关系
(1)分子数的关系
无论是CO2或H2O或二者的混合物,通过足量的Na2O2时,放出O2的分子数与CO2或H2O或CO2和H2O的混合物的分子数之比均为1∶2。
(2)固体质量关系
分析反应的化学方程式,可得下列关系式:
Na2O2Na2CO3(组成相当于Na2O2·CO)
Na2O2NaOH(组成相当于Na2O2·H2)
①与CO2反应时,固体增加的质量等于与消耗的CO2等分子数的CO的质量。
②与H2O反应时,固体增加的质量等于与消耗的H2O等分子数的H2的质量。
【典型例题】
【例3】下列反应中,反应条件与反应物用量改变时不影响其反应产物的是( )。
A.Na+O2 B.C+O2
C.CO2+Ca(OH)2 D.Na2O2+CO2
【答案】D
【解析】A项,钠和氧气在常温下反应生成氧化钠,加热时生成过氧化钠;B项,碳和少量氧气反应生成一氧化碳,和过量氧气反应生成二氧化碳;C项,氢氧化钙与少量二氧化碳反应生成碳酸钙和水,与过量二氧化碳反应生成碳酸氢钙;D项,过氧化钠与二氧化碳反应生成碳酸钠和氧气,生成物与反应的条件和反应物用量无关。
【例4】下列有关钠及其化合物化学性质的化学方程式的书写或说法正确的是( )。
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2Na2O
B.将Na块放入水中,产生气体:2Na+2H2O2NaOH+H2↑
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO22Na2CO3+O2
D.利用加热法可除去Na2O中少量的Na2O2杂质
【答案】B
【解析】切开的金属Na暴露在空气中,光亮表面逐渐变暗,是由于钠与空气中的氧气反应生成氧化钠,反应的化学方程式为4Na+O22Na2O,A项错误;将Na块放入水中,钠与水发生置换反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O2NaOH+H2↑,B项正确;Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物,是因为发生反应:2Na2O2+2CO22Na2CO3+O2↑、2Na2O2+2H2O4NaOH+O2↑,C项错误;加热时Na2O与O2反应生成Na2O2,无法除去Na2O中少量的Na2O2杂质,D项错误。
【随堂检测】
1.下列关于金属钠的描述中,不正确的是( )。
A.有银白色金属光泽
B.在空气中燃烧只生成氧化钠
C.能与水反应
D.在空气中燃烧发出黄色火焰
【答案】B
【解析】钠在空气中燃烧,生成淡黄色的过氧化钠,B项不正确。
2.将Na2O2投入FeCl3溶液中,可观察到的现象是( )。
①生成白色沉淀 ②生成红褐色沉淀 ③有气泡产生 ④因为Na2O2具有漂白性,所以FeCl3溶液褪色
A.①④ B.②③ C.①③ D.仅②
【答案】B
【解析】将Na2O2投入FeCl3溶液中,Na2O2与水反应得到O2和NaOH,NaOH与FeCl3溶液反应生成红褐色沉淀。
3.(创新题)如图所示装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将出现的现象是( )。
A.U形管内红水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位:d【答案】C
【解析】Na2O2和H2O发生反应:2Na2O2+2H2O4NaOH+O2↑,生成的O2使气球膨胀,该反应放出大量的热,使广口瓶中空气受热膨胀而出现U形管中水位:d>c。
4.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融)2Na+Cl2↑。回答下列问题:
(1)保存金属钠的正确方法是 (填字母)。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式: ,生成物的颜色为 。
(3)Na、NaOH久置在空气中最终都是变为 (填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为 。
【答案】(1)D
(2)2Na+O2Na2O2 淡黄色
(3)Na2CO3
(4)2Na+CuCl2+2H2OCu(OH)2↓+H2↑+2NaCl
【解析】(1)钠是很活泼的金属元素,其单质易与水或氧气反应,又因为钠的密度小于水而大于煤油,因此钠通常保存在煤油中。(2)将一小块钠放在水平放置的试管中部,加热,反应的化学方程式为2Na+O2Na2O2。过氧化钠为淡黄色固体。(3)Na、NaOH久置在空气中最终都是变为碳酸钠,化学式为Na2CO3。(4)将一小块金属钠投入CuCl2溶液中,首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化铜发生复分解反应,反应的化学方程式为2Na+CuCl2+2H2OCu(OH)2↓+H2↑+2NaCl。
2
【学习目标】
1.通过对金属钠的性质研究等一系列科学探究活动,认识钠是一种非常活泼的金属单质,了解钠的物理性质、主要化学性质。
2.通过观察、分析实验现象,体会怎样科学合理地运用观察方法。
3.通过对钠与氧气反应的实验探究,体会实验方法在化学研究中的作用,并认识实验过程中控制实验条件的重要性。
4.在归纳金属钠的性质过程中,体验分类、比较等研究方法在研究和学习物质性质过程中的重要应用。
5.激发学生学习化学的兴趣,使学生乐于探究物质变化的奥秘,同时树立安全意识和环保意识。
【自主预习】
一、研究物质性质的基本方法
1.研究物质的性质有 、 、 、 、假说、模型等方法。
2.观察法
(1)含义:观察是一种 、 地运用 考察研究对象的方法。
(2)常见观察法
①直接观察法
②间接观察法:借助一些仪器进行观察
二、观察法、实验法的应用——金属钠及其与水的反应
1.观察法认识钠的物理性质
操作 观察试剂瓶里面的钠 用 从装有 的试剂瓶中取出金属钠,用 吸干表面的煤油,在干燥的 上用 切下一小块金属钠,观察钠块的切面,剩余钠块放回原试剂瓶
结论 钠性质活泼,需隔绝空气和水保存,实验室中钠保存在煤油中 钠具有 金属光泽,质 ,硬度 ,密度比煤油 ,常温下是
2.实验法探究钠与水的反应
实验探究 实验现象 原因解释
浮 钠浮在水面上 钠的密度比水
熔 钠熔化成光亮的小球 钠的熔点 ,且反应放热
游 钠在水面上四处游动,慢慢变小,最后消失 反应产生气体推动钠游动
响 发出“咝咝”的响声 钠与水反应很剧烈
红 烧杯中溶液变红 反应生成 性物质
化学方程式
【微点拨】
钠与酸的反应比钠与水的反应更剧烈,因为酸中的H+浓度大。
3.实验法探究钠与氧气的反应
反应条件 常温 加热
实验步骤
实验现象 新切开的钠具有银白色金属光泽,在空气中很快变 钠先熔化,然后剧烈燃烧,火焰呈 色,生成 色固体
化学方程式
【微点拨】
钠是非常活泼的金属,与氧气反应时,条件不同,产物不同。
三、钠的氧化物
1.氧化钠
(1)物理性质:氧化钠是一种白色固体。
(2)化学性质
①与水反应: 。
②与酸性氧化物(CO2)反应: 。
③与酸(HCl)反应: 。
【微点拨】
Na2O和CaO性质相似,都是典型的碱性氧化物,具有碱性氧化物的通性。
2.Na2O2的性质
(1)物理性质:是一种淡黄色固体粉末。
(2)化学性质
①Na2O2与H2O反应实验探究
化学方程式: 。
②Na2O2与CO2反应的化学方程式为 。
【微点拨】
(1)Na2O2不是碱性氧化物。
(2)Na2O2不但可以用作呼吸面具或潜水艇中的供氧剂。还可用作漂白剂,若向紫色石蕊溶液中加入Na2O2粉末,振荡后,除了观察到有气体产生外,还能观察到的现象是溶液先变蓝后褪色。
【参考答案】一、1.观察 实验 分类 比较 2.(1)有计划
有目的 感官
二、1.镊子 煤油 滤纸 玻璃片 小刀 银白色 软
小 大 固体 2.小 低 碱
2Na+2H2O 2NaOH+H2↑
3.暗 黄 淡黄 4Na+O2 2Na2O 2Na+O2 Na2O2
三、1.Na2O+H2O2NaOH Na2O+CO2Na2CO3 Na2O+2HCl2NaCl+H2O
2.2Na2O2+2H2O4NaOH+O2↑ 2Na2O2+2CO22Na2CO3+O2
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)实验中取出未用完的钠不能再放回原瓶。 ( )
(2)金属钠易与水反应,不能用手直接接触金属钠。 ( )
(3)金属钠能存放于煤油中,也可存放于CCl4中。 ( )
(4)钠投入酸中时,钠先与酸中的H+反应,当酸反应完时,再与水反应。 ( )
(5)Na2O和Na2O2中氧元素的化合价相同。 ( )
(6)过氧化钠与二氧化碳的反应是置换反应。 ( )
(7)Na2O和Na2O2与盐酸反应所观察到的现象相同。 ( )
(8)Na2O和Na2O2长期放置在空气中的最终产物相同。 ( )
【答案】(1)× (2)√ (3)× (4)√ (5)× (6)× (7)× (8)√
2.实验室用剩的钠如何处理,为什么
【答案】放回原瓶。钠单质比较贵,并且取用钠是在洁净干燥的表面皿上用小刀切下一小块,镊子、小刀、表面皿均未被污染,放回去不会造成污染,若将金属钠扔在废液缸里容易发生爆炸。
3.在灯芯上加一块钠,滴水就能点燃酒精灯,你知道为什么吗
【答案】钠与水反应放出大量热量,使温度达到酒精的着火点,从而酒精燃烧。
4.过氧化钠与水和二氧化碳反应都能产生氧气,根据这点性质,人们可以利用过氧化钠做什么
【答案】可以在呼吸面具或潜水艇中作为供氧剂。
【合作探究】
任务1:钠的化学性质
情境导入 某船员发现水上漂着一个铁桶,并将其打捞上船,打算清洗后使用,但当船员把盖子打开后,桶内冒起浓浓白烟,不小心接触桶内物质,双手立即感到剧烈疼痛,于是他又将其推入江里,一遇水,这个桶就爆炸了,水面可看到黄色火焰。消防队员找来一个较大的白色塑料桶,将打捞上岸的铁桶放入其中,并用煤油浸泡。
问题生成
1.根据你所掌握的知识,猜猜铁桶内物质可能是什么。
【答案】金属钠。
2.该铁桶遇水立刻爆炸的原因是什么
【答案】钠与水剧烈反应,放出大量的热并产生氢气而爆炸。
3.用煤油浸泡钠铁桶的灭火原理是什么
【答案】钠易与空气中的氧气、水等反应,而不与煤油反应,且密度比煤油大,故将钠放入煤油中隔绝空气。
4.钠单质暴露在空气中会不会有Na2O2生成
【答案】钠只有在加热条件下才会与O2反应生成Na2O2,故钠单质暴露在空气中不会有Na2O2生成。
5.金属钠与很稀的盐酸能否发生反应 写出钠与盐酸反应的化学方程式。
【答案】能。钠与酸反应的实质是钠与酸电离出的H+发生置换反应,反应十分剧烈,如2Na+2HCl2NaCl+H2↑。
6.如果金属钠是稍过量的,当盐酸反应完,金属钠会有剩余吗
【答案】金属钠不会有剩余,金属钠会继续和水反应。
7.在金属活动顺序表中,前面的金属可以从后面金属的盐溶液中置换出后面的金属。钾、钙、钠的单质可以从硫酸铜溶液中置换出铜吗 为什么
【答案】钾、钙、钠太活泼,将它们置于硫酸铜溶液中时,它们首先与水发生反应,因此不能从硫酸铜溶液中置换出铜。
【核心归纳】
1.钠与非金属单质的反应
2.钠与水、酸及盐溶液的反应规律
【典型例题】
【例1】已知金属锂的化学性质与金属钠相似。金属锂的密度是0.534 g·cm-3,煤油的密度是0.80 g·cm-3。下列有关金属锂的说法不正确的是( )。
A.自然界中不存在锂单质
B.在盛有煤油和水的烧杯中投入金属锂,金属锂在水层和煤油界面处发生反应
C.金属锂能与氧气、氯气、盐酸发生反应
D.金属锂与金属钠的性质有相似又有不同,体现了分类法和比较法在研究物质性质时的应用
【答案】B
【解析】由金属锂的化学性质与金属钠相似可知,锂是活泼金属,自然界不存在锂单质,A项正确;由金属锂、煤油及水的密度可知,煤油在上层,水在下层,金属锂会浮在煤油液面上而不会和水发生反应,B项错误;根据金属锂的化学性质与金属钠相似可知,金属锂能与氧气、氯气、盐酸发生反应,C项正确;金属锂与钠的性质有相似又有不同,可以用分类法和比较法来研究二者性质的异同,D项正确。
【例2】某同学按如图所示实验装置进行钠与水反应的实验,下列说法中正确的是( )。
A.打开右端软塞,将一小块金属钠加入煤油中,反应前片刻,钠的位置在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升进入长颈漏斗,b处有无色气体产生
D.若用酒精来代替煤油,可观察到相同的实验现象
【答案】C
【解析】钠的密度大于煤油的密度,所以会沉在煤油中,A项错误;钠的密度大于煤油的密度而小于水的密度,所以钠会
沉在煤油底部而漂浮在水面上,上下跳动,不可能在b处液面以下的水中反应,B项错误;钠和水反应生成NaOH和氢气,生成的氢气导致左端液面上升,进入长颈漏斗,b处有无色气体产生,C项正确;乙醇和水互溶,所以不会出现相同的实验现象,D项错误。
灵犀一点:金属钠与可溶性盐溶液反应的思维模板
任务2:钠的氧化物的性质
情境导入
1.滴水生火:把用脱脂棉(特殊处理,易燃烧)包裹的过氧化钠放入蒸发皿中,向其中滴入几滴水,脱脂棉剧烈燃烧。
2.吹气生火:把用脱脂棉包裹的过氧化钠放入蒸发皿中,用长玻璃管对着脱脂棉用力吹气,脱脂棉剧烈燃烧。
问题生成
1.“滴水生火”的化学原理是什么 请用化学方程式和必要文字解释。
【答案】过氧化钠与水反应生成氢氧化钠和氧气,同时放出大量的热,使温度达到脱脂棉的着火点,从而使脱脂棉剧烈燃烧;反应的化学方程式为2Na2O2+2H2O4NaOH+O2↑。
2.“吹气生火”的化学原理是什么 请用化学方程式和必要文字解释。
【答案】人呼出的气体中含有水蒸气和二氧化碳,二者均能和过氧化钠反应生成氧气,并放出大量的热,使温度达到脱脂棉的着火点,从而使脱脂棉剧烈燃烧。过氧化钠与二氧化碳反应的化学方程式为2Na2O2+2CO22Na2CO3+O2。
3.过氧化钠是碱性氧化物吗 过氧化钠与盐酸反应的产物是什么 请写出反应的化学方程式。
【答案】不是,因为过氧化钠与酸反应的产物除了钠盐和水外,还有氧气。过氧化钠先与水反应生成氢氧化钠,NaOH再和盐酸反应,总化学方程式为2Na2O2+4HCl4NaCl+2H2O+O2↑。
4.根据这两个“生火魔术”,人们可以利用过氧化钠做什么
【答案】过氧化钠可以作呼吸面具、潜水艇、航天飞船的供氧剂。
【核心归纳】
1.钠露置于空气中的变化
金属钠长期露置于空气中最终完全转变为Na2CO3粉末,此过程中的主要变化与现象:
主要变化的化学方程式为:
①4Na+O22Na2O
②Na2O+H2O2NaOH
④2NaOH+CO2Na2CO3+H2O,
Na2CO3+10H2ONa2CO3·10H2O
⑤Na2CO3·10H2ONa2CO3+10H2O
2.氧化钠与过氧化钠的比较
项目 氧化钠 过氧化钠
化学式 Na2O Na2O2
颜色 白色 淡黄色
状态 固体 固体
氧元素的化合价 -2 -1
生成条件 常温下缓慢氧化 加热
热稳定性 不稳定,易转化为Na2O2 较稳定
与H2O反应 Na2O+H2O2NaOH 2Na2O2+2H2O4NaOH+O2↑
与CO2反应 Na2O+CO2Na2CO3 2Na2O2+2CO22Na2CO3+O2
主要用途 用于制取Na2CO3 强氧化剂、漂白剂、供氧剂
转化 2Na2O+O22Na2O2
3.Na2O2与CO2、H2O反应的量的关系
(1)分子数的关系
无论是CO2或H2O或二者的混合物,通过足量的Na2O2时,放出O2的分子数与CO2或H2O或CO2和H2O的混合物的分子数之比均为1∶2。
(2)固体质量关系
分析反应的化学方程式,可得下列关系式:
Na2O2Na2CO3(组成相当于Na2O2·CO)
Na2O2NaOH(组成相当于Na2O2·H2)
①与CO2反应时,固体增加的质量等于与消耗的CO2等分子数的CO的质量。
②与H2O反应时,固体增加的质量等于与消耗的H2O等分子数的H2的质量。
【典型例题】
【例3】下列反应中,反应条件与反应物用量改变时不影响其反应产物的是( )。
A.Na+O2 B.C+O2
C.CO2+Ca(OH)2 D.Na2O2+CO2
【答案】D
【解析】A项,钠和氧气在常温下反应生成氧化钠,加热时生成过氧化钠;B项,碳和少量氧气反应生成一氧化碳,和过量氧气反应生成二氧化碳;C项,氢氧化钙与少量二氧化碳反应生成碳酸钙和水,与过量二氧化碳反应生成碳酸氢钙;D项,过氧化钠与二氧化碳反应生成碳酸钠和氧气,生成物与反应的条件和反应物用量无关。
【例4】下列有关钠及其化合物化学性质的化学方程式的书写或说法正确的是( )。
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2Na2O
B.将Na块放入水中,产生气体:2Na+2H2O2NaOH+H2↑
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO22Na2CO3+O2
D.利用加热法可除去Na2O中少量的Na2O2杂质
【答案】B
【解析】切开的金属Na暴露在空气中,光亮表面逐渐变暗,是由于钠与空气中的氧气反应生成氧化钠,反应的化学方程式为4Na+O22Na2O,A项错误;将Na块放入水中,钠与水发生置换反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O2NaOH+H2↑,B项正确;Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物,是因为发生反应:2Na2O2+2CO22Na2CO3+O2↑、2Na2O2+2H2O4NaOH+O2↑,C项错误;加热时Na2O与O2反应生成Na2O2,无法除去Na2O中少量的Na2O2杂质,D项错误。
【随堂检测】
1.下列关于金属钠的描述中,不正确的是( )。
A.有银白色金属光泽
B.在空气中燃烧只生成氧化钠
C.能与水反应
D.在空气中燃烧发出黄色火焰
【答案】B
【解析】钠在空气中燃烧,生成淡黄色的过氧化钠,B项不正确。
2.将Na2O2投入FeCl3溶液中,可观察到的现象是( )。
①生成白色沉淀 ②生成红褐色沉淀 ③有气泡产生 ④因为Na2O2具有漂白性,所以FeCl3溶液褪色
A.①④ B.②③ C.①③ D.仅②
【答案】B
【解析】将Na2O2投入FeCl3溶液中,Na2O2与水反应得到O2和NaOH,NaOH与FeCl3溶液反应生成红褐色沉淀。
3.(创新题)如图所示装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将出现的现象是( )。
A.U形管内红水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位:d
【解析】Na2O2和H2O发生反应:2Na2O2+2H2O4NaOH+O2↑,生成的O2使气球膨胀,该反应放出大量的热,使广口瓶中空气受热膨胀而出现U形管中水位:d>c。
4.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融)2Na+Cl2↑。回答下列问题:
(1)保存金属钠的正确方法是 (填字母)。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式: ,生成物的颜色为 。
(3)Na、NaOH久置在空气中最终都是变为 (填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为 。
【答案】(1)D
(2)2Na+O2Na2O2 淡黄色
(3)Na2CO3
(4)2Na+CuCl2+2H2OCu(OH)2↓+H2↑+2NaCl
【解析】(1)钠是很活泼的金属元素,其单质易与水或氧气反应,又因为钠的密度小于水而大于煤油,因此钠通常保存在煤油中。(2)将一小块钠放在水平放置的试管中部,加热,反应的化学方程式为2Na+O2Na2O2。过氧化钠为淡黄色固体。(3)Na、NaOH久置在空气中最终都是变为碳酸钠,化学式为Na2CO3。(4)将一小块金属钠投入CuCl2溶液中,首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化铜发生复分解反应,反应的化学方程式为2Na+CuCl2+2H2OCu(OH)2↓+H2↑+2NaCl。
2
