1.3 第2课时 气体摩尔体积 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 1.3 第2课时 气体摩尔体积 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 185.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览




文档简介
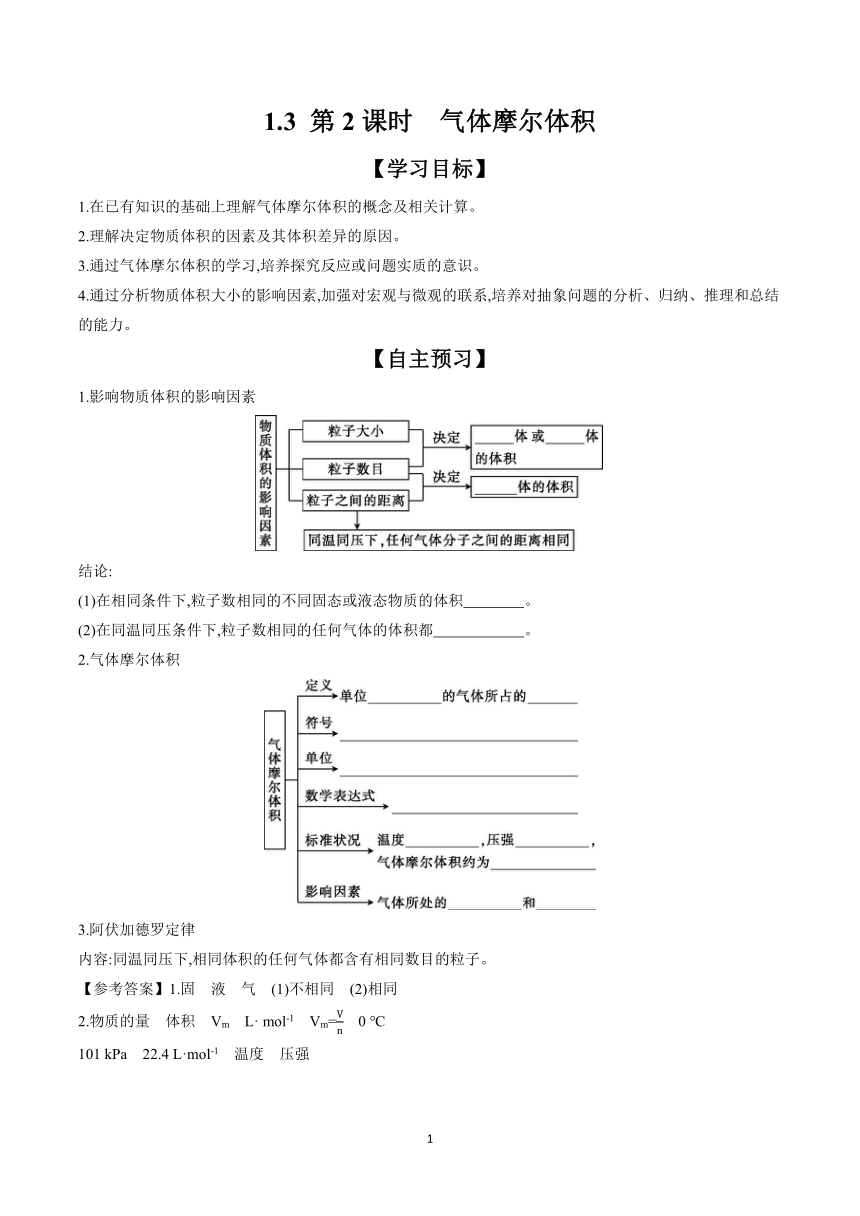
1.3 第2课时 气体摩尔体积
【学习目标】
1.在已有知识的基础上理解气体摩尔体积的概念及相关计算。
2.理解决定物质体积的因素及其体积差异的原因。
3.通过气体摩尔体积的学习,培养探究反应或问题实质的意识。
4.通过分析物质体积大小的影响因素,加强对宏观与微观的联系,培养对抽象问题的分析、归纳、推理和总结的能力。
【自主预习】
1.影响物质体积的影响因素
结论:
(1)在相同条件下,粒子数相同的不同固态或液态物质的体积 。
(2)在同温同压条件下,粒子数相同的任何气体的体积都 。
2.气体摩尔体积
3.阿伏加德罗定律
内容:同温同压下,相同体积的任何气体都含有相同数目的粒子。
【参考答案】1.固 液 气 (1)不相同 (2)相同
2.物质的量 体积 Vm L· mol-1 Vm= 0 ℃
101 kPa 22.4 L·mol-1 温度 压强
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)在标准状况下,1 mol O2与1 mol H2O的体积相同。 ( )
(2)在标准状况下,1 mol气体的体积约是22.4 L,在非标准状况下,1 mol气体的体积则一定不是22.4 L。 ( )
(3)同温同压下,等体积的两种气体单质一定具有相同的原子数。 ( )
(4)标准状况下,氢气的气体摩尔体积为22.4 L。 ( )
(5)同温同体积条件下,等质量的SO2和O2对应的压强之比为1∶2。 ( )
(6)在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同。 ( )
【答案】(1)× (2)× (3)× (4)× (5)√ (6)√
2.32 g O2在标准状况下的体积是多少 含有氧原子多少个
【答案】22.4 L;2NA。
3.标准状况下,22.4 L N2含有多少个氮气分子 质量是多少克
【答案】NA;28 g。
【合作探究】
任务1:气体摩尔体积
情境导入
1.气球在挤压下体积容易变小,而铅球在挤压下体积很难发生变化,那么,决定物质体积大小的因素有哪些
2.固体、液体、气体微观粒子示意图:
3.标准状况下气体摩尔体积示意图如下:
问题生成
1.对比固体和液体的微观粒子示意图,想一想:
(1)影响固体和液体物质体积的主要因素是什么 为什么
(2)气体的体积主要取决于哪些因素 为什么
【答案】(1)固体和液体的体积主要与粒子的大小和数目有关,因为固体和液体粒子间的间距很小,可以忽略不计。
(2)决定气体体积的主要因素是粒子数目和粒子间距。因为气体分子间的间距很大,气体粒子的大小可以忽略不计。
2.(1)如何改变粒子之间的距离
(2)描述气体体积要注意哪些问题
(3)在相同的温度和压强下,相同体积的任何气体的分子数是否相同 为什么
【答案】(1)升高(降低)温度或减小(增大)压强可以增大(减小)粒子间的距离。
(2)气体的体积与温度、压强有关,描述气体的体积时要指明温度和压强。
(3)相同。因为相同的温度和压强下,气体分子间的间距相同。
3.若1 mol某气体的体积为22.4 L,则该气体所处的状况一定是标准状况吗 为什么
【答案】不一定。气体体积受温度和压强的影响,因此1 mol气体体积为22.4 L时的状态可以是温度高于0 ℃、压强高于101 kPa或温度低于0 ℃、压强低于101 kPa。
4.标准状况下,1 mol任何物质的体积都约为22.4 L吗
【答案】不是。在标准状况下,1 mol气体的体积约为22.4 L,而1 mol固体或液体的体积均不是22.4 L。
5.气体摩尔体积的适用范围是气体,是否必须为纯净的气体
【答案】不是。气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,但混合气体中气体之间不能发生化学反应。如标准状况下,0.2 mol H2和0.8 mol O2组成的混合气体的体积约为22.4 L。
【核心归纳】
1.气体摩尔体积
(1)对于气体来说,在常温常压下,分子之间的平均距离比分子直径大得多,因此一定量的气体体积的大小主要取决于气体分子之间的平均距离。
(2)在相同的温度和压强下,1 mol任何气体含有的分子数都相同,分子之间的平均距离也近似相等,所以它们的体积基本相同。
(3)气体摩尔体积的适用范围是气体。可以是单一气体,也可为相互之间不反应的混合气体。
(4)使用22.4 L·mol-1时的注意事项
①条件:必须为标准状况。
②物质状态:必须为气态。如水、酒精、四氯化碳等物质在标准状况下不是气体。
③数值:22.4 L·mol-1是近似值。
(5)气体都是由分子构成的,因此气体的物质的量指代的是气体分子的物质的量,而不是其构成原子的物质的量。注意分析分子的构成,如Ar是单原子分子,O2是双原子分子,O3是三原子分子。
2.根据标准状况下气体摩尔体积进行的有关计算
①气体的物质的量n=。
②气体的密度ρ===。
③气体的分子数N=n·NA=·NA。
④气体的质量m=n·M=·M。
3.求解气体摩尔质量“五”方法
(1)根据物质的质量(m)和物质的量(n):M=。
(2)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):M=NA·。
(3)根据标准状况下气体的密度ρ: M=ρ×22.4 g·mol-1。
(4)根据同温同压下气体的相对密度(D=):=D。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……a%、b%、c%指混合物中各成分的物质的量分数(或体积分数)。
【典型例题】
【例1】下列关于气体摩尔体积的说法正确的是( )。
A.22.4 L任何气体的物质的量均为1 mol
B.非标准状况下,1 mol任何气体不可能占有22.4 L体积
C.0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
D.标准状况下,1 mol CO和1 mol CO2的体积之比为1∶2
【答案】C
【解析】标准状况下,22.4 L任何气体的物质的量均为1 mol,A项错误;非标准状况下,1 mol任何气体的体积也可能是22.4 L,B项错误;0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为(0.1 mol+0.2 mol+0.3 mol+0.4 mol)×22.4 L·mol-1=22.4 L,C项正确;标准状况下,1 mol CO和1 mol CO2的体积之比为1∶1,D项错误。
【例2】下列说法正确的是( )。
A.1 mol任何气体的气体摩尔体积都约为22.4 L·mol-1
B.20 ℃、1.0×105 Pa时,同体积的O2与CO2含有相同的分子数
C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况下
D.2 mol气体的体积约为44.8 L
【答案】B
【解析】A项,没有给出气体所处的温度和压强,标准状况下气体摩尔体积约为22.4 L·mol-1,错误;B项,根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同的分子数,正确;C项,1 mol气态物质在非标准状况下,体积也有可能等于22.4 L,错误;D项,没有给出气体所处的温度和压强,无法计算,错误。
任务2:阿伏加德罗定律及其推论(知识拓展)
情境导入 某同学在元旦晚会上表演的化学节目为猜气球——他先在实验室中用等质量的CH4、CO2、O2、SO2分别吹出四个气球,然后在晚会的现场让同学猜测气球分别是用哪种气体吹起的。
问题生成
1.哪个气球里的气体为CH4 理由是什么
【答案】D;同温同压条件下,相同质量的气体,体积与摩尔质量成反比,即摩尔质量越大,气体的体积越小。
2.标准状况下,等质量的CH4、CO2、O2、SO2分别吹出的四个气球,体积由大到小的顺序如何
【答案】CH4、CO2、O2、SO2的摩尔质量分别为16 g·mol-1、44 g·mol-1、32 g·mol-1、64 g·mol-1,故标准状况下,等质量的CH4、CO2、O2、SO2的体积大小为CH4>O2>CO2>SO2。
3.如果将标准状况改成同温同压的条件,第(1)和(2)问的答案有变化吗
【答案】没有。
4.如果没有指明等质量的四种气体所处的温度和压强,你能确定它们的体积大小关系吗
【答案】不能。
【核心归纳】
阿伏加德罗定律的推论
相同条件 结论
公式 语言叙述
同温同压 == 同温同压下,任何气体的体积之比等于分子数之比等于物质的量之比
同温同压同体积 = 同温同压下,同体积的任何气体的质量之比等于摩尔质量之比
同温同压同质量 = 同温同压下,相同质量的任何气体的体积之比等于摩尔质量的反比
同温同压 = 同温同压下,任何气体的密度之比等于摩尔质量之比
同温同体积 == 同温同体积下,气体的压强之比等于物质的量之比等于分子数之比
注意:阿伏加德罗定律的推论可根据公式pV=nRT进行推导,其中:p为压强(单位Pa),V为体积(单位L),n为物质的量(单位mol),R为常数,T为绝对温度(单位K)。
【典型例题】
【例3】同温同压下,质量忽略不计的A和B两气球,分别充入X气体和Y气体,且充气后两气球的体积相同。若相同条件下,A气球在CO中静止不动,B气球在O2中上浮。下列叙述正确的是( )。
A.X气体的摩尔质量比Y气体的摩尔质量大
B.X可能是N2,Y可能是CH4
C.X气体的密度小于Y气体的密度
D.充气后A气球的质量比B气球的质量大
【答案】B
【解析】同温同压下,气体的密度之比等于其摩尔质量之比。A气球在CO中静止不动,说明X气体与CO的密度相等,摩尔质量也相等,B气球在氧气中上浮,说明Y气体的密度小于氧气,摩尔质量也小于氧气;X气体与Y气体的摩尔质量无法比较,A项错误;X可能是N2,Y可能是CH4,B项正确;X气体与Y气体的密度无法比较,C项错误;充气后A气球的质量与B气球的质量无法比较,D项错误。
【例4】下列叙述正确的是( )。
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 L HCl和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体的物质的量越大,压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③④ B.②③⑥⑦⑧
C.④⑦⑧ D.⑤⑥⑦⑧
【答案】C
【解析】①标准状况下,0.2 mol任何气体物质的体积均为4.48 L,但液体和固体不是,错误;②温度、压强影响气体摩尔体积,若1 mol气体的体积为22.4 L,则它可能处于标准状况下,也可能不是在标准状况下,错误;③标准状况下,HCl为气体,而H2O不是气体,二者体积相等,它们物质的量不相等,错误;④1 g H2的物质的量为0.5 mol,14 g N2的物质的量为0.5 mol,二者物质的量相等,标准状况下,二者体积相等,正确;⑤28 g CO为1 mol,但不一定处于标准状况下,CO的体积不一定为22.4 L,错误;⑥标准状况下,两种物质不一定都是气体,它们物质的量相等,体积不一定相等,错误;⑦同温同体积时,气体压强与物质的量成正比,则气体的物质的量越大,压强越大,正确;⑧同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比,即气体的密度与气体的相对分子质量成正比,正确。
方法技巧:正确理解阿伏加德罗定律的应用
(1)阿伏加德罗定律的适用对象是气体(单一气体或混合气体),不适用于液体或固体。
(2)“三同”定“一同”。同温、同压、同体积和同分子数,四“同”共同存在,相互制约,只要有三“同”成立,则另一“同”就必定成立。
(3)“二同”定比例。温度、压强、气体体积、气体物质的量,若两个量相同,则另两个量成正比或反比。
(4)气体摩尔体积是阿伏加德罗定律的一个特例。
【随堂检测】
1.同温同压下,两种气体的体积不同,其主要原因是( )。
A.气体的分子大小不同
B.气体分子间的间距不同
C.气体的物质的量不同
D.气体的质量不同
【答案】C
【解析】同温同压下,气体分子之间的距离相等,而分子本身的大小又远小于气体分子之间的距离,故体积不同的主要原因是气体的物质的量不同。
2.等质量的下列物质在常温常压下体积最大的是( )。
A.浓硫酸 B.CO2 C.铁粉 D.水
【答案】B
【解析】等质量的四种物质在常温常压下,只有CO2为气体,其体积最大。
3.设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
A.64 g SO2含有的硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量之比为16∶1
C.28 g氮气所含的原子数目为NA
D.标准状况下,22.4 L H2O中含有 NA个水分子
【答案】B
4.(1)标准状况下,0.5 mol H2占有的体积约为 L。
(2)标准状况下,44.8 L H2的质量约为 g。
(3)标准状况下,3.01×1023个氧气分子所占的体积约为 L。
(4)标准状况下,33.6 L氧气所含的氧气分子数约为 个。
(5)标准状况下,16 g氧气和42 g N2的混合气体的体积为 L。
【答案】(1)11.2 (2)4 (3)11.2 (4)9.03×1023
(5)44.8
【解析】(1)V=0.5 mol×22.4 L·mol-1=11.2 L。
(2)标准状况下44.8 L H2的物质的量约为=2 mol,m(H2)=2 mol×2 g·mol-1=4 g。
(3)n(O2)==0.5 mol,V(O2)=0.5 mol×22.4 L·mol-1=11.2 L。
(4)n(O2)==1.5 mol,N=1.5 mol×6.02×1023 mol-1=9.03×1023。
(5)n(O2)==0.5 mol,n(N2)==1.5 mol,标准状况下混合气体的体积为(0.5+1.5) mol×22.4 L·mol-1=44.8 L。
2
【学习目标】
1.在已有知识的基础上理解气体摩尔体积的概念及相关计算。
2.理解决定物质体积的因素及其体积差异的原因。
3.通过气体摩尔体积的学习,培养探究反应或问题实质的意识。
4.通过分析物质体积大小的影响因素,加强对宏观与微观的联系,培养对抽象问题的分析、归纳、推理和总结的能力。
【自主预习】
1.影响物质体积的影响因素
结论:
(1)在相同条件下,粒子数相同的不同固态或液态物质的体积 。
(2)在同温同压条件下,粒子数相同的任何气体的体积都 。
2.气体摩尔体积
3.阿伏加德罗定律
内容:同温同压下,相同体积的任何气体都含有相同数目的粒子。
【参考答案】1.固 液 气 (1)不相同 (2)相同
2.物质的量 体积 Vm L· mol-1 Vm= 0 ℃
101 kPa 22.4 L·mol-1 温度 压强
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)在标准状况下,1 mol O2与1 mol H2O的体积相同。 ( )
(2)在标准状况下,1 mol气体的体积约是22.4 L,在非标准状况下,1 mol气体的体积则一定不是22.4 L。 ( )
(3)同温同压下,等体积的两种气体单质一定具有相同的原子数。 ( )
(4)标准状况下,氢气的气体摩尔体积为22.4 L。 ( )
(5)同温同体积条件下,等质量的SO2和O2对应的压强之比为1∶2。 ( )
(6)在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同。 ( )
【答案】(1)× (2)× (3)× (4)× (5)√ (6)√
2.32 g O2在标准状况下的体积是多少 含有氧原子多少个
【答案】22.4 L;2NA。
3.标准状况下,22.4 L N2含有多少个氮气分子 质量是多少克
【答案】NA;28 g。
【合作探究】
任务1:气体摩尔体积
情境导入
1.气球在挤压下体积容易变小,而铅球在挤压下体积很难发生变化,那么,决定物质体积大小的因素有哪些
2.固体、液体、气体微观粒子示意图:
3.标准状况下气体摩尔体积示意图如下:
问题生成
1.对比固体和液体的微观粒子示意图,想一想:
(1)影响固体和液体物质体积的主要因素是什么 为什么
(2)气体的体积主要取决于哪些因素 为什么
【答案】(1)固体和液体的体积主要与粒子的大小和数目有关,因为固体和液体粒子间的间距很小,可以忽略不计。
(2)决定气体体积的主要因素是粒子数目和粒子间距。因为气体分子间的间距很大,气体粒子的大小可以忽略不计。
2.(1)如何改变粒子之间的距离
(2)描述气体体积要注意哪些问题
(3)在相同的温度和压强下,相同体积的任何气体的分子数是否相同 为什么
【答案】(1)升高(降低)温度或减小(增大)压强可以增大(减小)粒子间的距离。
(2)气体的体积与温度、压强有关,描述气体的体积时要指明温度和压强。
(3)相同。因为相同的温度和压强下,气体分子间的间距相同。
3.若1 mol某气体的体积为22.4 L,则该气体所处的状况一定是标准状况吗 为什么
【答案】不一定。气体体积受温度和压强的影响,因此1 mol气体体积为22.4 L时的状态可以是温度高于0 ℃、压强高于101 kPa或温度低于0 ℃、压强低于101 kPa。
4.标准状况下,1 mol任何物质的体积都约为22.4 L吗
【答案】不是。在标准状况下,1 mol气体的体积约为22.4 L,而1 mol固体或液体的体积均不是22.4 L。
5.气体摩尔体积的适用范围是气体,是否必须为纯净的气体
【答案】不是。气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,但混合气体中气体之间不能发生化学反应。如标准状况下,0.2 mol H2和0.8 mol O2组成的混合气体的体积约为22.4 L。
【核心归纳】
1.气体摩尔体积
(1)对于气体来说,在常温常压下,分子之间的平均距离比分子直径大得多,因此一定量的气体体积的大小主要取决于气体分子之间的平均距离。
(2)在相同的温度和压强下,1 mol任何气体含有的分子数都相同,分子之间的平均距离也近似相等,所以它们的体积基本相同。
(3)气体摩尔体积的适用范围是气体。可以是单一气体,也可为相互之间不反应的混合气体。
(4)使用22.4 L·mol-1时的注意事项
①条件:必须为标准状况。
②物质状态:必须为气态。如水、酒精、四氯化碳等物质在标准状况下不是气体。
③数值:22.4 L·mol-1是近似值。
(5)气体都是由分子构成的,因此气体的物质的量指代的是气体分子的物质的量,而不是其构成原子的物质的量。注意分析分子的构成,如Ar是单原子分子,O2是双原子分子,O3是三原子分子。
2.根据标准状况下气体摩尔体积进行的有关计算
①气体的物质的量n=。
②气体的密度ρ===。
③气体的分子数N=n·NA=·NA。
④气体的质量m=n·M=·M。
3.求解气体摩尔质量“五”方法
(1)根据物质的质量(m)和物质的量(n):M=。
(2)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):M=NA·。
(3)根据标准状况下气体的密度ρ: M=ρ×22.4 g·mol-1。
(4)根据同温同压下气体的相对密度(D=):=D。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……a%、b%、c%指混合物中各成分的物质的量分数(或体积分数)。
【典型例题】
【例1】下列关于气体摩尔体积的说法正确的是( )。
A.22.4 L任何气体的物质的量均为1 mol
B.非标准状况下,1 mol任何气体不可能占有22.4 L体积
C.0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
D.标准状况下,1 mol CO和1 mol CO2的体积之比为1∶2
【答案】C
【解析】标准状况下,22.4 L任何气体的物质的量均为1 mol,A项错误;非标准状况下,1 mol任何气体的体积也可能是22.4 L,B项错误;0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为(0.1 mol+0.2 mol+0.3 mol+0.4 mol)×22.4 L·mol-1=22.4 L,C项正确;标准状况下,1 mol CO和1 mol CO2的体积之比为1∶1,D项错误。
【例2】下列说法正确的是( )。
A.1 mol任何气体的气体摩尔体积都约为22.4 L·mol-1
B.20 ℃、1.0×105 Pa时,同体积的O2与CO2含有相同的分子数
C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况下
D.2 mol气体的体积约为44.8 L
【答案】B
【解析】A项,没有给出气体所处的温度和压强,标准状况下气体摩尔体积约为22.4 L·mol-1,错误;B项,根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同的分子数,正确;C项,1 mol气态物质在非标准状况下,体积也有可能等于22.4 L,错误;D项,没有给出气体所处的温度和压强,无法计算,错误。
任务2:阿伏加德罗定律及其推论(知识拓展)
情境导入 某同学在元旦晚会上表演的化学节目为猜气球——他先在实验室中用等质量的CH4、CO2、O2、SO2分别吹出四个气球,然后在晚会的现场让同学猜测气球分别是用哪种气体吹起的。
问题生成
1.哪个气球里的气体为CH4 理由是什么
【答案】D;同温同压条件下,相同质量的气体,体积与摩尔质量成反比,即摩尔质量越大,气体的体积越小。
2.标准状况下,等质量的CH4、CO2、O2、SO2分别吹出的四个气球,体积由大到小的顺序如何
【答案】CH4、CO2、O2、SO2的摩尔质量分别为16 g·mol-1、44 g·mol-1、32 g·mol-1、64 g·mol-1,故标准状况下,等质量的CH4、CO2、O2、SO2的体积大小为CH4>O2>CO2>SO2。
3.如果将标准状况改成同温同压的条件,第(1)和(2)问的答案有变化吗
【答案】没有。
4.如果没有指明等质量的四种气体所处的温度和压强,你能确定它们的体积大小关系吗
【答案】不能。
【核心归纳】
阿伏加德罗定律的推论
相同条件 结论
公式 语言叙述
同温同压 == 同温同压下,任何气体的体积之比等于分子数之比等于物质的量之比
同温同压同体积 = 同温同压下,同体积的任何气体的质量之比等于摩尔质量之比
同温同压同质量 = 同温同压下,相同质量的任何气体的体积之比等于摩尔质量的反比
同温同压 = 同温同压下,任何气体的密度之比等于摩尔质量之比
同温同体积 == 同温同体积下,气体的压强之比等于物质的量之比等于分子数之比
注意:阿伏加德罗定律的推论可根据公式pV=nRT进行推导,其中:p为压强(单位Pa),V为体积(单位L),n为物质的量(单位mol),R为常数,T为绝对温度(单位K)。
【典型例题】
【例3】同温同压下,质量忽略不计的A和B两气球,分别充入X气体和Y气体,且充气后两气球的体积相同。若相同条件下,A气球在CO中静止不动,B气球在O2中上浮。下列叙述正确的是( )。
A.X气体的摩尔质量比Y气体的摩尔质量大
B.X可能是N2,Y可能是CH4
C.X气体的密度小于Y气体的密度
D.充气后A气球的质量比B气球的质量大
【答案】B
【解析】同温同压下,气体的密度之比等于其摩尔质量之比。A气球在CO中静止不动,说明X气体与CO的密度相等,摩尔质量也相等,B气球在氧气中上浮,说明Y气体的密度小于氧气,摩尔质量也小于氧气;X气体与Y气体的摩尔质量无法比较,A项错误;X可能是N2,Y可能是CH4,B项正确;X气体与Y气体的密度无法比较,C项错误;充气后A气球的质量与B气球的质量无法比较,D项错误。
【例4】下列叙述正确的是( )。
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 L HCl和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体的物质的量越大,压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③④ B.②③⑥⑦⑧
C.④⑦⑧ D.⑤⑥⑦⑧
【答案】C
【解析】①标准状况下,0.2 mol任何气体物质的体积均为4.48 L,但液体和固体不是,错误;②温度、压强影响气体摩尔体积,若1 mol气体的体积为22.4 L,则它可能处于标准状况下,也可能不是在标准状况下,错误;③标准状况下,HCl为气体,而H2O不是气体,二者体积相等,它们物质的量不相等,错误;④1 g H2的物质的量为0.5 mol,14 g N2的物质的量为0.5 mol,二者物质的量相等,标准状况下,二者体积相等,正确;⑤28 g CO为1 mol,但不一定处于标准状况下,CO的体积不一定为22.4 L,错误;⑥标准状况下,两种物质不一定都是气体,它们物质的量相等,体积不一定相等,错误;⑦同温同体积时,气体压强与物质的量成正比,则气体的物质的量越大,压强越大,正确;⑧同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比,即气体的密度与气体的相对分子质量成正比,正确。
方法技巧:正确理解阿伏加德罗定律的应用
(1)阿伏加德罗定律的适用对象是气体(单一气体或混合气体),不适用于液体或固体。
(2)“三同”定“一同”。同温、同压、同体积和同分子数,四“同”共同存在,相互制约,只要有三“同”成立,则另一“同”就必定成立。
(3)“二同”定比例。温度、压强、气体体积、气体物质的量,若两个量相同,则另两个量成正比或反比。
(4)气体摩尔体积是阿伏加德罗定律的一个特例。
【随堂检测】
1.同温同压下,两种气体的体积不同,其主要原因是( )。
A.气体的分子大小不同
B.气体分子间的间距不同
C.气体的物质的量不同
D.气体的质量不同
【答案】C
【解析】同温同压下,气体分子之间的距离相等,而分子本身的大小又远小于气体分子之间的距离,故体积不同的主要原因是气体的物质的量不同。
2.等质量的下列物质在常温常压下体积最大的是( )。
A.浓硫酸 B.CO2 C.铁粉 D.水
【答案】B
【解析】等质量的四种物质在常温常压下,只有CO2为气体,其体积最大。
3.设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
A.64 g SO2含有的硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量之比为16∶1
C.28 g氮气所含的原子数目为NA
D.标准状况下,22.4 L H2O中含有 NA个水分子
【答案】B
4.(1)标准状况下,0.5 mol H2占有的体积约为 L。
(2)标准状况下,44.8 L H2的质量约为 g。
(3)标准状况下,3.01×1023个氧气分子所占的体积约为 L。
(4)标准状况下,33.6 L氧气所含的氧气分子数约为 个。
(5)标准状况下,16 g氧气和42 g N2的混合气体的体积为 L。
【答案】(1)11.2 (2)4 (3)11.2 (4)9.03×1023
(5)44.8
【解析】(1)V=0.5 mol×22.4 L·mol-1=11.2 L。
(2)标准状况下44.8 L H2的物质的量约为=2 mol,m(H2)=2 mol×2 g·mol-1=4 g。
(3)n(O2)==0.5 mol,V(O2)=0.5 mol×22.4 L·mol-1=11.2 L。
(4)n(O2)==1.5 mol,N=1.5 mol×6.02×1023 mol-1=9.03×1023。
(5)n(O2)==0.5 mol,n(N2)==1.5 mol,标准状况下混合气体的体积为(0.5+1.5) mol×22.4 L·mol-1=44.8 L。
2
