1.3 第3课时 物质的量浓度 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 1.3 第3课时 物质的量浓度 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 296.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 21:38:44 | ||
图片预览




文档简介
1.3 第3课时 物质的量浓度
【学习目标】
1.理解物质的量浓度的概念,运用物质的量浓度的概念进行简单的计算,学会配制一定物质的量浓度溶液的方法和技能。
2.通过学习溶液的配制建立溶液组成的简单模型,通过对溶质的质量分数与物质的量浓度的比较,提高运用比较、归纳、推理的能力,培养理论联系实际的学习自然科学的思想。
3.通过进行一定物质的量浓度溶液的配制实验,培养实验探究的能力,逐步加强科学探究与创新意识。
【自主预习】
1.溶质的质量分数
(1)概念:溶液中的 质量与 质量之比。
(2)表达式:w(溶质)= ×100%。
2.物质的量浓度
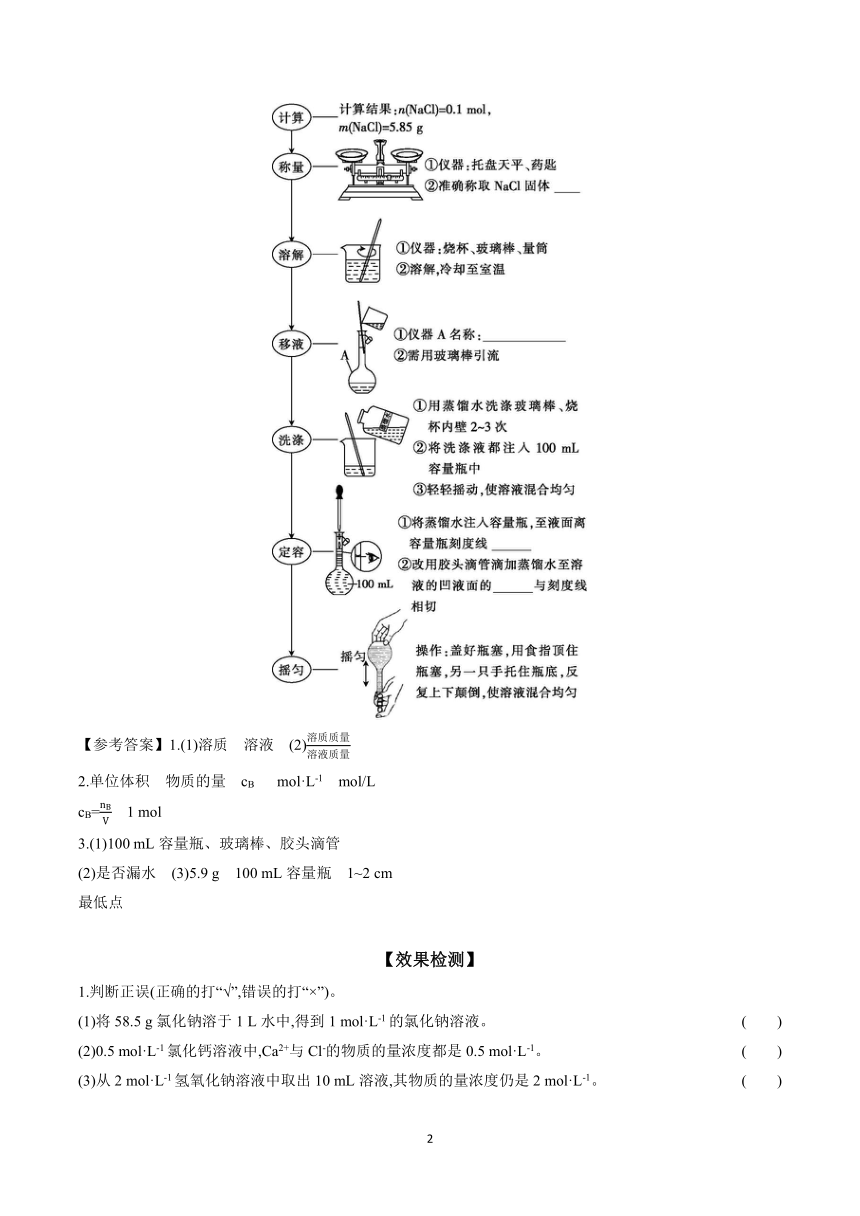
3.配制一定物质的量浓度(100 mL 1.00 mol·L-1氯化钠)的溶液
(1)完成该实验,除量筒、托盘天平(带砝码)、药匙、烧杯外,还需要的仪器有 。
(2)容量瓶的选择与使用
①容量瓶上标有温度(一般为20 ℃)和容积。
②容量瓶有不同的规格,常用的有50 mL、100 mL、250 mL、500 mL和1000 mL等几种。
③使用容量瓶时要注意以下几点:
a.不能溶解固体;b.不能稀释浓溶液;c.不能加热;d.不能作反应容器;e.不能长期贮存溶液;f.使用前要检验容量瓶 。
(3)配制实验步骤
【参考答案】1.(1)溶质 溶液 (2)
2.单位体积 物质的量 cB mol·L-1 mol/L
cB= 1 mol
3.(1)100 mL容量瓶、玻璃棒、胶头滴管
(2)是否漏水 (3)5.9 g 100 mL容量瓶 1~2 cm
最低点
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)将58.5 g氯化钠溶于1 L水中,得到1 mol·L-1的氯化钠溶液。 ( )
(2)0.5 mol·L-1氯化钙溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1。 ( )
(3)从2 mol·L-1氢氧化钠溶液中取出10 mL溶液,其物质的量浓度仍是2 mol·L-1。 ( )
(4)容量瓶在使用前应检查是否漏液。 ( )
(5)用固体配制溶液时,可直接将固体在容量瓶中进行溶解。 ( )
(6)实验室需要950 mL 0.1 mol·L-1氯化钠溶液,配制时应选用1000 mL容量瓶。 ( )
(7)配制一定物质的量浓度溶液时,两次使用玻璃棒,其作用分别是搅拌和引流。 ( )
(8)配制1 L 0.1 mol·L-1硫酸铜溶液,需要25 g CuSO4·5H2O。 ( )
【答案】(1)× (2)× (3)√ (4)√ (5)× (6)√
(7)√ (8)√
2.1 mol·L-1葡萄糖(C6H12O6,M=180 g·mol-1)溶液的含义是什么
【答案】1 L葡萄糖溶液中含有1 mol葡萄糖,或者是1 L葡萄糖溶液中含有180 g葡萄糖。
3.100 mL 0.1 mol·L-1 Na2CO3溶液中含有溶质多少克
【答案】1.06 g。
【合作探究】
任务1:物质的量浓度及相关计算
情境导入 生活中表示溶液的浓度,实际有很多方法,白酒中的酒精含量是体积百分数,食用油用的质量分数,矿泉水中的矿物质含量用的是mg·L-1,而血液检验中使用了mmol·L-1这样的单位。
问题生成
1.实际生产生活中,对于溶液,人们是测量质量方便还是测量体积方便呢
【答案】体积。
2.学习了物质的量后,我们能否用物质的量来表示溶液的组成 如何表示
【答案】能。用单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫作溶质B的物质的量浓度,其符号为cB,单位为mol·L-1。
3.1 mol·L-1 NaCl溶液表示什么含义
【答案】1 L溶液中含有1 mol NaCl。
4.将1 mol NaCl溶于1 L水中,溶液的物质的量浓度是1 mol·L-1吗 将100 mL 1 mol·L-1氯化钠溶液平均分成5份,每份溶液的物质的量浓度是多少
【答案】不是,根据物质的量浓度的定义,体积必须是溶液的体积。1 mol·L-1氯化钠溶液平均分成5份,每份的物质的量浓度仍是1 mol·L-1。
5.物质的量浓度表达式cB=中,V能不能用溶剂的体积代替
【答案】不能。“V”指的是溶液的体积,一般不等于溶剂的体积,也不等于溶剂的体积和溶质的体积之和,要通过溶液的质量和密度换算得到。
【核心归纳】
1.正确理解物质的量浓度
(1)体积是溶液的体积,不是溶剂的体积,应根据V=计算。
(2)溶质可以是单质、化合物,也可以是离子或某种特定组合。
(3)在一定浓度的溶液里取出任意体积的溶液,其浓度不变,所含溶质的质量改变。
2.要能正确判断溶液的溶质并计算其物质的量
(1)与水发生反应生成新的物质,如Na、Na2O、Na2O2NaOH;SO3H2SO4。
(2)特殊物质:如NH3溶于水后溶质为NH3·H2O,但计算浓度时仍以NH3作为溶质。
(3)含结晶水的物质:CuSO4·5H2OCuSO4;
Na2CO3·10H2ONa2CO3。
3.要注意溶液稀释定律(守恒观点)
(1)溶质的质量在稀释前后保持不变,即m1w1=m2w2。
(2)溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。
(3)溶液质量守恒,m(稀)=m(浓)+m(水)(体积一般不守恒)。
4.已知一定体积(V)的溶液中溶质的量,计算溶质的物质的量浓度的方法
(1)若已知溶质质量:
(2)若已知溶液中某粒子的个数:
5.一定体积(V1)的气体(标准状况下)溶于水后形成的溶液中溶质的物质的量浓度的计算方法
(1)若已知溶液的体积V2:
(2)若已知溶液的密度:[假定气体的摩尔质量为M g·mol-1,V L(标准状况)该气体溶于1 L水中所得溶液的密度为ρ g·cm-3]
c=== mol·L-1。
6.物质的量浓度与溶质的质量分数的换算
(1)换算公式
cB= mol·L-1
M:溶质B的摩尔质量(单位:g·mol-1);ρ:溶液密度(单位:g·mL-1);w为溶质的质量分数。
(2)推导方法
设溶液体积为1 L,则:
cB=== mol·L-1。
7.溶液中离子浓度的有关计算
(1)单一溶质溶液中溶质组成计算
根据组成规律求算:在溶液中,阴离子与阳离子浓度之比等于化学组成中阴、阳离子个数之比。
如K2SO4溶液中:c(K+)=2c(S)=2c(K2SO4)。
(2)混合溶液中电荷守恒计算
根据电荷守恒,溶质所有阳离子带正电荷总数与阴离子带负电荷总数相等。
如在Na2SO4、NaCl混合溶液中,c(Na+)=2c(S)+c(Cl-),c(Na+)、c(Cl-)分别为7 mol·L-1、3 mol·L-1,则c(S)= mol·L-1=2 mol·L-1。
【典型例题】
【例1】游泳池里的水一般常加适量的硫酸铜,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300mL,经分析其中含有0.0192g Cu2+,则水样中硫酸铜的物质的量浓度为 mol·L-1。
【答案】0.001
【解析】c(CuSO4)=c(Cu2+)===0.001mol·L-1。
【例2】用1 L水吸收560 L(标准状况下)氨气,所得氨水的密度是0.90 g·cm-3,求:
(1)氨气的物质的量是 。
(2)所得氨水的物质的量浓度约是 (保留两位小数)。
【答案】(1)25 mol (2)15.79 mol·L-1
【解析】(1)n(NH3)==25mol。
(2)V=,c=≈15.79mol·L-1。
【例3】从1 L 1 mol·L-1氢氧化钠溶液中取出100 mL:
(1)取出的这100 mL氢氧化钠溶液的物质的量浓度是 ,所含氢氧化钠的质量是 。
(2)若将取出的这100 mL氢氧化钠溶液加水稀释至500 mL,所得溶液的物质的量浓度是 。
【答案】(1)1mol·L-1 4g (2)0.2mol·L-1
【解析】(1)1L溶液中取出100mL,浓度不变,c(NaOH)=1mol·L-1。100mL溶液中含m(NaOH)=n(NaOH)·M(NaOH)=1mol·L-1×0.1L×40g·mol-1=4g。(2)稀释前后溶质的物质的量不变,c(浓)·V(浓)=c(稀)·V(稀),即1mol·L-1×0.1L=c(稀)×0.5L,c(稀)=0.2mol·L-1。
任务2:一定物质的量浓度溶液的配制
情境导入 氯化钠是一种重要的体液内电解质平衡调节药。正常人体内总钠量平均为150 g,其中44%以氯化钠形式存在于细胞外液,约9%存在于细胞内。在临床上,氯化钠注射液可以用于治疗各种原因导致的失水症。另外,当机体大量出血的时候,而短时间内又没办法进行输血,这个时候可以暂时地输入氯化钠注射液来维持血容量进行急救。那么我们该如何配制一定物质的量浓度的氯化钠溶液呢
问题生成
1.配制480 mL 0.2 mol·L-1的氯化钠溶液需要多大规格的容量瓶
【答案】500 mL。
2.配制溶液前,容量瓶需要润洗吗
【答案】不需要。
3.配制480 mL 0.2 mol·L-1的氯化钠溶液的具体步骤是什么
【答案】(1)计算需要的NaCl的质量为5.85 g。
(2)称量NaCl的质量(应该使用精密度比较高的分析天平或电子天平,但是本实验中可使用托盘天平代替,此时应该称量5.9 g)。
(3)将称量好的固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使其完全溶解。待温度恢复至室温。
(4)将烧杯中的溶液沿玻璃棒转移至500 mL容量瓶。
(5)用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也转移至容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
(6)向容量瓶内注入蒸馏水,至距离刻度线1~2 cm处,改用胶头滴管滴加,直至溶液的凹液面最低点与容量瓶的刻度线恰好相切。
(7)盖好瓶塞,反复上下颠倒,摇匀。将配制好的溶液倒入试剂瓶中,并贴好标签。
4.为什么要用蒸馏水洗涤烧杯内壁和玻璃棒,并将洗涤液转移至容量瓶中
【答案】烧杯内壁和玻璃棒上都会沾有一些氯化钠溶液,洗涤是为了减小实验误差。
【核心归纳】
1.容量瓶的结构与规格
2.容量瓶的选择与使用
(1)容量瓶是配制一定物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
(2)使用前要查漏。检验程序:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
(3)使用容量瓶注意“五不”:不能溶解固体,不能稀释浓溶液,不能加热,不能作反应容器,不能长期存放溶液。
(4)定容时平视刻度,凹液面最低点与刻度线相切。
3.溶液配制中的误差分析
误差的判断依据:cB==,故凡是能影响固体质量的操作或影响溶液体积的操作都会产生误差。
可能引起误差的一些操作 过程分析 对浓度 的影响
m V
称量过程中的误差分析 称量时间过长 减小 - 偏低
称NaOH时用滤纸 减小 - 偏低
配制过程中的误差分析 移液前容量瓶内有少量水 不变 不变 无影响
向容量瓶转移液体时有少量液体流出 减小 - 偏低
未洗涤烧杯和玻璃棒 减小 - 偏低
定容时,水加多后用滴管吸出 减小 - 偏低
定容摇匀时液面下降再加水 - 增大 偏低
定容时仰视读刻度(图1) - 增大 偏低
定容时俯视读刻度(图2) - 减小 偏高
未冷却至室温就注入容量瓶定容 - 减小 偏高
(1)仰视刻度线(图1),加水量偏多,溶液浓度偏低。
(2)俯视刻度线(图2),加水量偏少,溶液浓度偏高。
【典型例题】
【例4】关于配制980 mL 0.1 mol·L-1CuSO4溶液的实验,下列说法正确的是( )。
A.需要称取CuSO4·5H2O固体的质量为16.0 g
B.一定要用到的玻璃仪器有 1000 mL容量瓶、烧杯、玻璃棒、漏斗、胶头滴管
C.为加快CuSO4·5H2O固体的溶解,可适当加热,然后趁热将溶液转移到容量瓶中
D.倒立摇匀后发现液面低于刻度线,若补加蒸馏水至刻度线会使所得溶液的浓度偏低
【答案】D
【解析】实验室没有980 mL容量瓶,应该选用1000 mL容量瓶配制。需要称取CuSO4·5H2O固体的质量=1 L×0.1 mol·L-1×250 g·mol-1=25.0 g,A项错误;配制一定物质的量浓度的溶液用到的玻璃仪器有 1000 mL容量瓶、烧杯、玻璃棒、胶头滴管,用不到漏斗,B项错误;为加快CuSO4·5H2O固体的溶解,可适当加热,然后将溶液冷却后转移到容量瓶中,C项错误;倒立摇匀后发现液面低于刻度线,若补加蒸馏水至刻度线,导致溶液的体积偏大,所得溶液的浓度偏低,D项正确。
【例5】在配制一定物质的量浓度溶液的过程中,下列操作对所配溶液浓度无影响的是 (填字母,下同);会使所配溶液的浓度偏大的是 ;会使所配溶液的浓度偏小的是 。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量的溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.容量瓶中液面未到刻度线便停止加水
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量的溶液溅出
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
F.定容时,俯视容量瓶刻度线
【答案】DE CF AB
【解析】将配得的溶液从容量瓶转移到试剂瓶中时,溶液的浓度已经是所要配的浓度,有少量的溶液溅出对浓度无影响;将烧杯中溶液转移到容量瓶,还要加水定容,故转移之前容量瓶中有少量蒸馏水对所配溶液浓度无影响;俯视容量瓶刻度线,会使所配溶液体积偏小,浓度偏大。
【随堂检测】
1.将20 g氢氧化钠固体溶于水,配制成500 mL溶液,该溶液的物质的量浓度为( )。
A.1.0 mol·L-1 B.0.5 mol·L-1
C.20 mol·L-1 D.0.04 mol·L-1
【答案】A
2.下列关于1.0 mol·L-1Na2SO4溶液的叙述正确的是( )。
①溶液中含有1 mol Na2SO4
②1 L溶液中含有142 g Na2SO4
③将1 mol Na2SO4溶于1 L水中所得的溶液
④将322 g Na2SO4·10H2O溶于水后再稀释成1000 mL所得的溶液
A.①③ B.②④ C.③④ D.②③
【答案】B
【解析】溶液中溶质的物质的量与溶液体积有关,溶液体积未给出,无法计算溶质的物质的量,①错误;142 g Na2SO4的物质的量为1 mol,溶于水配成1 L溶液,可得1 mol·L-1的Na2SO4溶液,②正确;1 mol Na2SO4溶于1 L水,所得溶液的体积不是1 L,③错误;322 g硫酸钠晶体的物质的量为1 mol,则溶液中硫酸钠的物质的量为1 mol,溶液体积为1 L,所得硫酸钠溶液的浓度为1 mol·L-1,④正确。
3.实验室配制500 mL 0.2 mol·L-1Na2CO3溶液,下列说法错误的是( )。
A.称量时,若将Na2CO3固体置于托盘天平右盘,将导致所配溶液浓度偏小
B.将Na2CO3固体置于烧杯中溶解,冷却后转移到容量瓶中
C.定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线
D.将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中
【答案】C
【解析】A项,需称取Na2CO3固体的质量:m=nM=cVM=0.2 mol·L-1×0.5 L×106 g·mol-1=10.6 g,固体放在右盘,会导致实际称量的Na2CO3的质量只有9.4 g,正确;B项,固体在烧杯中溶解,容量瓶不能用于固体溶解,正确;C项,定容摇匀后因为容量瓶内壁上粘有液滴,所以液面低于刻度线,此时无需滴加蒸馏水,错误;D项,Na2CO3溶液显碱性,不能用带玻璃塞的试剂瓶,正确。
4.实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:①称量
②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容
⑧冷却。正确的操作顺序为 ,本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、 。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为 g,要完成本实验该同学应称出 g NaOH。
(3)使用容量瓶前必须进行的一步操作是 。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是 (填序号)。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量溶液洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤未冷却到室温就将溶液转移到容量瓶中并定容 ⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】(1)②①③⑧⑤⑥⑦④ 250 mL容量瓶、胶头滴管
(2)27.4 10.0
(3)检查容量瓶是否漏水
(4)④⑤
【解析】(1)实验室没有240 mL规格的容量瓶,应配制250 mL 1.0 mol·L-1的NaOH溶液,配制步骤:计算、称量、溶解或稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,则正确的顺序为②①③⑧⑤⑥⑦④;结合操作方法可知,使用的仪器有托盘天平、药匙、烧杯、玻璃棒、250 mL容量瓶、胶头滴管,所以还缺少的仪器为250 mL容量瓶、胶头滴管。(2)结合“左盘物体的质量=右盘物体的质量+游码的读数”可知,烧杯的实际质量为30 g-2.6 g=27.4 g;配制250 mL 1.0 mol·L-1的NaOH溶液,需要NaOH的质量为1.0 mol·L-1×0.25 L×40 g·mol-1=10.0 g。(3)容量瓶带有瓶塞,配制过程中需要摇匀,则使用容量瓶前必须检查容量瓶是否漏水。(4)①没有洗涤烧杯和玻璃棒,溶质质量减小,浓度偏低;②转移溶液时不慎有少量溶液洒到容量瓶外面,溶质质量减小,浓度偏低;③容量瓶不干燥,含有少量蒸馏水,不影响溶液体积和溶质质量,浓度不变;④定容时俯视刻度线,溶液体积偏小,浓度偏高;⑤未冷却到室温就将溶液转移到容量瓶中并定容,冷却后溶液体积减小,浓度偏高;⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液体积增大,浓度偏低。
2
【学习目标】
1.理解物质的量浓度的概念,运用物质的量浓度的概念进行简单的计算,学会配制一定物质的量浓度溶液的方法和技能。
2.通过学习溶液的配制建立溶液组成的简单模型,通过对溶质的质量分数与物质的量浓度的比较,提高运用比较、归纳、推理的能力,培养理论联系实际的学习自然科学的思想。
3.通过进行一定物质的量浓度溶液的配制实验,培养实验探究的能力,逐步加强科学探究与创新意识。
【自主预习】
1.溶质的质量分数
(1)概念:溶液中的 质量与 质量之比。
(2)表达式:w(溶质)= ×100%。
2.物质的量浓度
3.配制一定物质的量浓度(100 mL 1.00 mol·L-1氯化钠)的溶液
(1)完成该实验,除量筒、托盘天平(带砝码)、药匙、烧杯外,还需要的仪器有 。
(2)容量瓶的选择与使用
①容量瓶上标有温度(一般为20 ℃)和容积。
②容量瓶有不同的规格,常用的有50 mL、100 mL、250 mL、500 mL和1000 mL等几种。
③使用容量瓶时要注意以下几点:
a.不能溶解固体;b.不能稀释浓溶液;c.不能加热;d.不能作反应容器;e.不能长期贮存溶液;f.使用前要检验容量瓶 。
(3)配制实验步骤
【参考答案】1.(1)溶质 溶液 (2)
2.单位体积 物质的量 cB mol·L-1 mol/L
cB= 1 mol
3.(1)100 mL容量瓶、玻璃棒、胶头滴管
(2)是否漏水 (3)5.9 g 100 mL容量瓶 1~2 cm
最低点
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)将58.5 g氯化钠溶于1 L水中,得到1 mol·L-1的氯化钠溶液。 ( )
(2)0.5 mol·L-1氯化钙溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol·L-1。 ( )
(3)从2 mol·L-1氢氧化钠溶液中取出10 mL溶液,其物质的量浓度仍是2 mol·L-1。 ( )
(4)容量瓶在使用前应检查是否漏液。 ( )
(5)用固体配制溶液时,可直接将固体在容量瓶中进行溶解。 ( )
(6)实验室需要950 mL 0.1 mol·L-1氯化钠溶液,配制时应选用1000 mL容量瓶。 ( )
(7)配制一定物质的量浓度溶液时,两次使用玻璃棒,其作用分别是搅拌和引流。 ( )
(8)配制1 L 0.1 mol·L-1硫酸铜溶液,需要25 g CuSO4·5H2O。 ( )
【答案】(1)× (2)× (3)√ (4)√ (5)× (6)√
(7)√ (8)√
2.1 mol·L-1葡萄糖(C6H12O6,M=180 g·mol-1)溶液的含义是什么
【答案】1 L葡萄糖溶液中含有1 mol葡萄糖,或者是1 L葡萄糖溶液中含有180 g葡萄糖。
3.100 mL 0.1 mol·L-1 Na2CO3溶液中含有溶质多少克
【答案】1.06 g。
【合作探究】
任务1:物质的量浓度及相关计算
情境导入 生活中表示溶液的浓度,实际有很多方法,白酒中的酒精含量是体积百分数,食用油用的质量分数,矿泉水中的矿物质含量用的是mg·L-1,而血液检验中使用了mmol·L-1这样的单位。
问题生成
1.实际生产生活中,对于溶液,人们是测量质量方便还是测量体积方便呢
【答案】体积。
2.学习了物质的量后,我们能否用物质的量来表示溶液的组成 如何表示
【答案】能。用单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫作溶质B的物质的量浓度,其符号为cB,单位为mol·L-1。
3.1 mol·L-1 NaCl溶液表示什么含义
【答案】1 L溶液中含有1 mol NaCl。
4.将1 mol NaCl溶于1 L水中,溶液的物质的量浓度是1 mol·L-1吗 将100 mL 1 mol·L-1氯化钠溶液平均分成5份,每份溶液的物质的量浓度是多少
【答案】不是,根据物质的量浓度的定义,体积必须是溶液的体积。1 mol·L-1氯化钠溶液平均分成5份,每份的物质的量浓度仍是1 mol·L-1。
5.物质的量浓度表达式cB=中,V能不能用溶剂的体积代替
【答案】不能。“V”指的是溶液的体积,一般不等于溶剂的体积,也不等于溶剂的体积和溶质的体积之和,要通过溶液的质量和密度换算得到。
【核心归纳】
1.正确理解物质的量浓度
(1)体积是溶液的体积,不是溶剂的体积,应根据V=计算。
(2)溶质可以是单质、化合物,也可以是离子或某种特定组合。
(3)在一定浓度的溶液里取出任意体积的溶液,其浓度不变,所含溶质的质量改变。
2.要能正确判断溶液的溶质并计算其物质的量
(1)与水发生反应生成新的物质,如Na、Na2O、Na2O2NaOH;SO3H2SO4。
(2)特殊物质:如NH3溶于水后溶质为NH3·H2O,但计算浓度时仍以NH3作为溶质。
(3)含结晶水的物质:CuSO4·5H2OCuSO4;
Na2CO3·10H2ONa2CO3。
3.要注意溶液稀释定律(守恒观点)
(1)溶质的质量在稀释前后保持不变,即m1w1=m2w2。
(2)溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。
(3)溶液质量守恒,m(稀)=m(浓)+m(水)(体积一般不守恒)。
4.已知一定体积(V)的溶液中溶质的量,计算溶质的物质的量浓度的方法
(1)若已知溶质质量:
(2)若已知溶液中某粒子的个数:
5.一定体积(V1)的气体(标准状况下)溶于水后形成的溶液中溶质的物质的量浓度的计算方法
(1)若已知溶液的体积V2:
(2)若已知溶液的密度:[假定气体的摩尔质量为M g·mol-1,V L(标准状况)该气体溶于1 L水中所得溶液的密度为ρ g·cm-3]
c=== mol·L-1。
6.物质的量浓度与溶质的质量分数的换算
(1)换算公式
cB= mol·L-1
M:溶质B的摩尔质量(单位:g·mol-1);ρ:溶液密度(单位:g·mL-1);w为溶质的质量分数。
(2)推导方法
设溶液体积为1 L,则:
cB=== mol·L-1。
7.溶液中离子浓度的有关计算
(1)单一溶质溶液中溶质组成计算
根据组成规律求算:在溶液中,阴离子与阳离子浓度之比等于化学组成中阴、阳离子个数之比。
如K2SO4溶液中:c(K+)=2c(S)=2c(K2SO4)。
(2)混合溶液中电荷守恒计算
根据电荷守恒,溶质所有阳离子带正电荷总数与阴离子带负电荷总数相等。
如在Na2SO4、NaCl混合溶液中,c(Na+)=2c(S)+c(Cl-),c(Na+)、c(Cl-)分别为7 mol·L-1、3 mol·L-1,则c(S)= mol·L-1=2 mol·L-1。
【典型例题】
【例1】游泳池里的水一般常加适量的硫酸铜,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300mL,经分析其中含有0.0192g Cu2+,则水样中硫酸铜的物质的量浓度为 mol·L-1。
【答案】0.001
【解析】c(CuSO4)=c(Cu2+)===0.001mol·L-1。
【例2】用1 L水吸收560 L(标准状况下)氨气,所得氨水的密度是0.90 g·cm-3,求:
(1)氨气的物质的量是 。
(2)所得氨水的物质的量浓度约是 (保留两位小数)。
【答案】(1)25 mol (2)15.79 mol·L-1
【解析】(1)n(NH3)==25mol。
(2)V=,c=≈15.79mol·L-1。
【例3】从1 L 1 mol·L-1氢氧化钠溶液中取出100 mL:
(1)取出的这100 mL氢氧化钠溶液的物质的量浓度是 ,所含氢氧化钠的质量是 。
(2)若将取出的这100 mL氢氧化钠溶液加水稀释至500 mL,所得溶液的物质的量浓度是 。
【答案】(1)1mol·L-1 4g (2)0.2mol·L-1
【解析】(1)1L溶液中取出100mL,浓度不变,c(NaOH)=1mol·L-1。100mL溶液中含m(NaOH)=n(NaOH)·M(NaOH)=1mol·L-1×0.1L×40g·mol-1=4g。(2)稀释前后溶质的物质的量不变,c(浓)·V(浓)=c(稀)·V(稀),即1mol·L-1×0.1L=c(稀)×0.5L,c(稀)=0.2mol·L-1。
任务2:一定物质的量浓度溶液的配制
情境导入 氯化钠是一种重要的体液内电解质平衡调节药。正常人体内总钠量平均为150 g,其中44%以氯化钠形式存在于细胞外液,约9%存在于细胞内。在临床上,氯化钠注射液可以用于治疗各种原因导致的失水症。另外,当机体大量出血的时候,而短时间内又没办法进行输血,这个时候可以暂时地输入氯化钠注射液来维持血容量进行急救。那么我们该如何配制一定物质的量浓度的氯化钠溶液呢
问题生成
1.配制480 mL 0.2 mol·L-1的氯化钠溶液需要多大规格的容量瓶
【答案】500 mL。
2.配制溶液前,容量瓶需要润洗吗
【答案】不需要。
3.配制480 mL 0.2 mol·L-1的氯化钠溶液的具体步骤是什么
【答案】(1)计算需要的NaCl的质量为5.85 g。
(2)称量NaCl的质量(应该使用精密度比较高的分析天平或电子天平,但是本实验中可使用托盘天平代替,此时应该称量5.9 g)。
(3)将称量好的固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使其完全溶解。待温度恢复至室温。
(4)将烧杯中的溶液沿玻璃棒转移至500 mL容量瓶。
(5)用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也转移至容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
(6)向容量瓶内注入蒸馏水,至距离刻度线1~2 cm处,改用胶头滴管滴加,直至溶液的凹液面最低点与容量瓶的刻度线恰好相切。
(7)盖好瓶塞,反复上下颠倒,摇匀。将配制好的溶液倒入试剂瓶中,并贴好标签。
4.为什么要用蒸馏水洗涤烧杯内壁和玻璃棒,并将洗涤液转移至容量瓶中
【答案】烧杯内壁和玻璃棒上都会沾有一些氯化钠溶液,洗涤是为了减小实验误差。
【核心归纳】
1.容量瓶的结构与规格
2.容量瓶的选择与使用
(1)容量瓶是配制一定物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
(2)使用前要查漏。检验程序:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
(3)使用容量瓶注意“五不”:不能溶解固体,不能稀释浓溶液,不能加热,不能作反应容器,不能长期存放溶液。
(4)定容时平视刻度,凹液面最低点与刻度线相切。
3.溶液配制中的误差分析
误差的判断依据:cB==,故凡是能影响固体质量的操作或影响溶液体积的操作都会产生误差。
可能引起误差的一些操作 过程分析 对浓度 的影响
m V
称量过程中的误差分析 称量时间过长 减小 - 偏低
称NaOH时用滤纸 减小 - 偏低
配制过程中的误差分析 移液前容量瓶内有少量水 不变 不变 无影响
向容量瓶转移液体时有少量液体流出 减小 - 偏低
未洗涤烧杯和玻璃棒 减小 - 偏低
定容时,水加多后用滴管吸出 减小 - 偏低
定容摇匀时液面下降再加水 - 增大 偏低
定容时仰视读刻度(图1) - 增大 偏低
定容时俯视读刻度(图2) - 减小 偏高
未冷却至室温就注入容量瓶定容 - 减小 偏高
(1)仰视刻度线(图1),加水量偏多,溶液浓度偏低。
(2)俯视刻度线(图2),加水量偏少,溶液浓度偏高。
【典型例题】
【例4】关于配制980 mL 0.1 mol·L-1CuSO4溶液的实验,下列说法正确的是( )。
A.需要称取CuSO4·5H2O固体的质量为16.0 g
B.一定要用到的玻璃仪器有 1000 mL容量瓶、烧杯、玻璃棒、漏斗、胶头滴管
C.为加快CuSO4·5H2O固体的溶解,可适当加热,然后趁热将溶液转移到容量瓶中
D.倒立摇匀后发现液面低于刻度线,若补加蒸馏水至刻度线会使所得溶液的浓度偏低
【答案】D
【解析】实验室没有980 mL容量瓶,应该选用1000 mL容量瓶配制。需要称取CuSO4·5H2O固体的质量=1 L×0.1 mol·L-1×250 g·mol-1=25.0 g,A项错误;配制一定物质的量浓度的溶液用到的玻璃仪器有 1000 mL容量瓶、烧杯、玻璃棒、胶头滴管,用不到漏斗,B项错误;为加快CuSO4·5H2O固体的溶解,可适当加热,然后将溶液冷却后转移到容量瓶中,C项错误;倒立摇匀后发现液面低于刻度线,若补加蒸馏水至刻度线,导致溶液的体积偏大,所得溶液的浓度偏低,D项正确。
【例5】在配制一定物质的量浓度溶液的过程中,下列操作对所配溶液浓度无影响的是 (填字母,下同);会使所配溶液的浓度偏大的是 ;会使所配溶液的浓度偏小的是 。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量的溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.容量瓶中液面未到刻度线便停止加水
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量的溶液溅出
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
F.定容时,俯视容量瓶刻度线
【答案】DE CF AB
【解析】将配得的溶液从容量瓶转移到试剂瓶中时,溶液的浓度已经是所要配的浓度,有少量的溶液溅出对浓度无影响;将烧杯中溶液转移到容量瓶,还要加水定容,故转移之前容量瓶中有少量蒸馏水对所配溶液浓度无影响;俯视容量瓶刻度线,会使所配溶液体积偏小,浓度偏大。
【随堂检测】
1.将20 g氢氧化钠固体溶于水,配制成500 mL溶液,该溶液的物质的量浓度为( )。
A.1.0 mol·L-1 B.0.5 mol·L-1
C.20 mol·L-1 D.0.04 mol·L-1
【答案】A
2.下列关于1.0 mol·L-1Na2SO4溶液的叙述正确的是( )。
①溶液中含有1 mol Na2SO4
②1 L溶液中含有142 g Na2SO4
③将1 mol Na2SO4溶于1 L水中所得的溶液
④将322 g Na2SO4·10H2O溶于水后再稀释成1000 mL所得的溶液
A.①③ B.②④ C.③④ D.②③
【答案】B
【解析】溶液中溶质的物质的量与溶液体积有关,溶液体积未给出,无法计算溶质的物质的量,①错误;142 g Na2SO4的物质的量为1 mol,溶于水配成1 L溶液,可得1 mol·L-1的Na2SO4溶液,②正确;1 mol Na2SO4溶于1 L水,所得溶液的体积不是1 L,③错误;322 g硫酸钠晶体的物质的量为1 mol,则溶液中硫酸钠的物质的量为1 mol,溶液体积为1 L,所得硫酸钠溶液的浓度为1 mol·L-1,④正确。
3.实验室配制500 mL 0.2 mol·L-1Na2CO3溶液,下列说法错误的是( )。
A.称量时,若将Na2CO3固体置于托盘天平右盘,将导致所配溶液浓度偏小
B.将Na2CO3固体置于烧杯中溶解,冷却后转移到容量瓶中
C.定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线
D.将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中
【答案】C
【解析】A项,需称取Na2CO3固体的质量:m=nM=cVM=0.2 mol·L-1×0.5 L×106 g·mol-1=10.6 g,固体放在右盘,会导致实际称量的Na2CO3的质量只有9.4 g,正确;B项,固体在烧杯中溶解,容量瓶不能用于固体溶解,正确;C项,定容摇匀后因为容量瓶内壁上粘有液滴,所以液面低于刻度线,此时无需滴加蒸馏水,错误;D项,Na2CO3溶液显碱性,不能用带玻璃塞的试剂瓶,正确。
4.实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:①称量
②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容
⑧冷却。正确的操作顺序为 ,本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、 。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为 g,要完成本实验该同学应称出 g NaOH。
(3)使用容量瓶前必须进行的一步操作是 。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是 (填序号)。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量溶液洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤未冷却到室温就将溶液转移到容量瓶中并定容 ⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】(1)②①③⑧⑤⑥⑦④ 250 mL容量瓶、胶头滴管
(2)27.4 10.0
(3)检查容量瓶是否漏水
(4)④⑤
【解析】(1)实验室没有240 mL规格的容量瓶,应配制250 mL 1.0 mol·L-1的NaOH溶液,配制步骤:计算、称量、溶解或稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,则正确的顺序为②①③⑧⑤⑥⑦④;结合操作方法可知,使用的仪器有托盘天平、药匙、烧杯、玻璃棒、250 mL容量瓶、胶头滴管,所以还缺少的仪器为250 mL容量瓶、胶头滴管。(2)结合“左盘物体的质量=右盘物体的质量+游码的读数”可知,烧杯的实际质量为30 g-2.6 g=27.4 g;配制250 mL 1.0 mol·L-1的NaOH溶液,需要NaOH的质量为1.0 mol·L-1×0.25 L×40 g·mol-1=10.0 g。(3)容量瓶带有瓶塞,配制过程中需要摇匀,则使用容量瓶前必须检查容量瓶是否漏水。(4)①没有洗涤烧杯和玻璃棒,溶质质量减小,浓度偏低;②转移溶液时不慎有少量溶液洒到容量瓶外面,溶质质量减小,浓度偏低;③容量瓶不干燥,含有少量蒸馏水,不影响溶液体积和溶质质量,浓度不变;④定容时俯视刻度线,溶液体积偏小,浓度偏高;⑤未冷却到室温就将溶液转移到容量瓶中并定容,冷却后溶液体积减小,浓度偏高;⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液体积增大,浓度偏低。
2
