2.1 第1课时 元素与物质的关系 物质分类与物质性质 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.1 第1课时 元素与物质的关系 物质分类与物质性质 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 765.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 21:39:24 | ||
图片预览




文档简介
2.1 第1课时 元素与物质的关系 物质分类与物质性质
【学习目标】
1.根据物质的组成和性质可以对物质进行分类。
2.感受分类在科研和学习中的重要作用。
3.能从物质的宏观特征入手对物质进行分类和表征。
【自主预习】
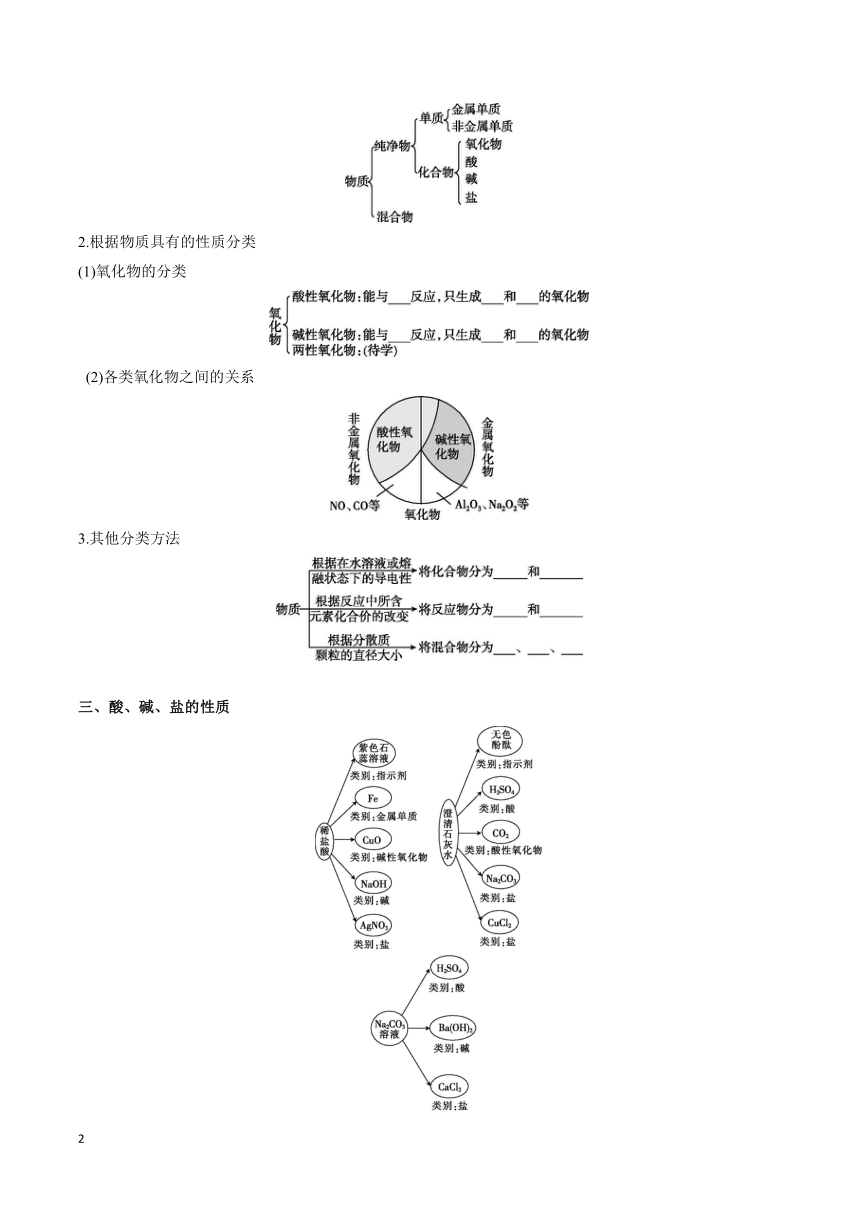
一、元素与物质的关系
1.元素与物质的关系
2.元素的存在形态
3.元素的化合价与物质关系
(1)同一种元素可以存在于不同类别的物质中。
(2)有些元素在不同化合物中可能呈现不同的化合价。
(3)基于核心元素的化合价和物质类别研究物质,为我们认识物质性质和实现物质转化提供了新思路。
(4)碳及其化合物的“价—类”二维图如下
二、物质的分类
1.根据物质的组成分类
2.根据物质具有的性质分类
(1)氧化物的分类
(2)各类氧化物之间的关系
3.其他分类方法
三、酸、碱、盐的性质
1.写出稀盐酸分别与下列物质反应的化学方程式,并注明反应类型。
(1)Fe: ;
反应。
(2)CuO: ;
反应。
(3)NaOH: ;
反应。
(4)AgNO3: ;
反应。
2.写出澄清石灰水分别与下列物质反应的化学方程式,并注明反应类型。
(1)H2SO4: ;
反应。
(2)CO2: ;
反应。
(3)Na2CO3: ;
反应。
(4)CuCl2: ;
反应。
3.写出Na2CO3溶液分别与下列物质反应的化学方程式,并注明反应类型。
(1)H2SO4: ;
反应。
(2)Ba(OH)2: ;
反应。
(3)CaCl2: ;
反应。
不同的酸、碱、盐具有相似的化学性质,从微观角度看,酸溶液中都有 ,碱溶液中都有 ,碳酸盐溶液中都有 等。
四、物质的转化
1.酸性氧化物与碱性氧化物的性质
酸性氧化物:① ;
② ;
③ 。
碱性氧化物:④ ;
⑤ ;
⑥ 。
2.写出物质转化的化学方程式并判断化学反应类型。
(1)单质→氧化物→酸→盐(以碳元素为例)
化学方程式 反应类型
(2)单质→氧化物→碱→盐(以钙元素为例)
化学方程式 反应类型
【参考答案】一、2.单质 化合物
二、2.碱 盐 水 酸 盐 水 3.电解质 非电解质
氧化剂 还原剂 溶液 浊液 胶体
三、1.(1)Fe+2HClFeCl2+H2↑ 置换 (2)CuO+2HClCuCl2+H2O 复分解
(3)NaOH+HClNaCl+H2O 复分解
(4)AgNO3+HClAgCl↓+HNO3 复分解
2.(1)Ca(OH)2+H2SO4CaSO4↓+2H2O 复分解 (2)CO2+Ca(OH)2CaCO3↓+H2O 复分解 (3)Na2CO3+Ca(OH)2CaCO3↓+2NaOH 复分解 (4)CuCl2+Ca(OH)2CaCl2+Cu(OH)2↓ 复分解
3.(1)Na2CO3+H2SO4Na2SO4+H2O+CO2↑
复分解 (2)Na2CO3+Ba(OH)2BaCO3↓+2NaOH 复分解 (3)Na2CO3+CaCl2CaCO3↓+2NaCl 复分解 H+ OH- C
四、1.①与水反应生成相应的含氧酸[除了二氧化硅(SiO2),它不与水反应] ②与碱反应只生成一种盐和水
③与碱性氧化物反应生成盐
④部分碱性氧化物与水反应生成相应的碱
⑤部分碱性氧化物可直接与酸性氧化物反应,高温下,部分碱性氧化物和酸性氧化物作用生成盐
⑥碱性氧化物受热时比较稳定,一般不会分解
2.(1)C+O2CO2 化合反应 CO2+H2OH2CO3 化合反应 Ca(OH)2+H2CO3CaCO3↓+2H2O 复分解反应
(2)2Ca+O22CaO 化合反应
CaO+H2OCa(OH)2 化合反应
Ca(OH)2+2HClCaCl2+2H2O 复分解反应
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)纯净物只由一种原子构成,而混合物由多种原子构成。 ( )
(2)Ca(OH)2既属于碱又属于化合物、纯净物。 ( )
(3)硝酸钾既属于钾盐,又属于硝酸盐。 ( )
(4)所有非金属氧化物都是酸性氧化物。 ( )
(5)CaO、CuO均属于碱性氧化物,能与水反应生成碱。 ( )
(6)能电离出氢离子的化合物都是酸。 ( )
(7)碳酸钙不能一步反应生成氢氧化钙。 ( )
【答案】(1)× (2)√ (3)√ (4)× (5)× (6)×
(7)√
2.有没有既不是酸性氧化物又不是碱性氧化物的氧化物呢 请举例说明。
【答案】有,如CO、NO、NO2、MnO2等。
3.完成下表,从中可得出什么结论
酸性氧化物 对应酸 硫元素化合价
SO2
H2SO4
【答案】
酸性氧化物 对应酸 硫元素化合价
SO2 H2SO3 +4
SO3 H2SO4 +6
在酸性氧化物和对应的酸中,同种元素的化合价相同。
【合作探究】
任务1:物质的分类依据及方法
情境导入
1.2021年在东京奥运会上中国国家体操队以3金3银2铜共计8枚奖牌的优异成绩向全世界展示了中国实力、中国精神。大家在观看比赛的时候发现体操运动员常在手掌上涂擦一种防滑的碳酸镁粉,目的是增加手掌与器械之间的摩擦力,防止从杠上脱手。
2.2021 年9月,国际学术期刊《科学》杂志发表了我国中科院天津工业生物所在人工合成淀粉方面取得重大颠覆性、原创性突破——首次在实验室实现以二氧化碳为原料人工合成淀粉[(C6H10O5)n]。
1.以下有关碳酸镁的说法中正确的是 。
①含有3种元素 ②所含元素均处于游离态 ③属于氧化物 ④属于盐
【答案】①④
2.根据碳酸钙的性质,请你预测碳酸镁(MgCO3)的物理性质和化学性质(各列举两项即可)。
【答案】白色、难溶于水的粉末。加热分解,能够和盐酸反应(答案合理即可)。
3.素材2中涉及的二氧化碳和淀粉[(C6H10O5)n],你能判断出它们所属物质的类别吗
【答案】二氧化碳属于氧化物(或酸性氧化物、无机物等,答案合理即可),淀粉属于有机物。
【核心归纳】
物质的分类
混合物
【典型例题】
【例1】下列各组物质中,按单质、化合物、混合物顺序排列的是( )。
A.铁、氢氧化钠、冰水共存物
B.二氧化碳、水蒸气、硫酸
C.氧气、氧化铜、盐酸
D.水银、空气、干冰
【答案】C
【解析】冰水共存物为纯净物,故A项不符合题意;二氧化碳为化合物,硫酸为纯净物,故B项不符合题意;氧气为单质,氧化铜为化合物,盐酸为混合物,故C项符合题意;空气为混合物,干冰为纯净物,故D项不符合题意。
灵犀一点:由一种元素组成的纯净物为单质;由两种或者两种以上元素组成的纯净物为化合物;由两种或者两种以上物质组成的物质为混合物。
【例2】科学家开发出一种蜂窝状石墨烯。生产原理为Na2O+2CONa2CO3+C(石墨烯)。下列说法正确的是( )。
A.该生产石墨烯的反应属于置换反应
B.石墨烯与金刚石都是由碳元素形成的不同单质
C.Na2O属于碱性氧化物,CO属于酸性氧化物
D.Na2CO3俗名纯碱,其类别属于碱
【答案】B
【解析】生产石墨烯的原理为Na2O+2CONa2CO3+C(石墨烯),反应物是两种化合物,该反应不是置换反应,故A项错误;石墨烯和金刚石是碳元素的不同单质,故B项正确;CO属于不成盐氧化物,与酸、碱都不反应,Na2O属于碱性氧化物,能与酸反应生成盐和水,故C项错误;Na2CO3俗名纯碱,但其类别属于盐,故D项错误。
灵犀一点:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应。
任务2:酸、碱、盐的性质探究
情境导入
1.绿萝是一种观叶植物,枝叶繁茂,叶色好看,可以起到装饰房间、净化空气,缓解视力疲劳和释放氧气、改善空气质量等作用,因此受到不少花友的青睐。如果常给绿萝浇一浇米醋水、橘子水或者柠檬水等“弱酸性水”,可以避免绿萝叶子发黄。
2.南方的土壤多呈酸性,酸雨(主要成分是硫酸和硝酸)是使土壤酸化的原因之一,能影响土壤中生物的活性,改变土壤中养分的形态,降低养分的有效性,促使游离的锰离子、铝离子溶入土壤溶液中,进而对作物产生毒害作用。治理酸雨产生的酸性土壤,可在秋收后,把地里的秸秆杂草收拾干净,每亩撒生石灰100公斤,翻耕,耙匀,调节土壤酸碱度。
问题生成
1.素材1中米醋水中含有醋酸,柠檬水中含有柠檬酸,素材2中的硫酸和硝酸,它们都是酸的一种。为什么不同的酸具有相似的化学性质
【答案】不同的酸在组成上相似,从微观视角来看,不同的酸溶液中都含有H+,从而决定了酸具有酸的通性。
2.如何验证醋酸具有酸性,请说出一个简单可行的办法。
【答案】可以滴加紫色石蕊试液,看其是否变红;可以加入镁粉或碳酸钙粉末,看其是否溶解等(答案合理即可)。
3.素材2中涉及的反应有哪些 写出反应的化学方程式,并注明反应类型。
【答案】CaO+H2O Ca(OH)2(化合反应),Ca(OH)2+2HNO3 Ca(NO3)2+2H2O(复分解反应),Ca(OH)2+H2SO4 CaSO4+2H2O(复分解反应)。
【核心归纳】
1.酸、碱、盐的化学通性
(1)酸的化学通性
酸
(2)碱的化学通性
碱
(3)盐的化学通性
盐
2.氧化物的化学性质
(1)酸性氧化物的化学性质
酸性氧化物
(2)碱性氧化物的化学性质
碱性氧化物
【典型例题】
【例3】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫中有许多“吃人的野兽”(能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。下列说法错误的是( )。
A.若要走出迷宫,用图中物质前的序号连接起来表示所走的路线为③⑥⑩⑦
B.在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有2个
C.能“吃掉”盐酸的盐是Na2CO3,反应的化学方程式为Na2CO3+2HCl2NaCl+H2O+CO2↑
D.如果将盐酸换成氧气,它也能沿着盐酸走出的路线“走出”这个迷宫
【答案】D
【解析】由于盐酸不能和二氧化碳、氯化钠、一氧化碳、铜、硫酸、银等反应,走出迷宫的路线为③⑥⑩⑦,故A项正确;中和反应是酸与碱反应,根据碱的种类确定中和反应的个数,碱有2种,则中和反应有2个,故B项正确;图中能与盐酸反应的盐只有Na2CO3,反应的化学方程式为Na2CO3+2HCl2NaCl+CO2↑+H2O,故C项正确;如果将盐酸换成氧气,不能沿着盐酸走出的路线“走出”这个迷宫,因为氧气遇到CO、Cu、Ag会被“吃掉”,故D项错误。
【例4】现有Mg、CO、CuO、KOH溶液、Na2CO3溶液、Ba(OH)2溶液、H2SO4溶液七种物质,在常温下两种物质间能发生的化学反应有( )。
A.4个 B.5个 C.6个 D.7个
【答案】C
【解析】根据物质的性质,常温下能发生反应的组合有①Mg与H2SO4溶液、②CuO与H2SO4溶液、③KOH溶液与H2SO4溶液、④Na2CO3溶液与Ba(OH)2溶液、⑤Na2CO3溶液与H2SO4溶液、⑥Ba(OH)2溶液与H2SO4溶液,共6个。
灵犀一点:单质、酸、碱、盐、氧化物之间的转化关系
【微点拨】
酸与金属反应可以生成氢气和盐,这是一般规律,但并不是所有的酸都能与金属反应生成氢气。
【随堂检测】
1.某化学反应可用以下微观示意图表示:,其中“”“”“”“”分别表示不同的分子或原子。该反应所属的基本反应类型为( )。
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
【答案】C
【解析】由反应的微观示意图可以看出,反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,因此该反应属于置换反应。
2.化学是一门以实验为主的学科,下列四组实验验证中,不能体现酸的通性的是( )。
【答案】C
【解析】盐酸与BaCl2溶液不反应,而稀H2SO4与BaCl2溶液反应生成BaSO4沉淀,与酸的通性无关。
3.在Zn、ZnO、ZnCO3、HCl溶液和NaCl溶液五种物质中,两种物质反应能生成ZnCl2的组合有( )。
A.2种 B.3种 C.4种 D.5种
【答案】B
【解析】符合题意的反应有Zn+2HClZnCl2+H2↑、ZnO+2HClZnCl2+H2O、ZnCO3+2HClZnCl2+H2O+CO2↑。
4.X、Y、Z、M、N中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )。
A.铜 B.碳 C.铁 D.钙
【答案】D
【解析】X为CaO,Y为Ca(OH)2,Z为Ca(NO3)2,M为CaCl2,N为CaCO3。
5.三星堆古遗址出土的上千件青铜器、金器、玉石器中,最具特色的首推青铜器。其中,大立人青铜像被尊称为“世界铜像之王”。由于时间久远,青铜器表面常有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为Cu2(OH)2CO3,“铜绿”能与酸反应生成铜盐、CO2和H2O。
某同学利用如图所示一系列反应实现了“铜→铜绿→……→Cu”的转化。
铜铜绿CuCl2Cu(OH)2CuOCu
(1)从三种不同分类标准回答,“铜绿”属于 (填物质类别)。
(2)请写出反应②的化学方程式: 。
(3)上述转化过程中属于化合反应的是 (填序号)。
(4)写出反应⑤的化学方程式和反应类型: 、 。
【答案】(1)铜盐、碳酸盐、碱式盐、含氧酸盐等(任选三个即可)。
(2)Cu2(OH)2CO3+4HCl2CuCl2+CO2↑+3H2O
(3)①
(4)CuO+H2Cu+H2O 置换反应
【解析】(1)“铜绿”是Cu2(OH)2CO3,根据盐的分类,它可以属于铜盐、碳酸盐、碱式盐、含氧酸盐等。
(2)由题给信息可知,反应②的化学方程式是Cu2(OH)2CO3+4HCl2CuCl2+CO2↑+3H2O。
(3)反应①是化合反应[2Cu+CO2+O2+H2OCu2(OH)2CO3]。
(4)由题给信息可知,反应⑤的化学方程式是CuO+H2Cu+H2O,属于置换反应。
2
【学习目标】
1.根据物质的组成和性质可以对物质进行分类。
2.感受分类在科研和学习中的重要作用。
3.能从物质的宏观特征入手对物质进行分类和表征。
【自主预习】
一、元素与物质的关系
1.元素与物质的关系
2.元素的存在形态
3.元素的化合价与物质关系
(1)同一种元素可以存在于不同类别的物质中。
(2)有些元素在不同化合物中可能呈现不同的化合价。
(3)基于核心元素的化合价和物质类别研究物质,为我们认识物质性质和实现物质转化提供了新思路。
(4)碳及其化合物的“价—类”二维图如下
二、物质的分类
1.根据物质的组成分类
2.根据物质具有的性质分类
(1)氧化物的分类
(2)各类氧化物之间的关系
3.其他分类方法
三、酸、碱、盐的性质
1.写出稀盐酸分别与下列物质反应的化学方程式,并注明反应类型。
(1)Fe: ;
反应。
(2)CuO: ;
反应。
(3)NaOH: ;
反应。
(4)AgNO3: ;
反应。
2.写出澄清石灰水分别与下列物质反应的化学方程式,并注明反应类型。
(1)H2SO4: ;
反应。
(2)CO2: ;
反应。
(3)Na2CO3: ;
反应。
(4)CuCl2: ;
反应。
3.写出Na2CO3溶液分别与下列物质反应的化学方程式,并注明反应类型。
(1)H2SO4: ;
反应。
(2)Ba(OH)2: ;
反应。
(3)CaCl2: ;
反应。
不同的酸、碱、盐具有相似的化学性质,从微观角度看,酸溶液中都有 ,碱溶液中都有 ,碳酸盐溶液中都有 等。
四、物质的转化
1.酸性氧化物与碱性氧化物的性质
酸性氧化物:① ;
② ;
③ 。
碱性氧化物:④ ;
⑤ ;
⑥ 。
2.写出物质转化的化学方程式并判断化学反应类型。
(1)单质→氧化物→酸→盐(以碳元素为例)
化学方程式 反应类型
(2)单质→氧化物→碱→盐(以钙元素为例)
化学方程式 反应类型
【参考答案】一、2.单质 化合物
二、2.碱 盐 水 酸 盐 水 3.电解质 非电解质
氧化剂 还原剂 溶液 浊液 胶体
三、1.(1)Fe+2HClFeCl2+H2↑ 置换 (2)CuO+2HClCuCl2+H2O 复分解
(3)NaOH+HClNaCl+H2O 复分解
(4)AgNO3+HClAgCl↓+HNO3 复分解
2.(1)Ca(OH)2+H2SO4CaSO4↓+2H2O 复分解 (2)CO2+Ca(OH)2CaCO3↓+H2O 复分解 (3)Na2CO3+Ca(OH)2CaCO3↓+2NaOH 复分解 (4)CuCl2+Ca(OH)2CaCl2+Cu(OH)2↓ 复分解
3.(1)Na2CO3+H2SO4Na2SO4+H2O+CO2↑
复分解 (2)Na2CO3+Ba(OH)2BaCO3↓+2NaOH 复分解 (3)Na2CO3+CaCl2CaCO3↓+2NaCl 复分解 H+ OH- C
四、1.①与水反应生成相应的含氧酸[除了二氧化硅(SiO2),它不与水反应] ②与碱反应只生成一种盐和水
③与碱性氧化物反应生成盐
④部分碱性氧化物与水反应生成相应的碱
⑤部分碱性氧化物可直接与酸性氧化物反应,高温下,部分碱性氧化物和酸性氧化物作用生成盐
⑥碱性氧化物受热时比较稳定,一般不会分解
2.(1)C+O2CO2 化合反应 CO2+H2OH2CO3 化合反应 Ca(OH)2+H2CO3CaCO3↓+2H2O 复分解反应
(2)2Ca+O22CaO 化合反应
CaO+H2OCa(OH)2 化合反应
Ca(OH)2+2HClCaCl2+2H2O 复分解反应
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)纯净物只由一种原子构成,而混合物由多种原子构成。 ( )
(2)Ca(OH)2既属于碱又属于化合物、纯净物。 ( )
(3)硝酸钾既属于钾盐,又属于硝酸盐。 ( )
(4)所有非金属氧化物都是酸性氧化物。 ( )
(5)CaO、CuO均属于碱性氧化物,能与水反应生成碱。 ( )
(6)能电离出氢离子的化合物都是酸。 ( )
(7)碳酸钙不能一步反应生成氢氧化钙。 ( )
【答案】(1)× (2)√ (3)√ (4)× (5)× (6)×
(7)√
2.有没有既不是酸性氧化物又不是碱性氧化物的氧化物呢 请举例说明。
【答案】有,如CO、NO、NO2、MnO2等。
3.完成下表,从中可得出什么结论
酸性氧化物 对应酸 硫元素化合价
SO2
H2SO4
【答案】
酸性氧化物 对应酸 硫元素化合价
SO2 H2SO3 +4
SO3 H2SO4 +6
在酸性氧化物和对应的酸中,同种元素的化合价相同。
【合作探究】
任务1:物质的分类依据及方法
情境导入
1.2021年在东京奥运会上中国国家体操队以3金3银2铜共计8枚奖牌的优异成绩向全世界展示了中国实力、中国精神。大家在观看比赛的时候发现体操运动员常在手掌上涂擦一种防滑的碳酸镁粉,目的是增加手掌与器械之间的摩擦力,防止从杠上脱手。
2.2021 年9月,国际学术期刊《科学》杂志发表了我国中科院天津工业生物所在人工合成淀粉方面取得重大颠覆性、原创性突破——首次在实验室实现以二氧化碳为原料人工合成淀粉[(C6H10O5)n]。
1.以下有关碳酸镁的说法中正确的是 。
①含有3种元素 ②所含元素均处于游离态 ③属于氧化物 ④属于盐
【答案】①④
2.根据碳酸钙的性质,请你预测碳酸镁(MgCO3)的物理性质和化学性质(各列举两项即可)。
【答案】白色、难溶于水的粉末。加热分解,能够和盐酸反应(答案合理即可)。
3.素材2中涉及的二氧化碳和淀粉[(C6H10O5)n],你能判断出它们所属物质的类别吗
【答案】二氧化碳属于氧化物(或酸性氧化物、无机物等,答案合理即可),淀粉属于有机物。
【核心归纳】
物质的分类
混合物
【典型例题】
【例1】下列各组物质中,按单质、化合物、混合物顺序排列的是( )。
A.铁、氢氧化钠、冰水共存物
B.二氧化碳、水蒸气、硫酸
C.氧气、氧化铜、盐酸
D.水银、空气、干冰
【答案】C
【解析】冰水共存物为纯净物,故A项不符合题意;二氧化碳为化合物,硫酸为纯净物,故B项不符合题意;氧气为单质,氧化铜为化合物,盐酸为混合物,故C项符合题意;空气为混合物,干冰为纯净物,故D项不符合题意。
灵犀一点:由一种元素组成的纯净物为单质;由两种或者两种以上元素组成的纯净物为化合物;由两种或者两种以上物质组成的物质为混合物。
【例2】科学家开发出一种蜂窝状石墨烯。生产原理为Na2O+2CONa2CO3+C(石墨烯)。下列说法正确的是( )。
A.该生产石墨烯的反应属于置换反应
B.石墨烯与金刚石都是由碳元素形成的不同单质
C.Na2O属于碱性氧化物,CO属于酸性氧化物
D.Na2CO3俗名纯碱,其类别属于碱
【答案】B
【解析】生产石墨烯的原理为Na2O+2CONa2CO3+C(石墨烯),反应物是两种化合物,该反应不是置换反应,故A项错误;石墨烯和金刚石是碳元素的不同单质,故B项正确;CO属于不成盐氧化物,与酸、碱都不反应,Na2O属于碱性氧化物,能与酸反应生成盐和水,故C项错误;Na2CO3俗名纯碱,但其类别属于盐,故D项错误。
灵犀一点:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应。
任务2:酸、碱、盐的性质探究
情境导入
1.绿萝是一种观叶植物,枝叶繁茂,叶色好看,可以起到装饰房间、净化空气,缓解视力疲劳和释放氧气、改善空气质量等作用,因此受到不少花友的青睐。如果常给绿萝浇一浇米醋水、橘子水或者柠檬水等“弱酸性水”,可以避免绿萝叶子发黄。
2.南方的土壤多呈酸性,酸雨(主要成分是硫酸和硝酸)是使土壤酸化的原因之一,能影响土壤中生物的活性,改变土壤中养分的形态,降低养分的有效性,促使游离的锰离子、铝离子溶入土壤溶液中,进而对作物产生毒害作用。治理酸雨产生的酸性土壤,可在秋收后,把地里的秸秆杂草收拾干净,每亩撒生石灰100公斤,翻耕,耙匀,调节土壤酸碱度。
问题生成
1.素材1中米醋水中含有醋酸,柠檬水中含有柠檬酸,素材2中的硫酸和硝酸,它们都是酸的一种。为什么不同的酸具有相似的化学性质
【答案】不同的酸在组成上相似,从微观视角来看,不同的酸溶液中都含有H+,从而决定了酸具有酸的通性。
2.如何验证醋酸具有酸性,请说出一个简单可行的办法。
【答案】可以滴加紫色石蕊试液,看其是否变红;可以加入镁粉或碳酸钙粉末,看其是否溶解等(答案合理即可)。
3.素材2中涉及的反应有哪些 写出反应的化学方程式,并注明反应类型。
【答案】CaO+H2O Ca(OH)2(化合反应),Ca(OH)2+2HNO3 Ca(NO3)2+2H2O(复分解反应),Ca(OH)2+H2SO4 CaSO4+2H2O(复分解反应)。
【核心归纳】
1.酸、碱、盐的化学通性
(1)酸的化学通性
酸
(2)碱的化学通性
碱
(3)盐的化学通性
盐
2.氧化物的化学性质
(1)酸性氧化物的化学性质
酸性氧化物
(2)碱性氧化物的化学性质
碱性氧化物
【典型例题】
【例3】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫中有许多“吃人的野兽”(能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。下列说法错误的是( )。
A.若要走出迷宫,用图中物质前的序号连接起来表示所走的路线为③⑥⑩⑦
B.在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有2个
C.能“吃掉”盐酸的盐是Na2CO3,反应的化学方程式为Na2CO3+2HCl2NaCl+H2O+CO2↑
D.如果将盐酸换成氧气,它也能沿着盐酸走出的路线“走出”这个迷宫
【答案】D
【解析】由于盐酸不能和二氧化碳、氯化钠、一氧化碳、铜、硫酸、银等反应,走出迷宫的路线为③⑥⑩⑦,故A项正确;中和反应是酸与碱反应,根据碱的种类确定中和反应的个数,碱有2种,则中和反应有2个,故B项正确;图中能与盐酸反应的盐只有Na2CO3,反应的化学方程式为Na2CO3+2HCl2NaCl+CO2↑+H2O,故C项正确;如果将盐酸换成氧气,不能沿着盐酸走出的路线“走出”这个迷宫,因为氧气遇到CO、Cu、Ag会被“吃掉”,故D项错误。
【例4】现有Mg、CO、CuO、KOH溶液、Na2CO3溶液、Ba(OH)2溶液、H2SO4溶液七种物质,在常温下两种物质间能发生的化学反应有( )。
A.4个 B.5个 C.6个 D.7个
【答案】C
【解析】根据物质的性质,常温下能发生反应的组合有①Mg与H2SO4溶液、②CuO与H2SO4溶液、③KOH溶液与H2SO4溶液、④Na2CO3溶液与Ba(OH)2溶液、⑤Na2CO3溶液与H2SO4溶液、⑥Ba(OH)2溶液与H2SO4溶液,共6个。
灵犀一点:单质、酸、碱、盐、氧化物之间的转化关系
【微点拨】
酸与金属反应可以生成氢气和盐,这是一般规律,但并不是所有的酸都能与金属反应生成氢气。
【随堂检测】
1.某化学反应可用以下微观示意图表示:,其中“”“”“”“”分别表示不同的分子或原子。该反应所属的基本反应类型为( )。
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
【答案】C
【解析】由反应的微观示意图可以看出,反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,因此该反应属于置换反应。
2.化学是一门以实验为主的学科,下列四组实验验证中,不能体现酸的通性的是( )。
【答案】C
【解析】盐酸与BaCl2溶液不反应,而稀H2SO4与BaCl2溶液反应生成BaSO4沉淀,与酸的通性无关。
3.在Zn、ZnO、ZnCO3、HCl溶液和NaCl溶液五种物质中,两种物质反应能生成ZnCl2的组合有( )。
A.2种 B.3种 C.4种 D.5种
【答案】B
【解析】符合题意的反应有Zn+2HClZnCl2+H2↑、ZnO+2HClZnCl2+H2O、ZnCO3+2HClZnCl2+H2O+CO2↑。
4.X、Y、Z、M、N中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )。
A.铜 B.碳 C.铁 D.钙
【答案】D
【解析】X为CaO,Y为Ca(OH)2,Z为Ca(NO3)2,M为CaCl2,N为CaCO3。
5.三星堆古遗址出土的上千件青铜器、金器、玉石器中,最具特色的首推青铜器。其中,大立人青铜像被尊称为“世界铜像之王”。由于时间久远,青铜器表面常有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为Cu2(OH)2CO3,“铜绿”能与酸反应生成铜盐、CO2和H2O。
某同学利用如图所示一系列反应实现了“铜→铜绿→……→Cu”的转化。
铜铜绿CuCl2Cu(OH)2CuOCu
(1)从三种不同分类标准回答,“铜绿”属于 (填物质类别)。
(2)请写出反应②的化学方程式: 。
(3)上述转化过程中属于化合反应的是 (填序号)。
(4)写出反应⑤的化学方程式和反应类型: 、 。
【答案】(1)铜盐、碳酸盐、碱式盐、含氧酸盐等(任选三个即可)。
(2)Cu2(OH)2CO3+4HCl2CuCl2+CO2↑+3H2O
(3)①
(4)CuO+H2Cu+H2O 置换反应
【解析】(1)“铜绿”是Cu2(OH)2CO3,根据盐的分类,它可以属于铜盐、碳酸盐、碱式盐、含氧酸盐等。
(2)由题给信息可知,反应②的化学方程式是Cu2(OH)2CO3+4HCl2CuCl2+CO2↑+3H2O。
(3)反应①是化合反应[2Cu+CO2+O2+H2OCu2(OH)2CO3]。
(4)由题给信息可知,反应⑤的化学方程式是CuO+H2Cu+H2O,属于置换反应。
2
