2.3 第3课时 氧化还原反应的应用 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3 第3课时 氧化还原反应的应用 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 595.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 21:42:03 | ||
图片预览




文档简介
2.3 第3课时 氧化还原反应的应用
【学习目标】
1.能从元素价态的角度,依据氧化还原反应原理,预测物质的化学性质和变化,并能设计实验进行初步验证,能分析解释有关实验现象。
2.能从元素价态变化的视角说明物质的转化路径。
3.依据氧化还原反应的原理,掌握氯气的实验室制法。
【自主预习】
一、氧化还原反应在研究物质性质中的应用
1.研究物质氧化性或还原性的思路
2.过氧化氢(H2O2)氧化性及还原性的探究
性质预测 氧元素化合价为 价,可升高到 价,具有 氧元素化合价由 价可降低到 价,具有氧化性
选择试剂 、
实验操作
实验现象 酸性高锰酸钾溶液 ,产生 ,该气体能使 淀粉-KI溶液变
实验结论 H2O2表现 ,被 为 H2O2表现 ,被还原为
总结:H2O2的性质
3.物质氧化性或还原性的影响因素
(1)物质氧化性或还原性的强弱由物质得失电子能力的强弱决定。
(2)环境条件也会影响物质氧化性或还原性的强弱。如酸性越强,KMnO4的氧化性 。
二、氧化还原反应在物质转化和能量转化中的应用
1.氧化还原反应在物质转化中的应用
(1)冶炼金属
①金属冶炼的本质:
金属阳离子 被还原生成金属单质,
Mn++ne- 。
②金属冶炼的方法
a.电解法
原理:利用外加电源提供电子,使金属元素的化合价降低,从而完成还原反应获得金属单质。
例如,电解熔融氧化铝制铝:2Al2O3(熔融)4Al+3O2↑。
b.热还原法
原理:用C、CO等物质作还原剂,在加热条件下将金属氧化物还原为金属单质。
如:Fe2O3+3CO 。
c.湿法冶金
原理:利用活泼金属做还原剂,将目标金属从其盐溶液中还原出来。
如:CuSO4+Fe 。
d.热分解法
原理:在加热条件下,物质自身发生氧化还原反应,将金属还原出来。
如:2HgO2Hg+O2↑。
(2)实验室制取氯气
①制备原理
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
该反应为氧化还原反应,氧化剂为 ,还原剂为 。
②仪器装置
装置C的作用: ;
装置D的作用: 。
③收集方法: 排空气法。
④验满方法
a.将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸 ,则证明已集满。
b.将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸 ,则证明已集满。
⑤尾气吸收:用氢氧化钠溶液吸收,反应的化学方程式为2NaOH+Cl2NaCl+NaClO+H2O,氯气既表现 性又表现 性。
⑥其他方法:高锰酸钾与浓盐酸在常温下反应,反应的化学方程式为2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂为 。
2.利用氧化还原反应获取能量
【参考答案】一、1.还原性 氧化性 氧化性 还原性
2.-1 0 还原性 -1 -2 酸性高锰酸钾溶液
KI溶液 淀粉溶液 紫色褪去 无色无味气体 带火星的木条复燃 蓝色 还原性 氧化 氧气 氧化性 H2O 2H2O22H2O+O2↑
3.越强
二、1.(1)得电子 M 2Fe+3CO2 FeSO4+Cu
(2)MnO2 HCl 除去Cl2中少量的HCl气体 干燥氯气(或除去Cl2中的H2O) 向上 变蓝 先变红后褪色 氧化 还原 KMnO4
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)HCl既有氧化性,又有还原性。 ( )
(2)反应Ag2O+H2O22Ag+O2↑+H2O中,H2O2体现氧化性。 ( )
(3)H2O2既有氧化性又有还原性。 ( )
(4)用二氧化锰和浓盐酸反应制备氯气,浓盐酸在反应中起到酸性和氧化剂作用。 ( )
(5)向KMnO4晶体中滴加浓盐酸,产生黄绿色气体,该反应中浓盐酸作氧化剂。 ( )
(6)对氯气进行尾气处理时,不能用澄清石灰水来吸收Cl2。 ( )
(7)实验室制备氯气,在装药品之前需要检验装置气密性。 ( )
(8)溶液中加AgNO3溶液,有白色沉淀产生,说明溶液中一定含Cl-或C。 ( )
【答案】(1)√ (2)× (3)√ (4)× (5)× (6)√
(7)√ (8)×
2.初中化学实验中,选择气体收集装置时,主要考虑哪些因素
【答案】气体密度、气体在水中的溶解度、气体是否与水反应等。
3.实验室制取氯气的反应中盐酸体现什么性质 你能用双线桥法表示该反应吗
【答案】盐酸体现还原性和酸性,
。
4.教材实验【活动·探究】中证明过氧化氢既具有氧化性又具有还原性的依据是什么
【答案】过氧化氢可以把KI中的I-氧化为I2,证明过氧化氢具有氧化性;过氧化氢中-1价的氧元素被酸性KMnO4溶液氧化为O2,证明过氧化氢具有还原性。
5.教材P68“无论是哪种冶炼方法,其本质都是利用氧化还原反应中的电子转移,使被还原的化合物中的金属元素的化合价从正价降低至0价,生成金属单质。”金属元素被还原一定生成金属单质吗 金属冶炼过程中一定需要加入还原剂吗
【答案】金属阳离子被还原,化合价一定降低,但是不一定生成金属单质,如Fe3+可能被还原成Fe2+;金属冶炼过程中未必加入还原剂,如电解法制备金属钠。
【合作探究】
任务1:氧化还原反应在物质转化中的应用
情境导入 我国的劳动人民在春秋时期就会冶铁,比欧洲早了近2000年,并且我国铁矿石的储量居世界第一,从1996年开始我国年钢产量连续超1亿吨,位居世界首位。
高炉生产时从炉顶装入铁矿石(主要成分是Fe2O3)、焦炭、造渣用熔剂(石灰石),从位于炉子下部沿炉周的风口吹入经预热的空气。高温下焦炭在鼓入的空气中燃烧生成一氧化碳,一氧化碳在炉内上升过程中除去铁矿石中的氧,从而得到铁。
问题生成
1.上述过程中涉及的氧化还原反应有哪些 用化学方程式表示。
【答案】C + O2CO2、C+CO22CO、Fe2O3+3CO2Fe+3CO2。
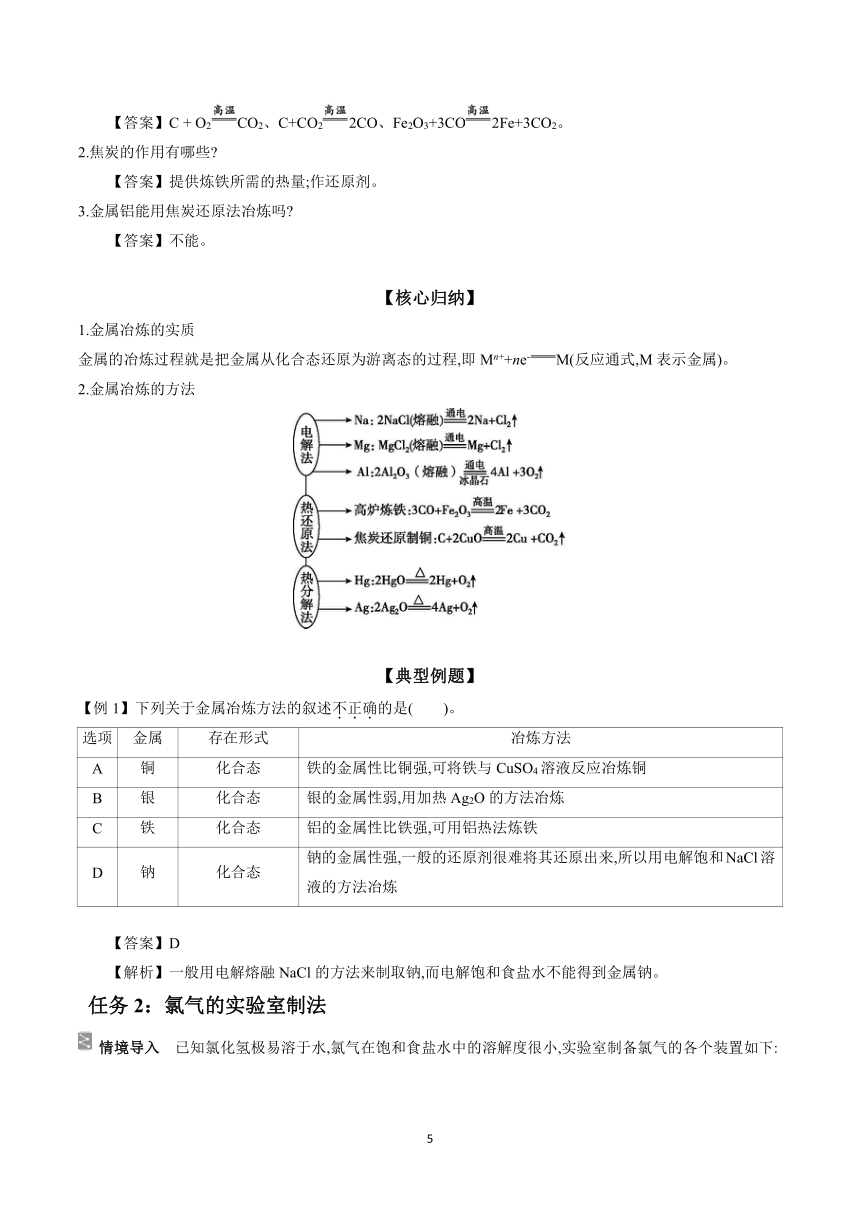
2.焦炭的作用有哪些
【答案】提供炼铁所需的热量;作还原剂。
3.金属铝能用焦炭还原法冶炼吗
【答案】不能。
【核心归纳】
1.金属冶炼的实质
金属的冶炼过程就是把金属从化合态还原为游离态的过程,即Mn++ne-M(反应通式,M表示金属)。
2.金属冶炼的方法
【典型例题】
【例1】下列关于金属冶炼方法的叙述不正确的是( )。
选项 金属 存在形式 冶炼方法
A 铜 化合态 铁的金属性比铜强,可将铁与CuSO4溶液反应冶炼铜
B 银 化合态 银的金属性弱,用加热Ag2O的方法冶炼
C 铁 化合态 铝的金属性比铁强,可用铝热法炼铁
D 钠 化合态 钠的金属性强,一般的还原剂很难将其还原出来,所以用电解饱和NaCl溶液的方法冶炼
【答案】D
【解析】一般用电解熔融NaCl的方法来制取钠,而电解饱和食盐水不能得到金属钠。
任务2:氯气的实验室制法
情境导入 已知氯化氢极易溶于水,氯气在饱和食盐水中的溶解度很小,实验室制备氯气的各个装置如下:
问题生成
1.饱和食盐水的作用是什么 饱和食盐水能不能换成Na2CO3溶液 饱和食盐水和浓硫酸的顺序能颠倒吗
【答案】除去氯气中的HCl。不能,Na2CO3溶液吸收Cl2和HCl,同时生成杂质气体CO2。不能颠倒。
2.收集Cl2除了用向上排空气法外还可用什么方法
【答案】排饱和食盐水法。
3.如何检验Cl2
【答案】将湿润的淀粉-KI试纸放于管口,试纸变蓝或将湿润的蓝色石蕊试纸放于管口,试纸先变红后褪色。
4.通过氯气的制备,归纳总结实验室制取气体装置的设计模型。
【答案】
【核心归纳】
1.实验室制备氯气的流程
2.实验室制备氯气的注意事项
(1)可用KMnO4、K2Cr2O7、KClO3、Ca(ClO)2等作氧化剂与浓盐酸反应制取氯气,使用以上物质时,反应不需要加热,如KClO3+6HCl(浓)KCl+3Cl2↑+3H2O。
(2)用盐酸与MnO2反应制取氯气时,必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
(3)氯气难溶于饱和食盐水,故可用饱和食盐水除去混合气体中的HCl,再用浓硫酸除去水蒸气。
(4)用强碱溶液(如NaOH溶液)吸收Cl2,不用Ca(OH)2溶液吸收的原因是Ca(OH)2溶解度小,溶液浓度低,吸收不完全。
(5)收集氯气时,将湿润的淀粉-KI试纸靠近盛Cl2的集气瓶口,观察到试纸立即变蓝,则证明已集满;或将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,观察到试纸先变红后褪色,则证明已集满。
(6)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
【典型例题】
【例2】利用如图所示装置可以制备无水氯化铁。下列有关说法不正确的是( )。
A.烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D中分别盛有饱和食盐水和浓硫酸
C.装置D和装置E之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的作用是吸收尾气
【答案】C
【解析】装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁,C项错误。
【例3】实验室利用如图所示装置制备干燥、纯净的氯气。下列有关叙述不正确的是( )。
A.本实验操作顺序:检验装置气密性→添加固体药品→添加液体药品→加热
B.装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液
C.氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气
D.装置Ⅴ中反应的离子方程式为Cl2+2OH-Cl-+ClO-+H2O
【答案】B
【解析】本实验的操作顺序为检验装置气密性→在圆底烧瓶中添加固体药品二氧化锰→通过分液漏斗添加液体药品浓盐酸→加热制取氯气,净化干燥后收集,且注意尾气处理,A项正确;装置Ⅱ、Ⅲ中的试剂依次为饱和NaCl溶液、浓硫酸,先除去氯气中的氯化氢气体,后干燥氯气,B项不正确;氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气,利用向上排空气法收集Cl2,C项正确;装置Ⅴ中多余的氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-Cl-+ClO-+H2O,D项正确。
【例4】用KClO3与浓盐酸反应制取氯气的简易装置如图所示。下列说法正确的是( )。
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A中发生反应的化学方程式为KClO3+6HCl(浓)3Cl2↑+KCl+3H2O
C.待没有气泡产生后,向A中加入足量AgNO3溶液,根据沉淀质量可求出剩余盐酸的量
D.装置B盛放的是饱和食盐水,目的是除去HCl
【答案】B
【解析】MnO2与浓盐酸反应需加热,A项错误;剩余盐酸和反应生成的KCl均能与AgNO3反应生成白色沉淀,故无法根据AgCl质量直接求出剩余盐酸的量,C项错误;装置B用于收集Cl2,D项错误。
规律方法:1.常见的气体发生装置
2.常见的除杂装置——用于除去气体中的杂质气体
3.常见的气体收集装置
4.尾气处理装置
(1)点燃法:如CO、H2、CH4等易燃性气体,可用此法。
(2)收集法:用气球或气囊将多余的气体收集储存,如NO、H2、CO等。
(3)吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
【随堂检测】
1.在制氯气时有如下操作,正确的操作顺序是( )。
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出 ③在圆底烧瓶中加入二氧化锰粉末 ④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中 ⑤将多余的Cl2用NaOH溶液吸收 ⑥用向上排空气法收集氯气
A.①②③④⑤⑥ B.③④②①⑥⑤
C.①④③②⑥⑤ D.①③④②⑥⑤
【答案】D
【解析】实验室制取气体的操作要注意:①连接好装置后,要先检查气密性,后装药品;②装药品的顺序是先加固体,后加液体;③若有有毒的气体产生,一定要有尾气处理装置。
2.下列化学反应在金属冶炼工业中还没有得到应用的是( )。
A.2NaCl(熔融)2Na+Cl2↑
B.Al2O3+3C2Al+3CO↑
C.Fe2O3+3CO2Fe+3CO2
D.2Ag2O4Ag+O2↑
【答案】B
【解析】目前金属铝的制备方法是电解熔融氧化铝,其他选项中所涉及的内容均符合理论和生产实际。
3.下列说法中正确的是( )。
A.金属的冶炼都是把金属单质从其矿物中分离出来
B.金属冶炼过程中,被冶炼的金属一定被氧化
C.金属冶炼过程中,被冶炼的金属被还原
D.金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原
【答案】C
【解析】金属的冶炼是将金属从其化合物中还原出来,金属在化合物中只能显正价。冶炼时金属元素的化合价只可能降低,被还原。
4.“绿色氧化剂”过氧化氢可作为采矿业废液的消毒剂,可消除采矿废液中的氰化物(如KCN),化学方程式为KCN+H2O+H2O2A+NH3↑。(已知KCN中C为+2价)
(1)生成物A的化学式为 。
(2)在标准状况下,有0.448 L氨气生成,转移的电子的物质的量为 。
(3)反应中被氧化的元素为 。
(4)H2O2被称为“绿色氧化剂”的理由是 。
【答案】(1)KHCO3 (2)0.04 mol (3)碳(或C) (4)H2O2作氧化剂时,其还原产物一般是H2O,对环境无污染
【解析】(1)根据原子守恒可知,生成物A的化学式为KHCO3。(2)由化学方程式可知,生成1 mol NH3时转移2 mol电子,则在标准状况下,有0.448 L即0.02 mol NH3生成时,转移0.04 mol电子。(3)碳元素化合价升高,反应中被氧化的元素为C。(4)H2O2作氧化剂时,其还原产物一般是H2O,对环境无污染,因此H2O2被称为“绿色氧化剂”。
5.在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所用仪器如图所示:
(1)上述仪器的正确连接顺序: 接 ; 接 ; 接 ; 接 。(填各接口处的字母)
(2)装置中,饱和食盐水的作用是 ;NaOH溶液的作用是 。
(3)①气体发生装置中进行反应的化学方程式为 ;该反应体现浓盐酸的 性、 性。
②NaOH溶液中发生反应的离子方程式为 。
(4)实验室用下列方法制取氯气:①用含146 g氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应。若不考虑氯化氢的挥发,则反应后所得氯气的质量 (填字母)。
A.①比②多 B.②比①多
C.两种方法一样多 D.无法比较
【答案】(1)E C D A B H G F
(2)除去氯气中的HCl杂质 吸收过量的氯气
(3)①MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
酸 还原
②2OH-+Cl2Cl-+ClO-+H2O
(4)B
【解析】实验目的为制取干燥纯净的氯气。浓盐酸具有挥发性,则制取的氯气中含有氯化氢、水蒸气等杂质,在收集前先用饱和食盐水除去HCl杂质,后用浓硫酸除去水蒸气,得到干燥的氯气。氯气的密度大于空气,则用向上排空气法收集氯气,氯气有毒,则需进行尾气处理,用NaOH溶液吸收。
(3)①实验室用二氧化锰与浓盐酸共热制取氯气,化学方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑。反应中,HCl中Cl元素化合价升高,作还原剂,表现还原性;HCl还与二氧化锰反应生成盐和水,表现酸性。
(4)①用含146 g氯化氢的浓盐酸与足量的二氧化锰反应,随着反应的进行,盐酸的浓度减小,到一定程度后则不再反应,生成的氯气的质量小于71 g。②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,可生成71 g氯气。
2
【学习目标】
1.能从元素价态的角度,依据氧化还原反应原理,预测物质的化学性质和变化,并能设计实验进行初步验证,能分析解释有关实验现象。
2.能从元素价态变化的视角说明物质的转化路径。
3.依据氧化还原反应的原理,掌握氯气的实验室制法。
【自主预习】
一、氧化还原反应在研究物质性质中的应用
1.研究物质氧化性或还原性的思路
2.过氧化氢(H2O2)氧化性及还原性的探究
性质预测 氧元素化合价为 价,可升高到 价,具有 氧元素化合价由 价可降低到 价,具有氧化性
选择试剂 、
实验操作
实验现象 酸性高锰酸钾溶液 ,产生 ,该气体能使 淀粉-KI溶液变
实验结论 H2O2表现 ,被 为 H2O2表现 ,被还原为
总结:H2O2的性质
3.物质氧化性或还原性的影响因素
(1)物质氧化性或还原性的强弱由物质得失电子能力的强弱决定。
(2)环境条件也会影响物质氧化性或还原性的强弱。如酸性越强,KMnO4的氧化性 。
二、氧化还原反应在物质转化和能量转化中的应用
1.氧化还原反应在物质转化中的应用
(1)冶炼金属
①金属冶炼的本质:
金属阳离子 被还原生成金属单质,
Mn++ne- 。
②金属冶炼的方法
a.电解法
原理:利用外加电源提供电子,使金属元素的化合价降低,从而完成还原反应获得金属单质。
例如,电解熔融氧化铝制铝:2Al2O3(熔融)4Al+3O2↑。
b.热还原法
原理:用C、CO等物质作还原剂,在加热条件下将金属氧化物还原为金属单质。
如:Fe2O3+3CO 。
c.湿法冶金
原理:利用活泼金属做还原剂,将目标金属从其盐溶液中还原出来。
如:CuSO4+Fe 。
d.热分解法
原理:在加热条件下,物质自身发生氧化还原反应,将金属还原出来。
如:2HgO2Hg+O2↑。
(2)实验室制取氯气
①制备原理
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
该反应为氧化还原反应,氧化剂为 ,还原剂为 。
②仪器装置
装置C的作用: ;
装置D的作用: 。
③收集方法: 排空气法。
④验满方法
a.将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸 ,则证明已集满。
b.将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸 ,则证明已集满。
⑤尾气吸收:用氢氧化钠溶液吸收,反应的化学方程式为2NaOH+Cl2NaCl+NaClO+H2O,氯气既表现 性又表现 性。
⑥其他方法:高锰酸钾与浓盐酸在常温下反应,反应的化学方程式为2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂为 。
2.利用氧化还原反应获取能量
【参考答案】一、1.还原性 氧化性 氧化性 还原性
2.-1 0 还原性 -1 -2 酸性高锰酸钾溶液
KI溶液 淀粉溶液 紫色褪去 无色无味气体 带火星的木条复燃 蓝色 还原性 氧化 氧气 氧化性 H2O 2H2O22H2O+O2↑
3.越强
二、1.(1)得电子 M 2Fe+3CO2 FeSO4+Cu
(2)MnO2 HCl 除去Cl2中少量的HCl气体 干燥氯气(或除去Cl2中的H2O) 向上 变蓝 先变红后褪色 氧化 还原 KMnO4
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)HCl既有氧化性,又有还原性。 ( )
(2)反应Ag2O+H2O22Ag+O2↑+H2O中,H2O2体现氧化性。 ( )
(3)H2O2既有氧化性又有还原性。 ( )
(4)用二氧化锰和浓盐酸反应制备氯气,浓盐酸在反应中起到酸性和氧化剂作用。 ( )
(5)向KMnO4晶体中滴加浓盐酸,产生黄绿色气体,该反应中浓盐酸作氧化剂。 ( )
(6)对氯气进行尾气处理时,不能用澄清石灰水来吸收Cl2。 ( )
(7)实验室制备氯气,在装药品之前需要检验装置气密性。 ( )
(8)溶液中加AgNO3溶液,有白色沉淀产生,说明溶液中一定含Cl-或C。 ( )
【答案】(1)√ (2)× (3)√ (4)× (5)× (6)√
(7)√ (8)×
2.初中化学实验中,选择气体收集装置时,主要考虑哪些因素
【答案】气体密度、气体在水中的溶解度、气体是否与水反应等。
3.实验室制取氯气的反应中盐酸体现什么性质 你能用双线桥法表示该反应吗
【答案】盐酸体现还原性和酸性,
。
4.教材实验【活动·探究】中证明过氧化氢既具有氧化性又具有还原性的依据是什么
【答案】过氧化氢可以把KI中的I-氧化为I2,证明过氧化氢具有氧化性;过氧化氢中-1价的氧元素被酸性KMnO4溶液氧化为O2,证明过氧化氢具有还原性。
5.教材P68“无论是哪种冶炼方法,其本质都是利用氧化还原反应中的电子转移,使被还原的化合物中的金属元素的化合价从正价降低至0价,生成金属单质。”金属元素被还原一定生成金属单质吗 金属冶炼过程中一定需要加入还原剂吗
【答案】金属阳离子被还原,化合价一定降低,但是不一定生成金属单质,如Fe3+可能被还原成Fe2+;金属冶炼过程中未必加入还原剂,如电解法制备金属钠。
【合作探究】
任务1:氧化还原反应在物质转化中的应用
情境导入 我国的劳动人民在春秋时期就会冶铁,比欧洲早了近2000年,并且我国铁矿石的储量居世界第一,从1996年开始我国年钢产量连续超1亿吨,位居世界首位。
高炉生产时从炉顶装入铁矿石(主要成分是Fe2O3)、焦炭、造渣用熔剂(石灰石),从位于炉子下部沿炉周的风口吹入经预热的空气。高温下焦炭在鼓入的空气中燃烧生成一氧化碳,一氧化碳在炉内上升过程中除去铁矿石中的氧,从而得到铁。
问题生成
1.上述过程中涉及的氧化还原反应有哪些 用化学方程式表示。
【答案】C + O2CO2、C+CO22CO、Fe2O3+3CO2Fe+3CO2。
2.焦炭的作用有哪些
【答案】提供炼铁所需的热量;作还原剂。
3.金属铝能用焦炭还原法冶炼吗
【答案】不能。
【核心归纳】
1.金属冶炼的实质
金属的冶炼过程就是把金属从化合态还原为游离态的过程,即Mn++ne-M(反应通式,M表示金属)。
2.金属冶炼的方法
【典型例题】
【例1】下列关于金属冶炼方法的叙述不正确的是( )。
选项 金属 存在形式 冶炼方法
A 铜 化合态 铁的金属性比铜强,可将铁与CuSO4溶液反应冶炼铜
B 银 化合态 银的金属性弱,用加热Ag2O的方法冶炼
C 铁 化合态 铝的金属性比铁强,可用铝热法炼铁
D 钠 化合态 钠的金属性强,一般的还原剂很难将其还原出来,所以用电解饱和NaCl溶液的方法冶炼
【答案】D
【解析】一般用电解熔融NaCl的方法来制取钠,而电解饱和食盐水不能得到金属钠。
任务2:氯气的实验室制法
情境导入 已知氯化氢极易溶于水,氯气在饱和食盐水中的溶解度很小,实验室制备氯气的各个装置如下:
问题生成
1.饱和食盐水的作用是什么 饱和食盐水能不能换成Na2CO3溶液 饱和食盐水和浓硫酸的顺序能颠倒吗
【答案】除去氯气中的HCl。不能,Na2CO3溶液吸收Cl2和HCl,同时生成杂质气体CO2。不能颠倒。
2.收集Cl2除了用向上排空气法外还可用什么方法
【答案】排饱和食盐水法。
3.如何检验Cl2
【答案】将湿润的淀粉-KI试纸放于管口,试纸变蓝或将湿润的蓝色石蕊试纸放于管口,试纸先变红后褪色。
4.通过氯气的制备,归纳总结实验室制取气体装置的设计模型。
【答案】
【核心归纳】
1.实验室制备氯气的流程
2.实验室制备氯气的注意事项
(1)可用KMnO4、K2Cr2O7、KClO3、Ca(ClO)2等作氧化剂与浓盐酸反应制取氯气,使用以上物质时,反应不需要加热,如KClO3+6HCl(浓)KCl+3Cl2↑+3H2O。
(2)用盐酸与MnO2反应制取氯气时,必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
(3)氯气难溶于饱和食盐水,故可用饱和食盐水除去混合气体中的HCl,再用浓硫酸除去水蒸气。
(4)用强碱溶液(如NaOH溶液)吸收Cl2,不用Ca(OH)2溶液吸收的原因是Ca(OH)2溶解度小,溶液浓度低,吸收不完全。
(5)收集氯气时,将湿润的淀粉-KI试纸靠近盛Cl2的集气瓶口,观察到试纸立即变蓝,则证明已集满;或将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,观察到试纸先变红后褪色,则证明已集满。
(6)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
【典型例题】
【例2】利用如图所示装置可以制备无水氯化铁。下列有关说法不正确的是( )。
A.烧瓶B中制备氯气的反应物为二氧化锰和浓盐酸
B.装置C、D中分别盛有饱和食盐水和浓硫酸
C.装置D和装置E之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的作用是吸收尾气
【答案】C
【解析】装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁,C项错误。
【例3】实验室利用如图所示装置制备干燥、纯净的氯气。下列有关叙述不正确的是( )。
A.本实验操作顺序:检验装置气密性→添加固体药品→添加液体药品→加热
B.装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液
C.氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气
D.装置Ⅴ中反应的离子方程式为Cl2+2OH-Cl-+ClO-+H2O
【答案】B
【解析】本实验的操作顺序为检验装置气密性→在圆底烧瓶中添加固体药品二氧化锰→通过分液漏斗添加液体药品浓盐酸→加热制取氯气,净化干燥后收集,且注意尾气处理,A项正确;装置Ⅱ、Ⅲ中的试剂依次为饱和NaCl溶液、浓硫酸,先除去氯气中的氯化氢气体,后干燥氯气,B项不正确;氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气,利用向上排空气法收集Cl2,C项正确;装置Ⅴ中多余的氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-Cl-+ClO-+H2O,D项正确。
【例4】用KClO3与浓盐酸反应制取氯气的简易装置如图所示。下列说法正确的是( )。
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A中发生反应的化学方程式为KClO3+6HCl(浓)3Cl2↑+KCl+3H2O
C.待没有气泡产生后,向A中加入足量AgNO3溶液,根据沉淀质量可求出剩余盐酸的量
D.装置B盛放的是饱和食盐水,目的是除去HCl
【答案】B
【解析】MnO2与浓盐酸反应需加热,A项错误;剩余盐酸和反应生成的KCl均能与AgNO3反应生成白色沉淀,故无法根据AgCl质量直接求出剩余盐酸的量,C项错误;装置B用于收集Cl2,D项错误。
规律方法:1.常见的气体发生装置
2.常见的除杂装置——用于除去气体中的杂质气体
3.常见的气体收集装置
4.尾气处理装置
(1)点燃法:如CO、H2、CH4等易燃性气体,可用此法。
(2)收集法:用气球或气囊将多余的气体收集储存,如NO、H2、CO等。
(3)吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
【随堂检测】
1.在制氯气时有如下操作,正确的操作顺序是( )。
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出 ③在圆底烧瓶中加入二氧化锰粉末 ④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中 ⑤将多余的Cl2用NaOH溶液吸收 ⑥用向上排空气法收集氯气
A.①②③④⑤⑥ B.③④②①⑥⑤
C.①④③②⑥⑤ D.①③④②⑥⑤
【答案】D
【解析】实验室制取气体的操作要注意:①连接好装置后,要先检查气密性,后装药品;②装药品的顺序是先加固体,后加液体;③若有有毒的气体产生,一定要有尾气处理装置。
2.下列化学反应在金属冶炼工业中还没有得到应用的是( )。
A.2NaCl(熔融)2Na+Cl2↑
B.Al2O3+3C2Al+3CO↑
C.Fe2O3+3CO2Fe+3CO2
D.2Ag2O4Ag+O2↑
【答案】B
【解析】目前金属铝的制备方法是电解熔融氧化铝,其他选项中所涉及的内容均符合理论和生产实际。
3.下列说法中正确的是( )。
A.金属的冶炼都是把金属单质从其矿物中分离出来
B.金属冶炼过程中,被冶炼的金属一定被氧化
C.金属冶炼过程中,被冶炼的金属被还原
D.金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原
【答案】C
【解析】金属的冶炼是将金属从其化合物中还原出来,金属在化合物中只能显正价。冶炼时金属元素的化合价只可能降低,被还原。
4.“绿色氧化剂”过氧化氢可作为采矿业废液的消毒剂,可消除采矿废液中的氰化物(如KCN),化学方程式为KCN+H2O+H2O2A+NH3↑。(已知KCN中C为+2价)
(1)生成物A的化学式为 。
(2)在标准状况下,有0.448 L氨气生成,转移的电子的物质的量为 。
(3)反应中被氧化的元素为 。
(4)H2O2被称为“绿色氧化剂”的理由是 。
【答案】(1)KHCO3 (2)0.04 mol (3)碳(或C) (4)H2O2作氧化剂时,其还原产物一般是H2O,对环境无污染
【解析】(1)根据原子守恒可知,生成物A的化学式为KHCO3。(2)由化学方程式可知,生成1 mol NH3时转移2 mol电子,则在标准状况下,有0.448 L即0.02 mol NH3生成时,转移0.04 mol电子。(3)碳元素化合价升高,反应中被氧化的元素为C。(4)H2O2作氧化剂时,其还原产物一般是H2O,对环境无污染,因此H2O2被称为“绿色氧化剂”。
5.在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气,所用仪器如图所示:
(1)上述仪器的正确连接顺序: 接 ; 接 ; 接 ; 接 。(填各接口处的字母)
(2)装置中,饱和食盐水的作用是 ;NaOH溶液的作用是 。
(3)①气体发生装置中进行反应的化学方程式为 ;该反应体现浓盐酸的 性、 性。
②NaOH溶液中发生反应的离子方程式为 。
(4)实验室用下列方法制取氯气:①用含146 g氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应。若不考虑氯化氢的挥发,则反应后所得氯气的质量 (填字母)。
A.①比②多 B.②比①多
C.两种方法一样多 D.无法比较
【答案】(1)E C D A B H G F
(2)除去氯气中的HCl杂质 吸收过量的氯气
(3)①MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
酸 还原
②2OH-+Cl2Cl-+ClO-+H2O
(4)B
【解析】实验目的为制取干燥纯净的氯气。浓盐酸具有挥发性,则制取的氯气中含有氯化氢、水蒸气等杂质,在收集前先用饱和食盐水除去HCl杂质,后用浓硫酸除去水蒸气,得到干燥的氯气。氯气的密度大于空气,则用向上排空气法收集氯气,氯气有毒,则需进行尾气处理,用NaOH溶液吸收。
(3)①实验室用二氧化锰与浓盐酸共热制取氯气,化学方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑。反应中,HCl中Cl元素化合价升高,作还原剂,表现还原性;HCl还与二氧化锰反应生成盐和水,表现酸性。
(4)①用含146 g氯化氢的浓盐酸与足量的二氧化锰反应,随着反应的进行,盐酸的浓度减小,到一定程度后则不再反应,生成的氯气的质量小于71 g。②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,可生成71 g氯气。
2
