3.1 第1课时 亚铁盐与铁盐 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.1 第1课时 亚铁盐与铁盐 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 370.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 21:42:15 | ||
图片预览



文档简介
3.1 第1课时 亚铁盐与铁盐
【学习目标】
1.了解含铁物质在自然界中的存在形式,知道含铁物质与社会生产、生活密切相关。
2.探究亚铁盐与铁盐的性质,能分析、解释有关实验现象。
3.认识亚铁盐与铁盐的还原性和氧化性,并能设计实验进行验证。
4.能用离子方程式表示亚铁盐与铁盐的相互转化。
【自主预习】
一、铁及铁元素的存在
1.铁元素在自然界中的含量
铁元素在地壳中的含量处于第 位,仅次于 、 和 元素。
2.铁元素的存在形态
(1)游离态:如陨铁
(2)化合态
二、亚铁盐和铁盐
1.亚铁盐和铁盐的组成
亚铁盐 铁盐
组成 含有 的盐 含有 的盐
常见物质 FeSO4·7H2O(绿色)、FeCl2等 FeCl3·6H2O(黄色)、Fe2(SO4)3(黄色)、Fe(NO3)3等
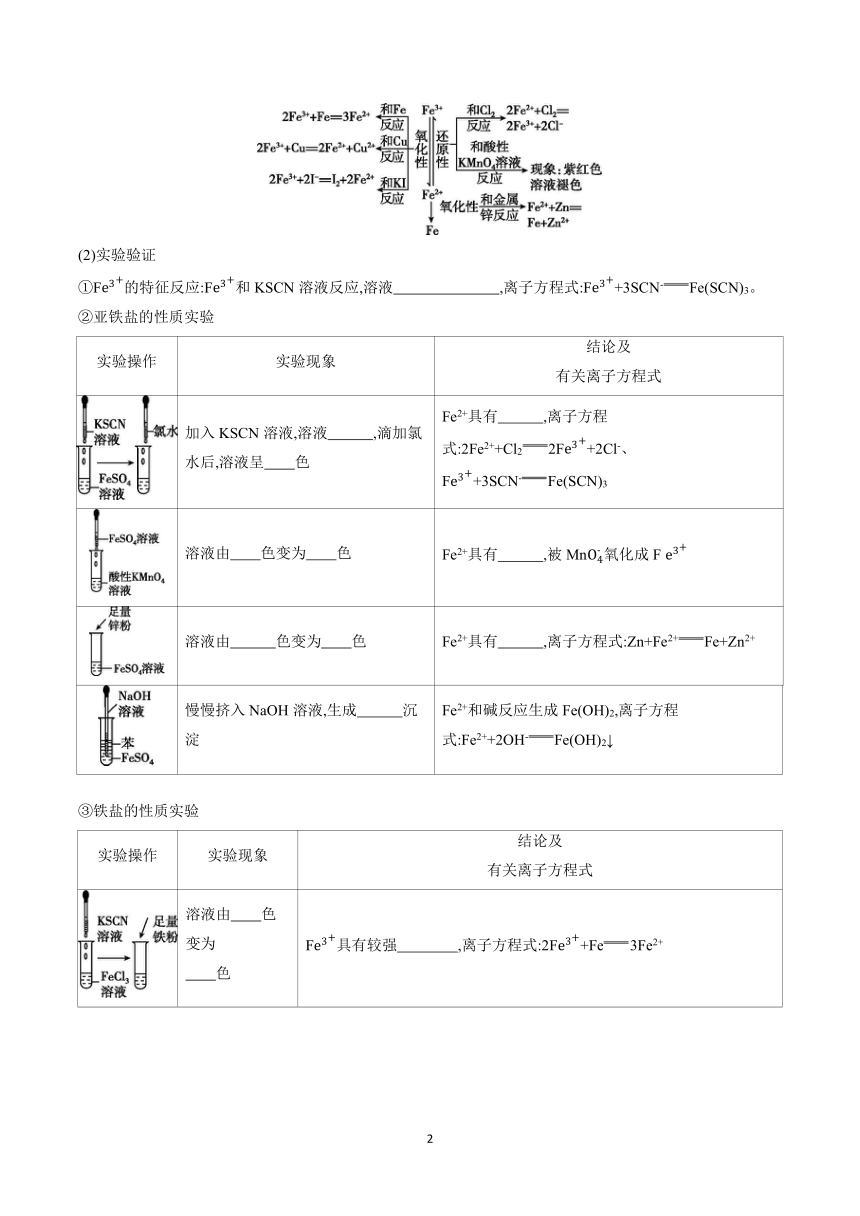
2.亚铁盐和铁盐的性质探究(以FeSO4、FeCl3为例)
(1)预测
①从物质类别预测Fe2+和F性质:
FeSO4和FeCl3都属于盐类,能和碱反应生成 及 。
②从化合价角度预测Fe2+和F性质:
(2)实验验证
①F的特征反应:F和KSCN溶液反应,溶液 ,离子方程式:F+3SCN-Fe(SCN)3。
②亚铁盐的性质实验
实验操作 实验现象 结论及 有关离子方程式
加入KSCN溶液,溶液 ,滴加氯水后,溶液呈 色 Fe2+具有 ,离子方程式:2Fe2++Cl22F+2Cl-、F+3SCN-Fe(SCN)3
溶液由 色变为 色 Fe2+具有 ,被Mn氧化成F
溶液由 色变为 色 Fe2+具有 ,离子方程式:Zn+Fe2+Fe+Zn2+
慢慢挤入NaOH溶液,生成 沉淀 Fe2+和碱反应生成Fe(OH)2,离子方程式:Fe2++2OH-Fe(OH)2↓
③铁盐的性质实验
实验操作 实验现象 结论及 有关离子方程式
溶液由 色变为 色 F具有较强 ,离子方程式:2F+Fe3Fe2+
溶液红色 ,变为 F具有较强 ,离子方程式:Cu+2FCu2++2Fe2+
产生 沉淀 F和碱反应生成Fe(OH)3,离子方程式:F+3OH-Fe(OH)3↓
【参考答案】一、1.四 氧 硅 铝
二、1.Fe2+ Fe3+ 2.(1)Fe(OH)2 Fe(OH)3
(2)①显红色 ②无现象 红 还原性 紫红 黄 还原性 浅绿 无 氧化性 白色 ③红 浅绿 氧化性 消失 蓝色 氧化性 红褐色
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)铁元素性质活泼,自然界中不存在单质铁。 ( )
(2)铁能被磁铁吸引,则任何金属都能被磁铁吸引。( )
(3)铁元素在地壳中的含量排在第2位。 ( )
(4)FeSO4溶液在空气中长久放置后显棕黄色。 ( )
(5)向溶液中加KSCN溶液,溶液变为红色,说明溶液中含Fe3+。 ( )
(6)用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2。 ( )
(7)在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的铁粉。 ( )
【答案】(1)× (2)× (3)× (4)√ (5)√ (6)×
(7)√
2.教材P82“铁锅的主要成分是铁单质”,那么使用铁锅炒菜可以补充人体内的铁元素吗
【答案】可以,铁与酸性物质反应生成亚铁盐能有效补充铁元素。
3.Fe3O4是一种黑色固体,具有导磁性,硬度很大。它不但可以作磨料,还可作颜料和抛光剂。如何证明Fe3O4中既有+2价铁又有+3价铁
【答案】取一定量Fe3O4溶于稀硫酸,形成溶液,分别取少量该溶液于两支试管中。一支试管中加入KSCN溶液,溶液变红,说明含有Fe3+,证明Fe3O4中有+3价铁;另一支试管中加入酸性KMnO4溶液,紫红色褪去,说明含有Fe2+,证明Fe3O4中有+2价铁。
【合作探究】
任务1:铁元素的存在
情境导入 指南针是我国古代的四大发明之一,它的发明对人类的科学技术和文明的发展起了无可估量的作用。我国人民很早就知道磁铁矿具有磁性这一特征,人们在用线悬空磁铁矿石的过程中发现,当磁石静止时,它的一头总是指着北方,而另一头总是指着南方。
到了战国时期,由于战争连绵不断,许多人为躲避战乱,不得不迁徙到其他地方。可是,在行走时需要认清方向,那么人们是怎么辨识方向的 人们想到了磁石的特性,但用线悬吊起来的磁石虽然指出了南北方向,然而究竟哪边是南哪边是北
后来,有人把磁石磨成一把汤匙的形状,放在平滑的青铜盘上,这把汤匙的柄指向南方.这样就制成了最早的指南针。
问题生成
1.如果对含有铁元素的物质进行分类,可以从哪些角度分类
【答案】从元素组成上分类,如单质和化合物;从物质类别上分类,如单质、氧化物、氢氧化物和盐等;从化合价角度进行分类,如0价的铁,+2和+3价的铁的化合物等。
2.铁和铁的化合物在日常生活中具有广泛的应用,如铁单质可用于制作铁锅,亚铁盐可用作补铁保健品,氧化铁可用作粉刷墙壁的 ,四氧化三铁可用作激光打印机的墨粉和 。
【答案】红色涂料 磁性材料
3.从化合价角度预测铁的氧化物具有怎样的性质。
【答案】FeO中铁为+2价,具有还原性;Fe2O3中铁为+3价,具有氧化性;Fe3O4中铁为+2、+3价,既有氧化性又有还原性。
【核心归纳】
1.研究物质性质的两个基本角度
2.铁及其化合物的分类与性质
【典型例题】
【例1】某南极考察队在印度洋发现了一种不寻常的鱼,它的血液像水一样无色透明。经研究发现这种鱼的血液中某种元素的含量是其他鱼的血液中的十分之一,这种元素是( )。
A.Cu B.Pb C.Ag D.Fe
【答案】D
【解析】血液显红色主要是因为血红蛋白的存在,而血红蛋白中必然含有铁元素。根据题给信息,“该鱼的血液像水一样无色透明”可知,该鱼的血液中几乎没有血红蛋白,则铁元素含量很少。
【例2】《新修本草》是我国古代中药学著作之一,记载药物844种,其中关于“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”据此推测,“青矾”的主要成分为( )。
A.CuSO4·5H2O B.FeSO4·7H2O
C.KAl(SO4)2·12H2O D.Fe2(SO4)3·9H2O
【答案】B
【解析】由题意知,青矾呈绿色,经煅烧后,生成红色固体。符合要求的是FeSO4·7H2O,它是绿色晶体,经高温煅烧后生成红棕色Fe2O3粉末。
任务2:亚铁盐和铁盐
情境导入 小明同学近几天一直感觉头晕目眩,身体乏力,就医时医生让小明进行验血。报告如下:
北京市医疗机构临床检验结果报告单
分析项目 检测结果 单位 参考范围
1 锌(Zn) 115.92 μmol·L-1 66~120
2 铁(Fe) 6.95↓ mmol·L-1 7.52~11.82
3 钙(Ca) 1.68 mmol·L-1 1.55~2.10
……
根据验血报告,医生给小明开了一些补铁剂和维生素C。补铁剂中的铁元素是几价铁 应如何检验 为什么补铁剂要和维生素C一起服用
问题生成
1.要检验该补铁剂中铁元素是Fe2+还是Fe3+,可选用不同检验方法,你能叙述出现象及结论吗
【答案】(1)用氢氧化钠溶液
含有Fe3+的现象及结论:将补铁剂溶于水,滴入NaOH溶液,若出现红褐色沉淀,则含有Fe3+。
含有Fe2+的现象及结论:将补铁剂溶于水,滴入NaOH溶液,若生成了白色絮状沉淀,且该沉淀迅速变成灰绿色,最后变成红褐色,则含有Fe2+。
(2)用KSCN(硫氰化钾)溶液
含有Fe3+的现象及结论:将补铁剂溶于水,滴入KSCN溶液,若溶液变红,则含有Fe3+。
含有Fe2+的现象及结论:将补铁剂溶于水,滴入KSCN溶液,无明显现象,再滴加氯水,溶液变红,则含有Fe2+。
2.要证明该补铁剂中不含有Fe3+而含有Fe2+,某同学计划选用如下几种试剂,实验操作时最佳顺序为 。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
【答案】③①
【解析】加入KSCN溶液不变红证明无Fe3+,再加氯水,若有Fe2+,则Fe2+可被氧化为Fe3+,使溶液变红色;酸性KMnO4溶液也能氧化Fe2+,但KMnO4本身为紫红色,使Fe3+与KSCN反应后溶液的颜色不易被观察。
【核心归纳】
Fe2+、Fe3+的检验方法
(1)观察溶液颜色法
(2)KSCN溶液和氯水法
(3)NaOH溶液法
(4)KMnO4溶液法
【典型例题】
【例3】已知下列三个实验中均发生了化学反应:
①将光亮的铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水 ③将铜丝放入氯化铁溶液中。下列判断正确的是( )。
A.实验①中铁钉作氧化剂
B.实验②说明Fe2+具有还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性Fe3+>Fe2+>Cu2+
【答案】B
【解析】铁和硫酸铜发生置换反应生成铜和硫酸亚铁,铁作还原剂,A项错误;向硫酸亚铁溶液中滴入几滴双氧水,Fe2+被氧化成Fe3+,体现Fe2+的还原性,B项正确;将铜丝放入氯化铁溶液中生成氯化亚铁和氯化铜,不是置换反应,C项错误;氧化剂的氧化性强于氧化产物的氧化性,则氧化性Fe3+>Cu2+>Fe2+,D项错误。
【例4】选择合适的试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂的顺序能达到实验目的的是( )。
试剂 选项 甲组 乙组
A 新制氯水、KSCN溶液 氢氧化钠溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
【答案】B
【解析】甲组,在Fe3+存在的条件下,检验Fe2+时要排除Fe3+的干扰,所选试剂应具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。酸性KMnO4溶液符合条件:5Fe2++Mn+8H+5Fe3++Mn2++4H2O,现象为紫色变浅(或褪色)。乙组,在Fe2+存在的条件下,用KSCN溶液检验Fe3+,Fe2+无干扰。
灵犀一点:1.只含Fe2+的溶液:注意检验Fe2+时加入试剂的顺序
待测液不变色红色(含Fe2+,不含Fe3+)
(1)加KSCN溶液前,要注意不要加入氧化性物质使Fe2+被氧化,如H2O2、N(H+)等。
(2)氧化剂不能选用酸性KMnO4溶液,因为酸性KMnO4溶液本身显紫红色,对实验现象有干扰,且酸性KMnO4溶液能氧化KSCN,即使溶液含Fe3+也不变红色,不能证明不含Fe3+。
2.同时含有Fe2+和Fe3+的溶液:Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能通过先加入KSCN溶液再加氯水检验Fe2+,通常向溶液中加入适量K3[Fe(CN)6]溶液,若产生蓝色沉淀,说明含有Fe2+。
检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入足量的新制氯水中(过量氯水能氧化SCN-)。
【随堂检测】
1.将下列物质溶于稀盐酸后,滴加硫氰化钾(KSCN)溶液没有颜色变化,再加入氯水即呈红色的是( )。
A.Fe B.Fe2O3
C.FeCl3 D.Fe(OH)3
【答案】A
【解析】加入KSCN时溶液无明显现象,则溶液中没有Fe3+,加入氯水后溶液变为红色,说明加入氯水后溶液中生成了Fe3+,故原溶液中含有Fe2+。
2.下列物质的颜色按红棕色、黑色、红褐色、浅绿色顺序排列的是( )。
A.Fe2O3、Fe3O4、Fe(OH)3、FeSO4·7H2O
B.Fe3O4、Fe2O3、FeSO4·7H2O、Fe(OH)2
C.Fe(OH)2、FeO、FeCl3·6H2O、FeSO4·7H2O
D.FeO、Fe2O3、Fe(OH)3、FeCl3·6H2O
【答案】A
3.为了检验某FeCl2溶液是否变质,可向溶液中加入的最佳试剂是( )。
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊溶液
【答案】C
【解析】氯化亚铁溶液变质是Fe2+被氧化成Fe3+,Fe3+能与SCN-结合使溶液呈红色,这一反应是Fe3+的特征反应,所以可用KSCN溶液检验某FeCl2溶液是否变质。
4.工业印刷电路板的制作流程如图所示,其中“蚀刻”所用的是FeCl3溶液。
(1)请你写出FeCl3溶液蚀刻印刷铜板的反应原理: (用离子方程式表示)。
(2)由FeCl2可生成Fe或FeCl3,请写出反应的化学方程式: 。
(3)反应后的“蚀刻液”中含有的金属离子有 ;设计回收方案从“蚀刻液”中回收得到Cu和FeCl3:
。
【答案】(1)2Fe3++Cu2Fe2++Cu2+
(2)FeCl2+ZnZnCl2+Fe,2FeCl2+Cl22FeCl3(合理答案均可)
(3)Fe3+、Fe2+、Cu2+ 为从溶液中提取Cu,应向溶液中加入过量铁粉:Fe+Cu2+Fe2++Cu、Fe+2Fe3+3Fe2+;然后用盐酸溶解过量的铁粉:Fe+2HClFeCl2+H2↑,过滤洗涤后得到Cu;再向滤液中通入适量氯气即可得到FeCl3:2FeCl2+Cl22FeCl3
2
【学习目标】
1.了解含铁物质在自然界中的存在形式,知道含铁物质与社会生产、生活密切相关。
2.探究亚铁盐与铁盐的性质,能分析、解释有关实验现象。
3.认识亚铁盐与铁盐的还原性和氧化性,并能设计实验进行验证。
4.能用离子方程式表示亚铁盐与铁盐的相互转化。
【自主预习】
一、铁及铁元素的存在
1.铁元素在自然界中的含量
铁元素在地壳中的含量处于第 位,仅次于 、 和 元素。
2.铁元素的存在形态
(1)游离态:如陨铁
(2)化合态
二、亚铁盐和铁盐
1.亚铁盐和铁盐的组成
亚铁盐 铁盐
组成 含有 的盐 含有 的盐
常见物质 FeSO4·7H2O(绿色)、FeCl2等 FeCl3·6H2O(黄色)、Fe2(SO4)3(黄色)、Fe(NO3)3等
2.亚铁盐和铁盐的性质探究(以FeSO4、FeCl3为例)
(1)预测
①从物质类别预测Fe2+和F性质:
FeSO4和FeCl3都属于盐类,能和碱反应生成 及 。
②从化合价角度预测Fe2+和F性质:
(2)实验验证
①F的特征反应:F和KSCN溶液反应,溶液 ,离子方程式:F+3SCN-Fe(SCN)3。
②亚铁盐的性质实验
实验操作 实验现象 结论及 有关离子方程式
加入KSCN溶液,溶液 ,滴加氯水后,溶液呈 色 Fe2+具有 ,离子方程式:2Fe2++Cl22F+2Cl-、F+3SCN-Fe(SCN)3
溶液由 色变为 色 Fe2+具有 ,被Mn氧化成F
溶液由 色变为 色 Fe2+具有 ,离子方程式:Zn+Fe2+Fe+Zn2+
慢慢挤入NaOH溶液,生成 沉淀 Fe2+和碱反应生成Fe(OH)2,离子方程式:Fe2++2OH-Fe(OH)2↓
③铁盐的性质实验
实验操作 实验现象 结论及 有关离子方程式
溶液由 色变为 色 F具有较强 ,离子方程式:2F+Fe3Fe2+
溶液红色 ,变为 F具有较强 ,离子方程式:Cu+2FCu2++2Fe2+
产生 沉淀 F和碱反应生成Fe(OH)3,离子方程式:F+3OH-Fe(OH)3↓
【参考答案】一、1.四 氧 硅 铝
二、1.Fe2+ Fe3+ 2.(1)Fe(OH)2 Fe(OH)3
(2)①显红色 ②无现象 红 还原性 紫红 黄 还原性 浅绿 无 氧化性 白色 ③红 浅绿 氧化性 消失 蓝色 氧化性 红褐色
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)铁元素性质活泼,自然界中不存在单质铁。 ( )
(2)铁能被磁铁吸引,则任何金属都能被磁铁吸引。( )
(3)铁元素在地壳中的含量排在第2位。 ( )
(4)FeSO4溶液在空气中长久放置后显棕黄色。 ( )
(5)向溶液中加KSCN溶液,溶液变为红色,说明溶液中含Fe3+。 ( )
(6)用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2。 ( )
(7)在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的铁粉。 ( )
【答案】(1)× (2)× (3)× (4)√ (5)√ (6)×
(7)√
2.教材P82“铁锅的主要成分是铁单质”,那么使用铁锅炒菜可以补充人体内的铁元素吗
【答案】可以,铁与酸性物质反应生成亚铁盐能有效补充铁元素。
3.Fe3O4是一种黑色固体,具有导磁性,硬度很大。它不但可以作磨料,还可作颜料和抛光剂。如何证明Fe3O4中既有+2价铁又有+3价铁
【答案】取一定量Fe3O4溶于稀硫酸,形成溶液,分别取少量该溶液于两支试管中。一支试管中加入KSCN溶液,溶液变红,说明含有Fe3+,证明Fe3O4中有+3价铁;另一支试管中加入酸性KMnO4溶液,紫红色褪去,说明含有Fe2+,证明Fe3O4中有+2价铁。
【合作探究】
任务1:铁元素的存在
情境导入 指南针是我国古代的四大发明之一,它的发明对人类的科学技术和文明的发展起了无可估量的作用。我国人民很早就知道磁铁矿具有磁性这一特征,人们在用线悬空磁铁矿石的过程中发现,当磁石静止时,它的一头总是指着北方,而另一头总是指着南方。
到了战国时期,由于战争连绵不断,许多人为躲避战乱,不得不迁徙到其他地方。可是,在行走时需要认清方向,那么人们是怎么辨识方向的 人们想到了磁石的特性,但用线悬吊起来的磁石虽然指出了南北方向,然而究竟哪边是南哪边是北
后来,有人把磁石磨成一把汤匙的形状,放在平滑的青铜盘上,这把汤匙的柄指向南方.这样就制成了最早的指南针。
问题生成
1.如果对含有铁元素的物质进行分类,可以从哪些角度分类
【答案】从元素组成上分类,如单质和化合物;从物质类别上分类,如单质、氧化物、氢氧化物和盐等;从化合价角度进行分类,如0价的铁,+2和+3价的铁的化合物等。
2.铁和铁的化合物在日常生活中具有广泛的应用,如铁单质可用于制作铁锅,亚铁盐可用作补铁保健品,氧化铁可用作粉刷墙壁的 ,四氧化三铁可用作激光打印机的墨粉和 。
【答案】红色涂料 磁性材料
3.从化合价角度预测铁的氧化物具有怎样的性质。
【答案】FeO中铁为+2价,具有还原性;Fe2O3中铁为+3价,具有氧化性;Fe3O4中铁为+2、+3价,既有氧化性又有还原性。
【核心归纳】
1.研究物质性质的两个基本角度
2.铁及其化合物的分类与性质
【典型例题】
【例1】某南极考察队在印度洋发现了一种不寻常的鱼,它的血液像水一样无色透明。经研究发现这种鱼的血液中某种元素的含量是其他鱼的血液中的十分之一,这种元素是( )。
A.Cu B.Pb C.Ag D.Fe
【答案】D
【解析】血液显红色主要是因为血红蛋白的存在,而血红蛋白中必然含有铁元素。根据题给信息,“该鱼的血液像水一样无色透明”可知,该鱼的血液中几乎没有血红蛋白,则铁元素含量很少。
【例2】《新修本草》是我国古代中药学著作之一,记载药物844种,其中关于“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”据此推测,“青矾”的主要成分为( )。
A.CuSO4·5H2O B.FeSO4·7H2O
C.KAl(SO4)2·12H2O D.Fe2(SO4)3·9H2O
【答案】B
【解析】由题意知,青矾呈绿色,经煅烧后,生成红色固体。符合要求的是FeSO4·7H2O,它是绿色晶体,经高温煅烧后生成红棕色Fe2O3粉末。
任务2:亚铁盐和铁盐
情境导入 小明同学近几天一直感觉头晕目眩,身体乏力,就医时医生让小明进行验血。报告如下:
北京市医疗机构临床检验结果报告单
分析项目 检测结果 单位 参考范围
1 锌(Zn) 115.92 μmol·L-1 66~120
2 铁(Fe) 6.95↓ mmol·L-1 7.52~11.82
3 钙(Ca) 1.68 mmol·L-1 1.55~2.10
……
根据验血报告,医生给小明开了一些补铁剂和维生素C。补铁剂中的铁元素是几价铁 应如何检验 为什么补铁剂要和维生素C一起服用
问题生成
1.要检验该补铁剂中铁元素是Fe2+还是Fe3+,可选用不同检验方法,你能叙述出现象及结论吗
【答案】(1)用氢氧化钠溶液
含有Fe3+的现象及结论:将补铁剂溶于水,滴入NaOH溶液,若出现红褐色沉淀,则含有Fe3+。
含有Fe2+的现象及结论:将补铁剂溶于水,滴入NaOH溶液,若生成了白色絮状沉淀,且该沉淀迅速变成灰绿色,最后变成红褐色,则含有Fe2+。
(2)用KSCN(硫氰化钾)溶液
含有Fe3+的现象及结论:将补铁剂溶于水,滴入KSCN溶液,若溶液变红,则含有Fe3+。
含有Fe2+的现象及结论:将补铁剂溶于水,滴入KSCN溶液,无明显现象,再滴加氯水,溶液变红,则含有Fe2+。
2.要证明该补铁剂中不含有Fe3+而含有Fe2+,某同学计划选用如下几种试剂,实验操作时最佳顺序为 。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
【答案】③①
【解析】加入KSCN溶液不变红证明无Fe3+,再加氯水,若有Fe2+,则Fe2+可被氧化为Fe3+,使溶液变红色;酸性KMnO4溶液也能氧化Fe2+,但KMnO4本身为紫红色,使Fe3+与KSCN反应后溶液的颜色不易被观察。
【核心归纳】
Fe2+、Fe3+的检验方法
(1)观察溶液颜色法
(2)KSCN溶液和氯水法
(3)NaOH溶液法
(4)KMnO4溶液法
【典型例题】
【例3】已知下列三个实验中均发生了化学反应:
①将光亮的铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水 ③将铜丝放入氯化铁溶液中。下列判断正确的是( )。
A.实验①中铁钉作氧化剂
B.实验②说明Fe2+具有还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性Fe3+>Fe2+>Cu2+
【答案】B
【解析】铁和硫酸铜发生置换反应生成铜和硫酸亚铁,铁作还原剂,A项错误;向硫酸亚铁溶液中滴入几滴双氧水,Fe2+被氧化成Fe3+,体现Fe2+的还原性,B项正确;将铜丝放入氯化铁溶液中生成氯化亚铁和氯化铜,不是置换反应,C项错误;氧化剂的氧化性强于氧化产物的氧化性,则氧化性Fe3+>Cu2+>Fe2+,D项错误。
【例4】选择合适的试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂的顺序能达到实验目的的是( )。
试剂 选项 甲组 乙组
A 新制氯水、KSCN溶液 氢氧化钠溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
【答案】B
【解析】甲组,在Fe3+存在的条件下,检验Fe2+时要排除Fe3+的干扰,所选试剂应具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。酸性KMnO4溶液符合条件:5Fe2++Mn+8H+5Fe3++Mn2++4H2O,现象为紫色变浅(或褪色)。乙组,在Fe2+存在的条件下,用KSCN溶液检验Fe3+,Fe2+无干扰。
灵犀一点:1.只含Fe2+的溶液:注意检验Fe2+时加入试剂的顺序
待测液不变色红色(含Fe2+,不含Fe3+)
(1)加KSCN溶液前,要注意不要加入氧化性物质使Fe2+被氧化,如H2O2、N(H+)等。
(2)氧化剂不能选用酸性KMnO4溶液,因为酸性KMnO4溶液本身显紫红色,对实验现象有干扰,且酸性KMnO4溶液能氧化KSCN,即使溶液含Fe3+也不变红色,不能证明不含Fe3+。
2.同时含有Fe2+和Fe3+的溶液:Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能通过先加入KSCN溶液再加氯水检验Fe2+,通常向溶液中加入适量K3[Fe(CN)6]溶液,若产生蓝色沉淀,说明含有Fe2+。
检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入足量的新制氯水中(过量氯水能氧化SCN-)。
【随堂检测】
1.将下列物质溶于稀盐酸后,滴加硫氰化钾(KSCN)溶液没有颜色变化,再加入氯水即呈红色的是( )。
A.Fe B.Fe2O3
C.FeCl3 D.Fe(OH)3
【答案】A
【解析】加入KSCN时溶液无明显现象,则溶液中没有Fe3+,加入氯水后溶液变为红色,说明加入氯水后溶液中生成了Fe3+,故原溶液中含有Fe2+。
2.下列物质的颜色按红棕色、黑色、红褐色、浅绿色顺序排列的是( )。
A.Fe2O3、Fe3O4、Fe(OH)3、FeSO4·7H2O
B.Fe3O4、Fe2O3、FeSO4·7H2O、Fe(OH)2
C.Fe(OH)2、FeO、FeCl3·6H2O、FeSO4·7H2O
D.FeO、Fe2O3、Fe(OH)3、FeCl3·6H2O
【答案】A
3.为了检验某FeCl2溶液是否变质,可向溶液中加入的最佳试剂是( )。
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊溶液
【答案】C
【解析】氯化亚铁溶液变质是Fe2+被氧化成Fe3+,Fe3+能与SCN-结合使溶液呈红色,这一反应是Fe3+的特征反应,所以可用KSCN溶液检验某FeCl2溶液是否变质。
4.工业印刷电路板的制作流程如图所示,其中“蚀刻”所用的是FeCl3溶液。
(1)请你写出FeCl3溶液蚀刻印刷铜板的反应原理: (用离子方程式表示)。
(2)由FeCl2可生成Fe或FeCl3,请写出反应的化学方程式: 。
(3)反应后的“蚀刻液”中含有的金属离子有 ;设计回收方案从“蚀刻液”中回收得到Cu和FeCl3:
。
【答案】(1)2Fe3++Cu2Fe2++Cu2+
(2)FeCl2+ZnZnCl2+Fe,2FeCl2+Cl22FeCl3(合理答案均可)
(3)Fe3+、Fe2+、Cu2+ 为从溶液中提取Cu,应向溶液中加入过量铁粉:Fe+Cu2+Fe2++Cu、Fe+2Fe3+3Fe2+;然后用盐酸溶解过量的铁粉:Fe+2HClFeCl2+H2↑,过滤洗涤后得到Cu;再向滤液中通入适量氯气即可得到FeCl3:2FeCl2+Cl22FeCl3
2
