3.2 第1课时 自然界中的硫 学案 (含答案)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.2 第1课时 自然界中的硫 学案 (含答案)2023-2024学年高一化学鲁科版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 247.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览


文档简介
3.2 第1课时 自然界中的硫
【学习目标】
1.了解含硫物质在自然界中的存在形式,了解硫的转化过程。
2.认识硫的物理性质、氧化性与还原性。
【自主预习】
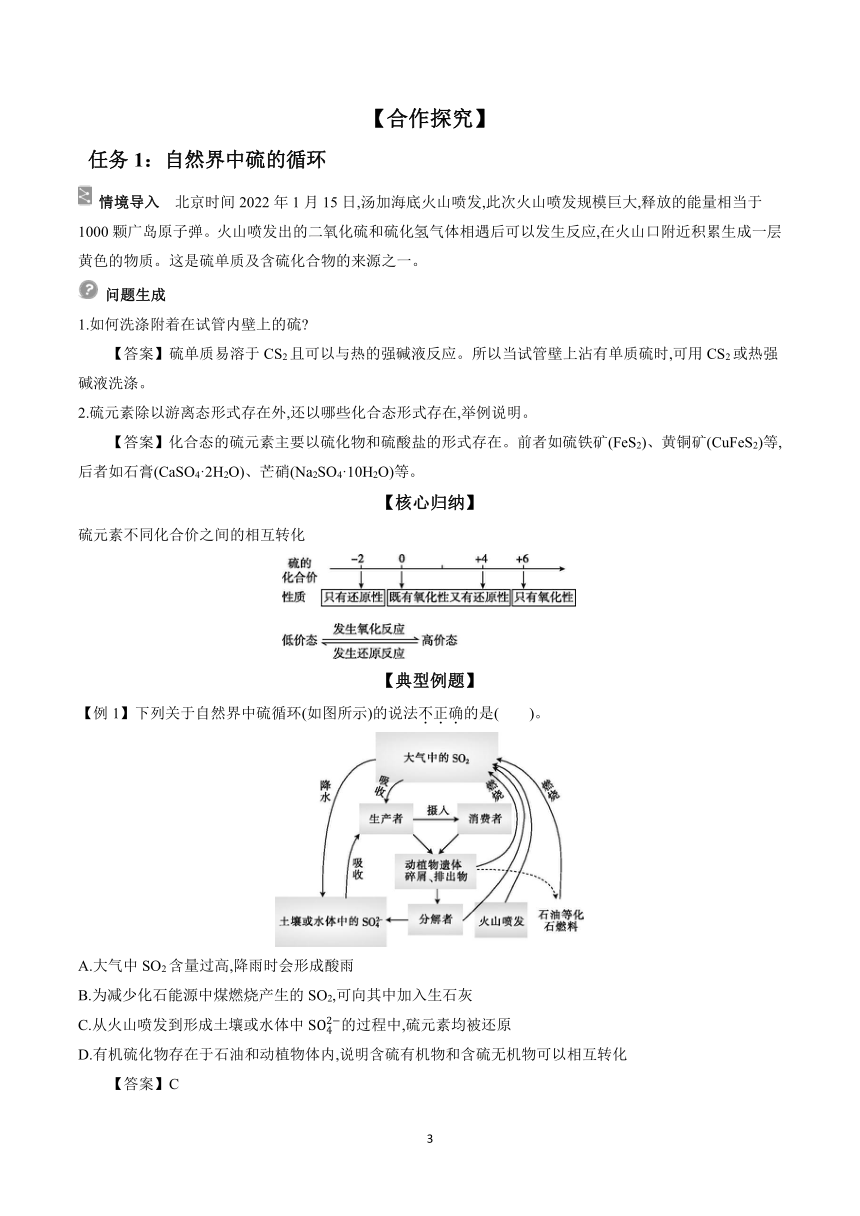
1.自然界中不同价态硫元素之间的转化
(1)硫的存在
(2)自然界中不同价态硫元素之间的转化
2.认识硫单质
(1)同素异形体
①定义:由同一种元素组成的 的几种 。
②常见非金属元素的同素异形体:硫元素有 、 ,氧元素有 、 ,碳元素有 、 、 。
(2)硫的物理性质
俗称 颜色、状态 熔、沸点 硬度 溶解性
水 酒精 CS2
硫黄 固体 都 很脆 溶 溶 溶
(3)硫的化学性质
①实验探究
实验操作
实验现象 混合物一端红热直到整个混合物红热,最后结成 块状FeS 发出明亮的 火焰,放出大量的热,生成一种有 气味的气体
②化学性质总结
a.
b.S可以和热碱反应:如6NaOH+3S2Na2S+Na2SO3+3H2O,该反应中硫体现 和 ,反应中氧化剂和还原剂的物质的量之比为 。
(4)硫的用途
硫黄主要用于制造硫酸、化肥、火柴及杀虫剂,还用于制造火药、烟花爆竹等。
【参考答案】2.(1)①性质不同 单质 ②正交硫 单斜硫 O2 O3
金刚石 石墨 C60
(2)黄色或淡黄色 不高 不 微 易
(3)①黑色 蓝紫色 刺激性 ②氧化性 还原性 2∶1
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)硫单质常存在于火山口附近。 ( )
(2)硫与金属或非金属反应时均作氧化剂。 ( )
(3)硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3。 ( )
(4)硫的化学性质较活泼,所以只以化合态存在于自然界中。 ( )
(5)S能氧化Fe,使Fe生成+3价铁的化合物。 ( )
(6)SO2与NaOH转化为Na2SO3的反应不是氧化还原反应。 ( )
【答案】(1)√ (2)× (3)× (4)× (5)× (6)√
2.分析硫原子得失电子的难易;试比较硫与氧的非金属性强弱。
【答案】硫原子的最外层有6个电子,在化学反应中容易得到2个电子,形成-2价的化合物;与同主族的氧元素相比,硫元素的原子多一个电子层,得电子的能力相对较弱,而失电子能力相对较强。
3.自然界中含有丰富的含硫元素的物质,如果对含有硫元素的物质进行分类,你可以从哪些角度进行分类
【答案】从元素组成,有单质和化合物;从物质类别,有氢化物、单质、氧化物、含氧酸、盐等;从化合价角度,有-2、0、+4和+6价硫的化合物等。
【合作探究】
任务1:自然界中硫的循环
情境导入 北京时间2022年1月15日,汤加海底火山喷发,此次火山喷发规模巨大,释放的能量相当于1000颗广岛原子弹。火山喷发出的二氧化硫和硫化氢气体相遇后可以发生反应,在火山口附近积累生成一层黄色的物质。这是硫单质及含硫化合物的来源之一。
问题生成
1.如何洗涤附着在试管内壁上的硫
【答案】硫单质易溶于CS2且可以与热的强碱液反应。所以当试管壁上沾有单质硫时,可用CS2或热强碱液洗涤。
2.硫元素除以游离态形式存在外,还以哪些化合态形式存在,举例说明。
【答案】化合态的硫元素主要以硫化物和硫酸盐的形式存在。前者如硫铁矿(FeS2)、黄铜矿(CuFeS2)等,后者如石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)等。
【核心归纳】
硫元素不同化合价之间的相互转化
【典型例题】
【例1】下列关于自然界中硫循环(如图所示)的说法不正确的是( )。
A.大气中SO2含量过高,降雨时会形成酸雨
B.为减少化石能源中煤燃烧产生的SO2,可向其中加入生石灰
C.从火山喷发到形成土壤或水体中S的过程中,硫元素均被还原
D.有机硫化物存在于石油和动植物体内,说明含硫有机物和含硫无机物可以相互转化
【答案】C
【解析】大气中SO2含量过高,降雨时雨水溶解SO2生成H2SO3,H2SO3被空气中的氧气氧化为H2SO4,降落下来而形成酸雨,A项正确;加入生石灰后,发生反应CaO+SO2CaSO3、2CaSO3+O22CaSO4,既治理了SO2的污染,还可以得到石膏(CaSO4·2H2O),B项正确;从火山爆发到形成土壤或水体中S的过程中,硫元素既被氧化也被还原,C项错误;有机硫化物存在于石油和动植物体内,说明含硫有机物和含硫无机物可以相互转化,D项正确。
【例2】硫元素在自然界中的循环如图所示,下列有关说法不正确的是( )。
A.硫在自然界中既有游离态又有化合态
B.该循环过程中,硫元素均被氧化
C.过程⑤可在土壤的缺氧区完成
D.若生物体中有机硫的成键方式为,则过程④中硫没有发生氧化还原反应
【答案】B
【解析】硫在自然界中既有游离态又有化合态,A项正确;如图所示,硫元素在循环过程中化合价有升有降,故S元素既被氧化,也被还原,B项错误;由于过程⑤中的H2S具有较强的还原性,故该过程可在土壤的缺氧区完成,C项正确;从生物体中有机硫的成键方式来看,硫元素的化合价为-2,故过程④中硫元素的化合价没有变化,D项正确。
任务2:认识硫单质
情境导入
1.火药是我国古代的四大发明之一,当时的火药是由硫黄、硝石和木炭按照一定比例混合制成的。可以看出,我国古代人民很早就发现了硫。硫具有鲜亮的橙黄色,它在燃烧时会产生一种难闻的臭味。
2.唐朝诗人白居易在《长恨歌》中写道,“春寒赐浴华清池,温泉水滑洗凝脂”,描述了杨贵妃常用的美容秘术——温泉沐浴。温泉之所以具有护肤养颜、疗疾保健的作用,是因为泉水中含有硫黄等矿物质,能明显改善皮肤的微循环,且硫的某些化合物能够灭菌止痒。
问题生成
1.把少量硫粉放入试管中加热,硫的状态及受热后的现象分别是什么 说明硫具有哪些物理性质
【答案】硫为黄色或淡黄色固体,受热时硫逐渐熔化为淡黄色液体,继续加热,液体最后变为气体。说明硫的熔点低,受热易熔化。
2.在空气中加热S粉和Fe粉的混合物,可观察到下列现象:
(1)有淡蓝色火焰,且生成有刺激性气味的气体;
(2)混合粉末变红,放出热量,最后变成黑色固体;
(3)不时有火星从混合物中射出。
请分别写出以上三种情况发生反应的化学方程式。
【答案】(1)S+O2SO2
(2)Fe+SFeS
(3)3Fe+2O2Fe3O4
3.硫单质是黑火药的主要成分。黑火药是我国古代四大发明之一,黑火药爆炸时的化学方程式为2KNO3+3C+SK2S+N2↑+3CO2↑,则该反应中氧化剂为 ,101 g硝酸钾与 g硫恰好完全反应,产生标准状况下气体的体积为 L。
【答案】KNO3和S 16 44.8
【核心归纳】
硫单质的化学性质
氧化性 与金属反应 2Na+SNa2S,Fe+SFeS,2Cu+SCu2S
与非金属反应 H2+SH2S
黑火药反应 S+2KNO3+3CK2S+3CO2↑+N2↑
还原性 与非金属反应 S+O2SO2
与氧化 性酸反应 S+6HNO3(浓)H2SO4+6NO2↑+2H2O S+2H2SO4(浓)3SO2↑+2H2O
既表现氧化性又表现还原性 与热的碱溶液反应 3S+6NaOH2Na2S+Na2SO3+3H2O
【典型例题】
【例3】硫在中国古代被列为重要中药材。下列有关硫的说法正确的是( )。
A.S具有氧化性,故铁粉和硫粉共热可生成Fe2S3
B.S既有氧化性又有还原性,硫分别与铁粉和铜粉反应,都可生成二价金属硫化物
C.黑火药中的KNO3、C、S可用水、CS2作溶剂,用过滤等操作进行分离
D.S在充足的O2中燃烧的化学方程式为2S+3O22SO3
【答案】C
【解析】硫单质的氧化性较弱,与变价金属反应只能生成低价态的金属化合物,A项错误;硫既有氧化性又有还原性,与Fe、Cu反应时均生成低价硫化物:Fe+SFeS、2Cu+SCu2S,B项错误;CS2可溶解硫,过滤后蒸发滤液可得硫,再将滤渣溶于水,过滤又可得炭粉,滤液经蒸发浓缩、冷却结晶,得到硝酸钾,C项正确;不管O2是否过量,S与O2反应只能生成SO2,D项错误。
【例4】下列关于硫的说法正确的是( )。
A.硫是一种黄色或淡黄色的不溶于水的固体
B.1 mol硫原子参加反应时一定转移2NA个电子
C.硫与非金属反应均作还原剂
D.1.6 g硫与5.6 g铁反应能得到7.2 g纯净硫化物
【答案】A
【解析】在S+O2SO2反应中,1 mol 硫原子参加反应时,转移4NA个电子,B项错误;S与H2反应时,S作氧化剂,C项错误;Fe与S反应时,反应物中Fe过量,反应后得到含有4.4 g FeS和2.8 g Fe的混合物,D项错误。
灵犀一点:从物质类别和元素化合价两角度理解硫单质的化学性质:
H2、Na2、FeO2、
(1)硫与金属反应的规律
①硫在一定条件下与大多数金属反应生成相应的金属硫化物。
②硫与变价金属反应生成低价态金属硫化物。
③常温下硫粉易与汞反应,Hg+SHgS,洒落金属汞时,可用硫黄粉覆盖。
(2)硫与热的烧碱溶液反应的化学方程式为3S+6NaOH2Na2S+Na2SO3+3H2O,硫表现氧化性和还原性。
【随堂检测】
1.下列说法不正确的是( )。
A.硫有多种同素异形体
B.硫的化学性质与氧气完全相同
C.硫在空气中燃烧时,火焰呈淡蓝色;在氧气中燃烧时,火焰呈蓝紫色
D.硫在一定条件下能与某些金属反应,生成金属硫化物
【答案】B
【解析】硫有多种同素异形体,常见的有正交硫和单斜硫。硫与氧气的某些性质相同,因为都是非金属元素,作氧化剂时,常显-2价,特别是与金属或H2的反应,但又不完全相同。硫具有氧化性和还原性,可以发生自身的氧化还原反应。
2.下列含硫物质中,硫元素只有氧化性的是( )。
A.Na2S B.SO2 C.H2SO3 D.H2SO4
【答案】D
【解析】硫元素的最低价态为-2价,最高价态为+6价,当硫元素处于最高价态时只有氧化性。
3.取一定量的铁粉和硫粉的混合物隔绝空气加热,充分反应后冷却,再加入足量的稀盐酸,标准状况下生成2.24 L气体,下列说法不正确的是( )。
A.原混合物中可能含3.2 g硫粉
B.原混合物的质量可能大于8.8 g
C.原混合物中一定含有5.6 g铁粉
D.2.24 L气体的质量可能大于3.4 g
【答案】D
【解析】Fe+SFeS,若S过量,则与盐酸反应的只有FeS,FeS+2HClFeCl2+H2S↑,由此可见n(H2S)=n(FeS)=n(Fe),则n(Fe)=n(H2S)==0.1 mol,m(Fe)=56 g·mol-1×0.1 mol=5.6 g;若Fe过量,则与盐酸反应的物质是FeS及剩余的Fe,FeS+2HClFeCl2+H2S↑、Fe+2HClFeCl2+H2↑,分析以上两个方程式可知,不论Fe与S反应是谁过量,生成气体的物质的量与原混合物中Fe的物质的量相等。当5.6 g铁粉恰好与3.2 g硫粉反应时,生成8.8 g FeS,A项正确;若硫粉过量,则硫粉的质量大于3.2 g,混合物的质量大于8.8 g,B项正确;已知标准状况下生成2.24 L气体,则一定有0.1 mol Fe(5.6 g)存在,C项正确;若2.24 L气体都是H2S气体,则H2S气体的质量等于3.4 g,若2.24 L气体是H2S与H2的混合气体,则气体的质量小于3.4 g,D项错误。
4.按图连接好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆)。取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃后迅速移入锥形瓶中并塞紧橡皮塞,硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢回到原标定的刻度。简要回答下列问题:
(1)水银柱推向左管说明了什么 。
(2)硫粉未燃尽时火焰就熄灭了。说明 。
(3)根据水银柱最后又回到原先标定的刻度,可得到什么结论 。
【答案】(1)该反应是放热反应;气体受热膨胀
(2)瓶内氧气已耗尽
(3)同温同压下,反应消耗的氧气与生成的SO2:体积相同;压强相同;物质的量相同
【解析】(2)硫粉燃烧,实际上是硫粉与空气中的氧气反应,硫粉未燃尽时火焰就熄灭了,显然是氧气消耗完的原因。(3)水银柱最后又回到原先标定的刻度,应该是容器中气体的压强、体积、物质的量等指标在反应前后没有改变,由此可得结论。
2
【学习目标】
1.了解含硫物质在自然界中的存在形式,了解硫的转化过程。
2.认识硫的物理性质、氧化性与还原性。
【自主预习】
1.自然界中不同价态硫元素之间的转化
(1)硫的存在
(2)自然界中不同价态硫元素之间的转化
2.认识硫单质
(1)同素异形体
①定义:由同一种元素组成的 的几种 。
②常见非金属元素的同素异形体:硫元素有 、 ,氧元素有 、 ,碳元素有 、 、 。
(2)硫的物理性质
俗称 颜色、状态 熔、沸点 硬度 溶解性
水 酒精 CS2
硫黄 固体 都 很脆 溶 溶 溶
(3)硫的化学性质
①实验探究
实验操作
实验现象 混合物一端红热直到整个混合物红热,最后结成 块状FeS 发出明亮的 火焰,放出大量的热,生成一种有 气味的气体
②化学性质总结
a.
b.S可以和热碱反应:如6NaOH+3S2Na2S+Na2SO3+3H2O,该反应中硫体现 和 ,反应中氧化剂和还原剂的物质的量之比为 。
(4)硫的用途
硫黄主要用于制造硫酸、化肥、火柴及杀虫剂,还用于制造火药、烟花爆竹等。
【参考答案】2.(1)①性质不同 单质 ②正交硫 单斜硫 O2 O3
金刚石 石墨 C60
(2)黄色或淡黄色 不高 不 微 易
(3)①黑色 蓝紫色 刺激性 ②氧化性 还原性 2∶1
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)硫单质常存在于火山口附近。 ( )
(2)硫与金属或非金属反应时均作氧化剂。 ( )
(3)硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3。 ( )
(4)硫的化学性质较活泼,所以只以化合态存在于自然界中。 ( )
(5)S能氧化Fe,使Fe生成+3价铁的化合物。 ( )
(6)SO2与NaOH转化为Na2SO3的反应不是氧化还原反应。 ( )
【答案】(1)√ (2)× (3)× (4)× (5)× (6)√
2.分析硫原子得失电子的难易;试比较硫与氧的非金属性强弱。
【答案】硫原子的最外层有6个电子,在化学反应中容易得到2个电子,形成-2价的化合物;与同主族的氧元素相比,硫元素的原子多一个电子层,得电子的能力相对较弱,而失电子能力相对较强。
3.自然界中含有丰富的含硫元素的物质,如果对含有硫元素的物质进行分类,你可以从哪些角度进行分类
【答案】从元素组成,有单质和化合物;从物质类别,有氢化物、单质、氧化物、含氧酸、盐等;从化合价角度,有-2、0、+4和+6价硫的化合物等。
【合作探究】
任务1:自然界中硫的循环
情境导入 北京时间2022年1月15日,汤加海底火山喷发,此次火山喷发规模巨大,释放的能量相当于1000颗广岛原子弹。火山喷发出的二氧化硫和硫化氢气体相遇后可以发生反应,在火山口附近积累生成一层黄色的物质。这是硫单质及含硫化合物的来源之一。
问题生成
1.如何洗涤附着在试管内壁上的硫
【答案】硫单质易溶于CS2且可以与热的强碱液反应。所以当试管壁上沾有单质硫时,可用CS2或热强碱液洗涤。
2.硫元素除以游离态形式存在外,还以哪些化合态形式存在,举例说明。
【答案】化合态的硫元素主要以硫化物和硫酸盐的形式存在。前者如硫铁矿(FeS2)、黄铜矿(CuFeS2)等,后者如石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)等。
【核心归纳】
硫元素不同化合价之间的相互转化
【典型例题】
【例1】下列关于自然界中硫循环(如图所示)的说法不正确的是( )。
A.大气中SO2含量过高,降雨时会形成酸雨
B.为减少化石能源中煤燃烧产生的SO2,可向其中加入生石灰
C.从火山喷发到形成土壤或水体中S的过程中,硫元素均被还原
D.有机硫化物存在于石油和动植物体内,说明含硫有机物和含硫无机物可以相互转化
【答案】C
【解析】大气中SO2含量过高,降雨时雨水溶解SO2生成H2SO3,H2SO3被空气中的氧气氧化为H2SO4,降落下来而形成酸雨,A项正确;加入生石灰后,发生反应CaO+SO2CaSO3、2CaSO3+O22CaSO4,既治理了SO2的污染,还可以得到石膏(CaSO4·2H2O),B项正确;从火山爆发到形成土壤或水体中S的过程中,硫元素既被氧化也被还原,C项错误;有机硫化物存在于石油和动植物体内,说明含硫有机物和含硫无机物可以相互转化,D项正确。
【例2】硫元素在自然界中的循环如图所示,下列有关说法不正确的是( )。
A.硫在自然界中既有游离态又有化合态
B.该循环过程中,硫元素均被氧化
C.过程⑤可在土壤的缺氧区完成
D.若生物体中有机硫的成键方式为,则过程④中硫没有发生氧化还原反应
【答案】B
【解析】硫在自然界中既有游离态又有化合态,A项正确;如图所示,硫元素在循环过程中化合价有升有降,故S元素既被氧化,也被还原,B项错误;由于过程⑤中的H2S具有较强的还原性,故该过程可在土壤的缺氧区完成,C项正确;从生物体中有机硫的成键方式来看,硫元素的化合价为-2,故过程④中硫元素的化合价没有变化,D项正确。
任务2:认识硫单质
情境导入
1.火药是我国古代的四大发明之一,当时的火药是由硫黄、硝石和木炭按照一定比例混合制成的。可以看出,我国古代人民很早就发现了硫。硫具有鲜亮的橙黄色,它在燃烧时会产生一种难闻的臭味。
2.唐朝诗人白居易在《长恨歌》中写道,“春寒赐浴华清池,温泉水滑洗凝脂”,描述了杨贵妃常用的美容秘术——温泉沐浴。温泉之所以具有护肤养颜、疗疾保健的作用,是因为泉水中含有硫黄等矿物质,能明显改善皮肤的微循环,且硫的某些化合物能够灭菌止痒。
问题生成
1.把少量硫粉放入试管中加热,硫的状态及受热后的现象分别是什么 说明硫具有哪些物理性质
【答案】硫为黄色或淡黄色固体,受热时硫逐渐熔化为淡黄色液体,继续加热,液体最后变为气体。说明硫的熔点低,受热易熔化。
2.在空气中加热S粉和Fe粉的混合物,可观察到下列现象:
(1)有淡蓝色火焰,且生成有刺激性气味的气体;
(2)混合粉末变红,放出热量,最后变成黑色固体;
(3)不时有火星从混合物中射出。
请分别写出以上三种情况发生反应的化学方程式。
【答案】(1)S+O2SO2
(2)Fe+SFeS
(3)3Fe+2O2Fe3O4
3.硫单质是黑火药的主要成分。黑火药是我国古代四大发明之一,黑火药爆炸时的化学方程式为2KNO3+3C+SK2S+N2↑+3CO2↑,则该反应中氧化剂为 ,101 g硝酸钾与 g硫恰好完全反应,产生标准状况下气体的体积为 L。
【答案】KNO3和S 16 44.8
【核心归纳】
硫单质的化学性质
氧化性 与金属反应 2Na+SNa2S,Fe+SFeS,2Cu+SCu2S
与非金属反应 H2+SH2S
黑火药反应 S+2KNO3+3CK2S+3CO2↑+N2↑
还原性 与非金属反应 S+O2SO2
与氧化 性酸反应 S+6HNO3(浓)H2SO4+6NO2↑+2H2O S+2H2SO4(浓)3SO2↑+2H2O
既表现氧化性又表现还原性 与热的碱溶液反应 3S+6NaOH2Na2S+Na2SO3+3H2O
【典型例题】
【例3】硫在中国古代被列为重要中药材。下列有关硫的说法正确的是( )。
A.S具有氧化性,故铁粉和硫粉共热可生成Fe2S3
B.S既有氧化性又有还原性,硫分别与铁粉和铜粉反应,都可生成二价金属硫化物
C.黑火药中的KNO3、C、S可用水、CS2作溶剂,用过滤等操作进行分离
D.S在充足的O2中燃烧的化学方程式为2S+3O22SO3
【答案】C
【解析】硫单质的氧化性较弱,与变价金属反应只能生成低价态的金属化合物,A项错误;硫既有氧化性又有还原性,与Fe、Cu反应时均生成低价硫化物:Fe+SFeS、2Cu+SCu2S,B项错误;CS2可溶解硫,过滤后蒸发滤液可得硫,再将滤渣溶于水,过滤又可得炭粉,滤液经蒸发浓缩、冷却结晶,得到硝酸钾,C项正确;不管O2是否过量,S与O2反应只能生成SO2,D项错误。
【例4】下列关于硫的说法正确的是( )。
A.硫是一种黄色或淡黄色的不溶于水的固体
B.1 mol硫原子参加反应时一定转移2NA个电子
C.硫与非金属反应均作还原剂
D.1.6 g硫与5.6 g铁反应能得到7.2 g纯净硫化物
【答案】A
【解析】在S+O2SO2反应中,1 mol 硫原子参加反应时,转移4NA个电子,B项错误;S与H2反应时,S作氧化剂,C项错误;Fe与S反应时,反应物中Fe过量,反应后得到含有4.4 g FeS和2.8 g Fe的混合物,D项错误。
灵犀一点:从物质类别和元素化合价两角度理解硫单质的化学性质:
H2、Na2、FeO2、
(1)硫与金属反应的规律
①硫在一定条件下与大多数金属反应生成相应的金属硫化物。
②硫与变价金属反应生成低价态金属硫化物。
③常温下硫粉易与汞反应,Hg+SHgS,洒落金属汞时,可用硫黄粉覆盖。
(2)硫与热的烧碱溶液反应的化学方程式为3S+6NaOH2Na2S+Na2SO3+3H2O,硫表现氧化性和还原性。
【随堂检测】
1.下列说法不正确的是( )。
A.硫有多种同素异形体
B.硫的化学性质与氧气完全相同
C.硫在空气中燃烧时,火焰呈淡蓝色;在氧气中燃烧时,火焰呈蓝紫色
D.硫在一定条件下能与某些金属反应,生成金属硫化物
【答案】B
【解析】硫有多种同素异形体,常见的有正交硫和单斜硫。硫与氧气的某些性质相同,因为都是非金属元素,作氧化剂时,常显-2价,特别是与金属或H2的反应,但又不完全相同。硫具有氧化性和还原性,可以发生自身的氧化还原反应。
2.下列含硫物质中,硫元素只有氧化性的是( )。
A.Na2S B.SO2 C.H2SO3 D.H2SO4
【答案】D
【解析】硫元素的最低价态为-2价,最高价态为+6价,当硫元素处于最高价态时只有氧化性。
3.取一定量的铁粉和硫粉的混合物隔绝空气加热,充分反应后冷却,再加入足量的稀盐酸,标准状况下生成2.24 L气体,下列说法不正确的是( )。
A.原混合物中可能含3.2 g硫粉
B.原混合物的质量可能大于8.8 g
C.原混合物中一定含有5.6 g铁粉
D.2.24 L气体的质量可能大于3.4 g
【答案】D
【解析】Fe+SFeS,若S过量,则与盐酸反应的只有FeS,FeS+2HClFeCl2+H2S↑,由此可见n(H2S)=n(FeS)=n(Fe),则n(Fe)=n(H2S)==0.1 mol,m(Fe)=56 g·mol-1×0.1 mol=5.6 g;若Fe过量,则与盐酸反应的物质是FeS及剩余的Fe,FeS+2HClFeCl2+H2S↑、Fe+2HClFeCl2+H2↑,分析以上两个方程式可知,不论Fe与S反应是谁过量,生成气体的物质的量与原混合物中Fe的物质的量相等。当5.6 g铁粉恰好与3.2 g硫粉反应时,生成8.8 g FeS,A项正确;若硫粉过量,则硫粉的质量大于3.2 g,混合物的质量大于8.8 g,B项正确;已知标准状况下生成2.24 L气体,则一定有0.1 mol Fe(5.6 g)存在,C项正确;若2.24 L气体都是H2S气体,则H2S气体的质量等于3.4 g,若2.24 L气体是H2S与H2的混合气体,则气体的质量小于3.4 g,D项错误。
4.按图连接好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆)。取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃后迅速移入锥形瓶中并塞紧橡皮塞,硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢回到原标定的刻度。简要回答下列问题:
(1)水银柱推向左管说明了什么 。
(2)硫粉未燃尽时火焰就熄灭了。说明 。
(3)根据水银柱最后又回到原先标定的刻度,可得到什么结论 。
【答案】(1)该反应是放热反应;气体受热膨胀
(2)瓶内氧气已耗尽
(3)同温同压下,反应消耗的氧气与生成的SO2:体积相同;压强相同;物质的量相同
【解析】(2)硫粉燃烧,实际上是硫粉与空气中的氧气反应,硫粉未燃尽时火焰就熄灭了,显然是氧气消耗完的原因。(3)水银柱最后又回到原先标定的刻度,应该是容器中气体的压强、体积、物质的量等指标在反应前后没有改变,由此可得结论。
2
