第1章 微项目 探秘膨松剂——体会研究物质性质的方法和程序的实用价值 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第1章 微项目 探秘膨松剂——体会研究物质性质的方法和程序的实用价值 学案(含答案) 2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 204.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 21:44:43 | ||
图片预览



文档简介
微项目:探秘膨松剂
——体会研究物质性质的方法和程序的实用价值
【必备知识】
1.膨松剂:膨松剂是在食品加工过程中加入的,能使面坯发起形成多孔组织,从而使食品具有柔软或酥脆特点的一类物质。
2.膨松剂的分类
情景思考
老面是指发面的面种子,北方叫面引子,也有的地方叫面头或酵头,就是发面蒸馒头时剩下的一小团面,由于里面有很多酵母菌,下次发面的时候可作为菌种用。这种用上次发酵的面作菌种发面蒸的馒头就叫老面馒头。老面在保存过程中往往会同时有乳酸菌存在,发的时间稍长就会有独特的酸味出现,故用老面发面蒸馒头时需要加食用碱来中和其酸味。
老面能使馒头变得松软多孔,其原理是什么
【答案】面团在酵母菌及其他一定数量和种类的微生物共同作用下发生反应,生成二氧化碳、乳酸、醋酸、乙醇等物质,其中二氧化碳能使面团变得松软多孔呈海绵状。
【关键能力】
项目活动1:探究碳酸氢钠用作膨松剂的作用原理
上面两种蒸馒头的方法,均用到了碳酸氢钠,为什么效果不同
【活动探究】
1.碳酸氢钠在发面中的作用原理推测
(1)碳酸氢钠受热分解,产生气体。
(2)碳酸氢钠与酸反应,产生气体。
2.实验用品
碳酸氢钠、盐酸、澄清石灰水、试管、酒精灯、铁架台(带铁夹或试管夹)、带导管的橡胶塞、药匙、胶头滴管、火柴。
3.实验方案
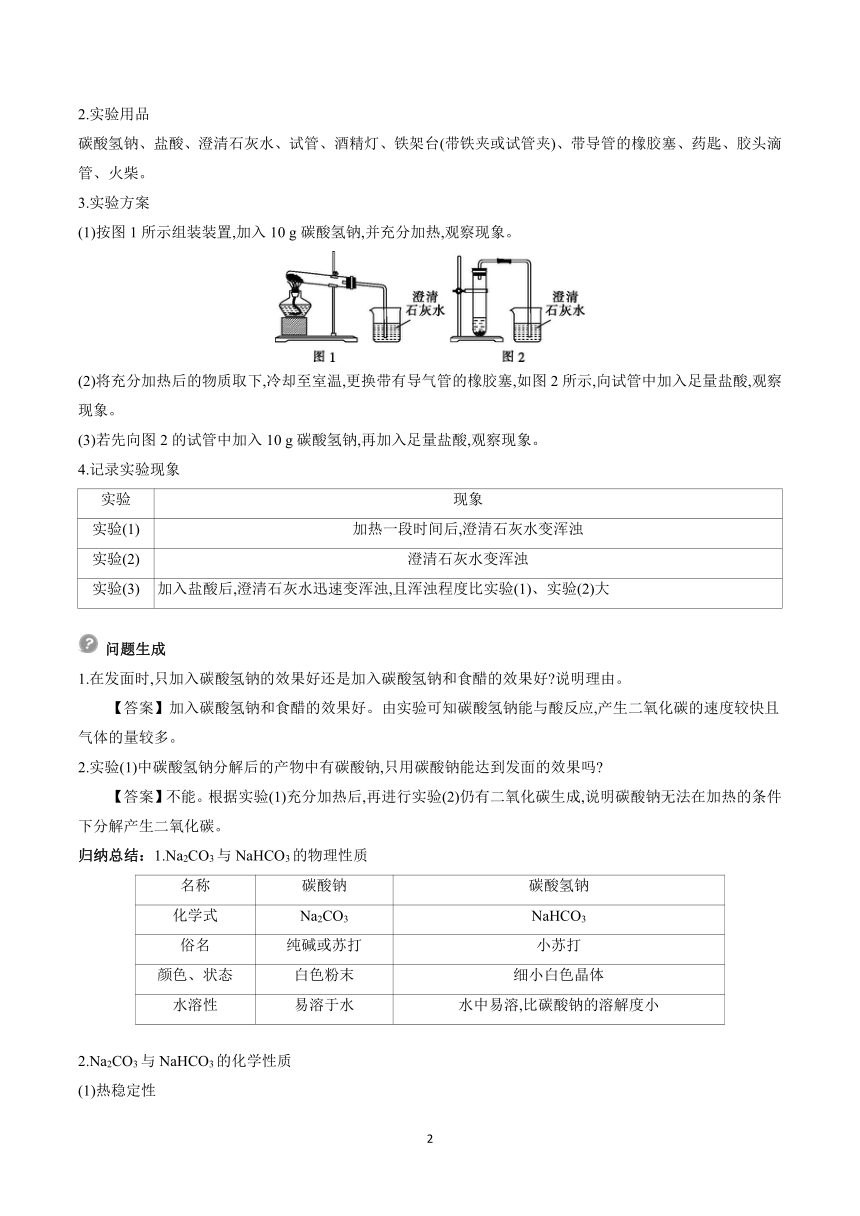
(1)按图1所示组装装置,加入10 g碳酸氢钠,并充分加热,观察现象。
(2)将充分加热后的物质取下,冷却至室温,更换带有导气管的橡胶塞,如图2所示,向试管中加入足量盐酸,观察现象。
(3)若先向图2的试管中加入10 g碳酸氢钠,再加入足量盐酸,观察现象。
4.记录实验现象
实验 现象
实验(1) 加热一段时间后,澄清石灰水变浑浊
实验(2) 澄清石灰水变浑浊
实验(3) 加入盐酸后,澄清石灰水迅速变浑浊,且浑浊程度比实验(1)、实验(2)大
问题生成
1.在发面时,只加入碳酸氢钠的效果好还是加入碳酸氢钠和食醋的效果好 说明理由。
【答案】加入碳酸氢钠和食醋的效果好。由实验可知碳酸氢钠能与酸反应,产生二氧化碳的速度较快且气体的量较多。
2.实验(1)中碳酸氢钠分解后的产物中有碳酸钠,只用碳酸钠能达到发面的效果吗
【答案】不能。根据实验(1)充分加热后,再进行实验(2)仍有二氧化碳生成,说明碳酸钠无法在加热的条件下分解产生二氧化碳。
归纳总结:1.Na2CO3与NaHCO3的物理性质
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱或苏打 小苏打
颜色、状态 白色粉末 细小白色晶体
水溶性 易溶于水 水中易溶,比碳酸钠的溶解度小
2.Na2CO3与NaHCO3的化学性质
(1)热稳定性
①Na2CO3的热稳定性强,受热难分解。
②NaHCO3的热稳定性差,受热易分解,化学方程式为2NaHCO3Na2CO3+CO2↑+H2O。
(2)与酸(足量盐酸)反应
①Na2CO3+2HCl2NaCl+CO2↑+H2O。
②NaHCO3+HClNaCl+CO2↑+H2O。
(3)碱性:水溶液均呈碱性,且浓度相同时,Na2CO3的碱性强于NaHCO3。
(4)与碱反应
①与NaOH溶液反应
Na2CO3不反应;NaHCO3+NaOHNa2CO3+H2O。
②与石灰水(足量)反应
Na2CO3+Ca(OH)2CaCO3↓+2NaOH;NaHCO3+Ca(OH)2CaCO3↓+NaOH+H2O。
3.Na2CO3与NaHCO3的相互转化
Na2CO3NaHCO3
迁移应用
1.为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,其原因是( )。
①热稳定性差 ②增加甜味 ③产生二氧化碳
④提供Na+
A.②③ B.①③ C.①④ D.③④
【答案】B
【解析】碳酸氢钠不稳定,受热易分解,化学方程式为2NaHCO3Na2CO3+CO2↑+H2O,分解产生的二氧化碳气体从面团中逸出,从而使面包松软可口。
2.胃酸过多又称胃酸过高,是胃肠疾病的常见症状之一。治疗胃酸过多可以用碳酸氢钠,请用化学方程式解释碳酸氢钠可以治疗胃酸过多的原因: 。
【答案】NaHCO3+HClNaCl+CO2↑+H2O
3.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸钠俗称 。
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 (填“>”、“=”或“<”)后者。
(3)除去碳酸钠固体中的碳酸氢钠时,发生反应的化学方程式为 。
(4)写出两种鉴别两者的方法:
① 。
② 。
【答案】(1)苏打(或纯碱)
(2)=
(3)2NaHCO3Na2CO3+CO2↑+H2O
(4)①加热分解法:取少许两种待检粉末于试管中,分别加热,有CO2气体产生的是NaHCO3
②盐酸产气法:取少许两种待检粉末于试管中,同时分别向两支试管中滴加1 mL稀盐酸,产气速度快的是NaHCO3
项目活动2:设计并使用复合膨松剂
用碳酸氢钠作膨松剂蒸的馒头呈淡黄色,碳酸氢钠作单一膨松剂时,可能造成食品口味不纯,颜色加深等问题。
如何才能使馒头变得又白又松软,口味更佳呢
【活动探究】
1.实验用品
白醋或柠檬酸、食用碳酸氢钠、蒸馒头用的器具。
2.实验步骤
(1)制作馒头:①和面时只加入食用碳酸氢钠;②和面时加入食用碳酸氢钠和白醋;③和面时加入食用碳酸氢钠和柠檬酸。
(2)观察馒头的色泽,并趁热闻一下气味,品尝一下馒头的味道,并记录下来。
馒头 色泽 气味 味道 膨松程度
① 略显淡黄色 无明显气味 口感不佳(碱味) 较小
② 白色 无明显气味 口感较好,无特 殊味道 较大
③ 白色 柠檬味 柠檬味 较大
问题生成
1.如果用碳酸氢钠作为复合膨松剂的主材料,另一种主材料用白醋或柠檬酸,哪一个更合适 说明理由。
【答案】柠檬酸。常温下柠檬酸是固体,白醋是液体,白醋和碳酸氢钠混合会直接反应,故柠檬酸更合适。
2.如果用碳酸氢钠作为复合膨松剂的主材料,另一种主材料需具有什么性质
【答案】酸性。所选材料必须能与碳酸氢钠反应产生二氧化碳。
3.复合膨松剂为什么应在干燥环境中保存
【答案】复合膨松剂中的碳酸盐和酸性物质遇水反应产生CO2,故应在干燥的环境中保存。
归纳总结:复合膨松剂的组成
组成部分 用量 作用
碳酸盐类 如碳酸氢钠的通常用量为膨松剂质量的30%~50% 反应产生二氧化碳
酸性物质 如柠檬酸的通常用量为膨松剂质量的30%~40% 与碳酸盐反应,控制反应速率和提升膨松剂的作用效果,调节产品的酸碱度
助剂 指的是淀粉、脂肪酸等,通常用量为膨松剂质量的10%~30% 防止膨松剂吸潮结块而失效,调节气体产生速率或使气体均匀产生
迁移应用
某兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。于是该小组对白色粉末的化学成分进行了以下探究:
【提出猜想】猜想1:碳酸钠;
猜想2:碳酸氢钠;
猜想3:碳酸钠和碳酸氢钠。
【查阅资料】①碳酸钠溶液、碳酸氢钠溶液均呈碱性。
②碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解。
【实验探究】甲、乙两名同学分别根据有关猜想设计下列实验方案并进行实验:
实验操作 实验现象 实验结论
甲 将白色粉末溶于水后用pH试纸测定其酸碱度 pH (填“>”、“<”或“=”)7 溶液呈碱性,猜想1成立
乙 用下图所示的装置进行实验 试管A中有水珠产生,试管B中溶液变浑浊 猜想2成立,试管B中反应的化学方程式为
【交流反思】大家一致认为甲、乙两名同学的结论不准确:
(1)甲同学的实验结论不准确的原因是 。
(2)乙同学的实验方案不能排除白色粉末中是否含有 。
【继续探究】丙同学称取m g白色粉末与足量稀盐酸充分反应后
生成二氧化碳的质量为n g,通过计算并分析实验数据确定猜想3正确,则n的取值范围为 (用含m的代数式表示)。
【结论分析】探究后他们核查到添加剂的主要成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
【拓展应用】下列物质在常温下放置一段时间后也会分解的是 (填字母)。
A.浓硫酸 B.氢氧化钠
C.碳酸氢铵 D.氯化钠
【答案】【实验探究】> CO2+Ca(OH)2CaCO3↓+H2O
【交流反思】(1)碳酸氢钠溶液也呈碱性
(2)碳酸钠
【继续探究】~
【拓展应用】C
【解析】【继续探究】设丙同学称取的m g白色粉末全部是碳酸钠。
Na2CO3+2HCl 2NaCl+H2O+CO2↑
106 44
M n
=
n=
设丙同学称取的m g白色粉末全部是碳酸氢钠。
NaHCO3+HClNaCl+H2O+CO2↑
84 44
m n
=
n=
故n的取值范围为~。
【拓展应用】常温下碳酸氢铵放置一段时间后会分解生成氨气、二氧化碳和水蒸气。
【课堂检测】
1.下列物质中,既可作膨松剂,又可用于治疗胃酸过多的是( )。
A.NaHCO3 B.Al(OH)3 C.CaCO3 D.Na2CO3
【答案】A
【解析】NaHCO3既可作膨松剂,又可用作抗酸药;Al(OH)3、CaCO3可作抗酸药,不能作膨松剂;Na2CO3碱性过强,不用作膨松剂和抗酸药。
2.下列说法中正确的是( )。
A.发酵粉中主要含苏打,能使制出的糕点疏松多孔
B.碳酸氢钠能与酸反应,不能与碱反应
C.碳酸氢钠可以用于治疗胃酸过多
D.碳酸钠属于碱,其水溶液显碱性
【答案】C
【解析】发酵粉的主要成分是小苏打,A项错误;NaHCO3既能与酸反应,又能与碱反应,B项错误;Na2CO3属于盐,D项错误。
3.下列膨松剂中,属于复合膨松剂的是( )。
A.泡打粉 B.碳酸钠
C.碳酸氢钠 D.碳酸氢铵
【答案】A
【解析】泡打粉是由碱性物质、酸式盐和填充物按一定比例混合而成的化学复合膨松剂。
4.为除去括号内的杂质,所选用的试剂或方法不正确的是( )。
A.NaCl溶液(Na2SO4):加入适量的Ba(NO3)2溶液,过滤
B.NaHCO3溶液(Na2CO3):通入过量的CO2气体
C.Na2O2粉末(Na2O):将混合物在氧气中加热
D.Na2CO3溶液(NaHCO3):加入适量的NaOH溶液
【答案】A
【解析】向含Na2SO4的NaCl溶液中加入适量Ba(NO3)2溶液,反应生成BaSO4沉淀和NaNO3,过滤后,滤液中引入新杂质NaNO3,A项错误;向含有Na2CO3的NaHCO3溶液中通入足量CO2气体,发生反应Na2CO3+CO2+H2O2NaHCO3,Na2CO3转化为NaHCO3,B项正确;将混合物在氧气中加热,Na2O与O2反应转化为Na2O2,C项正确;向含有NaHCO3的Na2CO3溶液中加入适量NaOH溶液,NaHCO3与NaOH溶液反应生成Na2CO3和H2O,从而除去杂质,D项正确。
5.下列有关Na2CO3和NaHCO3的性质的叙述中错误的是( )。
A.Na2CO3和NaHCO3都是盐,都能与酸反应
B.常温下溶解度:Na2CO3>NaHCO3
C.等物质的量的Na2CO3和NaHCO3与相同浓度的盐酸充分反应,消耗酸的体积之比是2∶1
D.向澄清石灰水中分别加入少量Na2CO3和NaHCO3溶液,前者产生沉淀,后者不产生沉淀
【答案】D
【解析】向澄清的石灰水中分别加入少量Na2CO3和NaHCO3溶液,两者都产生沉淀:Na2CO3+Ca(OH)22NaOH+CaCO3↓,NaHCO3+Ca(OH)2CaCO3↓+H2O+NaOH,D项错误。
6.已知①中盛有一定量的Na2CO3溶液,根据如图所示的实验过程,判断下列说法不正确的是( )。
A.②中溶液为红色
B.③溶液中发生反应的化学方程式为Na2CO3+Ca(OH)2CaCO3↓+2NaOH
C.加入过量稀盐酸后,④中观察到溶液红色褪去,沉淀溶解并产生大量气泡
D.④中溶液的溶质除酚酞外,还有2种
【答案】D
【解析】Na2CO3溶液呈碱性,滴加酚酞溶液后,溶液变为红色;向Na2CO3溶液中加入澄清石灰水,发生复分解反应生成CaCO3沉淀,反应的化学方程式为Ca(OH)2+Na2CO3CaCO3↓+2NaOH;加入过量稀盐酸,NaOH、Na2CO3都与盐酸反应,溶液的碱性减弱,红色褪去,CaCO3与盐酸反应生成CaCl2、CO2和H2O,产生大量气泡;④中溶液的溶质除酚酞外,还有生成的NaCl、CaCl2及过量的HCl。
7.胃液中含有盐酸,胃酸过多的人常有胃疼的感觉,易吐酸水,服用适量的小苏打(NaHCO3)能治疗胃酸过多,请写出有关反应的化学方程式: ;如果病人同时患有胃溃疡,为防胃壁穿孔,最好服用含氢氧化铝的胃药(如胃舒平),反应的化学方程式为 。
【答案】HCl+NaHCO3H2O+CO2↑+NaCl Al(OH)3+3HClAlCl3+3H2O
【解析】胃液中含有盐酸,盐酸与NaHCO3发生反应的化学方程式为HCl+NaHCO3H2O+CO2↑+NaCl,与氢氧化铝发生反应的化学方程式为Al(OH)3+3HClAlCl3+3H2O。
8.(创新题)已知:NH4HCO3NH3↑+H2O+CO2↑;Na2CO3比较稳定,受热不分解;碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳。现有某膨松剂,含碳酸氢钠、碳酸氢铵中的一种或两种,某化学兴趣小组对该膨松剂进行如下探究:
在玻璃管中加入该膨松剂,按图示连接好装置(气密性良好,铁架台略去),点燃酒精灯。
(1)关闭止水夹2,打开止水夹1,观察到的现象是 ,说明产物中有二氧化碳,该反应的化学方程式为 。
(2)打开止水夹2,关闭止水夹1,观察到的现象是 ,说明产物中有氨气。
(3)若想确定该膨松剂的成分是碳酸氢钠和碳酸氢铵的混合物,在上述实验的基础上(不添加其他仪器和试剂)应该继续完成的实验是 (填具体实验操作及现象)。
【答案】(1)澄清石灰水变浑浊 Ca(OH)2+CO2CaCO3↓+H2O
(2)无色酚酞溶液变为红色
(3)打开止水夹1,关闭止水夹2,继续加热至石灰水中不再有气泡产生,玻璃管中仍有固体剩余
【解析】(1)碳酸氢钠、碳酸氢铵受热分解都能生成二氧化碳,关闭止水夹2,打开止水夹1,观察到的现象是澄清石灰水变浑浊,氢氧化钙和二氧化碳反应的化学方程式为Ca(OH)2+CO2CaCO3↓+H2O。(2)如果有氨气生成,则氨气进入酚酞溶液中,能和水反应生成氨水,氨水呈碱性,能使酚酞溶液变红。
9.妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是 (填字母)。
A.受热易分解 B.水溶液呈碱性
C.属于碱 D.可与酸反应
(2)Na2CO3与NaHCO3质量均为1 g时,消耗H+的物质的量更多的是 。
(3)小鲁在实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。NaHCO3的作用是 。
(4)某品牌复合膨松剂的说明书如图所示:
【名 称】××复合膨松剂
【保质期】24个月
【净含量】1 kg
【使用量】面粉用量的0.5%~2.5%
【配 料】碳酸氢钠、焦磷酸二氢二钠、碳酸钙、葡萄糖酸-δ-内酯、淀粉
【适用范围】适用于各类馒头、包子等发酵面制品以及面包、糕点等的制作
【储存方法】阴凉干燥处储存
其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是
。
【答案】(1)BD
(2)Na2CO3
(3)受热分解产生CO2气体,从而使面团疏松;和乳酸、醋酸等有机酸反应,减少酸味
(4)提供H+与NaHCO3、CaCO3反应产生CO2气体,从而使面团疏松
【解析】(1)纯碱为碳酸钠,水溶液呈碱性,可与酸反应生成二氧化碳和水。
(2)Na2CO3与NaHCO3质量均为1 g时,消耗H+的物质的量之比为∶=84∶53,碳酸钠消耗的H+的物质的量多。
2
——体会研究物质性质的方法和程序的实用价值
【必备知识】
1.膨松剂:膨松剂是在食品加工过程中加入的,能使面坯发起形成多孔组织,从而使食品具有柔软或酥脆特点的一类物质。
2.膨松剂的分类
情景思考
老面是指发面的面种子,北方叫面引子,也有的地方叫面头或酵头,就是发面蒸馒头时剩下的一小团面,由于里面有很多酵母菌,下次发面的时候可作为菌种用。这种用上次发酵的面作菌种发面蒸的馒头就叫老面馒头。老面在保存过程中往往会同时有乳酸菌存在,发的时间稍长就会有独特的酸味出现,故用老面发面蒸馒头时需要加食用碱来中和其酸味。
老面能使馒头变得松软多孔,其原理是什么
【答案】面团在酵母菌及其他一定数量和种类的微生物共同作用下发生反应,生成二氧化碳、乳酸、醋酸、乙醇等物质,其中二氧化碳能使面团变得松软多孔呈海绵状。
【关键能力】
项目活动1:探究碳酸氢钠用作膨松剂的作用原理
上面两种蒸馒头的方法,均用到了碳酸氢钠,为什么效果不同
【活动探究】
1.碳酸氢钠在发面中的作用原理推测
(1)碳酸氢钠受热分解,产生气体。
(2)碳酸氢钠与酸反应,产生气体。
2.实验用品
碳酸氢钠、盐酸、澄清石灰水、试管、酒精灯、铁架台(带铁夹或试管夹)、带导管的橡胶塞、药匙、胶头滴管、火柴。
3.实验方案
(1)按图1所示组装装置,加入10 g碳酸氢钠,并充分加热,观察现象。
(2)将充分加热后的物质取下,冷却至室温,更换带有导气管的橡胶塞,如图2所示,向试管中加入足量盐酸,观察现象。
(3)若先向图2的试管中加入10 g碳酸氢钠,再加入足量盐酸,观察现象。
4.记录实验现象
实验 现象
实验(1) 加热一段时间后,澄清石灰水变浑浊
实验(2) 澄清石灰水变浑浊
实验(3) 加入盐酸后,澄清石灰水迅速变浑浊,且浑浊程度比实验(1)、实验(2)大
问题生成
1.在发面时,只加入碳酸氢钠的效果好还是加入碳酸氢钠和食醋的效果好 说明理由。
【答案】加入碳酸氢钠和食醋的效果好。由实验可知碳酸氢钠能与酸反应,产生二氧化碳的速度较快且气体的量较多。
2.实验(1)中碳酸氢钠分解后的产物中有碳酸钠,只用碳酸钠能达到发面的效果吗
【答案】不能。根据实验(1)充分加热后,再进行实验(2)仍有二氧化碳生成,说明碳酸钠无法在加热的条件下分解产生二氧化碳。
归纳总结:1.Na2CO3与NaHCO3的物理性质
名称 碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱或苏打 小苏打
颜色、状态 白色粉末 细小白色晶体
水溶性 易溶于水 水中易溶,比碳酸钠的溶解度小
2.Na2CO3与NaHCO3的化学性质
(1)热稳定性
①Na2CO3的热稳定性强,受热难分解。
②NaHCO3的热稳定性差,受热易分解,化学方程式为2NaHCO3Na2CO3+CO2↑+H2O。
(2)与酸(足量盐酸)反应
①Na2CO3+2HCl2NaCl+CO2↑+H2O。
②NaHCO3+HClNaCl+CO2↑+H2O。
(3)碱性:水溶液均呈碱性,且浓度相同时,Na2CO3的碱性强于NaHCO3。
(4)与碱反应
①与NaOH溶液反应
Na2CO3不反应;NaHCO3+NaOHNa2CO3+H2O。
②与石灰水(足量)反应
Na2CO3+Ca(OH)2CaCO3↓+2NaOH;NaHCO3+Ca(OH)2CaCO3↓+NaOH+H2O。
3.Na2CO3与NaHCO3的相互转化
Na2CO3NaHCO3
迁移应用
1.为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,其原因是( )。
①热稳定性差 ②增加甜味 ③产生二氧化碳
④提供Na+
A.②③ B.①③ C.①④ D.③④
【答案】B
【解析】碳酸氢钠不稳定,受热易分解,化学方程式为2NaHCO3Na2CO3+CO2↑+H2O,分解产生的二氧化碳气体从面团中逸出,从而使面包松软可口。
2.胃酸过多又称胃酸过高,是胃肠疾病的常见症状之一。治疗胃酸过多可以用碳酸氢钠,请用化学方程式解释碳酸氢钠可以治疗胃酸过多的原因: 。
【答案】NaHCO3+HClNaCl+CO2↑+H2O
3.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸钠俗称 。
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 (填“>”、“=”或“<”)后者。
(3)除去碳酸钠固体中的碳酸氢钠时,发生反应的化学方程式为 。
(4)写出两种鉴别两者的方法:
① 。
② 。
【答案】(1)苏打(或纯碱)
(2)=
(3)2NaHCO3Na2CO3+CO2↑+H2O
(4)①加热分解法:取少许两种待检粉末于试管中,分别加热,有CO2气体产生的是NaHCO3
②盐酸产气法:取少许两种待检粉末于试管中,同时分别向两支试管中滴加1 mL稀盐酸,产气速度快的是NaHCO3
项目活动2:设计并使用复合膨松剂
用碳酸氢钠作膨松剂蒸的馒头呈淡黄色,碳酸氢钠作单一膨松剂时,可能造成食品口味不纯,颜色加深等问题。
如何才能使馒头变得又白又松软,口味更佳呢
【活动探究】
1.实验用品
白醋或柠檬酸、食用碳酸氢钠、蒸馒头用的器具。
2.实验步骤
(1)制作馒头:①和面时只加入食用碳酸氢钠;②和面时加入食用碳酸氢钠和白醋;③和面时加入食用碳酸氢钠和柠檬酸。
(2)观察馒头的色泽,并趁热闻一下气味,品尝一下馒头的味道,并记录下来。
馒头 色泽 气味 味道 膨松程度
① 略显淡黄色 无明显气味 口感不佳(碱味) 较小
② 白色 无明显气味 口感较好,无特 殊味道 较大
③ 白色 柠檬味 柠檬味 较大
问题生成
1.如果用碳酸氢钠作为复合膨松剂的主材料,另一种主材料用白醋或柠檬酸,哪一个更合适 说明理由。
【答案】柠檬酸。常温下柠檬酸是固体,白醋是液体,白醋和碳酸氢钠混合会直接反应,故柠檬酸更合适。
2.如果用碳酸氢钠作为复合膨松剂的主材料,另一种主材料需具有什么性质
【答案】酸性。所选材料必须能与碳酸氢钠反应产生二氧化碳。
3.复合膨松剂为什么应在干燥环境中保存
【答案】复合膨松剂中的碳酸盐和酸性物质遇水反应产生CO2,故应在干燥的环境中保存。
归纳总结:复合膨松剂的组成
组成部分 用量 作用
碳酸盐类 如碳酸氢钠的通常用量为膨松剂质量的30%~50% 反应产生二氧化碳
酸性物质 如柠檬酸的通常用量为膨松剂质量的30%~40% 与碳酸盐反应,控制反应速率和提升膨松剂的作用效果,调节产品的酸碱度
助剂 指的是淀粉、脂肪酸等,通常用量为膨松剂质量的10%~30% 防止膨松剂吸潮结块而失效,调节气体产生速率或使气体均匀产生
迁移应用
某兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。于是该小组对白色粉末的化学成分进行了以下探究:
【提出猜想】猜想1:碳酸钠;
猜想2:碳酸氢钠;
猜想3:碳酸钠和碳酸氢钠。
【查阅资料】①碳酸钠溶液、碳酸氢钠溶液均呈碱性。
②碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解。
【实验探究】甲、乙两名同学分别根据有关猜想设计下列实验方案并进行实验:
实验操作 实验现象 实验结论
甲 将白色粉末溶于水后用pH试纸测定其酸碱度 pH (填“>”、“<”或“=”)7 溶液呈碱性,猜想1成立
乙 用下图所示的装置进行实验 试管A中有水珠产生,试管B中溶液变浑浊 猜想2成立,试管B中反应的化学方程式为
【交流反思】大家一致认为甲、乙两名同学的结论不准确:
(1)甲同学的实验结论不准确的原因是 。
(2)乙同学的实验方案不能排除白色粉末中是否含有 。
【继续探究】丙同学称取m g白色粉末与足量稀盐酸充分反应后
生成二氧化碳的质量为n g,通过计算并分析实验数据确定猜想3正确,则n的取值范围为 (用含m的代数式表示)。
【结论分析】探究后他们核查到添加剂的主要成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
【拓展应用】下列物质在常温下放置一段时间后也会分解的是 (填字母)。
A.浓硫酸 B.氢氧化钠
C.碳酸氢铵 D.氯化钠
【答案】【实验探究】> CO2+Ca(OH)2CaCO3↓+H2O
【交流反思】(1)碳酸氢钠溶液也呈碱性
(2)碳酸钠
【继续探究】~
【拓展应用】C
【解析】【继续探究】设丙同学称取的m g白色粉末全部是碳酸钠。
Na2CO3+2HCl 2NaCl+H2O+CO2↑
106 44
M n
=
n=
设丙同学称取的m g白色粉末全部是碳酸氢钠。
NaHCO3+HClNaCl+H2O+CO2↑
84 44
m n
=
n=
故n的取值范围为~。
【拓展应用】常温下碳酸氢铵放置一段时间后会分解生成氨气、二氧化碳和水蒸气。
【课堂检测】
1.下列物质中,既可作膨松剂,又可用于治疗胃酸过多的是( )。
A.NaHCO3 B.Al(OH)3 C.CaCO3 D.Na2CO3
【答案】A
【解析】NaHCO3既可作膨松剂,又可用作抗酸药;Al(OH)3、CaCO3可作抗酸药,不能作膨松剂;Na2CO3碱性过强,不用作膨松剂和抗酸药。
2.下列说法中正确的是( )。
A.发酵粉中主要含苏打,能使制出的糕点疏松多孔
B.碳酸氢钠能与酸反应,不能与碱反应
C.碳酸氢钠可以用于治疗胃酸过多
D.碳酸钠属于碱,其水溶液显碱性
【答案】C
【解析】发酵粉的主要成分是小苏打,A项错误;NaHCO3既能与酸反应,又能与碱反应,B项错误;Na2CO3属于盐,D项错误。
3.下列膨松剂中,属于复合膨松剂的是( )。
A.泡打粉 B.碳酸钠
C.碳酸氢钠 D.碳酸氢铵
【答案】A
【解析】泡打粉是由碱性物质、酸式盐和填充物按一定比例混合而成的化学复合膨松剂。
4.为除去括号内的杂质,所选用的试剂或方法不正确的是( )。
A.NaCl溶液(Na2SO4):加入适量的Ba(NO3)2溶液,过滤
B.NaHCO3溶液(Na2CO3):通入过量的CO2气体
C.Na2O2粉末(Na2O):将混合物在氧气中加热
D.Na2CO3溶液(NaHCO3):加入适量的NaOH溶液
【答案】A
【解析】向含Na2SO4的NaCl溶液中加入适量Ba(NO3)2溶液,反应生成BaSO4沉淀和NaNO3,过滤后,滤液中引入新杂质NaNO3,A项错误;向含有Na2CO3的NaHCO3溶液中通入足量CO2气体,发生反应Na2CO3+CO2+H2O2NaHCO3,Na2CO3转化为NaHCO3,B项正确;将混合物在氧气中加热,Na2O与O2反应转化为Na2O2,C项正确;向含有NaHCO3的Na2CO3溶液中加入适量NaOH溶液,NaHCO3与NaOH溶液反应生成Na2CO3和H2O,从而除去杂质,D项正确。
5.下列有关Na2CO3和NaHCO3的性质的叙述中错误的是( )。
A.Na2CO3和NaHCO3都是盐,都能与酸反应
B.常温下溶解度:Na2CO3>NaHCO3
C.等物质的量的Na2CO3和NaHCO3与相同浓度的盐酸充分反应,消耗酸的体积之比是2∶1
D.向澄清石灰水中分别加入少量Na2CO3和NaHCO3溶液,前者产生沉淀,后者不产生沉淀
【答案】D
【解析】向澄清的石灰水中分别加入少量Na2CO3和NaHCO3溶液,两者都产生沉淀:Na2CO3+Ca(OH)22NaOH+CaCO3↓,NaHCO3+Ca(OH)2CaCO3↓+H2O+NaOH,D项错误。
6.已知①中盛有一定量的Na2CO3溶液,根据如图所示的实验过程,判断下列说法不正确的是( )。
A.②中溶液为红色
B.③溶液中发生反应的化学方程式为Na2CO3+Ca(OH)2CaCO3↓+2NaOH
C.加入过量稀盐酸后,④中观察到溶液红色褪去,沉淀溶解并产生大量气泡
D.④中溶液的溶质除酚酞外,还有2种
【答案】D
【解析】Na2CO3溶液呈碱性,滴加酚酞溶液后,溶液变为红色;向Na2CO3溶液中加入澄清石灰水,发生复分解反应生成CaCO3沉淀,反应的化学方程式为Ca(OH)2+Na2CO3CaCO3↓+2NaOH;加入过量稀盐酸,NaOH、Na2CO3都与盐酸反应,溶液的碱性减弱,红色褪去,CaCO3与盐酸反应生成CaCl2、CO2和H2O,产生大量气泡;④中溶液的溶质除酚酞外,还有生成的NaCl、CaCl2及过量的HCl。
7.胃液中含有盐酸,胃酸过多的人常有胃疼的感觉,易吐酸水,服用适量的小苏打(NaHCO3)能治疗胃酸过多,请写出有关反应的化学方程式: ;如果病人同时患有胃溃疡,为防胃壁穿孔,最好服用含氢氧化铝的胃药(如胃舒平),反应的化学方程式为 。
【答案】HCl+NaHCO3H2O+CO2↑+NaCl Al(OH)3+3HClAlCl3+3H2O
【解析】胃液中含有盐酸,盐酸与NaHCO3发生反应的化学方程式为HCl+NaHCO3H2O+CO2↑+NaCl,与氢氧化铝发生反应的化学方程式为Al(OH)3+3HClAlCl3+3H2O。
8.(创新题)已知:NH4HCO3NH3↑+H2O+CO2↑;Na2CO3比较稳定,受热不分解;碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳。现有某膨松剂,含碳酸氢钠、碳酸氢铵中的一种或两种,某化学兴趣小组对该膨松剂进行如下探究:
在玻璃管中加入该膨松剂,按图示连接好装置(气密性良好,铁架台略去),点燃酒精灯。
(1)关闭止水夹2,打开止水夹1,观察到的现象是 ,说明产物中有二氧化碳,该反应的化学方程式为 。
(2)打开止水夹2,关闭止水夹1,观察到的现象是 ,说明产物中有氨气。
(3)若想确定该膨松剂的成分是碳酸氢钠和碳酸氢铵的混合物,在上述实验的基础上(不添加其他仪器和试剂)应该继续完成的实验是 (填具体实验操作及现象)。
【答案】(1)澄清石灰水变浑浊 Ca(OH)2+CO2CaCO3↓+H2O
(2)无色酚酞溶液变为红色
(3)打开止水夹1,关闭止水夹2,继续加热至石灰水中不再有气泡产生,玻璃管中仍有固体剩余
【解析】(1)碳酸氢钠、碳酸氢铵受热分解都能生成二氧化碳,关闭止水夹2,打开止水夹1,观察到的现象是澄清石灰水变浑浊,氢氧化钙和二氧化碳反应的化学方程式为Ca(OH)2+CO2CaCO3↓+H2O。(2)如果有氨气生成,则氨气进入酚酞溶液中,能和水反应生成氨水,氨水呈碱性,能使酚酞溶液变红。
9.妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是 (填字母)。
A.受热易分解 B.水溶液呈碱性
C.属于碱 D.可与酸反应
(2)Na2CO3与NaHCO3质量均为1 g时,消耗H+的物质的量更多的是 。
(3)小鲁在实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。NaHCO3的作用是 。
(4)某品牌复合膨松剂的说明书如图所示:
【名 称】××复合膨松剂
【保质期】24个月
【净含量】1 kg
【使用量】面粉用量的0.5%~2.5%
【配 料】碳酸氢钠、焦磷酸二氢二钠、碳酸钙、葡萄糖酸-δ-内酯、淀粉
【适用范围】适用于各类馒头、包子等发酵面制品以及面包、糕点等的制作
【储存方法】阴凉干燥处储存
其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是
。
【答案】(1)BD
(2)Na2CO3
(3)受热分解产生CO2气体,从而使面团疏松;和乳酸、醋酸等有机酸反应,减少酸味
(4)提供H+与NaHCO3、CaCO3反应产生CO2气体,从而使面团疏松
【解析】(1)纯碱为碳酸钠,水溶液呈碱性,可与酸反应生成二氧化碳和水。
(2)Na2CO3与NaHCO3质量均为1 g时,消耗H+的物质的量之比为∶=84∶53,碳酸钠消耗的H+的物质的量多。
2
